11. Теория электролитической диссоциации.pptx
- Количество слайдов: 29
 Основания, кислоты , соли в свете ТЭД.
Основания, кислоты , соли в свете ТЭД.
 процесс распада электролита на ионы
процесс распада электролита на ионы
 Теория электролитической диссоциации ( С. Аррениус, 1887 г. ) – веществаэлектролиты в растворах распадаются на ионы. Вещества-электролиты, которые проводят электрический ток
Теория электролитической диссоциации ( С. Аррениус, 1887 г. ) – веществаэлектролиты в растворах распадаются на ионы. Вещества-электролиты, которые проводят электрический ток
 ЭЛЕКТРОЛИТЫ И НЕЭЛЕКТРОЛИТЫ Сильные электролиты – при растворении полностью распадаются на ионы (растворимые соли, сильные кислоты, щелочи) Слабые электролиты – незначительно диссоциируют на ионы (слабые кислоты, нерастворимые основания и гидроксид амония NH 4 OH, малорастворимые соли) Неэлектролиты – не распадаются на ионы (простые вещества, нерастворимые оксиды, большинство органических веществ)
ЭЛЕКТРОЛИТЫ И НЕЭЛЕКТРОЛИТЫ Сильные электролиты – при растворении полностью распадаются на ионы (растворимые соли, сильные кислоты, щелочи) Слабые электролиты – незначительно диссоциируют на ионы (слабые кислоты, нерастворимые основания и гидроксид амония NH 4 OH, малорастворимые соли) Неэлектролиты – не распадаются на ионы (простые вещества, нерастворимые оксиды, большинство органических веществ)
 В растворах слабых электролитов устанавливается динамическое равновесие между недиссоциированными молекулами и ионами Степень диссоциации – отношение количества вещества распавшегося на ионы (nd) к общему количеству растворенного вещества (nr). α= n/ N
В растворах слабых электролитов устанавливается динамическое равновесие между недиссоциированными молекулами и ионами Степень диссоциации – отношение количества вещества распавшегося на ионы (nd) к общему количеству растворенного вещества (nr). α= n/ N
 Константа диссоциации – показывает отношение концентрации ионов к концентрации недиссоциированных молекул Константа 1. 2. 3. диссоциации зависит от: Природы (силы)электролита Температуры Концентрации Видеотека: Электролиты Влияние температуры на диссоциацию Влияние концентрации на диссоциацию
Константа диссоциации – показывает отношение концентрации ионов к концентрации недиссоциированных молекул Константа 1. 2. 3. диссоциации зависит от: Природы (силы)электролита Температуры Концентрации Видеотека: Электролиты Влияние температуры на диссоциацию Влияние концентрации на диссоциацию
 Электролиты при растворении гидратируются и распадаются на ионы (катионы+ и анионы-). Под действием электрического тока катионы+ движутся к катоду(-), анионыдвижутся к аноду(+). Диссоциация это обратимый процесс: наряду с распадом вещества на ионы идет процесс обратной ассоциации в молекулы и кристаллы.
Электролиты при растворении гидратируются и распадаются на ионы (катионы+ и анионы-). Под действием электрического тока катионы+ движутся к катоду(-), анионыдвижутся к аноду(+). Диссоциация это обратимый процесс: наряду с распадом вещества на ионы идет процесс обратной ассоциации в молекулы и кристаллы.
 Основаниями называются вещества, в которых атомы металла связаны с гидроксильными группами Me(ОН)n Основания - электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. KOH K+ + OH— NH 4 OH NH+4 + OH—
Основаниями называются вещества, в которых атомы металла связаны с гидроксильными группами Me(ОН)n Основания - электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. KOH K+ + OH— NH 4 OH NH+4 + OH—
 1. Щелочи - растворимые в воде основания (гидроксиды металлов I и II групп). Кристаллические вещества, устойчивы к разложению. 2. Нерастворимые и малорастворимые основания (большинство оснований , гидроксиды металлов побочных подгрупп: Cu(OH)2, Fe(OH) 3 и др. Твердые вещества, легко разлагаются на оксид и воду: Cu(OH)2 Cu. O + H 2 О
1. Щелочи - растворимые в воде основания (гидроксиды металлов I и II групп). Кристаллические вещества, устойчивы к разложению. 2. Нерастворимые и малорастворимые основания (большинство оснований , гидроксиды металлов побочных подгрупп: Cu(OH)2, Fe(OH) 3 и др. Твердые вещества, легко разлагаются на оксид и воду: Cu(OH)2 Cu. O + H 2 О
 Кислотность основания определяется числом гидроксильных групп (равно количеству молекул кислоты, необходимой для нейтрализации). NН 4 ОН — однокислотное основание, Са(ОН)2 — двухкислотное, Fе(ОН)3 — трехкислотное (многокислотное) Двух и многокислотные основания диссоциируют ступенчато: Ca(ОН)2 Са(ОН)+ + OH— (первая ступень) Ca(OH)+ Ca 2++OH— (вторая ступень) Константа диссоциации второй и третьей ступени значительно ниже первой.
Кислотность основания определяется числом гидроксильных групп (равно количеству молекул кислоты, необходимой для нейтрализации). NН 4 ОН — однокислотное основание, Са(ОН)2 — двухкислотное, Fе(ОН)3 — трехкислотное (многокислотное) Двух и многокислотные основания диссоциируют ступенчато: Ca(ОН)2 Са(ОН)+ + OH— (первая ступень) Ca(OH)+ Ca 2++OH— (вторая ступень) Константа диссоциации второй и третьей ступени значительно ниже первой.
 Сильные основания Слабые основания Na. OH гидроксид натрия (едкий натр) KOH гидроксид калия (едкое кали) Li. OH гидроксид лития Ba(OH)2 гидроксид бария Ca(OH)2 гидроксид кальция (гашеная известь) Mg(OH)2 гидроксид магния Fe(OH)2 гидроксид железа (II) Zn(OH)2 гидроксид цинка NH 4 OH гидроксид аммония Fe(OH)3 гидроксид железа (III) и т. д. (большинство гидроксидов металлов)
Сильные основания Слабые основания Na. OH гидроксид натрия (едкий натр) KOH гидроксид калия (едкое кали) Li. OH гидроксид лития Ba(OH)2 гидроксид бария Ca(OH)2 гидроксид кальция (гашеная известь) Mg(OH)2 гидроксид магния Fe(OH)2 гидроксид железа (II) Zn(OH)2 гидроксид цинка NH 4 OH гидроксид аммония Fe(OH)3 гидроксид железа (III) и т. д. (большинство гидроксидов металлов)
 Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток Hn(Ac). Кислота - электролит, при диссоциации которого в качестве катионов образуются только катионы водорода (Н+). HCl Н+ + Cl— H 2 SO 4 Н+ + НSО— 4
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток Hn(Ac). Кислота - электролит, при диссоциации которого в качестве катионов образуются только катионы водорода (Н+). HCl Н+ + Cl— H 2 SO 4 Н+ + НSО— 4
 Безкислородные кислоты: HCl, HBr, HF, H 2 S и др. (образуют сильные неметаллы VI и VII гр. ). Представляют растворы газов в воде. Кислородсодержащие кислоты : H 2 SO 4 ; H 2 СO 3; H 3 PO 4. – Как правило жидкости.
Безкислородные кислоты: HCl, HBr, HF, H 2 S и др. (образуют сильные неметаллы VI и VII гр. ). Представляют растворы газов в воде. Кислородсодержащие кислоты : H 2 SO 4 ; H 2 СO 3; H 3 PO 4. – Как правило жидкости.
 Основность кислот определяется количеством ионов водорода Н+, равно количеству молекул простого основания необходимого для нейтрализации. Диссоциация многоосновной кислоты протекает ступенчато. Константа диссоциации второй и третьей ступени значительно ниже чем первой. Н 3 РО 4 Н+ + Н 2 РО— 4 - первая ступень Н 2 РО— 4 Н+ + НРO 2 -4 - вторая ступень НРО 2 -4 Н+ PОЗ— 4 - третья ступень
Основность кислот определяется количеством ионов водорода Н+, равно количеству молекул простого основания необходимого для нейтрализации. Диссоциация многоосновной кислоты протекает ступенчато. Константа диссоциации второй и третьей ступени значительно ниже чем первой. Н 3 РО 4 Н+ + Н 2 РО— 4 - первая ступень Н 2 РО— 4 Н+ + НРO 2 -4 - вторая ступень НРО 2 -4 Н+ PОЗ— 4 - третья ступень
 Сильные кислоты Слабые кислоты HI иодоводородная HBr бромоводородная HCl хлороводородная H 2 SO 4 серная HNO 3 азотная HF фтороводородная H 3 PO 4 фосфорная H 2 SO 3 сернистая H 2 S сероводородная H 2 CO 3 угольная H 2 Si. O 3 кремниевая
Сильные кислоты Слабые кислоты HI иодоводородная HBr бромоводородная HCl хлороводородная H 2 SO 4 серная HNO 3 азотная HF фтороводородная H 3 PO 4 фосфорная H 2 SO 3 сернистая H 2 S сероводородная H 2 CO 3 угольная H 2 Si. O 3 кремниевая
 Соли – это сложные вещества, образованные атомами металлов и кислотных остатков Меn. Ас. Соли - электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония ( NH+4) и анионы кислотных остатков. (NH 4)2 SO 4 2 NH+4 + SO 2 -4 Na 3 PO 4 3 Na+ + PO 3 -4
Соли – это сложные вещества, образованные атомами металлов и кислотных остатков Меn. Ас. Соли - электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония ( NH+4) и анионы кислотных остатков. (NH 4)2 SO 4 2 NH+4 + SO 2 -4 Na 3 PO 4 3 Na+ + PO 3 -4
 Средние соли – все атомы кислорода замещены металлом. KCl, Fe. SO 4, Na 3 PO 4 Кислые соли – содержат Н+ диссоциируют ступенчато: KHSO 4 K+ + HSO— 4 H++SO 2 -4 Основные соли – содержат гидроксильную группу ОН—, диссоциируют ступенчато: Mg(OH)Cl Mg(OH)++Cl— Mg(OH)+ Mg 2++OH—
Средние соли – все атомы кислорода замещены металлом. KCl, Fe. SO 4, Na 3 PO 4 Кислые соли – содержат Н+ диссоциируют ступенчато: KHSO 4 K+ + HSO— 4 H++SO 2 -4 Основные соли – содержат гидроксильную группу ОН—, диссоциируют ступенчато: Mg(OH)Cl Mg(OH)++Cl— Mg(OH)+ Mg 2++OH—
 Водородный показатель – характеризует концентрацию свободных ионов водорода в воде или водном растворе: p. H = -log[H+]. Диссоциация воды (очень незначительно): Н 2 O Н+ + ОН— [H+] = [ОН—] = 10 — 7 моль/л. p. H = - lg [H+] = 7 - нейтральная среда При добавлении кислоты: Н 2 O + HCl = Н 2 O + H+ + Cl— 0 ≤ р. Н <7 – кислая среда При добавлении основания: Н 2 O + КОН = Н 2 O + К+ + ОН— 7< р. Н ≤ 14 – щелочная среда
Водородный показатель – характеризует концентрацию свободных ионов водорода в воде или водном растворе: p. H = -log[H+]. Диссоциация воды (очень незначительно): Н 2 O Н+ + ОН— [H+] = [ОН—] = 10 — 7 моль/л. p. H = - lg [H+] = 7 - нейтральная среда При добавлении кислоты: Н 2 O + HCl = Н 2 O + H+ + Cl— 0 ≤ р. Н <7 – кислая среда При добавлении основания: Н 2 O + КОН = Н 2 O + К+ + ОН— 7< р. Н ≤ 14 – щелочная среда

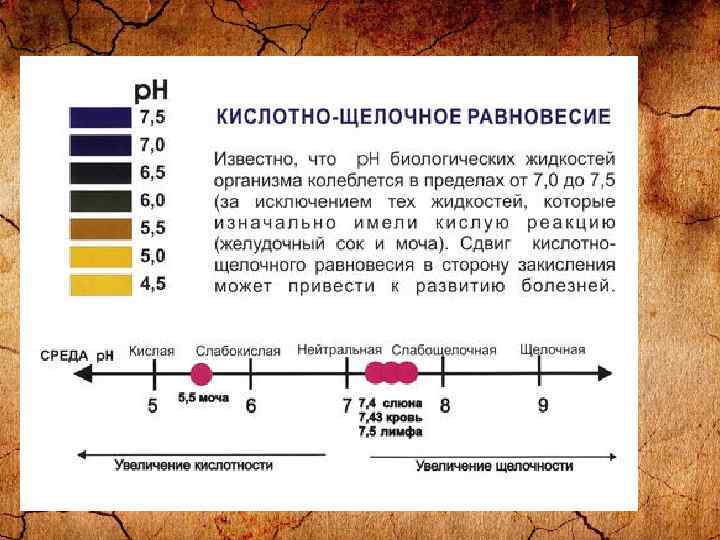

 Проверьте свой кислотно-щелочной баланс с помощью p. H тест-полосок С помощью p. H тест-полосок можно легко, быстро и точно определить уровень p. H, не выходя из дома. Если уровень p. H мочи колеблется в пределах 6, 0 -6, 4 утром и 6, 4 -7, 0 вечером, то ваш организм функционирует нормально. Если в слюне отметка уровня p. H остается между 6, 4 -6, 8 в течение всего дня – это также свидетельствует о здоровье ва-шего организма. Наиболее оптимальный уровень p. H слюны и мочи слегка кислый, в пределах 6, 4 -6, 5. Лучшее время для определения уровня p. H – за 1 час до еды или спустя 2 часа после еды. Регулярно проверяйте уровень вашего p. H.
Проверьте свой кислотно-щелочной баланс с помощью p. H тест-полосок С помощью p. H тест-полосок можно легко, быстро и точно определить уровень p. H, не выходя из дома. Если уровень p. H мочи колеблется в пределах 6, 0 -6, 4 утром и 6, 4 -7, 0 вечером, то ваш организм функционирует нормально. Если в слюне отметка уровня p. H остается между 6, 4 -6, 8 в течение всего дня – это также свидетельствует о здоровье ва-шего организма. Наиболее оптимальный уровень p. H слюны и мочи слегка кислый, в пределах 6, 4 -6, 5. Лучшее время для определения уровня p. H – за 1 час до еды или спустя 2 часа после еды. Регулярно проверяйте уровень вашего p. H.

 Электролиз – окислительновосстановительные реакции, которые протекают на электродах при прохождении электрического тока через расплав или раствор электролита. Электрический ток – самый сильный окислитель и восстановитель! В процессе электролиза восстанавливаются даже ионы щелочных металлов и окисляются ионы галогенов и кислорода.
Электролиз – окислительновосстановительные реакции, которые протекают на электродах при прохождении электрического тока через расплав или раствор электролита. Электрический ток – самый сильный окислитель и восстановитель! В процессе электролиза восстанавливаются даже ионы щелочных металлов и окисляются ионы галогенов и кислорода.


 Видеотека: Электролиз воды
Видеотека: Электролиз воды
 Видеотека: Электролиз сульфата меди
Видеотека: Электролиз сульфата меди
 Получение щелочных и щелочно-земельных металлов и аллюминия Получение галогенов, водорода и кислорода Нанесение металлических покрытий – никелирование, хромирование, золочение (гальваностегия) Изготовление рельевных металлических копий (гальванопластика) Очистка цветных металлов от примесей (рафинирование)
Получение щелочных и щелочно-земельных металлов и аллюминия Получение галогенов, водорода и кислорода Нанесение металлических покрытий – никелирование, хромирование, золочение (гальваностегия) Изготовление рельевных металлических копий (гальванопластика) Очистка цветных металлов от примесей (рафинирование)


