 Основания, их классификация и свойства.
Основания, их классификация и свойства.
 Основания – Это электролиты, которые диссоциируют с образованием катионов металла и гидроксиданионов. Me+n(OH)n → Me+n + n. OH- Физические свойства. Основания твердые вещества различных цветов и различной растворимости в воде.
Основания – Это электролиты, которые диссоциируют с образованием катионов металла и гидроксиданионов. Me+n(OH)n → Me+n + n. OH- Физические свойства. Основания твердые вещества различных цветов и различной растворимости в воде.
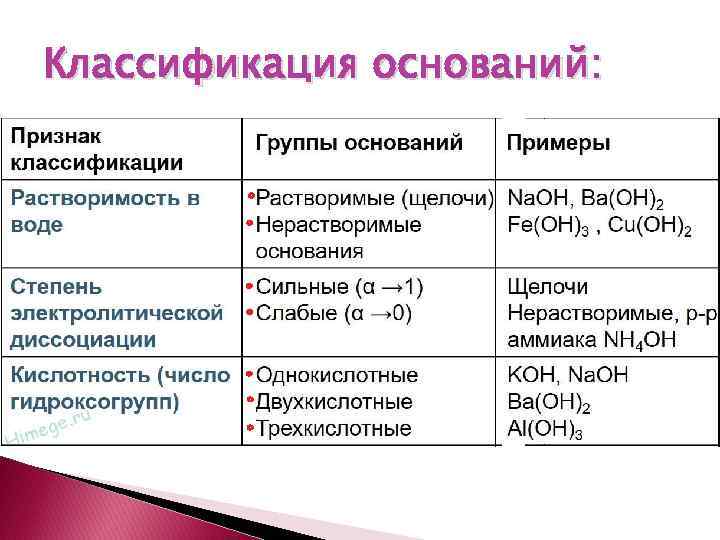 Классификация оснований:
Классификация оснований:
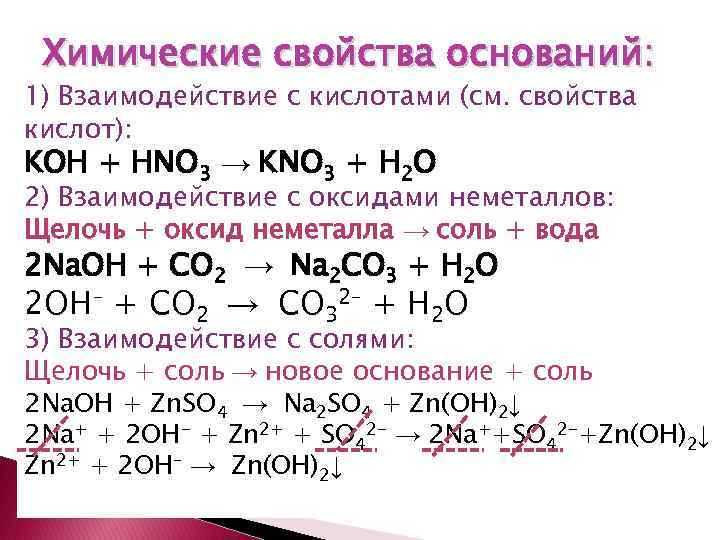 Химические свойства оснований: 1) Взаимодействие с кислотами (см. свойства кислот): KOH + HNO 3 → KNO 3 + H 2 O 2) Взаимодействие с оксидами неметаллов: Щелочь + оксид неметалла → соль + вода 2 Na. OH + СО 2 → Na 2 CO 3 + H 2 O 2 OH– + CO 2 → CO 32– + H 2 O 3) Взаимодействие с солями: Щелочь + соль → новое основание + соль 2 Na. OH + Zn. SО 4 → Na 2 SO 4 + Zn(OH)2↓ 2 Na+ + 2 OH- + Zn 2+ + SО 42 - → 2 Na++SО 42 -+Zn(OH)2↓ Zn 2+ + 2 OH– → Zn(OH)2↓
Химические свойства оснований: 1) Взаимодействие с кислотами (см. свойства кислот): KOH + HNO 3 → KNO 3 + H 2 O 2) Взаимодействие с оксидами неметаллов: Щелочь + оксид неметалла → соль + вода 2 Na. OH + СО 2 → Na 2 CO 3 + H 2 O 2 OH– + CO 2 → CO 32– + H 2 O 3) Взаимодействие с солями: Щелочь + соль → новое основание + соль 2 Na. OH + Zn. SО 4 → Na 2 SO 4 + Zn(OH)2↓ 2 Na+ + 2 OH- + Zn 2+ + SО 42 - → 2 Na++SО 42 -+Zn(OH)2↓ Zn 2+ + 2 OH– → Zn(OH)2↓
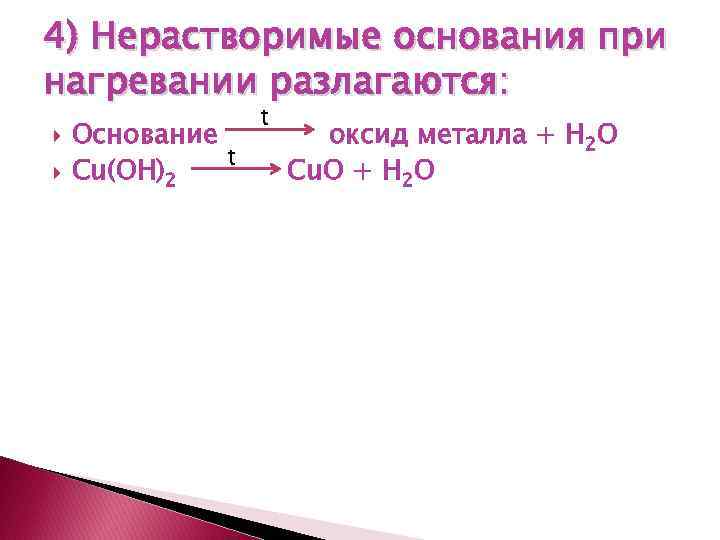 4) Нерастворимые основания при нагревании разлагаются: Основание t Cu(OH)2 t оксид металла + H 2 O Cu. O + H 2 O
4) Нерастворимые основания при нагревании разлагаются: Основание t Cu(OH)2 t оксид металла + H 2 O Cu. O + H 2 O
 Оксиды, их классификация и свойства.
Оксиды, их классификация и свойства.
 Классификация оксидов: По химическим свойствам: Несолеобразующие оксиды – оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют солей. NO, CO, N 2 O Солеобразующие оксиды – оксиды, которые взаимодействуют с кислотами и со щелочами и образуют при этом соль и воду. N 2 O 3, CO 2, SO 2
Классификация оксидов: По химическим свойствам: Несолеобразующие оксиды – оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют солей. NO, CO, N 2 O Солеобразующие оксиды – оксиды, которые взаимодействуют с кислотами и со щелочами и образуют при этом соль и воду. N 2 O 3, CO 2, SO 2
 Солеобразующие оксиды делятся на: Основные оксиды – такие оксиды, которым соответствуют основания. K 2 O - KOH, Ca. O – Ca(OH)2, Fe. O – Fe(OH)2
Солеобразующие оксиды делятся на: Основные оксиды – такие оксиды, которым соответствуют основания. K 2 O - KOH, Ca. O – Ca(OH)2, Fe. O – Fe(OH)2
 Солеобразующие оксиды делятся на: Основные оксиды – такие оксиды, которым соответствуют основания. Кислотные оксиды – такие оксиды, которым соответствуют кислоты. K 2 O - KOH, Ca. O – Ca(OH)2, Fe. O – Fe(OH)2 N 2 O 5 – HNO 3 Si. O 2 – H 2 Si. O 3 P 2 O 5 – H 3 PO 4
Солеобразующие оксиды делятся на: Основные оксиды – такие оксиды, которым соответствуют основания. Кислотные оксиды – такие оксиды, которым соответствуют кислоты. K 2 O - KOH, Ca. O – Ca(OH)2, Fe. O – Fe(OH)2 N 2 O 5 – HNO 3 Si. O 2 – H 2 Si. O 3 P 2 O 5 – H 3 PO 4
 Солеобразующие оксиды делятся на: Основные оксиды – такие оксиды, которым соответствую т основания. K 2 O - KOH, Ca. O – Ca(OH)2, Fe. O – Fe(OH)2 Кислотные оксиды – такие оксиды, которым соответствуют кислоты. N 2 O 5 – HNO 2 Si. O 2 – H 2 Si. O 3 P 2 O 5 – H 3 PO 4
Солеобразующие оксиды делятся на: Основные оксиды – такие оксиды, которым соответствую т основания. K 2 O - KOH, Ca. O – Ca(OH)2, Fe. O – Fe(OH)2 Кислотные оксиды – такие оксиды, которым соответствуют кислоты. N 2 O 5 – HNO 2 Si. O 2 – H 2 Si. O 3 P 2 O 5 – H 3 PO 4
 Домашнее задание: § 39 -40, № 3, с. 217,
Домашнее задание: § 39 -40, № 3, с. 217,