Л3Органические веществаживой клетки.ppt
- Количество слайдов: 51

Органические вещества живой клетки. Белок. Лекции № 3 1

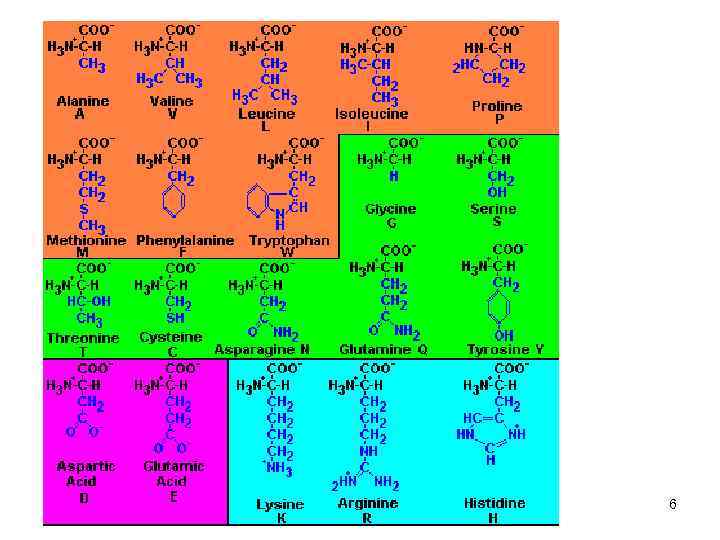
Белки • полимерные молекулы, мономеры - аминокислоты. • В составе белков в организме человека встречают 20 α-аминокислот. • Индивидуальность белковых молекул - порядок чередования аминокислот в белке. • Аминокислоты - буквы алфавита, ими, как в слове, записывается информация. • От последовательности аминокислот зависит пространственная структура и функции белка. 2

Общие структурные особенности аминокислот, входящих в состав белков • наличие амино- и карбоксильной групп, соединённых с одним и тем же αуглеродным атомом. • R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение. 3

• В водных растворах при нейтральном значении р. Н α- аминокислоты существуют в виде биполярных ионов. • в природе а/к -в двух изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного α-углеродного атома, так как его радикал представлен только атомом водорода. • В составе белков присутствуют только L -изомеры аминокислот. 4
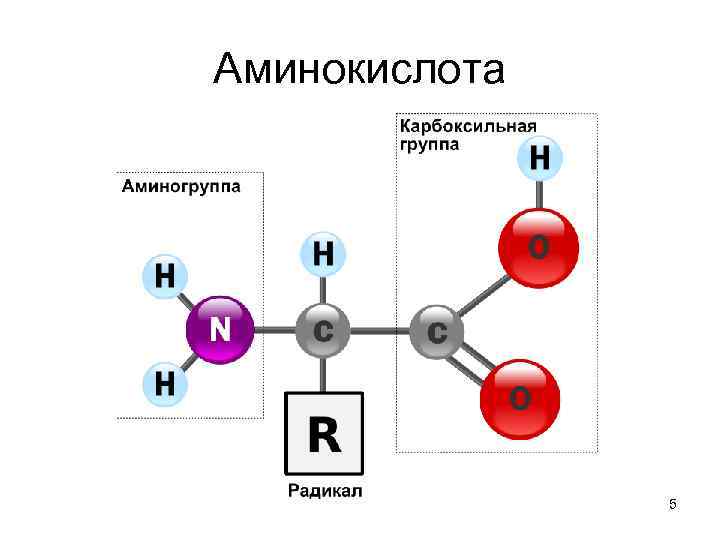
Аминокислота 5
6

Классификация аминокислот По радикалу • Неполярные: глицин, аланин, валин, изолейцин, лейц ин, пролин, метионин, фенилаланин, триптофан • Полярные незаряженные (заряды скомпенсированы) при p. H=7: серин, треонин, цистеин, аспарагин, глутами н, тирозин • Полярные заряженные отрицательно при p. H<7: аспарагиновая к-та, глутаминовая к-та • Полярные заряженные положительно при p. H>7: лизин, аргинин, гистидин 7

Классификация аминокислот • По функциональным группам Ароматические: фенилаланин, тирозин, триптофан Гетероциклические: гистидин, пролин Серосодержащие: цистеин, метионин Нециклические: все остальные 8

Классификация аминокислот Незаменимые – валин, изолейцин, треонин, мети онин, лизин, фенилаланин, триптофан, аргинин, гистидин. Заменимые – глицин, аланин, пролин, серин, цистеин, а спартат, аспарагин, глутамат, глутами н, тирозин. 9

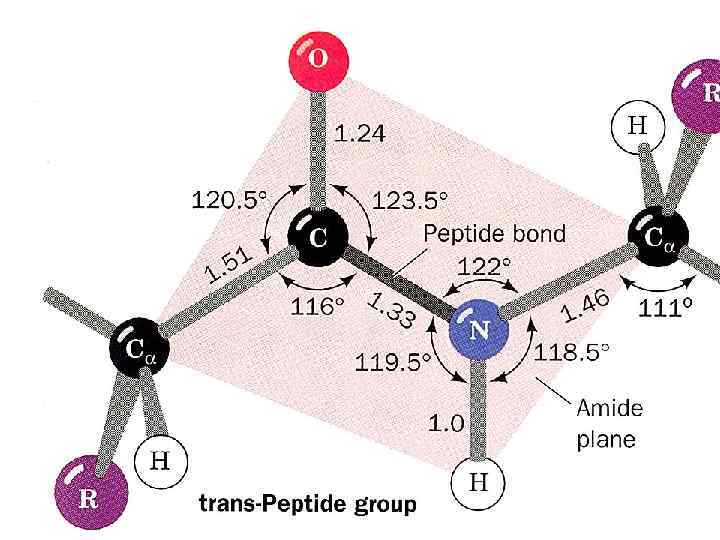
Пептидная связь • α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. • Пептидная связь образуется между акарбоксильной группой одной аминокислоты и α-аминогруппой другой, т. е. является амидной связью. – отщепление молекулы воды 10
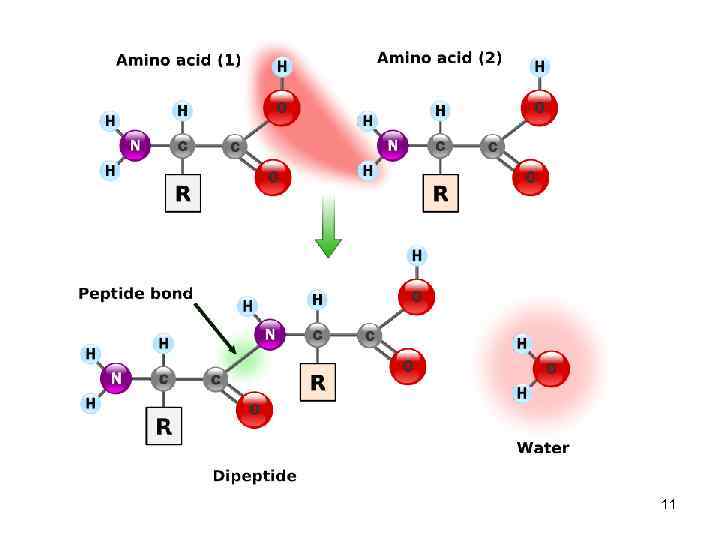
11

Пептиды • Пептиды до 10 аминокислот - олигопептиды по количеству аминокислот: трипептид, пентапептид, октапептид • Пептиды, содержащие более 10 аминокислот – полипептиды • Полипептиды, из более 50 аминокислотных остатков – белки, хотя глюкагон, состоящий из 29 аминокислот, называют белковым гормоном 12
13

СТРУКТУРА БЕЛКА • Пептидные цепи содержат а/к остатки, соединены пептидными связями. (прочные, разрыв - фермент) • Белок имее определённую пространственную структуру, она определяет функции белка. • Различают 4 уровня структурной организации белков 14
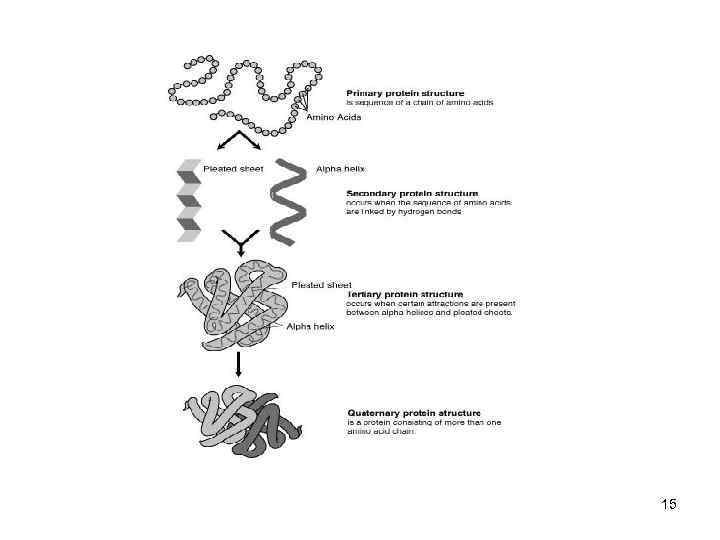
15

Первичная структура белка • линейная последовательность а/к в полипептидной цепи • первичная структура каждого белка закодирована в одном гене 16

Вторичная структура белка • Линейные цепи ак приобретают пространственную трёхмерную структуру -"конформацию". • образуется за счёт взаимодействия функциональных групп аминокислот • обусловлена первичной структурой белка. 17

Вторичная структура белка • регулярные структуры двух типов: αспираль и β-структура. 18
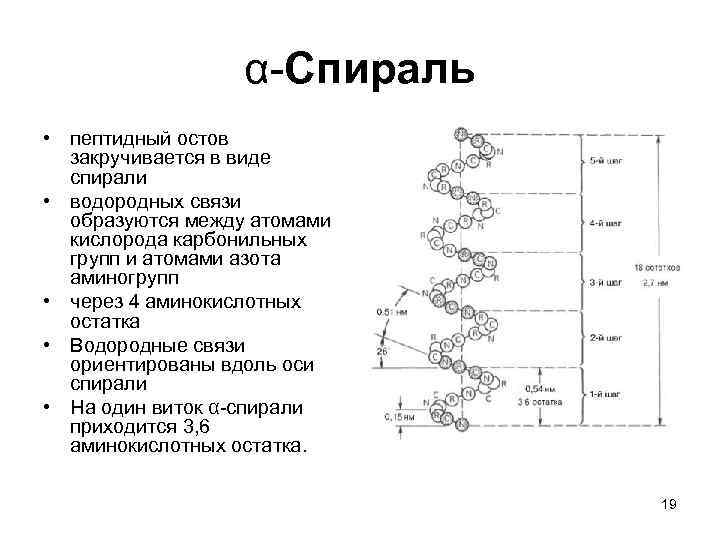
α-Спираль • пептидный остов закручивается в виде спирали • водородных связи образуются между атомами кислорода карбонильных групп и атомами азота аминогрупп • через 4 аминокислотных остатка • Водородные связи ориентированы вдоль оси спирали • На один виток α-спирали приходится 3, 6 аминокислотных остатка. 19
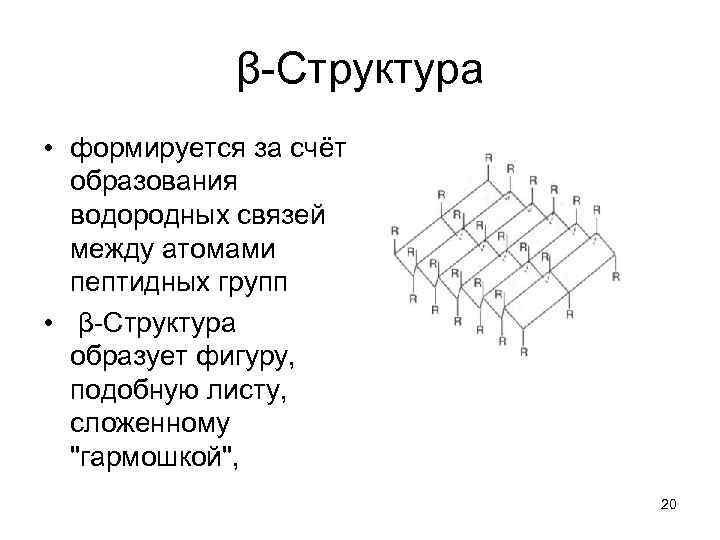
β-Структура • формируется за счёт образования водородных связей между атомами пептидных групп • β-Структура образует фигуру, подобную листу, сложенному "гармошкой", 20
21

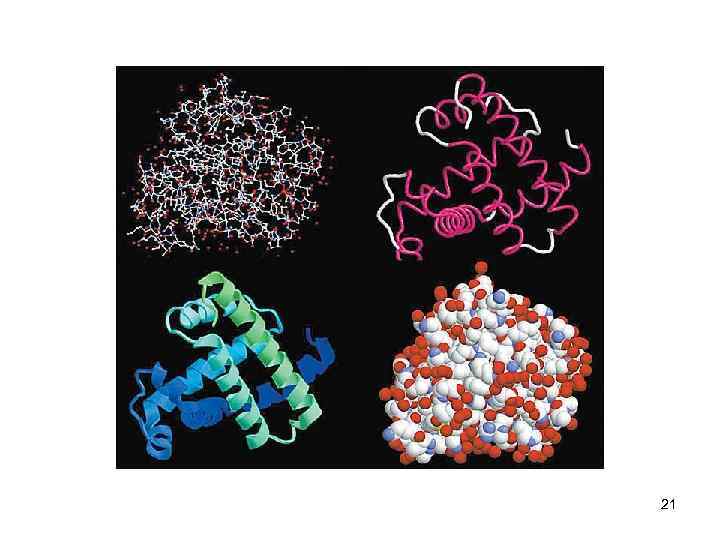
Третичная структура белков • трёхмерная пространственная структура • образуетсяза счёт взаимодействий между радикалами аминокислот, стоящих на значительном расстоянии друг от друга в цепи • функционально активная конформация - "нативная структура". 22

Гидрофобные взаимодействия • гидрофобные радикалы аминокислот стремятся к объединению • внутри белковой глобулы формируется гидрофобное ядро • гидрофильные радикалы а/к стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы. 23

Ионные связи • могут возникать между отрицательно заряженными (анионными) карбоксильными группами радикалов асп и глу кислот и положительно заряженными (катионными) группами радикалов лизина, аргинина или гистидина 24

Ковалентные связи • Третичную структуру некоторых белков стабилизируют дисульфидные связи, образующиеся за счёт взаимодействия SH-групп двух остатков цистеина. • могут находиться далеко друг от друга в линейной молекуле, но сближаются и образуют ковалентную связь 25

Денатурация белков • Гидрофобные взаимодействия, а также ионные и водородные связи относят к числу слабых • Разрыв большого количества слабых связей (t, хим. реакции и т. п. ) к разрушению нативной конформации белка • утрата специфической функции белков 26

Доменная структура белков • Если полипептидная цепь белка содержит более 200 аминокислот, как правило, её пространственная структура сформирована в виде двух или более доменов. • Домен - участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулярного белка. 27

Четвертичная структура белков • существуют белки, состоящие из двух и более полипептидных цепей • после формирования трёхмерной структуры каждой полипептидной цепи они объединяются • связи, соединяющие полипептидные цепи: гидрофобные, ионные, водородные • отдельные полипептидные цепи - субъединицы 28
29

Функции белков в организме 1. 2. 3. 4. 5. 6. 7. 8. 9. Каталитическая функция Структурная функция Защитная функция Регуляторная функция Сигнальная функция Транспортная функция Запасная (резервная) функция белков Рецепторная функция Моторная (двигательная) функция 30

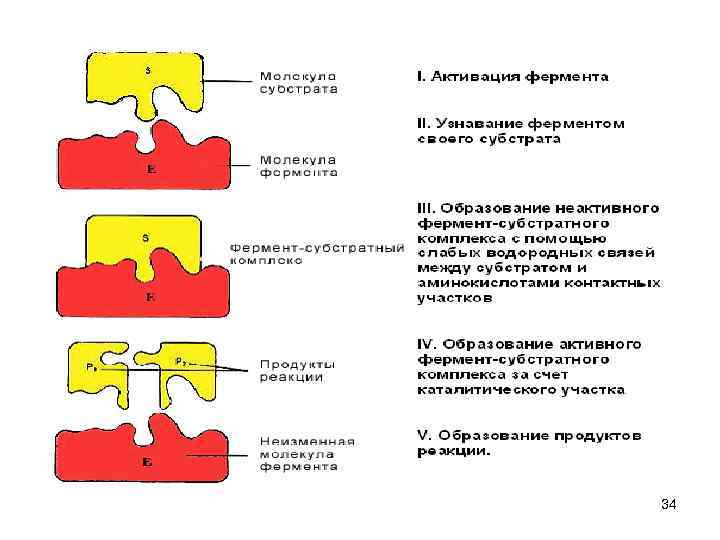
Каталитическая функция • Ферменты (энзимы) – белки - увеличивают скорость протекания химической реакции, при этом не расходуются • биологическая функция фермента обусловлена наличием в его структуре активного центра (АЦ) • в АЦ фермента есть участки связывания субстрата, и участки химического превращения субстрата (каталитический участок). 31

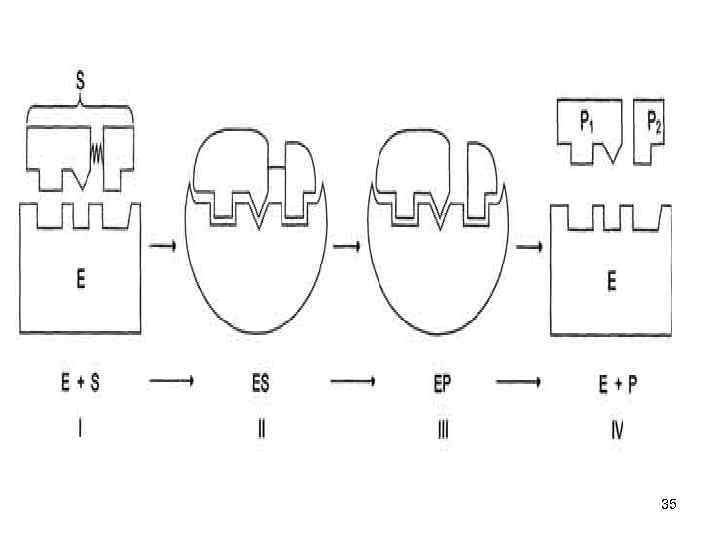
Фермент-субстратные реакции • В участке связывания субстрат связывается с ферментом - ферментсубстратный комплекс. • В каталитическом участке субстрат превращается в продукт • продукт отщепляется от активного центра фермента. 32

Катализ • Схематично процесс катализа можно представить следующим уравнением: Е + S ↔ ES ↔ ЕР ↔ Е + Р, • где Е - фермент (энзим), S - субстрат, Р - продукт. 33
34
35
36

Специфичность наиболее важное свойство ферментов. • субстратная сп. - способность фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. 37

Специфичность Выделяют 1. абсолютную субстратную специфичность (катализ 1 субстрата) - аргиназа; 2. групповую субстратную специфичность однотипные реакции с группой структурно похожих субстратов - панкреатическая липаза ; 3. стереоспецифичность ферментов к стереоизомерам (Lаминокислотам ) 38

Каталитическая специфичность • Фермент превращает субстрат по одному из возможных путей его превращения • Зависит от строения каталитического участка активного центра фермента • глюкозо-6 -фосфат в клетках печени человека - субстрат 4 различных ферментов; фосфоглюкомутазы, глюкозо-6 -фосфатазы, фосфоглюкоизомеразы и глюкозо-6 фосфатдегидрогеназы 39

Классы ферментов 1. Оксидоредуктазы, катализирующие окисление или восстановление алкогольдегидрогеназа 2. Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз выделяют киназы, переносящие фосфатную группу с молекулы АТФ. 3. Гидролазы, катализирующие гидролиз химических связей. Пример: пепсин, трипсин, амилаза,

Классы ферментов 4. Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов. 5. Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата. 6. Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. - ДНК-полимераза

КОФАКТОРЫ И КОФЕРМЕНТЫ Большинство ферментов для активности нуждается в: • низкомолекулярных органических соединениях небелковой природы (коферментах) • и/или в ионах металлов (кофакторах) Zn 2+, Mg 2+, Mn 2+, Fe 2+, Cu 2+, K+, Na+ . 42

Регуляция работы ферментов Активность ферментов зависит от количества: • молекул субстрата • продукта • наличия кофакторов и коферментов. Каскад : продукт одной ферментативной реакции является субстратом другой, образуя таким образом "метаболические пути". 43

Среди множества ферментов практически каждого метаболического пути различают ключевые, или регуляторные, ферменты, активность которых может изменяться в зависимости от потребности клетки в конечном продукте метаболического пути. 44

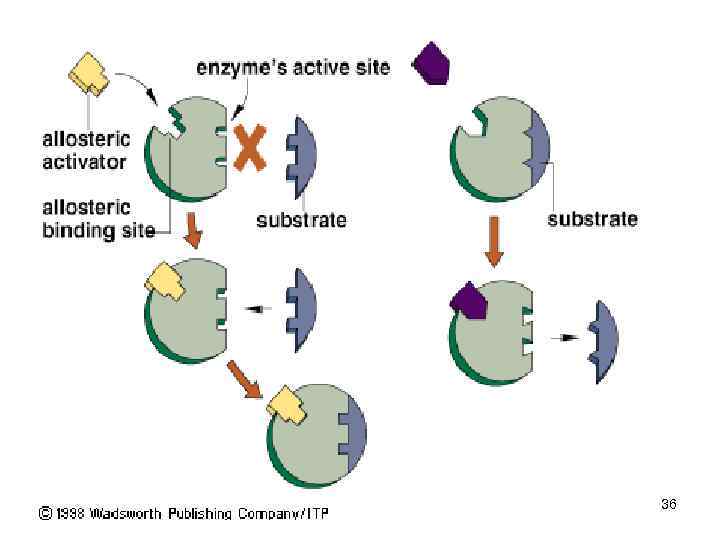
Основные способы регуляции активности ферментов • Аллостерическая регуляция. • Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. • Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра • Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. • Активность может увеличиться — это активация фермента, или уменьшиться — это ингибирование.

Регуляция активности ферментов путем фосфорилирования—дефосфорилирования . • Фермент изменяет активность в результате ковалентной модификации.
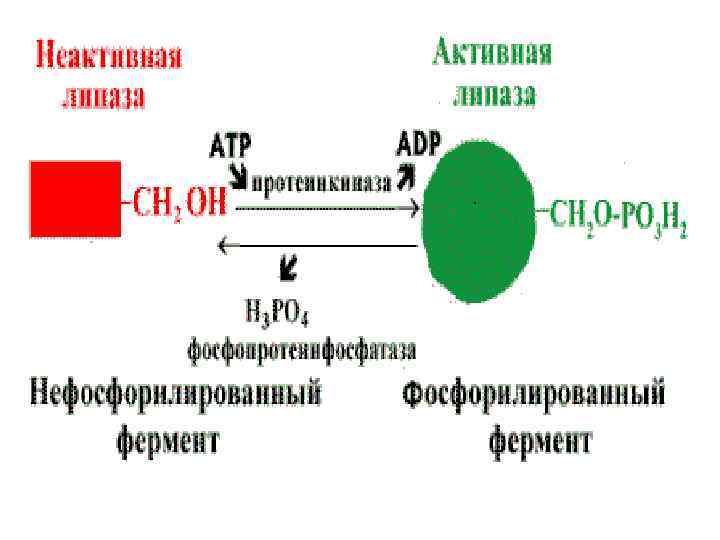

Активация ферментов путем частичного протеолиза. • Некоторые ферменты синтезируются первоначально неактивными и лишь после секреции из клетки переходят в активную форму. • Неактивный предшественник называется проферментом. • Активация профермента включает модификацию первичной структуры с одновременным изменением конформации. • Например, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента с N—конца

Ингибиторы ферментов • Действие ферментов можно полностью или частично подавить (ингибировать) химическими веществами (ингибиторами). • По характеру действия ингибиторы могут быть обратимыми и необратимыми. - прочность соединения ингибитора с ферментом.
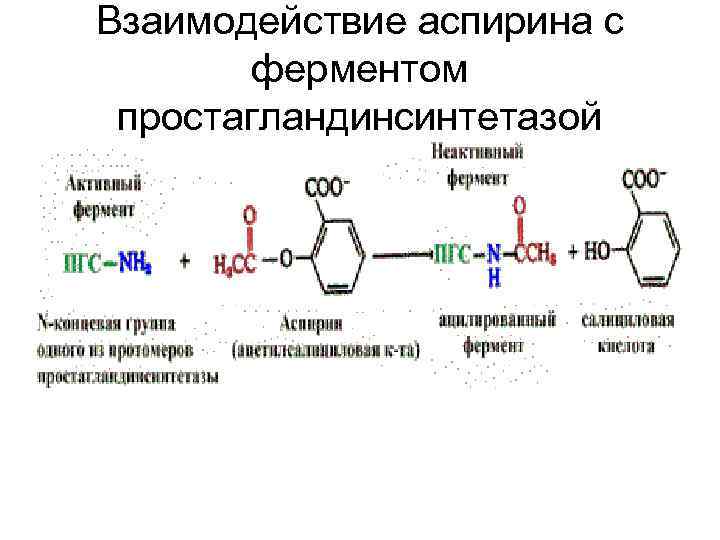
Взаимодействие аспирина с ферментом простагландинсинтетазой

Терапевтическое действие аспирина • как жаропонижающего и противовоспалительного средства • аспирин ингибирует один из ферментов, катализирующий синтез простагландинов (ПГ). Простагландины — вещества, участвующие в развитии воспаления. • Ингибирование обусловлено ковалентной модификацией одной из аминогрупп фермента — простагландинсинтетазы.
Л3Органические веществаживой клетки.ppt