Органические соединения.ppt
- Количество слайдов: 33
 Органические соединения, ВМС и их применение. • Низкомолекулярные органические соединения имеют длину углеродной цепи от 2 -х до 50 -ти. • ВМС (высокомолекулярные соединения) – соответственно 100 – 1000 атомов углерода и молекулярный вес 103– 106 а. е. м. Для ВМС характерно только конденсированное состояние (жидкое, твердое).
Органические соединения, ВМС и их применение. • Низкомолекулярные органические соединения имеют длину углеродной цепи от 2 -х до 50 -ти. • ВМС (высокомолекулярные соединения) – соответственно 100 – 1000 атомов углерода и молекулярный вес 103– 106 а. е. м. Для ВМС характерно только конденсированное состояние (жидкое, твердое).
 Отличительные особенности органических соединений. • По Бутлерову свойства химических соединений зависят от порядка химической связи между атомами и от взаимного влияния атомов в молекуле.
Отличительные особенности органических соединений. • По Бутлерову свойства химических соединений зависят от порядка химической связи между атомами и от взаимного влияния атомов в молекуле.
 1. Явление изомерии.
1. Явление изомерии.
 1. 2. Характерные связи между атомами в молекуле. • • • В большинстве случаев связь между атомами в молекуле ковалентная. Органические вещества в органических соединениях – неэлектролиты, не диссоциируют в растворах на ионы, медленно взаимодействуют друг с другом. Атомы углерода не проявляют выраженную склонность отдавать или присоединять электроны. Углерод занимает промежуточное место между металлами и неметаллами.
1. 2. Характерные связи между атомами в молекуле. • • • В большинстве случаев связь между атомами в молекуле ковалентная. Органические вещества в органических соединениях – неэлектролиты, не диссоциируют в растворах на ионы, медленно взаимодействуют друг с другом. Атомы углерода не проявляют выраженную склонность отдавать или присоединять электроны. Углерод занимает промежуточное место между металлами и неметаллами.
 3. Характер связи. • • • В органических соединениях образуются углеродные цепи практически неограниченной длины. Тетраэдрическая структура атомов углерода входящих в цепь, определяет зигзагообразное строение. Способность вращения атомов вокруг оси связи – конформация.
3. Характер связи. • • • В органических соединениях образуются углеродные цепи практически неограниченной длины. Тетраэдрическая структура атомов углерода входящих в цепь, определяет зигзагообразное строение. Способность вращения атомов вокруг оси связи – конформация.
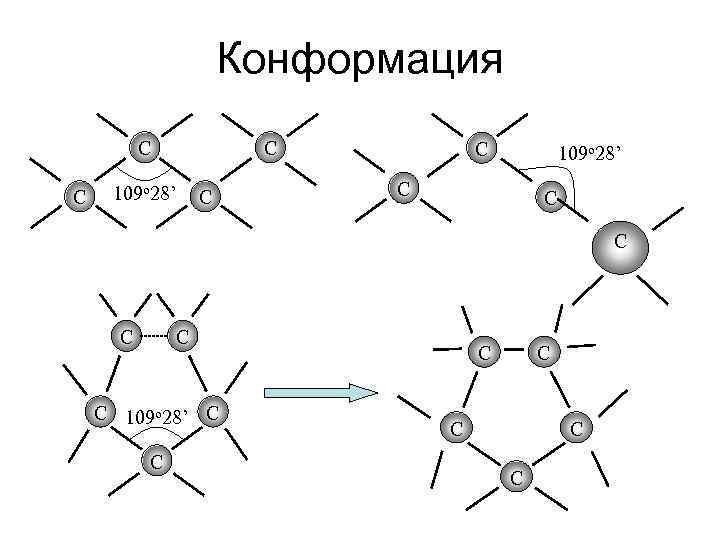 Конформация С С С 109 о 28’ С С С С
Конформация С С С 109 о 28’ С С С С
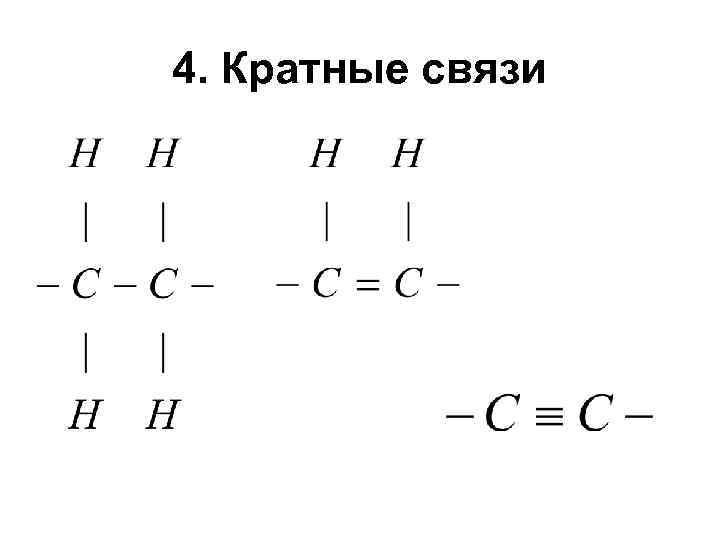 4. Кратные связи
4. Кратные связи
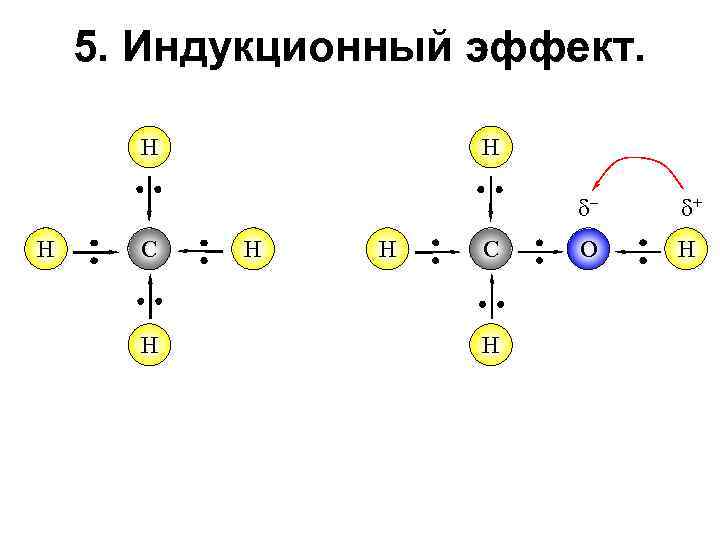 5. Индукционный эффект. Н Н – Н С Н Н Н С Н + О Н
5. Индукционный эффект. Н Н – Н С Н Н Н С Н + О Н
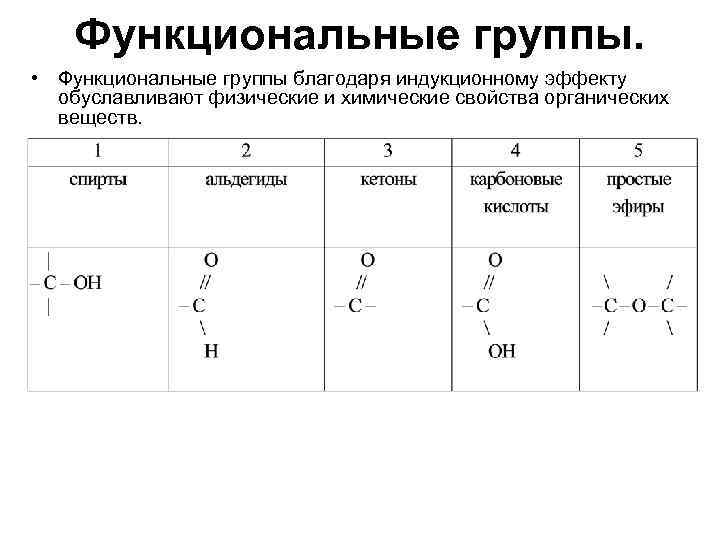 Функциональные группы. • Функциональные группы благодаря индукционному эффекту обуславливают физические и химические свойства органических веществ.
Функциональные группы. • Функциональные группы благодаря индукционному эффекту обуславливают физические и химические свойства органических веществ.
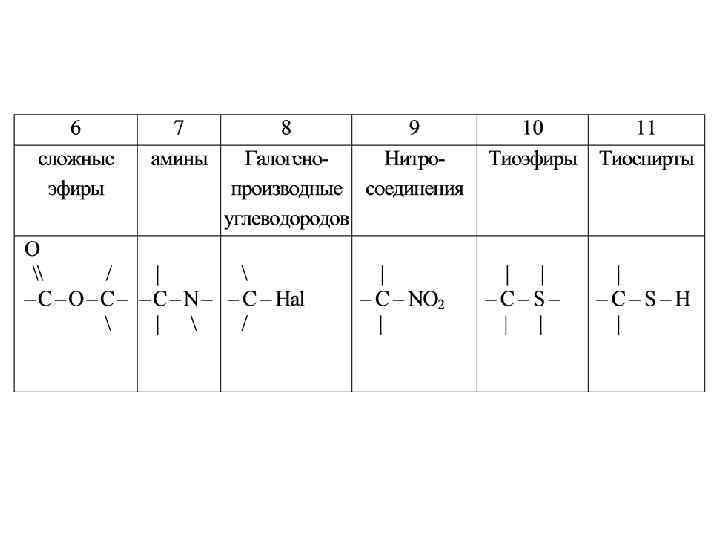
 Многочисленные органические соединения (больше 7000000) делят на три большие группы: I. Алифатические – соединения с открытой цепью атомов углерода (нет циклов). Алифатические соединения бывают предельные и непредельные. II. Карбоциклические соединения – соединения содержат замкнутое кольцо. Они могут быть предельные и непредельные. К этой группе относятся ароматические соединения, содержащие бензольное кольцо. III. Гетероциклические соединения – в построении колец участвуют не только атомы углерода, но и атомы других химических элементов, например, азот.
Многочисленные органические соединения (больше 7000000) делят на три большие группы: I. Алифатические – соединения с открытой цепью атомов углерода (нет циклов). Алифатические соединения бывают предельные и непредельные. II. Карбоциклические соединения – соединения содержат замкнутое кольцо. Они могут быть предельные и непредельные. К этой группе относятся ароматические соединения, содержащие бензольное кольцо. III. Гетероциклические соединения – в построении колец участвуют не только атомы углерода, но и атомы других химических элементов, например, азот.
 Полимеры – – химические соединения, молекулы которых состоят из многократно повторяющихся атомных группировок (элементарных звеньев) соединенных химическими связями в длинные цепи. • Молекулярная масса полимеров составляет 5000 – 200000 у. е.
Полимеры – – химические соединения, молекулы которых состоят из многократно повторяющихся атомных группировок (элементарных звеньев) соединенных химическими связями в длинные цепи. • Молекулярная масса полимеров составляет 5000 – 200000 у. е.
 Физико-химические свойства полимеров: • • Полимеры могут пребывать в характерном только для них высокоэластичном состоянии; Растворы полимеров имеют высокую вязкость; Полимеры – нелетучие вещества; Полимеры могут образовывать волокна, пленки, отличающиеся анизотропией свойств.
Физико-химические свойства полимеров: • • Полимеры могут пребывать в характерном только для них высокоэластичном состоянии; Растворы полимеров имеют высокую вязкость; Полимеры – нелетучие вещества; Полимеры могут образовывать волокна, пленки, отличающиеся анизотропией свойств.
 Свойства полимеров определяются структурой. • Для полимерных веществ с линейными и разветвленными макромолекулами характерны два типа связи: 1. Между атомами действуют прочные ковалентные химические связи длиной 0, 1 – 0, 15 нм. 2. Взаимодействие между цепными молекулами осуществляется за счет сил Ван-дер-Ваальса, проявляющихся на расстоянии 0, 3 – 0, 4 нм. Иногда между макромолекулами возникают водородные связи.
Свойства полимеров определяются структурой. • Для полимерных веществ с линейными и разветвленными макромолекулами характерны два типа связи: 1. Между атомами действуют прочные ковалентные химические связи длиной 0, 1 – 0, 15 нм. 2. Взаимодействие между цепными молекулами осуществляется за счет сил Ван-дер-Ваальса, проявляющихся на расстоянии 0, 3 – 0, 4 нм. Иногда между макромолекулами возникают водородные связи.
 Методы получения полимеров. • Исходными веществами для синтеза полимеров являются низкомолекулярные мономеры. Упрощенная схема синтеза: • Существуют два способа получения ВМС: 1. полимеризация; 2. поликонденсация.
Методы получения полимеров. • Исходными веществами для синтеза полимеров являются низкомолекулярные мономеры. Упрощенная схема синтеза: • Существуют два способа получения ВМС: 1. полимеризация; 2. поликонденсация.
 Метод полимеризации. Получение полиэтилена: Получение полипропилена:
Метод полимеризации. Получение полиэтилена: Получение полипропилена:
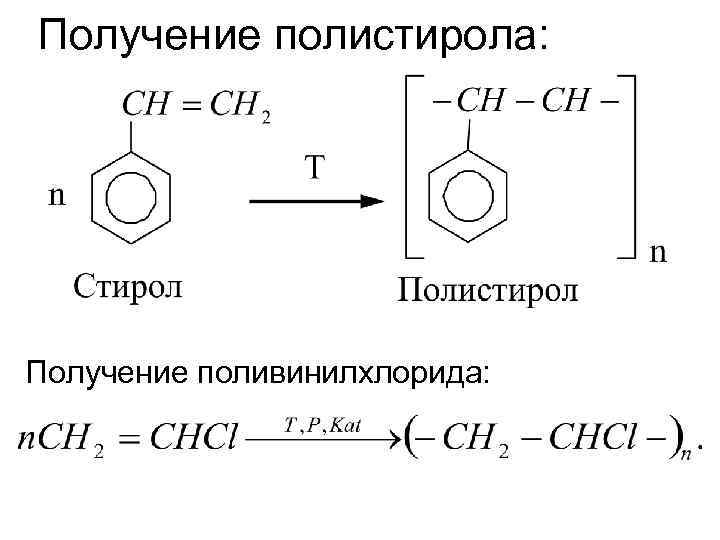 Получение полистирола: Получение поливинилхлорида:
Получение полистирола: Получение поливинилхлорида:
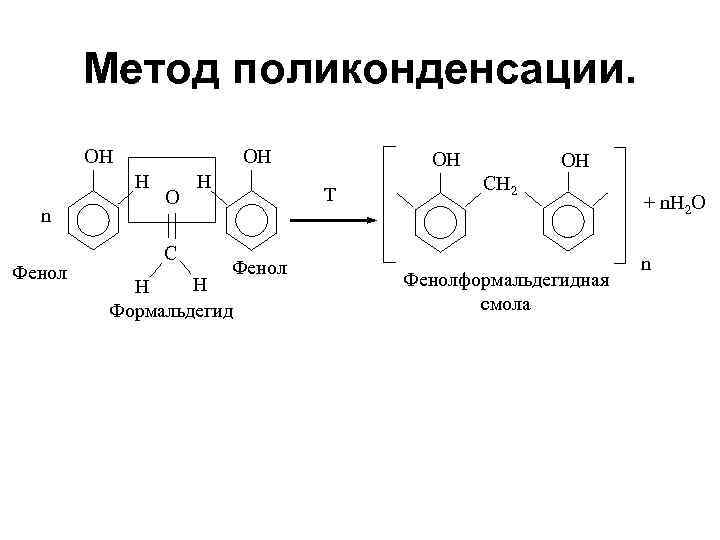 Метод поликонденсации. OH OH H n Фенол O C H OH Т Фенол H H Формальдегид OH CH 2 Фенолформальдегидная смола + n. H 2 O n
Метод поликонденсации. OH OH H n Фенол O C H OH Т Фенол H H Формальдегид OH CH 2 Фенолформальдегидная смола + n. H 2 O n
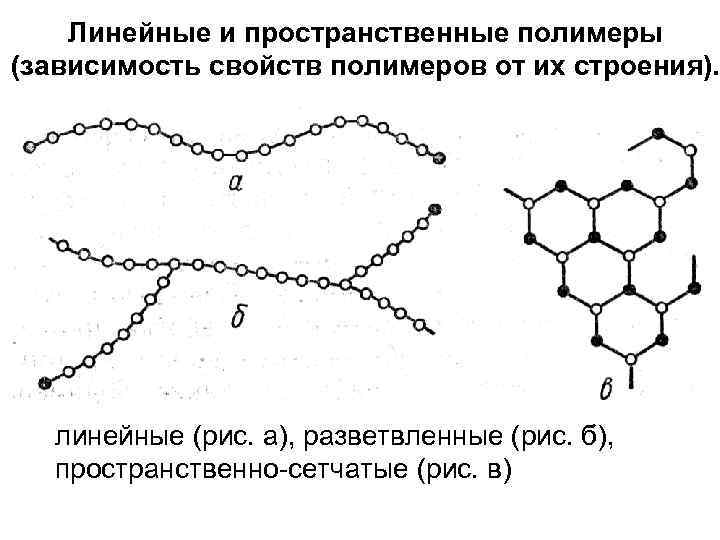 Линейные и пространственные полимеры (зависимость свойств полимеров от их строения). линейные (рис. а), разветвленные (рис. б), пространственно-сетчатые (рис. в)
Линейные и пространственные полимеры (зависимость свойств полимеров от их строения). линейные (рис. а), разветвленные (рис. б), пространственно-сетчатые (рис. в)
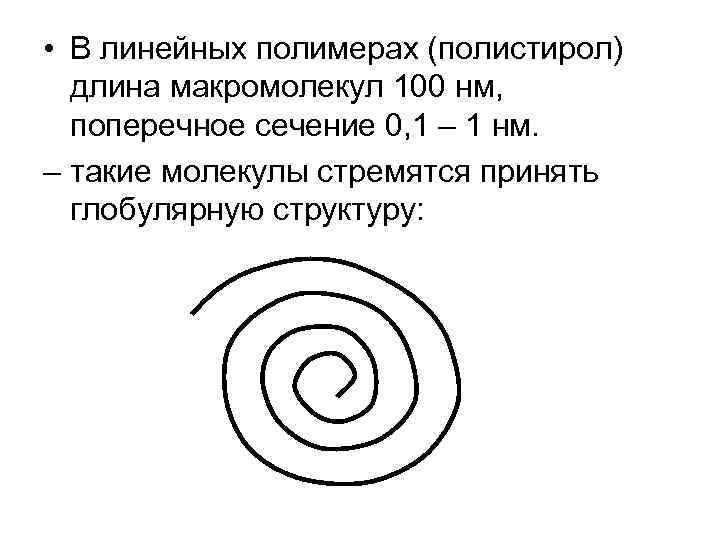 • В линейных полимерах (полистирол) длина макромолекул 100 нм, поперечное сечение 0, 1 – 1 нм. – такие молекулы стремятся принять глобулярную структуру:
• В линейных полимерах (полистирол) длина макромолекул 100 нм, поперечное сечение 0, 1 – 1 нм. – такие молекулы стремятся принять глобулярную структуру:
 • Линейные полимеры – эластичны, способны набухать, растворятся в растворителях и обладают термопластичными свойствами. • Разветвленные полимеры – обладают высокой прочностью, плохо растворимы и менее эластичны. Некоторые разветвленные полимеры при нагревании могут необратимо перейти в твердое неплавкое состояние. Это происходит вследствие образования пространственной сетчатой структуры (термореактивное свойство). – В сетчатых полимерах резко возрастает прочностные и динамические свойства, уменьшается способность к растворению.
• Линейные полимеры – эластичны, способны набухать, растворятся в растворителях и обладают термопластичными свойствами. • Разветвленные полимеры – обладают высокой прочностью, плохо растворимы и менее эластичны. Некоторые разветвленные полимеры при нагревании могут необратимо перейти в твердое неплавкое состояние. Это происходит вследствие образования пространственной сетчатой структуры (термореактивное свойство). – В сетчатых полимерах резко возрастает прочностные и динамические свойства, уменьшается способность к растворению.
 Сополимеризация – • Совместная полимеризация двух или нескольких мономеров. • Полимеры – называются сополимерами. • Мономеры в макромолекуле соединенные, беспорядочно называются статистическими (двух- и трехзвенные, рис. а и б). • Мономеры соединенные, упорядочено – называются регулярными (рис. в). • На рис. (г) – регулярный, сшитый сополимер.
Сополимеризация – • Совместная полимеризация двух или нескольких мономеров. • Полимеры – называются сополимерами. • Мономеры в макромолекуле соединенные, беспорядочно называются статистическими (двух- и трехзвенные, рис. а и б). • Мономеры соединенные, упорядочено – называются регулярными (рис. в). • На рис. (г) – регулярный, сшитый сополимер.

 Кристаллы полимеров. • Переход жидкого полимера в твердое состояние осуществляется кристаллизацией или стеклованием, в результате образуются кристаллические и аморфные полимеры. • Характерным состоянием полимеров является – аморфное состояние. • Аморфные полимеры могут быть в виде глобул и пачек. Под влиянием теплового воздействия пачки цепных молекул начинают ориентироваться по отношению друг к другу.
Кристаллы полимеров. • Переход жидкого полимера в твердое состояние осуществляется кристаллизацией или стеклованием, в результате образуются кристаллические и аморфные полимеры. • Характерным состоянием полимеров является – аморфное состояние. • Аморфные полимеры могут быть в виде глобул и пачек. Под влиянием теплового воздействия пачки цепных молекул начинают ориентироваться по отношению друг к другу.
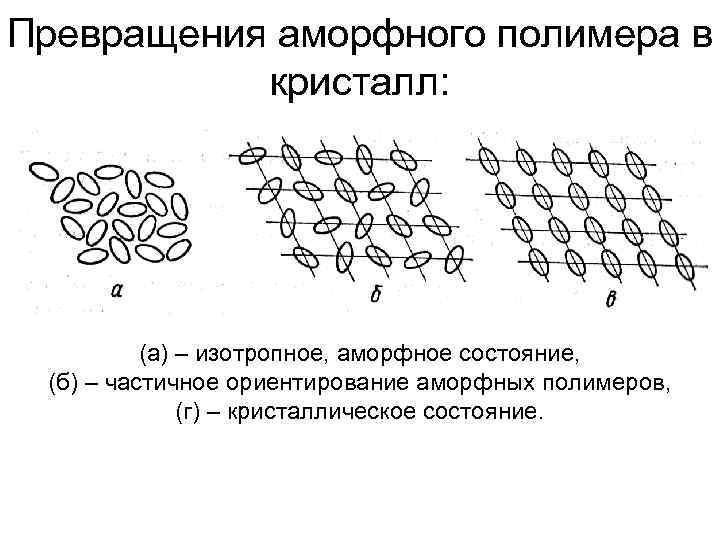 Превращения аморфного полимера в кристалл: (а) – изотропное, аморфное состояние, (б) – частичное ориентирование аморфных полимеров, (г) – кристаллическое состояние.
Превращения аморфного полимера в кристалл: (а) – изотропное, аморфное состояние, (б) – частичное ориентирование аморфных полимеров, (г) – кристаллическое состояние.
 Электронно-микроскопическое изображение кристаллических пачек поликарбоната – фибрилляры
Электронно-микроскопическое изображение кристаллических пачек поликарбоната – фибрилляры
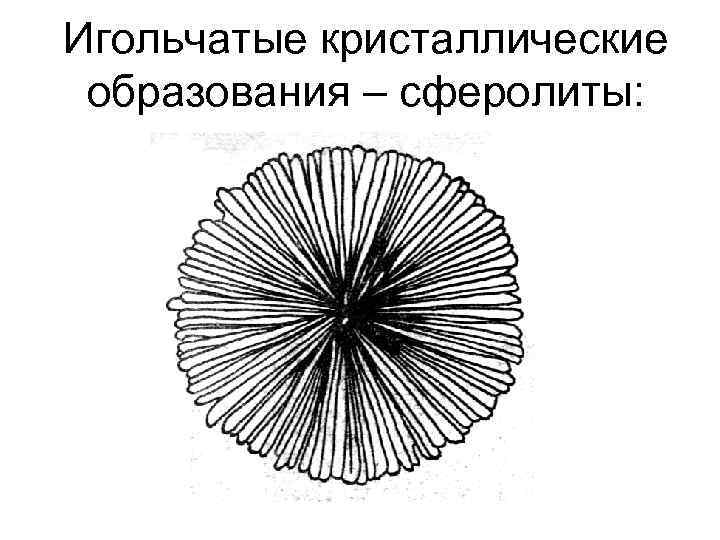 Игольчатые кристаллические образования – сферолиты:
Игольчатые кристаллические образования – сферолиты:
 Оптические картины двух типов сферолитов полимеров в поляризационном микроскопе.
Оптические картины двух типов сферолитов полимеров в поляризационном микроскопе.
 Электронно-микроскопическое изображение единичных кристаллов полиэтилена.
Электронно-микроскопическое изображение единичных кристаллов полиэтилена.
 Аморфные глобулярные полимеры при определенных кинетических условиях могут быть организованы в кристаллы:
Аморфные глобулярные полимеры при определенных кинетических условиях могут быть организованы в кристаллы:
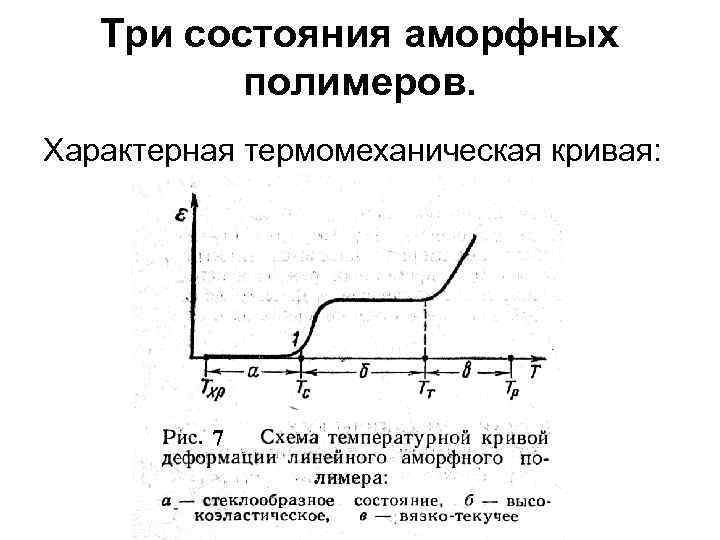 Три состояния аморфных полимеров. Характерная термомеханическая кривая: 7
Три состояния аморфных полимеров. Характерная термомеханическая кривая: 7
 Пластмассы – Вещества, состоящие из ВМС (50 -60%), красителей и наполнителей. • В качестве наполнителей используются древесные опилки, асбест, стекловолокно, текстиль, бумага и др. • Изделия из пластмасс формируются горячим прессованием, литьем под давлением. • Пластмасса при комнатной температуре теряет пластичность и превращается в твердый материал. • Пластмассы могут быть термореактивными и термопластичными.
Пластмассы – Вещества, состоящие из ВМС (50 -60%), красителей и наполнителей. • В качестве наполнителей используются древесные опилки, асбест, стекловолокно, текстиль, бумага и др. • Изделия из пластмасс формируются горячим прессованием, литьем под давлением. • Пластмасса при комнатной температуре теряет пластичность и превращается в твердый материал. • Пластмассы могут быть термореактивными и термопластичными.


