Органическая химия л.5.ppt
- Количество слайдов: 31
 Органическая химия Курс лекций для учащихся Лицея НГТУ Афонина Любовь Игоревна канд. хим. наук, научный сотрудник ИХТТМ СО РАН, доцент кафедры химии НГТУ 2/1/2018
Органическая химия Курс лекций для учащихся Лицея НГТУ Афонина Любовь Игоревна канд. хим. наук, научный сотрудник ИХТТМ СО РАН, доцент кафедры химии НГТУ 2/1/2018
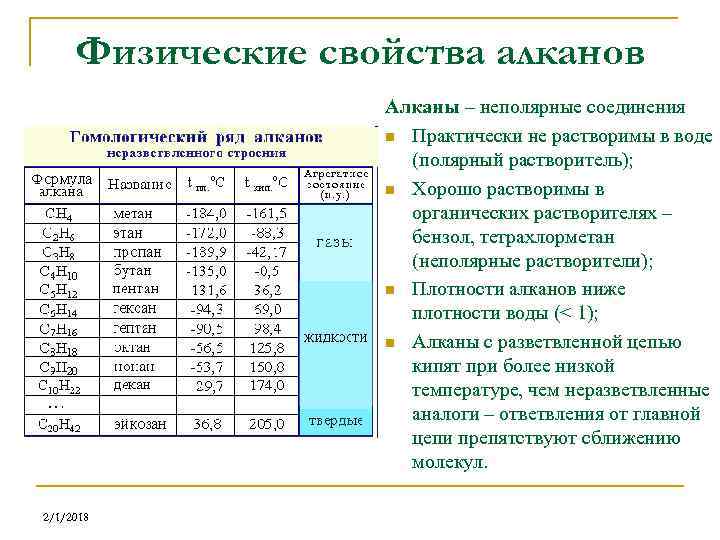 Физические свойства алканов Алканы – неполярные соединения n Практически не растворимы в воде (полярный растворитель); n Хорошо растворимы в органических растворителях – бензол, тетрахлорметан (неполярные растворители); n Плотности алканов ниже плотности воды (< 1); n Алканы с разветвленной цепью кипят при более низкой температуре, чем неразветвленные аналоги – ответвления от главной цепи препятствуют сближению молекул. 2/1/2018
Физические свойства алканов Алканы – неполярные соединения n Практически не растворимы в воде (полярный растворитель); n Хорошо растворимы в органических растворителях – бензол, тетрахлорметан (неполярные растворители); n Плотности алканов ниже плотности воды (< 1); n Алканы с разветвленной цепью кипят при более низкой температуре, чем неразветвленные аналоги – ответвления от главной цепи препятствуют сближению молекул. 2/1/2018
 Химические свойства алканов Химические свойства любого соединения определяются его строением, т. е. природой входящих в его состав атомов и характером связей между ними. 2/1/2018
Химические свойства алканов Химические свойства любого соединения определяются его строением, т. е. природой входящих в его состав атомов и характером связей между ними. 2/1/2018
 n n В молекулах алканов все атомы связаны друг с другом σ – связями; Валентности атомов С, не затраченные на связь друг с другом, полностью насыщены атомами Н; Это прочные соединения, в обычных условиях малоактивны. Предельная насыщенность алканов не допускает реакций присоединения, но не препятствует реакциям разложения, изомеризации и замещения; симметричность неполярных С–С и слабополярных С–Н ковалентных связей предполагает их гомолитический (симметричный) разрыв на свободные радикалы под действием света, температуры или катализаторов; Для реакций алканов характерен радикальный механизм. 2/1/2018
n n В молекулах алканов все атомы связаны друг с другом σ – связями; Валентности атомов С, не затраченные на связь друг с другом, полностью насыщены атомами Н; Это прочные соединения, в обычных условиях малоактивны. Предельная насыщенность алканов не допускает реакций присоединения, но не препятствует реакциям разложения, изомеризации и замещения; симметричность неполярных С–С и слабополярных С–Н ковалентных связей предполагает их гомолитический (симметричный) разрыв на свободные радикалы под действием света, температуры или катализаторов; Для реакций алканов характерен радикальный механизм. 2/1/2018
 Реакции радикального замещения В молекулах алканов связи C-Н пространственно более доступны для атаки другими частицами, чем менее прочные связи C-C, поэтому атом Н может быть замещен различными атомами или группами атомов. 1. Галогенирование (Cl 2, Br 2) - реакция замещения атомов водорода в молекуле алкана на галоген с образованием галогенпроизводных УВ. Реакция идет на свету или при нагревании. При избытке Cl 2 он последовательно замещает все атомы Н: 2/1/2018
Реакции радикального замещения В молекулах алканов связи C-Н пространственно более доступны для атаки другими частицами, чем менее прочные связи C-C, поэтому атом Н может быть замещен различными атомами или группами атомов. 1. Галогенирование (Cl 2, Br 2) - реакция замещения атомов водорода в молекуле алкана на галоген с образованием галогенпроизводных УВ. Реакция идет на свету или при нагревании. При избытке Cl 2 он последовательно замещает все атомы Н: 2/1/2018
 Аналогично протекает реакция хлорирования этана: СН 3 — СН 3 + Сl 2 СН 3 — СН 2 Сl + НСl хлорэтан СН 3 — СНСl 2 + НСl дихлорэтан На второй стадии хлорирования преимущественно замещается атом водорода, связанный с тем атомом углерода, где уже произошло замещение. n n Фтор реагирует с алканами очень энергично, рвутся все связи C-Н и C-C, продукты реакции – тетрафторметан СН 4 и фтороводород НF. С иодом алканы практически не взаимодействуют. 2/1/2018
Аналогично протекает реакция хлорирования этана: СН 3 — СН 3 + Сl 2 СН 3 — СН 2 Сl + НСl хлорэтан СН 3 — СНСl 2 + НСl дихлорэтан На второй стадии хлорирования преимущественно замещается атом водорода, связанный с тем атомом углерода, где уже произошло замещение. n n Фтор реагирует с алканами очень энергично, рвутся все связи C-Н и C-C, продукты реакции – тетрафторметан СН 4 и фтороводород НF. С иодом алканы практически не взаимодействуют. 2/1/2018
 Реакция галогенирования алканов протекает по радикальному цепному механизму (акад. Семенов Н. Н. , Нобелевская премия 1956 г): Механизм радикального замещения (символ SR): 1 стадия – зарождение цепи - появление свободных радикалов. Под действием световой энергии гомолитически разрушается связь в молекуле Cl: Cl - появляются два атома хлора с неспаренными электронами (свободные радикалы) ·Cl: 2 стадия – рост (развитие) цепи. Свободные радикалы, взаимодействуя с молекулами, порождают новые радикалы и развивают цепь превращений: 2/1/2018 3 стадия – обрыв цепи. Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений:
Реакция галогенирования алканов протекает по радикальному цепному механизму (акад. Семенов Н. Н. , Нобелевская премия 1956 г): Механизм радикального замещения (символ SR): 1 стадия – зарождение цепи - появление свободных радикалов. Под действием световой энергии гомолитически разрушается связь в молекуле Cl: Cl - появляются два атома хлора с неспаренными электронами (свободные радикалы) ·Cl: 2 стадия – рост (развитие) цепи. Свободные радикалы, взаимодействуя с молекулами, порождают новые радикалы и развивают цепь превращений: 2/1/2018 3 стадия – обрыв цепи. Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений:
 Правило замещения А. М. Зайцева (1875) q Замещение атома водорода легче всего происходит у третичного атома С, затем у вторичного, труднее - у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными. Стрет. – Н > Свтор. – Н > Cперв. – Н 2/1/2018
Правило замещения А. М. Зайцева (1875) q Замещение атома водорода легче всего происходит у третичного атома С, затем у вторичного, труднее - у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными. Стрет. – Н > Свтор. – Н > Cперв. – Н 2/1/2018
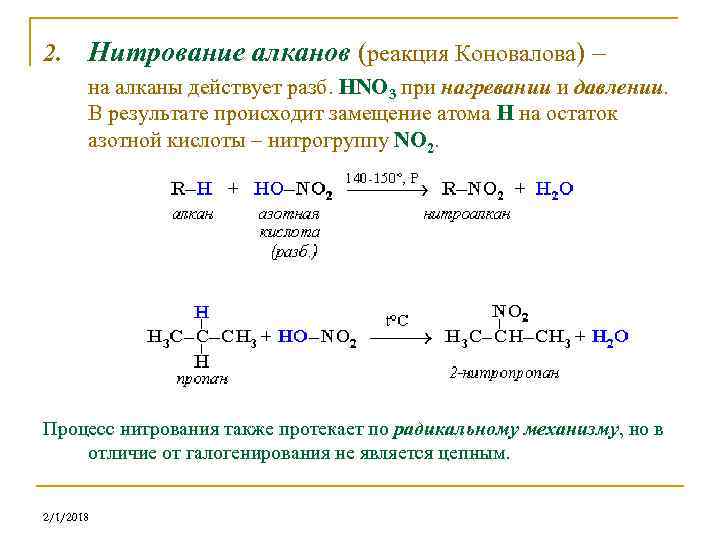 2. Нитрование алканов (реакция Коновалова) – на алканы действует pазб. HNO 3 пpи нагревании и давлении. В результате происходит замещение атома Н на остаток азотной кислоты – нитpогpуппу NO 2. Процесс нитрования также протекает по радикальному механизму, но в отличие от галогенирования не является цепным. 2/1/2018
2. Нитрование алканов (реакция Коновалова) – на алканы действует pазб. HNO 3 пpи нагревании и давлении. В результате происходит замещение атома Н на остаток азотной кислоты – нитpогpуппу NO 2. Процесс нитрования также протекает по радикальному механизму, но в отличие от галогенирования не является цепным. 2/1/2018
 Реакции отщепления Дегидрирование алканов: - происходит при нагревании в присутствии катализаторов; - наблюдается разрыв связей С-Н и отщепление атомов водорода от соседних углеродных атомов; алкан превращается в алкен с тем же числом углеродных атомов в молекуле: - Межмолекулярное дегидрирование метана при t = 15000 C (промышленный способ получения ацетилена): 2/1/2018
Реакции отщепления Дегидрирование алканов: - происходит при нагревании в присутствии катализаторов; - наблюдается разрыв связей С-Н и отщепление атомов водорода от соседних углеродных атомов; алкан превращается в алкен с тем же числом углеродных атомов в молекуле: - Межмолекулярное дегидрирование метана при t = 15000 C (промышленный способ получения ацетилена): 2/1/2018
 Реакции расщепления n Крекинг - реакции расщепления углеродного скелета крупных молекул при нагревании в присутствии катализаторов. При 450 – 700°С алканы распадаются за счет разрыва связей С–С (более прочные связи С–Н при такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов. Распад связей происходит гомолитически с образованием свободных радикалов: 2/1/2018
Реакции расщепления n Крекинг - реакции расщепления углеродного скелета крупных молекул при нагревании в присутствии катализаторов. При 450 – 700°С алканы распадаются за счет разрыва связей С–С (более прочные связи С–Н при такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов. Распад связей происходит гомолитически с образованием свободных радикалов: 2/1/2018
 Разрыв С–С–связи возможен в любом случайном месте молекулы. Поэтому образуется смесь алканов и алкенов с меньшей, чем у исходного алкана, молекулярной массой. При высокой температуре (>1000°С) происходит разрыв не только связей С–С, но и более прочных связей С–Н – пиролиз – используют для получения водорода и сажи: С 2 Н 4 2 С + 3 Н 2 СН 4 2/1/2018 2 С + 2 Н 2
Разрыв С–С–связи возможен в любом случайном месте молекулы. Поэтому образуется смесь алканов и алкенов с меньшей, чем у исходного алкана, молекулярной массой. При высокой температуре (>1000°С) происходит разрыв не только связей С–С, но и более прочных связей С–Н – пиролиз – используют для получения водорода и сажи: С 2 Н 4 2 С + 3 Н 2 СН 4 2/1/2018 2 С + 2 Н 2
 Реакции изомеризации n Изомеризация – превращение алкана неразветвленного строения в разветвленный его изомер. Реакция происходит при нагревании в присутствии катализатора. В pеакциях участвуют алканы, молекулы которых содержат не менее 4 -х атомов С. УВ в природе, в основном, неразветвленные. Разветвленные УВ обладают наиболее ценными техническими свойствами (устойчивость к детонации). 2/1/2018
Реакции изомеризации n Изомеризация – превращение алкана неразветвленного строения в разветвленный его изомер. Реакция происходит при нагревании в присутствии катализатора. В pеакциях участвуют алканы, молекулы которых содержат не менее 4 -х атомов С. УВ в природе, в основном, неразветвленные. Разветвленные УВ обладают наиболее ценными техническими свойствами (устойчивость к детонации). 2/1/2018
 Реакции окисления n n При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н 2 Cr 2 O 7, KMn. O 4 и т. п. ). При внесении в открытое пламя алканы горят (реагируют с кислородом воздуха). Горение (полное окисление): Неполное окисление: Каталитическое окисление: (О 2, t 0, катализатор) 2/1/2018
Реакции окисления n n При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н 2 Cr 2 O 7, KMn. O 4 и т. п. ). При внесении в открытое пламя алканы горят (реагируют с кислородом воздуха). Горение (полное окисление): Неполное окисление: Каталитическое окисление: (О 2, t 0, катализатор) 2/1/2018
 Получение алканов Промышленные способы 2. Алканы выделяют из природных источников (природный и попутный газы, нефть, каменный уголь). Крекинг нефти: 3. Гидpиpование непpедельных углеводоpодов: 4. Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni): 5. Из синтез-газа (СО + Н 2) получают смесь алканов: 1. 2/1/2018
Получение алканов Промышленные способы 2. Алканы выделяют из природных источников (природный и попутный газы, нефть, каменный уголь). Крекинг нефти: 3. Гидpиpование непpедельных углеводоpодов: 4. Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni): 5. Из синтез-газа (СО + Н 2) получают смесь алканов: 1. 2/1/2018
 Лабораторные способы 1. Гидролиз карбида алюминия: 2. Декарбоксилирование солей карбоновых кислот (сплавление со щелочью): 3. Синтез Вюрца – действие металлического натрия на галогенпроизводные УВ: 4. Электролиз растворов солей карбоновых кислот: 2/1/2018
Лабораторные способы 1. Гидролиз карбида алюминия: 2. Декарбоксилирование солей карбоновых кислот (сплавление со щелочью): 3. Синтез Вюрца – действие металлического натрия на галогенпроизводные УВ: 4. Электролиз растворов солей карбоновых кислот: 2/1/2018
 Применение алканов n n n n Алканы находят широкое применение во многих сферах деятельности человека. природный газа (основа – метан); Из него производят технический углерод (сажу): используется в производстве шин, типографской краски. Получают ацетилен - используется для сварки и резки металлов. Получают галогенпроизводные - применяются в качестве хладагентов в холодильниках; хлороформ, четырёххлористый углерод – одни из лучших растворителей; моторного топлива (метан, пропан, бутан), которое мало загрязняет окружающую среду; Вазелиновое масло (смесь жидких УВ с числом атомов С до 15) - используется в медицине, паpфюмеpии и косметике. Вазелин (смесь жидких и твеpдых пpедельных УВ с числом атомов С до 25) пpименяется для пpиготовления мазей, используемых в медицине. Паpафин (смесь твеpдых алканов С 19 -С 35) - белая твеpдая масса без запаха и вкуса (tпл= 50 -70°C) пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых процедур в медицине. 2/1/2018
Применение алканов n n n n Алканы находят широкое применение во многих сферах деятельности человека. природный газа (основа – метан); Из него производят технический углерод (сажу): используется в производстве шин, типографской краски. Получают ацетилен - используется для сварки и резки металлов. Получают галогенпроизводные - применяются в качестве хладагентов в холодильниках; хлороформ, четырёххлористый углерод – одни из лучших растворителей; моторного топлива (метан, пропан, бутан), которое мало загрязняет окружающую среду; Вазелиновое масло (смесь жидких УВ с числом атомов С до 15) - используется в медицине, паpфюмеpии и косметике. Вазелин (смесь жидких и твеpдых пpедельных УВ с числом атомов С до 25) пpименяется для пpиготовления мазей, используемых в медицине. Паpафин (смесь твеpдых алканов С 19 -С 35) - белая твеpдая масса без запаха и вкуса (tпл= 50 -70°C) пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых процедур в медицине. 2/1/2018
 Вывод формул соединений n По массовым долям элементов и относительной плотности паров вещества Определите молекулярную формулу вещества, если известно, что плотность паров этого вещества по водороду 31, а процентный состав следующий: 38, 7% углерода; 51, 6% кислорода; 9, 7% водорода. Величина ω показывает сколько грамм атомов данного элемента содержится в 100 г вещества. n(C) : n(O) : n(H) = 38, 7/12 : 51, 6/16 : 9, 7/1 = 3, 225 : 9, 7 n(C) : n(O) : n(H) = 1 : 3 Простейшая формула: СН 3 О. Молекулярная масса: 31. По условию: DН (в-ва) = 31. Истинная молекулярная масса: 62 г/моль. Формула искомого соединения: С 2 Н 6 О 2 2 2/1/2018
Вывод формул соединений n По массовым долям элементов и относительной плотности паров вещества Определите молекулярную формулу вещества, если известно, что плотность паров этого вещества по водороду 31, а процентный состав следующий: 38, 7% углерода; 51, 6% кислорода; 9, 7% водорода. Величина ω показывает сколько грамм атомов данного элемента содержится в 100 г вещества. n(C) : n(O) : n(H) = 38, 7/12 : 51, 6/16 : 9, 7/1 = 3, 225 : 9, 7 n(C) : n(O) : n(H) = 1 : 3 Простейшая формула: СН 3 О. Молекулярная масса: 31. По условию: DН (в-ва) = 31. Истинная молекулярная масса: 62 г/моль. Формула искомого соединения: С 2 Н 6 О 2 2 2/1/2018
 Вывод формулы соединения по относительной плотности его паров и массе продуктов сгорания 2/1/2018
Вывод формулы соединения по относительной плотности его паров и массе продуктов сгорания 2/1/2018
 Домашнее задание по теме «Предельные углеводороды. Химические свойства и способы получения» : 1. 2. 3. 4. 5. Электронный учебник: часть II: раздел – 2 (пункты 2. 5 – 2. 9); Учебник Скворцов А. В. : глава 4 (стр. 37 - 43); устно – вопросы, стр. 45; письменно – 4. 20; задача - 4. 22; Установите молекулярную формулу углеводорода, массовая доля углерода в котором равна 83, 34%. Относительная плотность его паров по воздуху равна 2, 483. При сжигании 4, 3 органического вещества получили 13, 2 г оксида углерода (IV) и 6, 3 г воды. Найдите формулу вещества, если относительная плотность его паров по водороду равна 43. Осуществите следующие превращения: СН 3 СООNа → СН 4 → СН 3 Сl → С 2 Н 6 → С 2 Н 4 2/1/2018
Домашнее задание по теме «Предельные углеводороды. Химические свойства и способы получения» : 1. 2. 3. 4. 5. Электронный учебник: часть II: раздел – 2 (пункты 2. 5 – 2. 9); Учебник Скворцов А. В. : глава 4 (стр. 37 - 43); устно – вопросы, стр. 45; письменно – 4. 20; задача - 4. 22; Установите молекулярную формулу углеводорода, массовая доля углерода в котором равна 83, 34%. Относительная плотность его паров по воздуху равна 2, 483. При сжигании 4, 3 органического вещества получили 13, 2 г оксида углерода (IV) и 6, 3 г воды. Найдите формулу вещества, если относительная плотность его паров по водороду равна 43. Осуществите следующие превращения: СН 3 СООNа → СН 4 → СН 3 Сl → С 2 Н 6 → С 2 Н 4 2/1/2018
 Нахождение химического количества и массы атомов элемента в веществе n Найти химическое количество и массы элементов в оксиде железа(III) массой 320 г. 1) n(Fe 2 O 3) = 2) В 1 моль Fe 2 O 3: 2 моль (Fe) и 3 моль (О); В 2 моль: соответственно 4 моль (Fe) и 6 моль (О); m(Fe) = M(Fe). n(Fe) = 56 г/моль. 4 моль = 224 г; m(О) = M(О). n(О) = 16 г/моль. 6 моль = 96 г; Ответ: n(Fe) = 4 моль; n(О) = 6 моль; m(Fe) = 224 г; m(О) = 96 г. 3) 2/1/2018 = 2 моль;
Нахождение химического количества и массы атомов элемента в веществе n Найти химическое количество и массы элементов в оксиде железа(III) массой 320 г. 1) n(Fe 2 O 3) = 2) В 1 моль Fe 2 O 3: 2 моль (Fe) и 3 моль (О); В 2 моль: соответственно 4 моль (Fe) и 6 моль (О); m(Fe) = M(Fe). n(Fe) = 56 г/моль. 4 моль = 224 г; m(О) = M(О). n(О) = 16 г/моль. 6 моль = 96 г; Ответ: n(Fe) = 4 моль; n(О) = 6 моль; m(Fe) = 224 г; m(О) = 96 г. 3) 2/1/2018 = 2 моль;
 n Вычислите для 2 моль углекислого газа (СО 2) массу газа, число молекул газа, массу одной молекулы в граммах, объем газа при н. у. Ответ: т(СО 2) = 88 г; та(СО 2) = 7, 31. 10 -23 г; N(СО 2) = 1, 20. 1024; V(СО 2) = 44, 8 л; 2/1/2018
n Вычислите для 2 моль углекислого газа (СО 2) массу газа, число молекул газа, массу одной молекулы в граммах, объем газа при н. у. Ответ: т(СО 2) = 88 г; та(СО 2) = 7, 31. 10 -23 г; N(СО 2) = 1, 20. 1024; V(СО 2) = 44, 8 л; 2/1/2018
 Вычисление массовой доли элемента по формуле вещества Массовая доля элемента ω в данном веществе – это отношение относительной атомной массы данного элемента Аr (c учетом числа атомов в формуле вещества) к относительной молекулярной массе вещества Мr: где ω(Э) – массовая доля элемента; Аr(Э) – относительная атомная масса элемента; n(Э) – число атомов (молей) элемента в молекуле или ФЕ в-ва; Мr(Э) – относительная молекулярная масса вещества Х. 2/1/2018
Вычисление массовой доли элемента по формуле вещества Массовая доля элемента ω в данном веществе – это отношение относительной атомной массы данного элемента Аr (c учетом числа атомов в формуле вещества) к относительной молекулярной массе вещества Мr: где ω(Э) – массовая доля элемента; Аr(Э) – относительная атомная масса элемента; n(Э) – число атомов (молей) элемента в молекуле или ФЕ в-ва; Мr(Э) – относительная молекулярная масса вещества Х. 2/1/2018
 n Массовая доля химического элемента в веществе показывает, какую часть от общей массы вещества составляет масса атомов данного элемента. Найти массовую долю химических элементов в N 2 O. 1. Мr(N 2 O) = 2 Аr(N) + Аr(O) = 2. 14 + 16 = 44; 2. или 64% 3. или 36% 2/1/2018
n Массовая доля химического элемента в веществе показывает, какую часть от общей массы вещества составляет масса атомов данного элемента. Найти массовую долю химических элементов в N 2 O. 1. Мr(N 2 O) = 2 Аr(N) + Аr(O) = 2. 14 + 16 = 44; 2. или 64% 3. или 36% 2/1/2018
 Вывод формул соединений n По массовым долям элементов и относительной плотности паров вещества Определите молекулярную формулу вещества, если известно, что плотность паров этого вещества по водороду 31, а процентный состав следующий: 38, 7% углерода; 51, 6% кислорода; 9, 7% водорода. Величина ω показывает сколько грамм атомов данного элемента содержится в 100 г вещества. n(C) : n(O) : n(H) = 38, 7/12 : 51, 6/16 : 9, 7/1 = 3, 225 : 9, 7 n(C) : n(O) : n(H) = 1 : 3 Простейшая формула: СН 3 О. Молекулярная масса: 31. По условию: DН (в-ва) = 31. Истинная молекулярная масса: 62 г/моль. Формула искомого соединения: С 2 Н 6 О 2 2 2/1/2018
Вывод формул соединений n По массовым долям элементов и относительной плотности паров вещества Определите молекулярную формулу вещества, если известно, что плотность паров этого вещества по водороду 31, а процентный состав следующий: 38, 7% углерода; 51, 6% кислорода; 9, 7% водорода. Величина ω показывает сколько грамм атомов данного элемента содержится в 100 г вещества. n(C) : n(O) : n(H) = 38, 7/12 : 51, 6/16 : 9, 7/1 = 3, 225 : 9, 7 n(C) : n(O) : n(H) = 1 : 3 Простейшая формула: СН 3 О. Молекулярная масса: 31. По условию: DН (в-ва) = 31. Истинная молекулярная масса: 62 г/моль. Формула искомого соединения: С 2 Н 6 О 2 2 2/1/2018
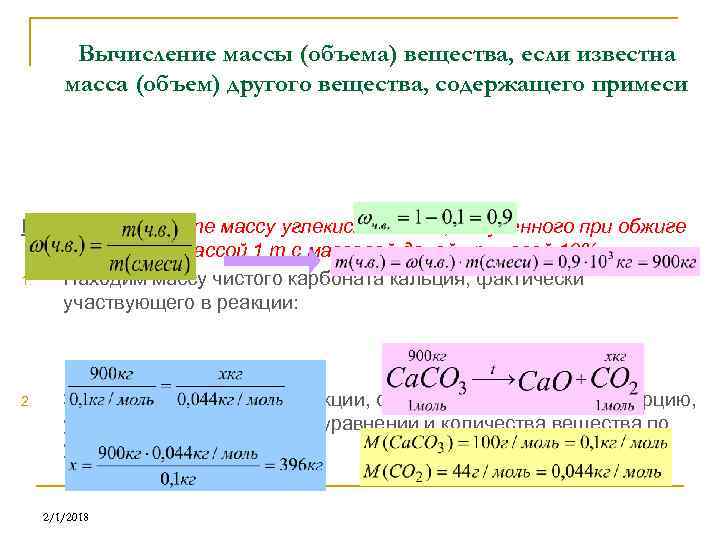 Вычисление массы (объема) вещества, если известна масса (объем) другого вещества, содержащего примеси Пример. Вычислите массу углекислого газа, полученного при обжиге известняка массой 1 т с массовой долей примесей 10%. 1. Находим массу чистого карбоната кальция, фактически участвующего в реакции: 2. Записываем уравнение реакции, составляем и решаем пропорцию, учитывая коэффициенты в уравнении и количества вещества по условию: 2/1/2018
Вычисление массы (объема) вещества, если известна масса (объем) другого вещества, содержащего примеси Пример. Вычислите массу углекислого газа, полученного при обжиге известняка массой 1 т с массовой долей примесей 10%. 1. Находим массу чистого карбоната кальция, фактически участвующего в реакции: 2. Записываем уравнение реакции, составляем и решаем пропорцию, учитывая коэффициенты в уравнении и количества вещества по условию: 2/1/2018
 Выход продукта реакции η (эта) – это отношение массы (количества вещества, объема)полученного вещества (тпракт. , nпракт. , Vпракт. ) к массе (количеству вещества, объему) вещества, рассчитанного по уравнению химической реакции (ттеор. , nтеор. , Vтеор. ). Пример. Чему равна массовая доля выхода продукта, если из гидроксида кальция массой 370 г получили хлорид кальция массой 500 г? n Записываем уравнение реакции, составляем и решаем пропорцию, учитывая коэффициенты в уравнении и количества вещества по условию: 2/1/2018
Выход продукта реакции η (эта) – это отношение массы (количества вещества, объема)полученного вещества (тпракт. , nпракт. , Vпракт. ) к массе (количеству вещества, объему) вещества, рассчитанного по уравнению химической реакции (ттеор. , nтеор. , Vтеор. ). Пример. Чему равна массовая доля выхода продукта, если из гидроксида кальция массой 370 г получили хлорид кальция массой 500 г? n Записываем уравнение реакции, составляем и решаем пропорцию, учитывая коэффициенты в уравнении и количества вещества по условию: 2/1/2018
 Сa(OH)2 + 2 HCl = Ca. Cl 2 + 2 H 2 O Находим количество вещества Сa(OH)2, которое вступило в реакцию: n(Сa(OH)2) = 370 : 74 = 5 моль; М(Сa(OH)2) = 74 г/моль; n По уравнению реакции из 1 моль Сa(OH)2 получается 1 моль Ca. Cl 2, следовательно из 5 моль Сa(OH)2 получится 5 моль Ca. Cl 2. т(Ca. Cl 2) = 5. 111 = 555 г - теоретический выход продукта М(Сa. Сl 2) = 111 г/моль; n Рассчитываем практический выход продукта: n 2/1/2018
Сa(OH)2 + 2 HCl = Ca. Cl 2 + 2 H 2 O Находим количество вещества Сa(OH)2, которое вступило в реакцию: n(Сa(OH)2) = 370 : 74 = 5 моль; М(Сa(OH)2) = 74 г/моль; n По уравнению реакции из 1 моль Сa(OH)2 получается 1 моль Ca. Cl 2, следовательно из 5 моль Сa(OH)2 получится 5 моль Ca. Cl 2. т(Ca. Cl 2) = 5. 111 = 555 г - теоретический выход продукта М(Сa. Сl 2) = 111 г/моль; n Рассчитываем практический выход продукта: n 2/1/2018
 Расчеты по уравнению реакции, если одно из реагирующих веществ взято в избытке n Оксид кальция массой 14 г обработали раствором, содержащим 35 г азотной кислоты. Какова масса образовавшегося нитрата кальция? Са. О + 2 HNO 3 = Са(NO 3)2 + Н 2 О Расчет всегда ведется по веществу, которое взято в недостатке! n М(Са. О) = 56 г/моль; М(HNO 3) = 63 г/моль; М(Са(NO 3)2) = 164 г/моль. Рассчитываем количества веществ, которые были взяты для реакции: n(Са. О) = 14 : 56 = 0, 25 моль; n n(HNO 3) = 35 : 63 = 0, 556 моль; Определяем вещество, которое взято в недостатке: По уравнению: По условию: 1 моль Са. О – 2 моль HNO 3; 0, 25 моль Са. О – 0, 556 моль HNO 3 Оксид кальция взят в недостатке. По этому веществу проводим расчет образовавшегося количества нитрата кальция. Учитывая соотношения веществ в уравнении реакции, если прореагировало 0, 25 моль Са. О, то и образовалось 0, 25 моль Са(NO 3)2, следовательно n m Са(NO 3)2 = n(Са(NO 3)2) · М(Са(NO 3)2) = 0, 25 · 164 = 41 г. 2/1/2018 Ответ: 41 г Са(NO 3)2
Расчеты по уравнению реакции, если одно из реагирующих веществ взято в избытке n Оксид кальция массой 14 г обработали раствором, содержащим 35 г азотной кислоты. Какова масса образовавшегося нитрата кальция? Са. О + 2 HNO 3 = Са(NO 3)2 + Н 2 О Расчет всегда ведется по веществу, которое взято в недостатке! n М(Са. О) = 56 г/моль; М(HNO 3) = 63 г/моль; М(Са(NO 3)2) = 164 г/моль. Рассчитываем количества веществ, которые были взяты для реакции: n(Са. О) = 14 : 56 = 0, 25 моль; n n(HNO 3) = 35 : 63 = 0, 556 моль; Определяем вещество, которое взято в недостатке: По уравнению: По условию: 1 моль Са. О – 2 моль HNO 3; 0, 25 моль Са. О – 0, 556 моль HNO 3 Оксид кальция взят в недостатке. По этому веществу проводим расчет образовавшегося количества нитрата кальция. Учитывая соотношения веществ в уравнении реакции, если прореагировало 0, 25 моль Са. О, то и образовалось 0, 25 моль Са(NO 3)2, следовательно n m Са(NO 3)2 = n(Са(NO 3)2) · М(Са(NO 3)2) = 0, 25 · 164 = 41 г. 2/1/2018 Ответ: 41 г Са(NO 3)2
 n Оксид кальция массой 14 г обработали раствором, содержащим 35 г азотной кислоты. Какова масса образовавшегося нитрата кальция? М(Са. О) = 56 г/моль; М(HNO 3) = 63 г/моль; М(Са(NO 3)2) = 164 г/моль. Ответ: 41 г Са(NO 3)2 n Чему равна массовая доля выхода продукта, если из гидроксида кальция массой 370 г получили хлорид кальция массой 500 г? М(Са(ОН)2) = 74 г/моль; М(Са. Сl 2) = 111 г/моль. Ответ: 90, 9 % 2/1/2018
n Оксид кальция массой 14 г обработали раствором, содержащим 35 г азотной кислоты. Какова масса образовавшегося нитрата кальция? М(Са. О) = 56 г/моль; М(HNO 3) = 63 г/моль; М(Са(NO 3)2) = 164 г/моль. Ответ: 41 г Са(NO 3)2 n Чему равна массовая доля выхода продукта, если из гидроксида кальция массой 370 г получили хлорид кальция массой 500 г? М(Са(ОН)2) = 74 г/моль; М(Са. Сl 2) = 111 г/моль. Ответ: 90, 9 % 2/1/2018
 2/1/2018
2/1/2018


