ОРГАНИЧЕСКАЯ ХИМИЯ - 6-chem.ppt
- Количество слайдов: 12
 ОРГАНИЧЕСКАЯ ХИМИЯ
ОРГАНИЧЕСКАЯ ХИМИЯ
 Галогенпроизводные ациклических углеводородов Классификация: по количеству атомов галогена (моно-, ди- и полигалогенпроизводные) по углеводородному радикалу (предельные, непредельные)
Галогенпроизводные ациклических углеводородов Классификация: по количеству атомов галогена (моно-, ди- и полигалогенпроизводные) по углеводородному радикалу (предельные, непредельные)
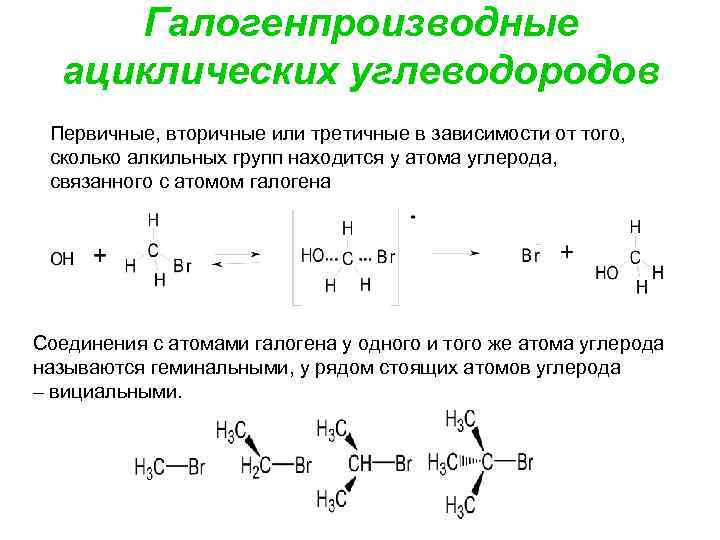 Галогенпроизводные ациклических углеводородов Первичные, вторичные или третичные в зависимости от того, сколько алкильных групп находится у атома углерода, связанного с атомом галогена Соединения с атомами галогена у одного и того же атома углерода называются геминальными, у рядом стоящих атомов углерода – вициальными.
Галогенпроизводные ациклических углеводородов Первичные, вторичные или третичные в зависимости от того, сколько алкильных групп находится у атома углерода, связанного с атомом галогена Соединения с атомами галогена у одного и того же атома углерода называются геминальными, у рядом стоящих атомов углерода – вициальными.
 Галогенпроизводные ациклических углеводородов Способы получения 1. Галогенирование алканов CH 3 -CH 3 + Cl 2 CH 3 CH 2 Cl + HCl 2. Присоединение галогенов, галогенводородов к непредельным углеводородам СН 2=СН 2 + Вr 2 CBr. Н 2 -СBr. Н 2 СН 3 -СН=СН 2 + НСl СН 3 -СНCl-СН 3 3. Замещение гидроксильной группы в спиртах R-OH + HCl R-Cl + H 2 O 4. Замещение кислорода в карбонильной группе: R-CHO + PCl 5 RCHCl 2 + POCl 3 5. Очень реакционноспособные йодпроизводные получают следующим образом: R-CH 2 -Cl + Na. I R-CH 2 -I + Na. Cl
Галогенпроизводные ациклических углеводородов Способы получения 1. Галогенирование алканов CH 3 -CH 3 + Cl 2 CH 3 CH 2 Cl + HCl 2. Присоединение галогенов, галогенводородов к непредельным углеводородам СН 2=СН 2 + Вr 2 CBr. Н 2 -СBr. Н 2 СН 3 -СН=СН 2 + НСl СН 3 -СНCl-СН 3 3. Замещение гидроксильной группы в спиртах R-OH + HCl R-Cl + H 2 O 4. Замещение кислорода в карбонильной группе: R-CHO + PCl 5 RCHCl 2 + POCl 3 5. Очень реакционноспособные йодпроизводные получают следующим образом: R-CH 2 -Cl + Na. I R-CH 2 -I + Na. Cl
 Галогенпроизводные ациклических углеводородов Химические свойства галогеналкилов обусловлены наличием ковалентной полярной связи углерод-галоген. Важнейший класс органических реакций – нуклеофильное замещение у насыщенного атома углерода Nu: + Z C Nu C + Z: 1. Реакции нуклеофильного замещения: R-Hal + Nu- R-Nu + Hal. Они реагируют с металлами, основаниями и солями слабых кислот: R-Hal + Ag. OH R-OH + Ag. Hal R-Hal + Na. OH R-OH + Na. Hal R-Hal + Na. CN R-CN + Na. Hal R-Hal + Na. HS R-SH + Na. Hal R-Hal + Na. OR R-O-R + Na. Hal R-Hal + 2 NH 3 R-NH 2 + NH 4 Hal 2 R-Hal + 2 Na R-R + 2 Na. Hal (реакция Вюрца)
Галогенпроизводные ациклических углеводородов Химические свойства галогеналкилов обусловлены наличием ковалентной полярной связи углерод-галоген. Важнейший класс органических реакций – нуклеофильное замещение у насыщенного атома углерода Nu: + Z C Nu C + Z: 1. Реакции нуклеофильного замещения: R-Hal + Nu- R-Nu + Hal. Они реагируют с металлами, основаниями и солями слабых кислот: R-Hal + Ag. OH R-OH + Ag. Hal R-Hal + Na. OH R-OH + Na. Hal R-Hal + Na. CN R-CN + Na. Hal R-Hal + Na. HS R-SH + Na. Hal R-Hal + Na. OR R-O-R + Na. Hal R-Hal + 2 NH 3 R-NH 2 + NH 4 Hal 2 R-Hal + 2 Na R-R + 2 Na. Hal (реакция Вюрца)
 Механизм нуклеофильное замещение у насыщенного атома углерода Классификация в соответствии с изменением заряда в субстрате или нуклеофиле по типу механизма замещения. По заряду. 1) Взаимодействие нейтрального субстрата с нейтральным нуклеофилом Nu: + RZ Nu+ R + ZПримеры: H 3 N: + RHal RN+H 3 Hal. Реакция Гофмана R 3 N: + RHal R 4 N+Hal. Реакция Гофмана RHal + ROH R-O-R + HHal
Механизм нуклеофильное замещение у насыщенного атома углерода Классификация в соответствии с изменением заряда в субстрате или нуклеофиле по типу механизма замещения. По заряду. 1) Взаимодействие нейтрального субстрата с нейтральным нуклеофилом Nu: + RZ Nu+ R + ZПримеры: H 3 N: + RHal RN+H 3 Hal. Реакция Гофмана R 3 N: + RHal R 4 N+Hal. Реакция Гофмана RHal + ROH R-O-R + HHal
 Механизм нуклеофильное замещение у насыщенного атома углерода 2. Взаимодействие нейтрального субстрата с анионным нуклеофилом Nu: - + RZ Nu R + Z: Примеры: R-Hal + R’O- R-O-R’ + Hal. R-Hal + CN- R-C N + Hal 3. Катионный субстрат – нейтральный нуклеофил Nu: + RZ+ Nu+ R + Z: Примеры: : S=C(NH 2)2 + RS+(CH 3)2 X- X-N+H 2=C(NH 2)-S-R + (CH 3)2 S
Механизм нуклеофильное замещение у насыщенного атома углерода 2. Взаимодействие нейтрального субстрата с анионным нуклеофилом Nu: - + RZ Nu R + Z: Примеры: R-Hal + R’O- R-O-R’ + Hal. R-Hal + CN- R-C N + Hal 3. Катионный субстрат – нейтральный нуклеофил Nu: + RZ+ Nu+ R + Z: Примеры: : S=C(NH 2)2 + RS+(CH 3)2 X- X-N+H 2=C(NH 2)-S-R + (CH 3)2 S
 Механизм нуклеофильное замещение у насыщенного атома углерода 4. Катионный субстрат – анионный нуклеофил Nu: - + RZ+ Nu. R + Z: Примеры: RCOO- + R’N+(CH 3)3 RCOOR’ + (CH 3)3 N:
Механизм нуклеофильное замещение у насыщенного атома углерода 4. Катионный субстрат – анионный нуклеофил Nu: - + RZ+ Nu. R + Z: Примеры: RCOO- + R’N+(CH 3)3 RCOOR’ + (CH 3)3 N:
 Галогенпроизводные ациклических углеводородов Для первичных галогеналкилов реакции нуклеофильного замещения протекают по механизму SN 2 Для третичных галогеналкилов замещение идет по механизму SN 1 (первая стадия медленная): (CH 3)3 C-Br (CH 3)3 C+ + Br(CH 3)3 C+ + OH- (CH 3)3 C-OH Для вторичных галогеналкилов – смешанный механизм. Скорости всех этих реакций уменьшаются в ряду: первичные > вторичные > третичные.
Галогенпроизводные ациклических углеводородов Для первичных галогеналкилов реакции нуклеофильного замещения протекают по механизму SN 2 Для третичных галогеналкилов замещение идет по механизму SN 1 (первая стадия медленная): (CH 3)3 C-Br (CH 3)3 C+ + Br(CH 3)3 C+ + OH- (CH 3)3 C-OH Для вторичных галогеналкилов – смешанный механизм. Скорости всех этих реакций уменьшаются в ряду: первичные > вторичные > третичные.
 Галогенпроизводные ациклических углеводородов 2. Галогеналкилы способны отщеплять галогенводороды с образованием олефинов. Для третичных галогеналкилов реакции протекают по механизму Е 1 (первая стадия медленная) Реакции, протекающие по бимолекулярному механизму Е 2 (скорость зависит от концентрации обоих реагентов), требуют присутствия основания.
Галогенпроизводные ациклических углеводородов 2. Галогеналкилы способны отщеплять галогенводороды с образованием олефинов. Для третичных галогеналкилов реакции протекают по механизму Е 1 (первая стадия медленная) Реакции, протекающие по бимолекулярному механизму Е 2 (скорость зависит от концентрации обоих реагентов), требуют присутствия основания.
 Галогенпроизводные ациклических углеводородов 3. При действии многих металлов в эфире галоген замещается на металл: R-Cl + 2 Li R-Li + Li. Cl R-Cl + Mg RMg. Cl (соединения Гриньяра) 4. Восстановление галогенпроизводных водородом (каталитически, в момент выделения) или химическими восстановителями (йодистым водородом): С 2 Н 5 I + НI С 2 Н 6 + I 2
Галогенпроизводные ациклических углеводородов 3. При действии многих металлов в эфире галоген замещается на металл: R-Cl + 2 Li R-Li + Li. Cl R-Cl + Mg RMg. Cl (соединения Гриньяра) 4. Восстановление галогенпроизводных водородом (каталитически, в момент выделения) или химическими восстановителями (йодистым водородом): С 2 Н 5 I + НI С 2 Н 6 + I 2
 Кислородсодержащие соединения. Спирты.
Кислородсодержащие соединения. Спирты.


