ОРГАНИЧЕСКАЯ ХИМИЯ - 4-chem.ppt
- Количество слайдов: 31
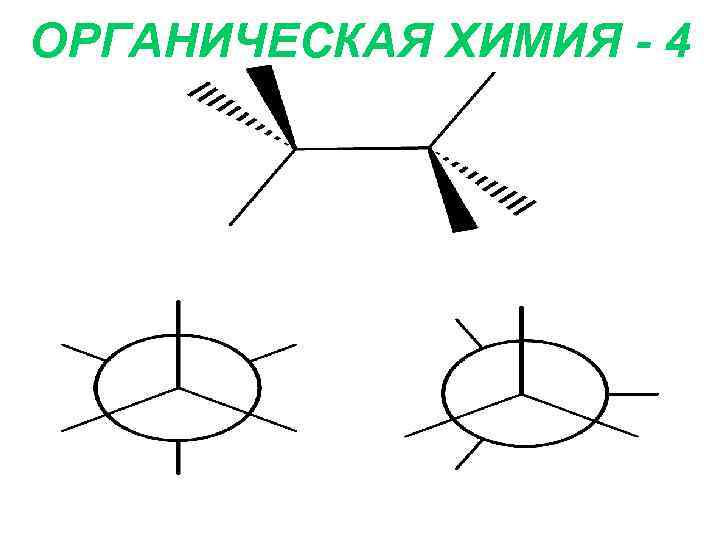
ОРГАНИЧЕСКАЯ ХИМИЯ - 4
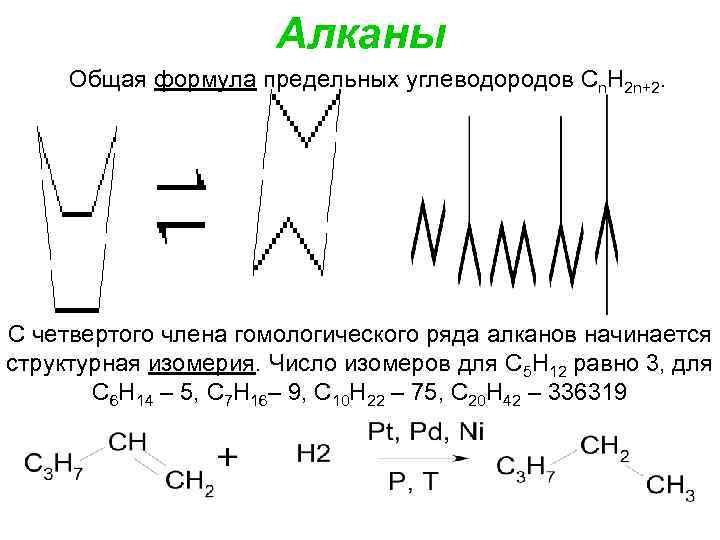
Алканы Общая формула предельных углеводородов Сn. Н 2 n+2. С четвертого члена гомологического ряда алканов начинается структурная изомерия. Число изомеров для С 5 Н 12 равно 3, для С 6 Н 14 – 5, С 7 Н 16– 9, С 10 Н 22 – 75, С 20 Н 42 – 336319

Номенклатура органических соединений • Эмпирическая номенклатура. Названия органических соединений даются случайно. Обычно они указывают или на их природный источник, или на какое-либо их свойство, которое было подмечено химиками, впервые получившими данное соединение. Например, щавелевая, яблочная или молочная кислоты, ацетон, уксусная кислота и другие.

Номенклатура органических соединений • Рациональная номенклатура. За основу названия выбирается, как правило, простейший (первый) представитель гомологического ряда (для предельных углеводородов – метан) с указанием названия заместителей-радикалов.

Номенклатура органических соединений • Систематическая номенклатура. • 1. Выбрать самую длинную неразветвленную углеродную цепь и пронумеровать атомы углерода с того конца, к которому ближе разветвление цепи; • 2. В названии цифрами указать места заместителей, назвать заместителей и указать их количество; • 3. Назвать углеводород, которому отвечает самая длинная углерод-углеродная цепь, например: • 2, 2, 3 -триметилпентан.
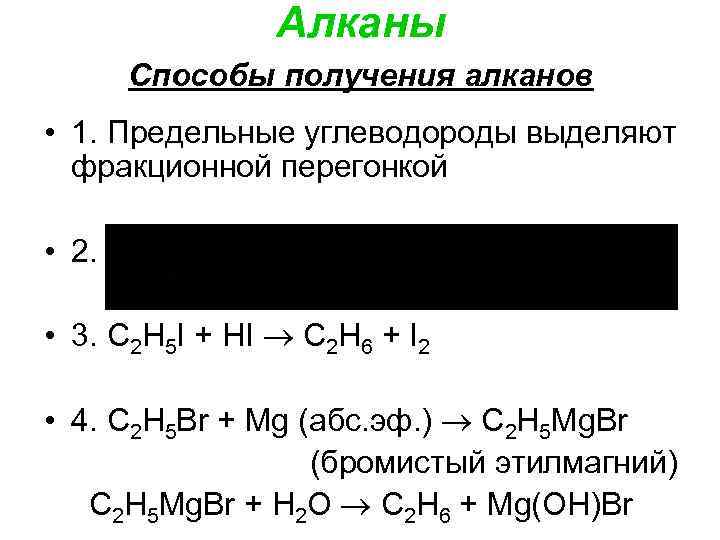
Алканы Способы получения алканов • 1. Предельные углеводороды выделяют фракционной перегонкой • 2. • 3. С 2 Н 5 I + НI С 2 Н 6 + I 2 • 4. С 2 Н 5 Br + Мg (абс. эф. ) С 2 Н 5 Мg. Вr (бромистый этилмагний) С 2 Н 5 Мg. Вr + H 2 O С 2 Н 6 + Мg(ОН)Вr

Алканы Способы получения алканов • 2 RI + 2 Na R-R + 2 Na. I • R-COONa R-R R-COONa R-COO- + Na+ R-COO- - e R-COO R + CO 2 2 R R-R • CH 3 COONa + Na. OH CH 4 + Na 2 CO 3

Алканы Химические свойства алканов • Химические превращения алканов могут происходить в результате гомолитического разрыва или углеродной цепи или связи углеродводород с последующим замещением атомов водорода другими атомами или группами. Отсюда для алканов характерны реакции расщепления и замещения. • Энергии связей: C-C 350 к. Дж/моль, С-Н 413, 7 к. Дж/моль. Однако химические реакции чаще идут с разрывом С-Н связи, так как эта связь доступнее действию реагентов. Процессы расщепления С-С и С-Н связей с образованием свободных радикалов требуют большой энергии активации и идут при обычной температуре только в присутствии катализаторов.

Алканы Химические свойства алканов Место вступления заместителя в молекулу алкана определяется вероятностью образования и стабильностью возникающего радикала. Наиболее стабильны радикалы с неспаренным электроном у третичного атома углерода, и поэтому они легче образуются. Устойчивость радикалов уменьшается в ряду: третичные, вторичные, первичные, метильный. Это связано со степенью делокализации неспаренного электрона в частице.

Алканы Химические свойства алканов Галогенирование - замещение водородных атомов галогенами. Скорость реакции уменьшается в ряду галогенов: F > Cl > Br. СН 4 + 4 F 2 СF 4 + 4 НF Хлор реагирует с алканами только под влиянием света, нагревания или в присутствии катализаторов. Это позволяет проводить последовательное замещение: СН 4 + Сl 2 CН 3 Сl + НСl CН 3 Сl + Сl 2 CН 2 Сl 2 + НСl CН 2 Сl 2 + Сl 2 CНСl 3 + НСl CНСl 3 + Сl 2 CСl 4 + НСl
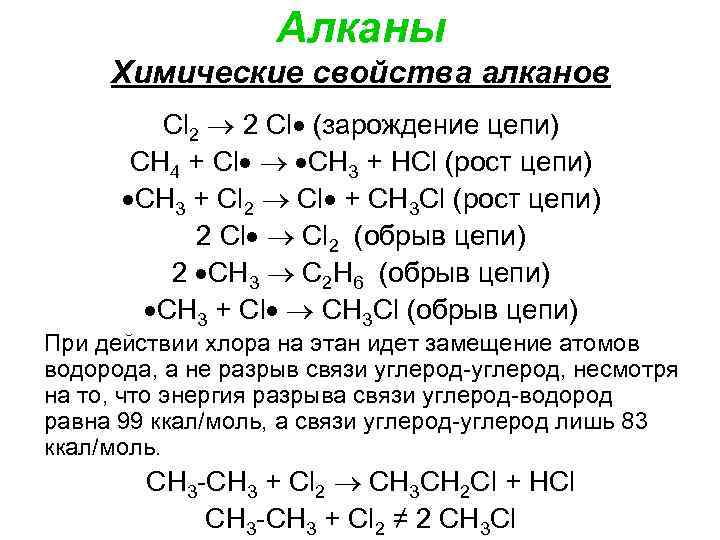
Алканы Химические свойства алканов Cl 2 2 Cl (зарождение цепи) СН 4 + Cl CН 3 + НСl (рост цепи) CН 3 + Cl 2 Cl + CН 3 Сl (рост цепи) 2 Cl 2 (обрыв цепи) 2 CН 3 C 2 Н 6 (обрыв цепи) CН 3 + Cl CН 3 Сl (обрыв цепи) При действии хлора на этан идет замещение атомов водорода, а не разрыв связи углерод-углерод, несмотря на то, что энергия разрыва связи углерод-водород равна 99 ккал/моль, а связи углерод-углерод лишь 83 ккал/моль. CH 3 -CH 3 + Cl 2 CH 3 CH 2 Cl + HCl CH 3 -CH 3 + Cl 2 ≠ 2 CH 3 Cl

Алканы Химические свойства алканов В таких случаях необходимо оценивать не только энергию разрыва соответствующих связей, а общий энергетический эффект процесса. Для первой реакции затраты энергии на гомолитический разрыв связи Cl-Cl составляют 58 ккал/моль, связи С-Н – 99 ккал/моль. Всего 157 ккал/моль. При образовании связи H-Cl выделяется 103 ккал/моль, а связи C-Cl – 78 ккал/моль. Всего 181 ккал/моль. Следовательно реакция экзотермична, а ее энергетический эффект составляет +24 ккал/моль. Для второй реакции затраты на разрыв связей Cl-Cl и С-С равны соответственно 58 и 83 ккал/моль. Всего 141 ккал/моль. Выделяется энергии при образовании двух связей C-Cl 156 ккал/моль. Таким образом, реакция тоже экзотермична, но ее энергетический эффект равен только +15 ккал/моль. То есть, исходя из этих цифр, нетрудно сделать вывод, что пойдет первая реакция, а не вторая.

Алканы Химические свойства алканов Почему не идет йодирование: CH 3 -CH 3 + I 2 CH 3 CH 2 I + HI ? Затраты энергии на разрыв связей I-I и C-H составляют соответственно 36 и 99 ккал/моль. Всего 135 ккал/моль. При образовании связей H-I и C-I выделяется соответственно 71 и 56 ккал/моль. Всего 127 ккал/моль. Таким образом, реакция в этом случае должна протекать с затратой энергии, т. е. эндотермически. А радикал способен вступать в реакцию замещения, когда с этим связано выделение энергии. Поэтому йод действует, наоборот, в качестве ингибитора радикальных реакций, т. к. он перенимает радикальные свойства, но не может их передать: • R + I-I R-I + I • I + R-H ≠ H-I + R

Алканы Химические свойства алканов Серная кислота при комнатной температуре не действует на алканы, а при нагревании она действует как окислитель. Дымящая серная кислота с высшими парафинами образует сульфокислоты: R-Н + Н 2 SО 4 R-SО 3 Н + Н 2 О

Алканы Химические свойства алканов На практике большое значение приобретает способ превращения парафинов в сульфокислоты и их производные реакциями сульфохлорирования и сульфоокисления: R-Н + SО 2 + Сl 2 R-SО 2 Сl + НСl алкансульфохлорид R-Н + 2 SО 2 + Н 2 О R-SО 2 ОН + Н 2 SО 4 алкансульфокислота

Алканы Химические свойства алканов Нитрование - реакция замещения атомов водорода на нитрогруппу (Коновалов М. И. , 1888 г. ): R-Н + НО-NО 2 R-NО 2 + Н 2 О Концентрированная азотная кислота или смесь концентрированной азотной и серной кислот (меланж) окисляют парафины. Нитрование же проводят разбавленной азотной кислотой.

Алканы Химические свойства алканов В промышленности применяют парофазное нитрование – парами азотной кислоты при 250500 о. С. В этом случае теряется избирательность реакции, кроме этого протекает крекинг парафинов (С-С расщепление), в основном образуются мононитросоединения. Реакция нитрования парафинов - это радикальный процесс. Атакующей частицей является диоксид азота (NО 2), который содержится в азотной кислоте. R-Н + NО 2 R + НNО 2 + НNО 3 N 2 О 4 + Н 2 О N 2 О 4 2 NО 2 (амбидентные свойства) N-атака: R + NО 2 R-NО 2 (нитросоединение) О-атака: R + NО 2 R-ОNО (эфир азотистой кислоты)

Алканы Химические свойства алканов Такие окислители как кислород воздуха, КМn. О 4, К 2 Сr 2 О 7 и др. окисляют парафины только при высоких температурах с разрывом углеродной цепи и образованием в основном кислот. Идет также процесс декарбоксилирования с выделением СО 2. Так как при окислении низших парафинов требуется высокая температура, то процесс мало управляем. В промышленности используют окисление высших парафинов нефти до синтетических высших жирных кислот (СЖК), которые используют в мыловаренной промышленности. Температура реакции 150 о. С, катализатор - соединения марганца.

Алканы Химические свойства алканов При температурах выше 1000 о. С все предельные углеводороды распадаются на углерод и водород. На этом основано производство дешевой газовой сажи и водорода. В определенных условиях удается отделять промежуточные продукты, например, ацетилен. Его получают из метана. Строение углеводородов и их молекулярная масса сказываются на температурах начала их разложения. Чем больше молекулярная масса, тем легче идет разложение. При 300 -700 о. С предельные углеводороды образуют сложную смесь предельных, непредельных и ароматических углеводородов. Основные реакции при крекинге - дегидрогенизация углеводорода и разрыв углеродной цепи, например: С 5 Н 12 C 3 Н 8 + С 2 Н 4 С 5 Н 12 C 5 Н 10 + Н 2 С 6 Н 14 С 6 Н 6 + 4 Н 2

Основы конформационного анализа
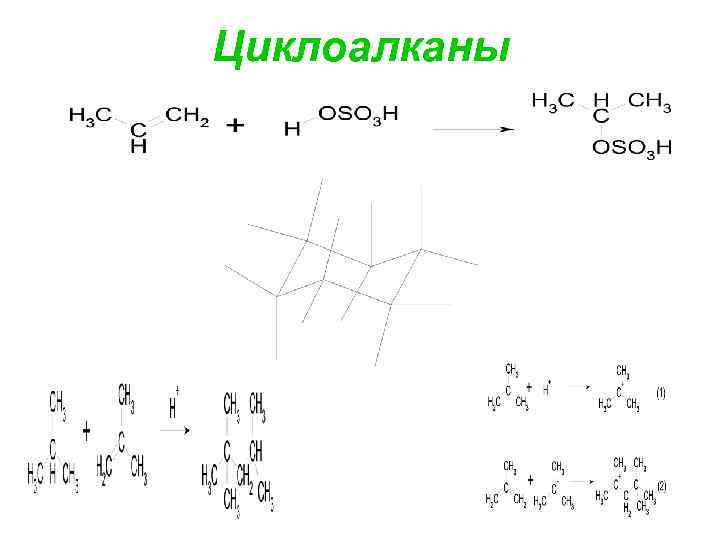
Циклоалканы
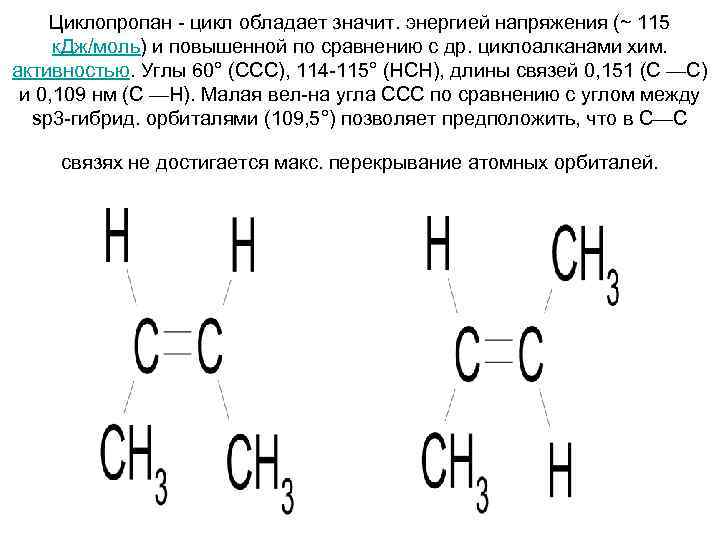
Циклопропан - цикл обладает значит. энергией напряжения (~ 115 к. Дж/моль) и повышенной по сравнению с др. циклоалканами хим. активностью. Углы 60° (ССС), 114 -115° (НСН), длины связей 0, 151 (С —С) и 0, 109 нм (С —Н). Малая вел-на угла ССС по сравнению с углом между sр3 -гибрид. орбиталями (109, 5°) позволяет предположить, что в С—С связях не достигается макс. перекрывание атомных орбиталей.
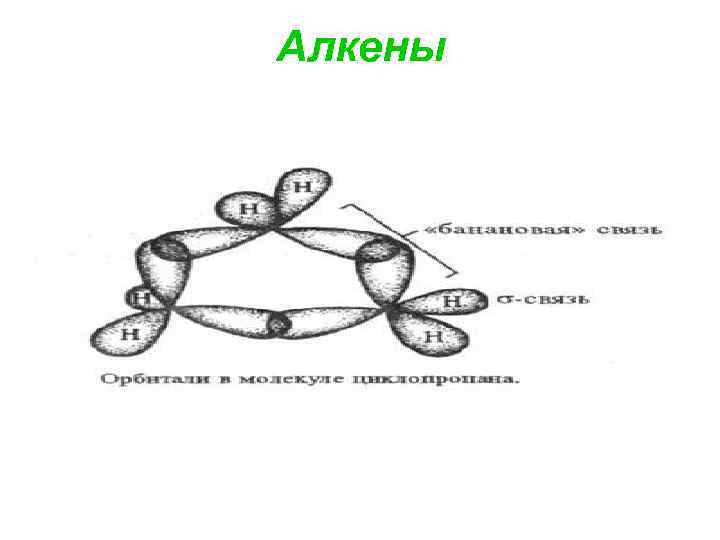
Алкены

Этиленовые углеводороды образуют гомологический ряд с общей формулой Сn. Н 2 n, родоначальником которого является этилен (СН 2=СН 2). Структурная изомерия для ряда этиленовых углеводородов начинается с 4 -ого члена, но изомеров больше, чем у алканов. Число структурных изомеров для С 4 равно трем, для С 5 пяти, для С 6 тринадцати т. д. Это связано с существованием изомерии положения двойной связи: СН 2=СН-СН 2 -СН 3 (бутен-1) и СН 3 -СН=СН-СН 3 (бутен-2) цис-2 -бутен транс-2 -бутен

Получение алкенов • Дегалогенирование алкил галогенидов • Дегидратация спиртов • Дегалогенирование вицинальных дигалогенидов • Элиминирование третичных аминов по Гофману • Дегидрирование алканов • Восстановление алкинов до цис- и трансалкенов • Реакция Виттига
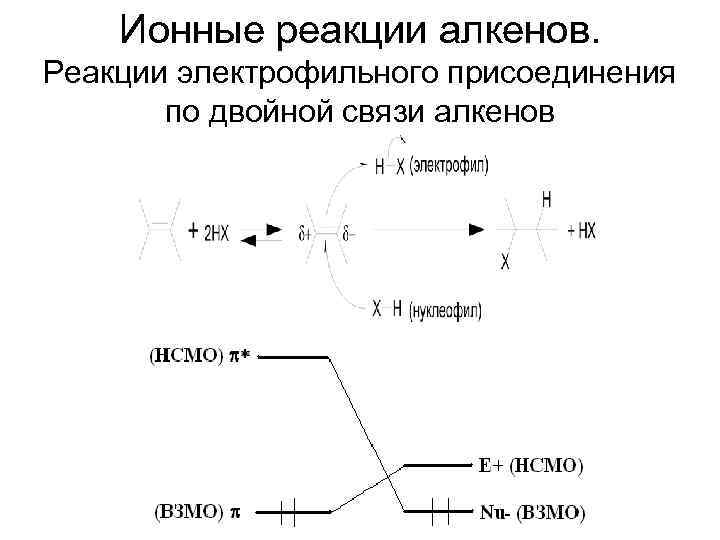
Ионные реакции алкенов. Реакции электрофильного присоединения по двойной связи алкенов

Химические свойства 1. Присоединение водорода (гидрирование) в присутствии катализатора (Рt, Рd, Ni): СН 2=СН-СН 2 -СН 3 + H 2 С 4 Н 10 бутен-1 н-бутан 2. Присоединение галогенов (галогенирование): СН 2=СН 2 + Вr 2 - CBr. Н 2 -СBr. Н 2 (1, 2 -дибромэтан) При этом происходит обесцвечивание бромной воды - качественная реакция на кратную (двойную) связь. 3. Присоединение галогеноводородов (гидрогалогенирование): СН 3 -СН=СН 2 + НСl СН 3 -СНCl-СН 3 (хлористый изопропил или 2 -хлорпропан) 4. Присоединение воды (гидратация) протекает по правилу Марковникова. бутанол-2
ОРИЕНТАЦИЯ. ПРАВИЛО МАРКОВНИКОВА
5. Олефины взаимодействуют с серной кислотой изопропилсульфокислота 6. Алкилирование алканов алкенами (используется в производстве высококачественных топлив для ДВС). (2, 2, 4 -триметилпентан) Реакция алкилирования – это электрофильное замещение (SЕ). (1) и (2) стадии можно рассматривать как димеризацию изобутилена. далее поторяются стадии (2), (3), . . . На стадии (3) карбкатион вырывает атом водорода с его парой электронов (гидрид-ион) из молекулы алкана.

7. Окисление олефинов. Окисляются алкены различными окислителями, в зависимости от их природы и условий реакции образуются разл окисления: а) окисление разбавленным водным раствором КМn. О 4 – качественная реакция на двойную связь этиленгликоль б) окисление концентрированным водным раствором КМn. О 4 или другими сильными окислителями приводит к разрыву двойной связи: 2 -метил-бутен-2 диметилкетон уксусная кислота в) кислород воздуха в присутствии Аg (катализатор) окисляет олефины до окисей (эпоксидов): окись этилена г) озонирование по Гарриесу - метод установления строения олефинов: триметилэтилен озонид ацетон

8. Реакция полимеризации - процесс образования высокомолекулярных веществ путем соединения друг с другом молекул исходного низкомолекулярного вещества мономера. n А (А)n , где n - степень полимеризации. Высокомолекулярные вещества имеют М r = 104 - 105 , n - несколько тысяч. Если n 10, то образуется олигомер - низкомолекулярный полимер. Различают два вида реакций полимеризации: а) ступенчатая полимеризация – когда образуются продукты с малым молекулярным весом, продукты реакции на каждой стадии могут быть изолированы. Так, Бутлеров получал из изобутилена диизобутилен, триизобутилен и т. д. б) линейная полимеризация – когда получаются вещества с большим молекулярным весом, начальные продукты полимеризации не могут быть изолированы.
ОРГАНИЧЕСКАЯ ХИМИЯ - 4-chem.ppt