Об_хим_1.ppt (Химия 1 курс)
- Количество слайдов: 32

Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии • Химия- наука о веществах, их строении, свойствах, взаимных превращениях и способах управления этими превращениями. • Традиционно химия делится на неорганическую, органическую и физическую. • Живые (биологические) системы состоят в основном из углерода, водорода, азота и кислорода. Правильное понимание биологии, и в частности молекулярной биологии, должно быть основано на детальном знании структур, свойств и реакционной способности биомолекул. Эти фундаментальные знания приобретаются при изучении химии.

Лекция № 1 Определения и основные понятия общей химии • Базовое понятие для химии- вещество. • Вещество- совокупность частиц, обладающих • определенными свойствами. Вещество может быть чистым, если все частицы одинаковые с одинаковыми свойствами, и смешанным, если частицы различны между собой по строению и свойствам. Вещества состоят из атомов и молекул. Вещества могут быть простыми, если все частицы состоят из одинаковых атомов, и сложным, если оно образовано из различных атомов

Лекция № 1 Определения и основные понятия общей химии • Молекула — это наименьшая частица вещества, которая сохраняет химические свойства данного вещества. • Атом — наименьшая химически неделимая частица. • Ион — атом или группа атомов, которые имеют электрический заряд. • Все вещества характеризуются определенными свойствами. • Свойство — это качественная и количественная характеристики вещества, физического тела или явления.
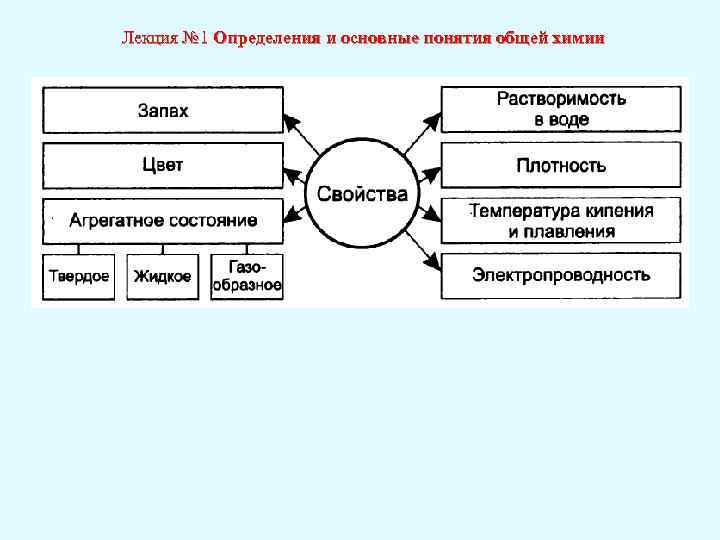
Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии • Основные положения учения об атомах и молекулах разработал русский ученый М. В. Ломоносов. • 1. Все вещества состоят из молекул, атомов или ионов. • 2. Атомы и молекулы находятся в непрерывном движении, их скорость возрастает с увеличением температуры. • 3. Атомы и молекулы имеют массу и размеры. • 4. Между молекулами в веществе существуют силы взаимного притяжения и отталкивания.

Лекция № 1 Определения и основные понятия общей химии • Количество вещества в химических процессах измеряются в молях и эквивалентах • Моль- количество вещества, содержащее количес-тво структурных единиц (атомов, ионов, молекул и т. д. ) равное постоянной Авогадро (NA) 6, 02 1023 • Эквивалент- некая реальная или условная частица, способная присоединять, вытеснять, связываться или любым другим способом быть эквивалентным атому водорода в реакциях кислотно-основного типа или электрону в реакциях окислительновосстановительного типа

Лекция № 1 Определения и основные понятия общей химии • Расчет эквивалентных масс кислоты и основания: мольную массу разделить на количество замещаемых протонов или гидроксильных групп Fe(OH)3 M(Fe(OH)3)=107 Fe(OH)3 +HCl= Fe(OH)2 Cl+H 2 O Э(Fe(OH)3)=107 Fe(OH)3 +2 HCl= Fe(OH)Cl 2+2 H 2 O Э(Fe(OH)3)=53, 5 Fe(OH)3 +3 HCl= Fe. Cl 3+3 H 2 O Э(Fe(OH)3)=35, 7 соли: мольную массу разделить на сумму валентностей катионов или анионов KCl M(KCl)=72, 5 Э(KCl)=72, 5 Cu. SO 4 M(Cu. SO 4)=160 Э(Cu. SO 4)=80 KFe(SO 4)2 M(KFe(SO 4)2) =287 Э(KFe(SO 4)2)=72, 3

Лекция № 1 Определения и основные понятия общей химии окислителей и восстановителей KMn. O 4 M(KMn. O 4)=158 2 KMn. O 4+16 HCl=2 Mn. Cl 2+2 KCl+5 Cl 2+4 H 2 O Э(KMn. O 4)= 31, 6 2 KMn. O 4+6 KCl+4 H 2 O=2 Mn. O 2+8 KOH+3 Cl 2 Э(KMn. O 4)= 52, 6 KMn. O 4+Fe. Cl 2+KOH=K 2 Mn. O 4+Fe. Cl 2 OH Э(KMn. O 4)= 158

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии • Химический элемент - это совокупность атомов с одинаковым положительным зарядом ядра • Элементы могут быть разделены на металлы и неметаллы • Металлы: блеск, электро- и теплопроводность; твердые и жидкие (Hg) • Неметаллы: лишены блеска, малая теплопроводность и электропроводность; твердые, жидкие и газы
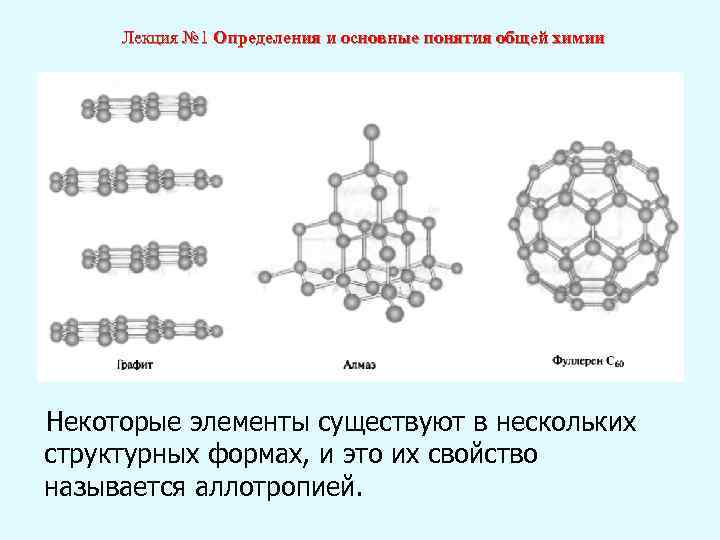
Лекция № 1 Определения и основные понятия общей химии Некоторые элементы существуют в нескольких структурных формах, и это их свойство называется аллотропией.

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии • В твердом состоянии атомы всегда расположены регулярно; твердое вещество имеет фиксированный объем (при данных давлении и температуре) и форму. Жидкость также при данных условиях имеет определенный объем, но не имеет формы. Она принимает форму сосуда, в котором находится. Частицы (атомы или молекулы) газа (пара) хаотично движутся и занимают большой объем. Газу не присуща форма. • В химических уравнениях всегда указывается состояние вещества, для чего используются следующие стандартные обозначения: твердое вещество (тв. ), жидкость (ж. ), газ (газ), водный раствор (водн. )

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии • Молярная масса вещества равна отношению массы вещества к его количеству. • Молярная масса вещества М в г/моль численно равна относительной молекулярной массе данного вещества.

Лекция № 1 Определения и основные понятия общей химии Молярный объем газа VM равен отношению объема газа V к количеству вещества n в этом объеме.

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии • Химическая реакция — это процесс превращения • • одних веществ в другие вещества. Химическое уравнение — изображение (показ) химической реакции при помощи химических формул и математических знаков. Химическое уравнение показывает, какие вещества и в каких количествах вступили в реакцию и получились в результате этой реакции.

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии • Литература по курсу • Химия: Учебник / А. А. Гуров, Ф. З. Бадаев, Л. П. Овчаренко, В. Н. Шаповал. - М. : Изд-во МГТУ им. Н. Э. Баумана, 2004. - 748 с: ил. • Хаускрофт К. , Констебл Э. Современный курс общей химии. В 2 -х т. Т. 1: Пер. с англ. - М. : Мир, 2002. - 540 с. , ил. - (Лучший зарубежный учебник) • Хаускрофт К. , Констебл Э. Современный курс общей химии. В 2 -х т. Т. 2: Пер. с англ. - М. : Мир, 2002. - 528 с. , ил. - (Лучший зарубежный учебник) • Общая химия/ под ред. Соколовской Е. М. , Вовченко Г. Д. , Третьякова Ю. Д. - М. : Изд- во МГУ, 1975 г. - 703 с.

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии

Лекция № 1 Определения и основные понятия общей химии
Об_хим_1.ppt (Химия 1 курс)