электрохимия часть 2 - копия.ppt
- Количество слайдов: 52
 ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ХИМИИ Гальванические цепи 1. Потенциометрическое титрование. 2. Направление окислительно- восстановительных процессов. Лектор: Степанова Ирина Петровна, доктор биологических наук, профессор, зав. кафедрой химии
ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ХИМИИ Гальванические цепи 1. Потенциометрическое титрование. 2. Направление окислительно- восстановительных процессов. Лектор: Степанова Ирина Петровна, доктор биологических наук, профессор, зав. кафедрой химии
 Потенциометрический метод анализа основан на использовании зависимости ЭДС электрохимической цепи от активности анализируемого иона.
Потенциометрический метод анализа основан на использовании зависимости ЭДС электрохимической цепи от активности анализируемого иона.
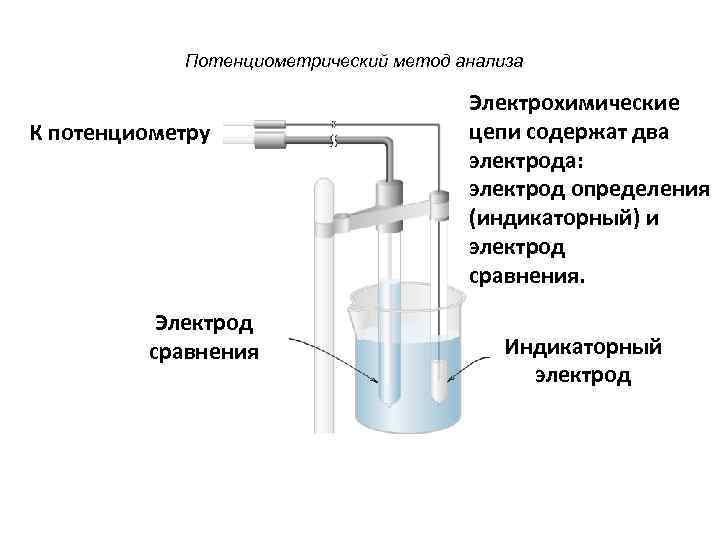 Потенциометрический метод анализа Электрохимические К потенциометру цепи содержат два электрода: электрод определения (индикаторный) и электрод сравнения. Электрод сравнения Индикаторный электрод
Потенциометрический метод анализа Электрохимические К потенциометру цепи содержат два электрода: электрод определения (индикаторный) и электрод сравнения. Электрод сравнения Индикаторный электрод
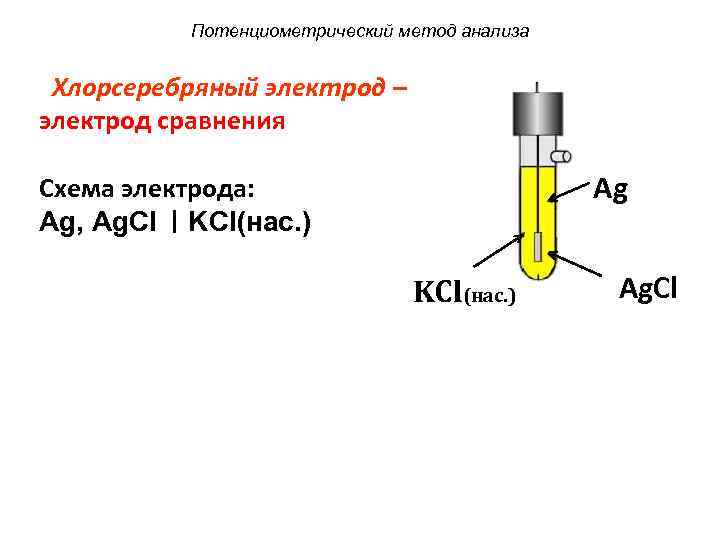 Потенциометрический метод анализа Хлорсеребряный электрод – электрод сравнения Схема электрода: Ag Ag, Ag. Cl KCl(нас. ) KCl(нас. ) Ag. Cl
Потенциометрический метод анализа Хлорсеребряный электрод – электрод сравнения Схема электрода: Ag Ag, Ag. Cl KCl(нас. ) KCl(нас. ) Ag. Cl
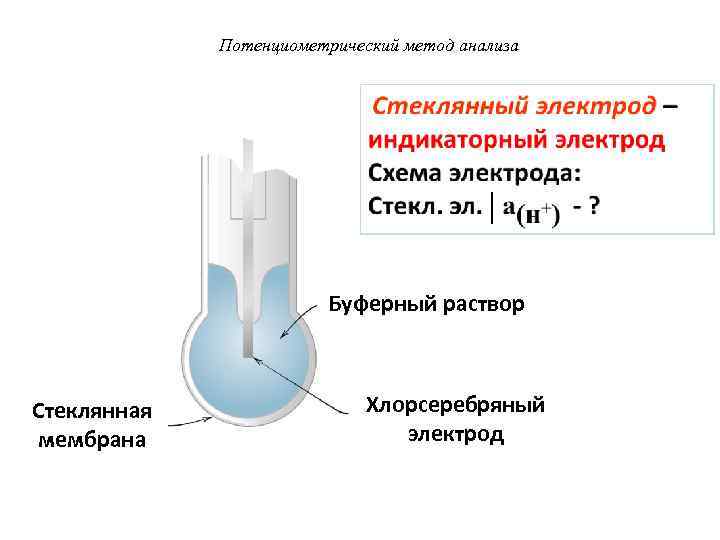 Потенциометрический метод анализа Буферный раствор Стеклянная Хлорсеребряный мембрана электрод
Потенциометрический метод анализа Буферный раствор Стеклянная Хлорсеребряный мембрана электрод
 Потенциометрический метод анализа
Потенциометрический метод анализа
 Потенциометрический метод анализа Виды потенциометрического анализа: - прямая потенциометрия, или ионометрия; - потенциометрическое титрование. Метод прямой потенциометрии основан на определении концентрации иона непосредственно по измеренной ЭДС электрохимической цепи.
Потенциометрический метод анализа Виды потенциометрического анализа: - прямая потенциометрия, или ионометрия; - потенциометрическое титрование. Метод прямой потенциометрии основан на определении концентрации иона непосредственно по измеренной ЭДС электрохимической цепи.
 Потенциометрический метод анализа Потенциометрическое титрование основано на определении точки эквивалентности по резкому изменению в ней ЭДС электрохимической цепи. Техника титрования: заполнение кончика бюретки
Потенциометрический метод анализа Потенциометрическое титрование основано на определении точки эквивалентности по резкому изменению в ней ЭДС электрохимической цепи. Техника титрования: заполнение кончика бюретки
 Потенциометрический метод анализа Техника титрования
Потенциометрический метод анализа Техника титрования
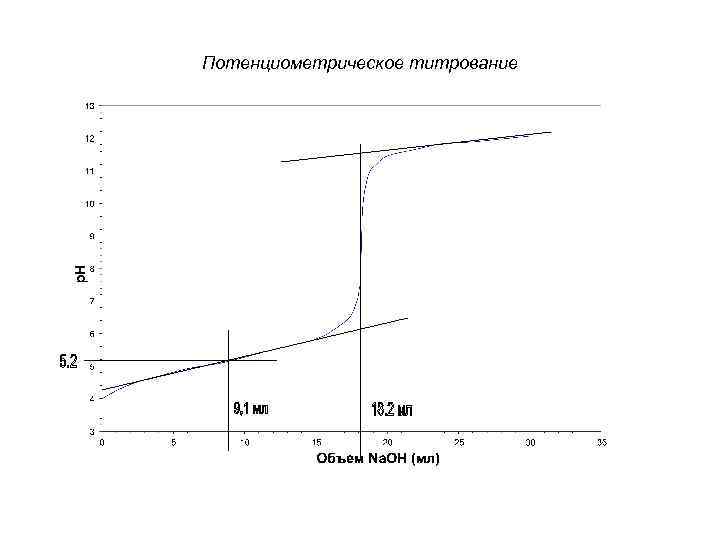
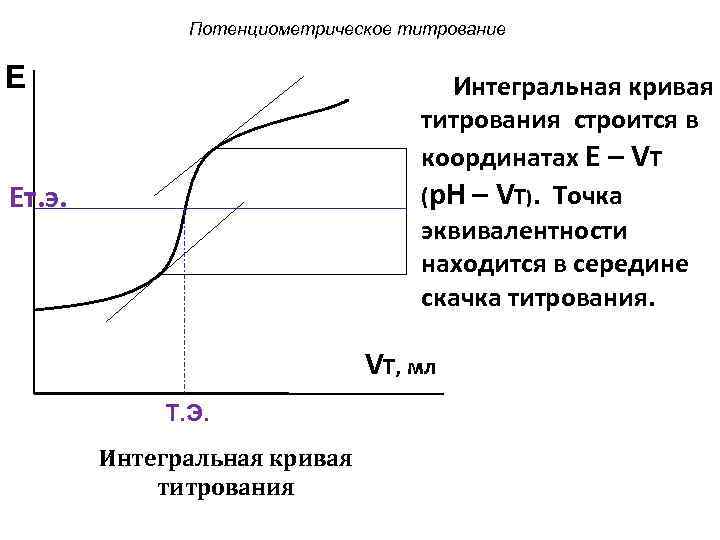 Потенциометрическое титрование E Интегральная кривая титрования строится в координатах E – VТ Eт. э. (p. H – VТ). Точка эквивалентности находится в середине скачка титрования. VT, мл Т. Э. Интегральная кривая титрования
Потенциометрическое титрование E Интегральная кривая титрования строится в координатах E – VТ Eт. э. (p. H – VТ). Точка эквивалентности находится в середине скачка титрования. VT, мл Т. Э. Интегральная кривая титрования
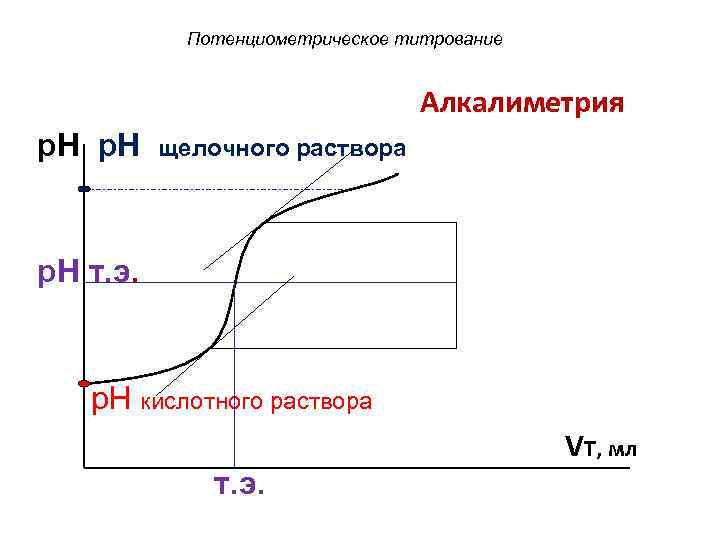 Потенциометрическое титрование Алкалиметрия p. H щелочного раствора p. H т. э. p. H кислотного раствора VT, мл т. э.
Потенциометрическое титрование Алкалиметрия p. H щелочного раствора p. H т. э. p. H кислотного раствора VT, мл т. э.
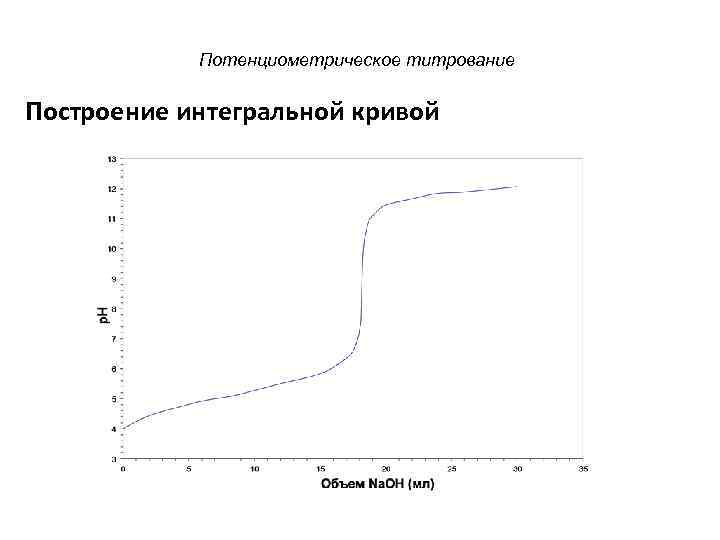 Потенциометрическое титрование Построение интегральной кривой
Потенциометрическое титрование Построение интегральной кривой
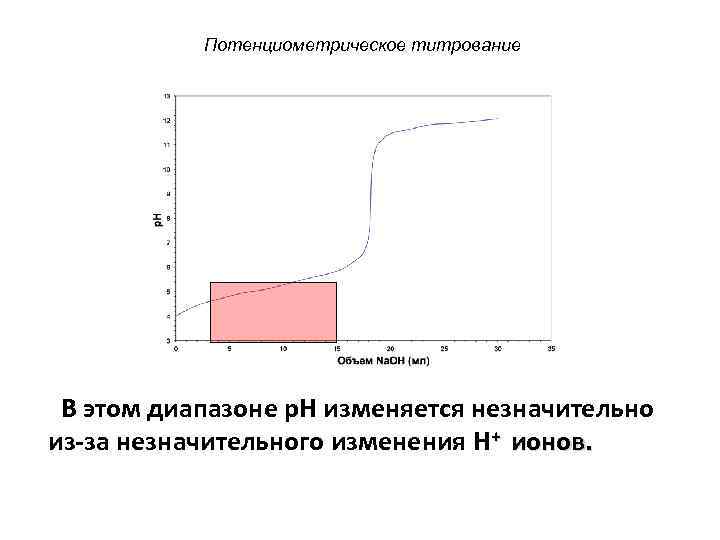 Потенциометрическое титрование В этом диапазоне p. H изменяется незначительно из-за незначительного изменения H+ ионов.
Потенциометрическое титрование В этом диапазоне p. H изменяется незначительно из-за незначительного изменения H+ ионов.
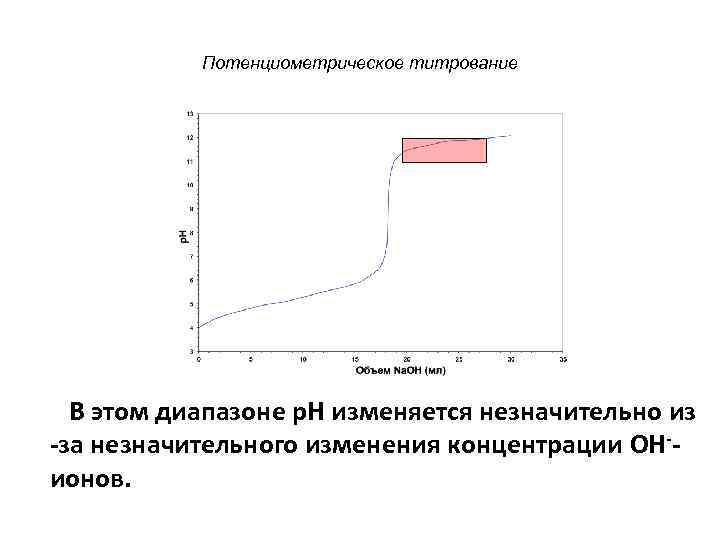 Потенциометрическое титрование В этом диапазоне p. H изменяется незначительно из -за незначительного изменения концентрации OH-- ионов.
Потенциометрическое титрование В этом диапазоне p. H изменяется незначительно из -за незначительного изменения концентрации OH-- ионов.
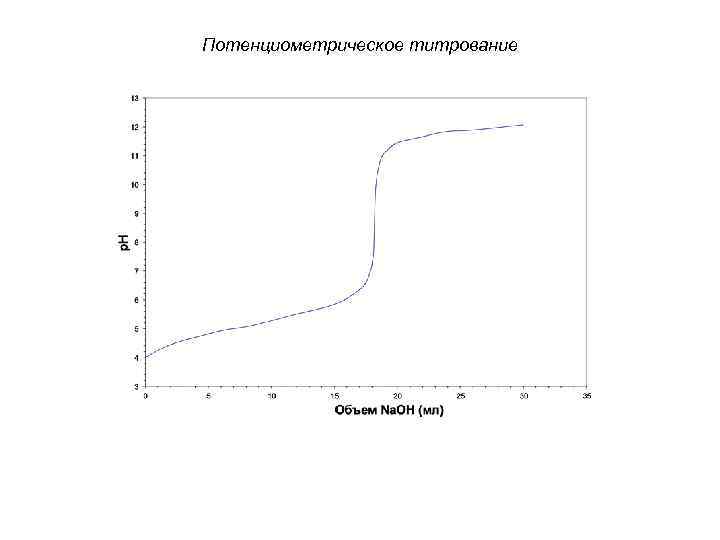 Потенциометрическое титрование
Потенциометрическое титрование
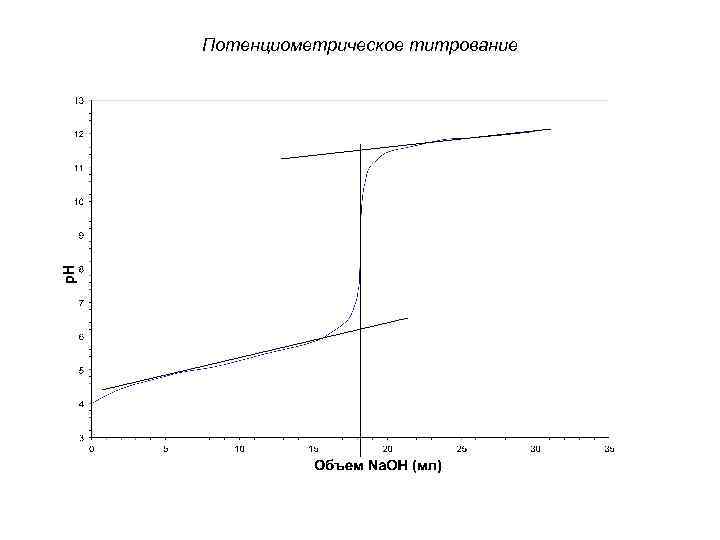 Потенциометрическое титрование
Потенциометрическое титрование
 Потенциометрическое титрование
Потенциометрическое титрование
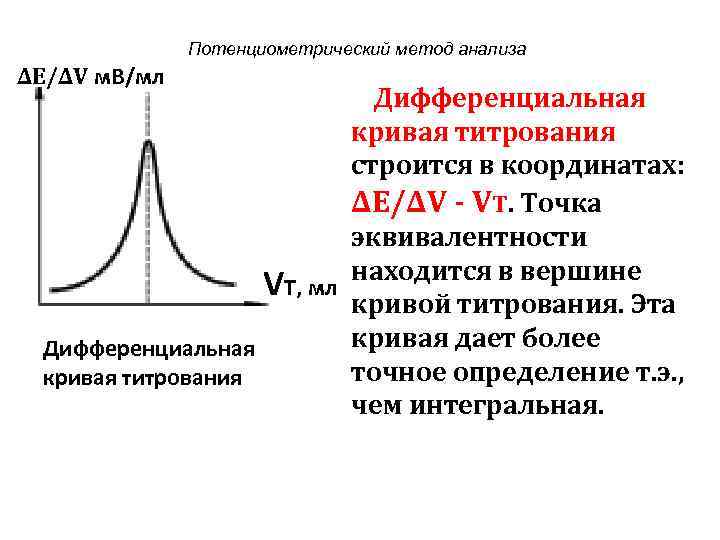 Потенциометрический метод анализа ∆Е/∆V м. В/мл Дифференциальная кривая титрования строится в координатах: ∆Е/∆V - VT. Точка эквивалентности находится в вершине VТ, мл кривой титрования. Эта Дифференциальная кривая дает более кривая титрования точное определение т. э. , чем интегральная.
Потенциометрический метод анализа ∆Е/∆V м. В/мл Дифференциальная кривая титрования строится в координатах: ∆Е/∆V - VT. Точка эквивалентности находится в вершине VТ, мл кривой титрования. Эта Дифференциальная кривая дает более кривая титрования точное определение т. э. , чем интегральная.
 Потенциометрический метод анализа Количественные расчеты производят по закону эквивалентов: Метод потенциометрического титрования применяют при анализе мутных, загрязненных и окрашенных растворов в смешанных и неводных растворителях.
Потенциометрический метод анализа Количественные расчеты производят по закону эквивалентов: Метод потенциометрического титрования применяют при анализе мутных, загрязненных и окрашенных растворов в смешанных и неводных растворителях.
 Направление окислительно- восстановительных процессов Окислительно-восстановительный процесс будет протекать в нужном направлении при условии, что разность электродных потенциалов будет положительной.
Направление окислительно- восстановительных процессов Окислительно-восстановительный процесс будет протекать в нужном направлении при условии, что разность электродных потенциалов будет положительной.
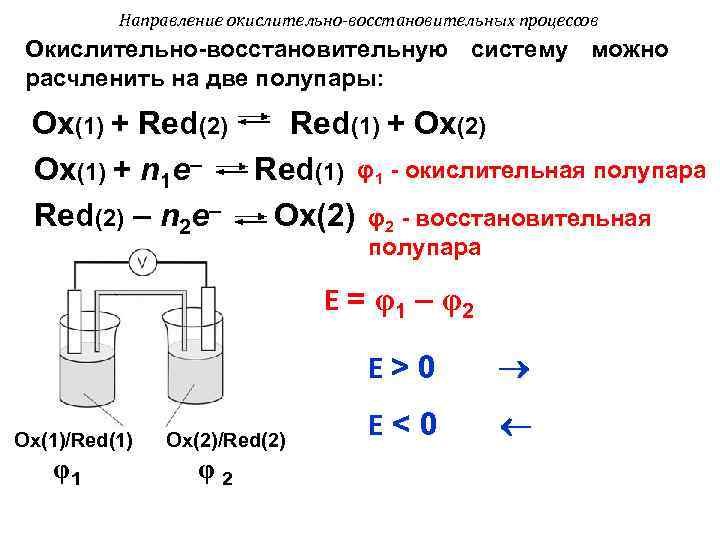 Направление окислительно-восстановительных процессов Окислительно-восстановительную систему можно расчленить на две полупары: Оx(1) + Red(2) Red(1) + Оx(2) Оx(1) + n 1 e– Red(1) φ1 - окислительная полупара Red(2) – n 2 e– Оx(2) φ2 - восстановительная полупара Е = φ1 – φ2 Е>0 Ox(1)/Red(1) Оx(2)/Red(2) Е<0 φ1 φ2
Направление окислительно-восстановительных процессов Окислительно-восстановительную систему можно расчленить на две полупары: Оx(1) + Red(2) Red(1) + Оx(2) Оx(1) + n 1 e– Red(1) φ1 - окислительная полупара Red(2) – n 2 e– Оx(2) φ2 - восстановительная полупара Е = φ1 – φ2 Е>0 Ox(1)/Red(1) Оx(2)/Red(2) Е<0 φ1 φ2
 Направление окислительно-восстановительных процессов Часто вместо таких полупар рассматривают две полуреакции, в которые включают не только атомы, изменяющие свою степень окисления, но и взаимодействующие с ними ионы Н+ и ОН-. Любая полупара, играющая в одной о/в реакции роль окислительной, может в другой реакции играть роль восстановительной.
Направление окислительно-восстановительных процессов Часто вместо таких полупар рассматривают две полуреакции, в которые включают не только атомы, изменяющие свою степень окисления, но и взаимодействующие с ними ионы Н+ и ОН-. Любая полупара, играющая в одной о/в реакции роль окислительной, может в другой реакции играть роль восстановительной.
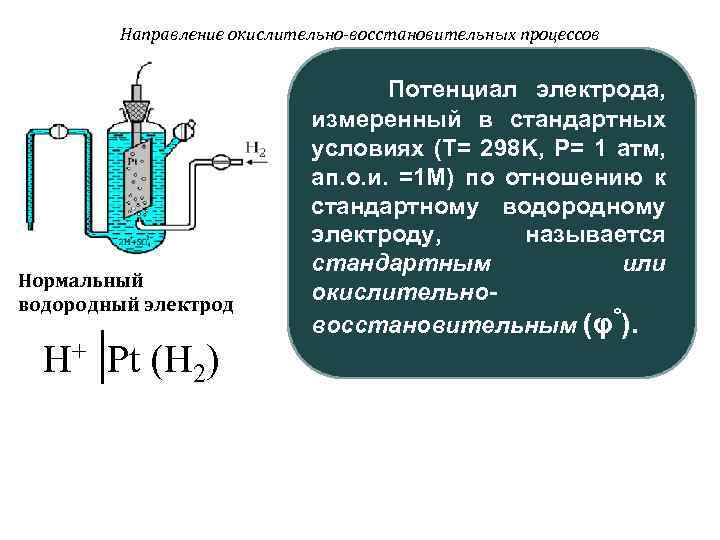 Направление окислительно-восстановительных процессов Потенциал электрода, измеренный в стандартных условиях (T= 298 K, P= 1 атм, ап. о. и. =1 M) по отношению к стандартному водородному электроду, называется стандартным или Нормальный водородный электрод окислительно- восстановительным (φ°). H+ Pt (H 2)
Направление окислительно-восстановительных процессов Потенциал электрода, измеренный в стандартных условиях (T= 298 K, P= 1 атм, ап. о. и. =1 M) по отношению к стандартному водородному электроду, называется стандартным или Нормальный водородный электрод окислительно- восстановительным (φ°). H+ Pt (H 2)
 Направление окислительно-восстановительных процессов Оx + Н 2 Red + 2 Н+ Е° = φ°(Оx/Red) – φ°(Н+/1/2 Н 2) = φ°(Оx/Red) Данные стандартного потенциала полуреакции восстановления φ° приведены в справочниках.
Направление окислительно-восстановительных процессов Оx + Н 2 Red + 2 Н+ Е° = φ°(Оx/Red) – φ°(Н+/1/2 Н 2) = φ°(Оx/Red) Данные стандартного потенциала полуреакции восстановления φ° приведены в справочниках.
 Направление окислительно-восстановительных процессов Окислительно-восстановительный процесс протекает в прямом направлении до конца при любых начальных условиях, если Е > 0, 4 В.
Направление окислительно-восстановительных процессов Окислительно-восстановительный процесс протекает в прямом направлении до конца при любых начальных условиях, если Е > 0, 4 В.
 Направление окислительно-восстановительных процессов Чем выше значение стандартного электродного потенциала φ0, тем выше у данной полупары окислительная способность, т. е. на этом электроде будет протекать процесс восстановления (+ е-). На электроде с более отрицательным значением φ0 протекает процесс окисления (- е-). У такой полупары выше восстановительная способность.
Направление окислительно-восстановительных процессов Чем выше значение стандартного электродного потенциала φ0, тем выше у данной полупары окислительная способность, т. е. на этом электроде будет протекать процесс восстановления (+ е-). На электроде с более отрицательным значением φ0 протекает процесс окисления (- е-). У такой полупары выше восстановительная способность.
 Направление окислительно-восстановительных процессов Ряд red-ox потенциалов: Повышение Полуреакция окисл. способности восст. способности φ°, В Br. O 3 + 5 H+ + 4 e HBr. O + 2 H 2 O 1, 45 HBr. O + H+ + 2 e Br + H 2 O 1, 33 Cl. O 4 + 8 H+ + 8 e Cl + 4 H 2 O 1, 3 Cl. O 4 + 4 H 2 O + 8 e Cl + 8 OH 0, 56
Направление окислительно-восстановительных процессов Ряд red-ox потенциалов: Повышение Полуреакция окисл. способности восст. способности φ°, В Br. O 3 + 5 H+ + 4 e HBr. O + 2 H 2 O 1, 45 HBr. O + H+ + 2 e Br + H 2 O 1, 33 Cl. O 4 + 8 H+ + 8 e Cl + 4 H 2 O 1, 3 Cl. O 4 + 4 H 2 O + 8 e Cl + 8 OH 0, 56
 Направление окислительно-восстановительных процессов Например: Сd 2+ + 2 e- Cd 0, IO 3 - + 6 H+ + 6 e- I- + 3 Н 2 О,
Направление окислительно-восстановительных процессов Например: Сd 2+ + 2 e- Cd 0, IO 3 - + 6 H+ + 6 e- I- + 3 Н 2 О,
 Направление окислительно-восстановительных процессов Первая система является системой восстановителя. На этом электроде будет протекать процесс отдачи электронов (процесс окисления): Cd 0 - 2 e- Сd 2+ Вторая система – система окислителя. На этом электроде будет протекать процесс присоединения электронов (процесс восстановления): IO 3 - + 6 H+ + 6 e- I- + 3 Н 2 О
Направление окислительно-восстановительных процессов Первая система является системой восстановителя. На этом электроде будет протекать процесс отдачи электронов (процесс окисления): Cd 0 - 2 e- Сd 2+ Вторая система – система окислителя. На этом электроде будет протекать процесс присоединения электронов (процесс восстановления): IO 3 - + 6 H+ + 6 e- I- + 3 Н 2 О
 Направление окислительно-восстановительных процессов Суммарное уравнение реакции: Cd 0 - 2 e- Сd 2+ 3 IO 3 - + 6 H+ + 6 e- I- + 3 Н 2 О 1 3 Cd 0 + IO 3 - + 6 H+ 3 Сd 2+ + I- + 3 Н 2 О
Направление окислительно-восстановительных процессов Суммарное уравнение реакции: Cd 0 - 2 e- Сd 2+ 3 IO 3 - + 6 H+ + 6 e- I- + 3 Н 2 О 1 3 Cd 0 + IO 3 - + 6 H+ 3 Сd 2+ + I- + 3 Н 2 О
 Направление окислительно-восстановительных процессов Гальваническая цепь: Cd 0 Сd 2+ IO 3 -, H+ Pt I- Е = φ° IO 3 -/I- - φ° Сd 2+/Cd 0 = 1, 085 – (-0, 4) = 1, 485 В Е ˃ 0, процесс возможен.
Направление окислительно-восстановительных процессов Гальваническая цепь: Cd 0 Сd 2+ IO 3 -, H+ Pt I- Е = φ° IO 3 -/I- - φ° Сd 2+/Cd 0 = 1, 085 – (-0, 4) = 1, 485 В Е ˃ 0, процесс возможен.
 Направление окислительно-восстановительных процессов Например: Cd 2+ (р) + 2 e- Cd (т) φ0 = -0, 40 В Cd 2+ - окислитель, Cr 3+ (р) + 3 e- Cr (т) φ0 = -0, 74 В Cr - восстановитель Aнод (окисление): Cr (s) -3 e- Cr 3+ x 2 Катод (восстановление): Cd 2+ + 2 e- Cd (s) x 3 2 Cr (s) + 3 Cd 2+ 3 Cd (s) + 2 Cr 3+ 0 0 Е = φ катода - φанода Е = -0, 40 – (-0, 74) Е = 0, 34 В
Направление окислительно-восстановительных процессов Например: Cd 2+ (р) + 2 e- Cd (т) φ0 = -0, 40 В Cd 2+ - окислитель, Cr 3+ (р) + 3 e- Cr (т) φ0 = -0, 74 В Cr - восстановитель Aнод (окисление): Cr (s) -3 e- Cr 3+ x 2 Катод (восстановление): Cd 2+ + 2 e- Cd (s) x 3 2 Cr (s) + 3 Cd 2+ 3 Cd (s) + 2 Cr 3+ 0 0 Е = φ катода - φанода Е = -0, 40 – (-0, 74) Е = 0, 34 В
 Направление окислительно-восстановительных процессов Например: Mn. O 4 - + 8 H+ + 5 e- Mn+2 + 4 H 2 O, φ0 Mn. O 4 -, H+/Mn+2 = 1, 51 В Fe+3 + e- Fe+2, φ0 Fe+3/Fe+2 = 0, 77 В
Направление окислительно-восстановительных процессов Например: Mn. O 4 - + 8 H+ + 5 e- Mn+2 + 4 H 2 O, φ0 Mn. O 4 -, H+/Mn+2 = 1, 51 В Fe+3 + e- Fe+2, φ0 Fe+3/Fe+2 = 0, 77 В
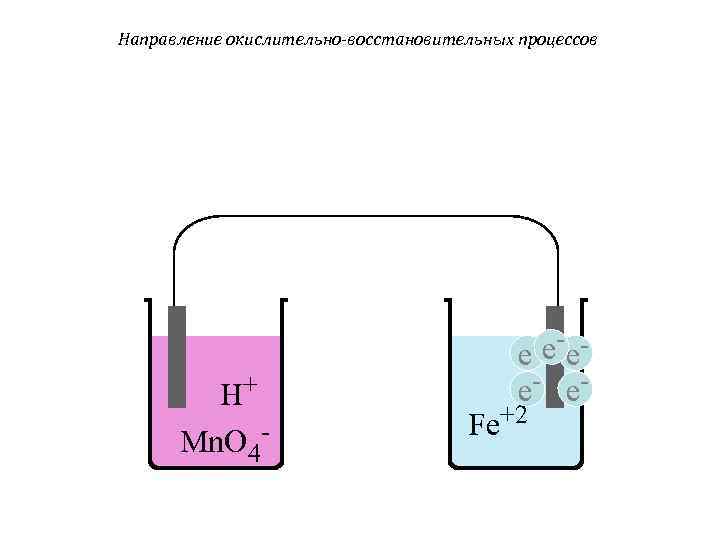 Направление окислительно-восстановительных процессов e - e- e- H+ e- e- Fe+2 Mn. O 4 -
Направление окислительно-восстановительных процессов e - e- e- H+ e- e- Fe+2 Mn. O 4 -
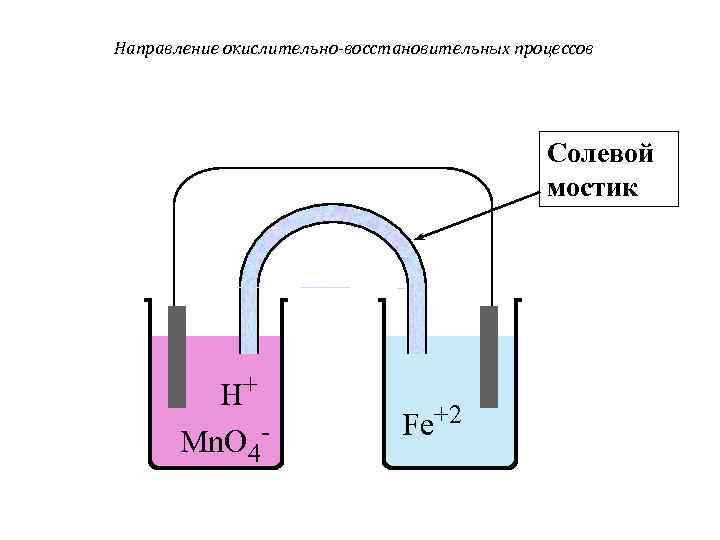 Направление окислительно-восстановительных процессов Солевой мостик H+ Fe+2 Mn. O 4 -
Направление окислительно-восстановительных процессов Солевой мостик H+ Fe+2 Mn. O 4 -
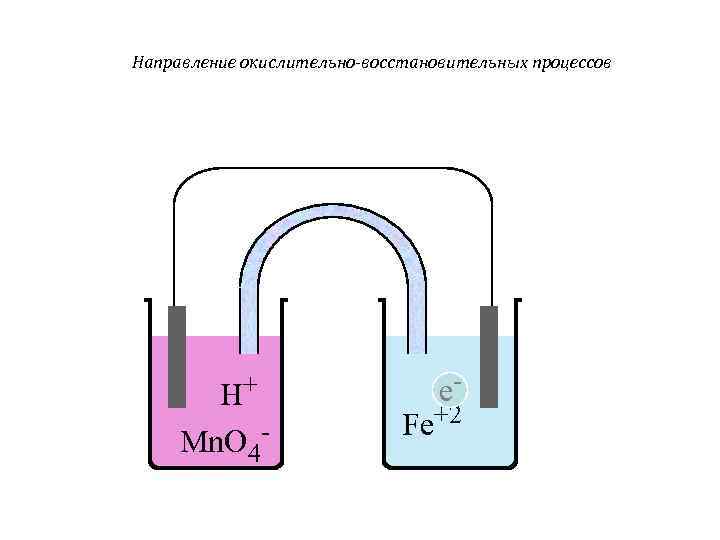 Направление окислительно-восстановительных процессов H+ e- Fe+2 Mn. O 4 -
Направление окислительно-восстановительных процессов H+ e- Fe+2 Mn. O 4 -
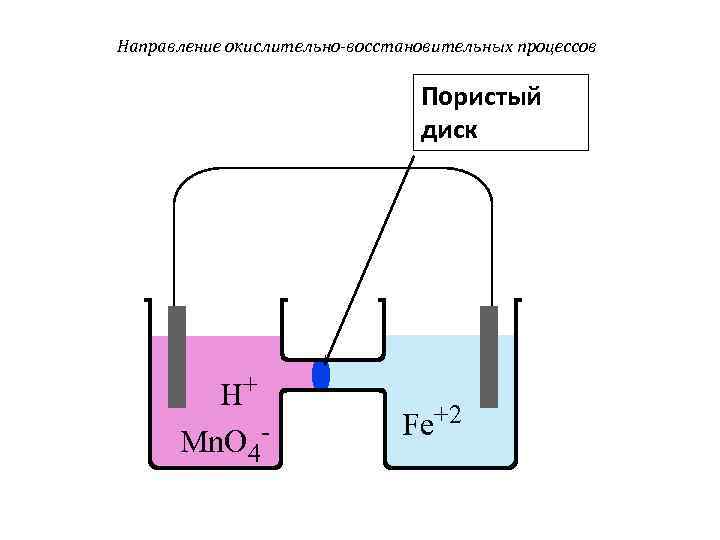 Направление окислительно-восстановительных процессов Пористый диск H+ Fe+2 Mn. O 4 -
Направление окислительно-восстановительных процессов Пористый диск H+ Fe+2 Mn. O 4 -
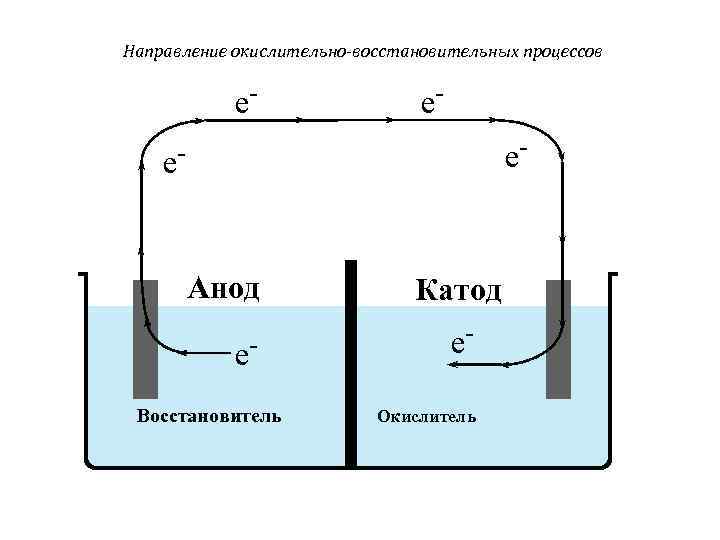 Направление окислительно-восстановительных процессов e- e- e- Анод Катод e- Восстановитель Окислитель
Направление окислительно-восстановительных процессов e- e- e- Анод Катод e- Восстановитель Окислитель
 Направление окислительно-восстановительных процессов Первая система является системой окислителя. На этом электроде будет протекать процесс присоединения электронов (процесс восстановления): Mn. O 4 - + 8 H+ + 5 e- Mn+2 + 4 H 2 O Вторая система – система восстановителя. На этом электроде будет протекать процесс электронов (процесс окисления): Fe+2 - e- Fe+3
Направление окислительно-восстановительных процессов Первая система является системой окислителя. На этом электроде будет протекать процесс присоединения электронов (процесс восстановления): Mn. O 4 - + 8 H+ + 5 e- Mn+2 + 4 H 2 O Вторая система – система восстановителя. На этом электроде будет протекать процесс электронов (процесс окисления): Fe+2 - e- Fe+3
 Направление окислительно-восстановительных процессов Суммарное уравнение реакции: Mn. O 4 - + 8 H+ + 5 e- Mn+2 + 4 H 2 O 1 Fe+2 - e- Fe+3 5 Mn. O 4 -+ 8 H++ 5 Fe+2 Mn+2 +5 Fe+3+4 H 2 O
Направление окислительно-восстановительных процессов Суммарное уравнение реакции: Mn. O 4 - + 8 H+ + 5 e- Mn+2 + 4 H 2 O 1 Fe+2 - e- Fe+3 5 Mn. O 4 -+ 8 H++ 5 Fe+2 Mn+2 +5 Fe+3+4 H 2 O
 Направление окислительно-восстановительных процессов •
Направление окислительно-восстановительных процессов •
 Практическое приложение ГЭ В гальванических элементах протекают необратимые реакции: их нельзя перезаряжать и можно использовать однократно. Химические источники тока, в которых протекают обратимые реакции, называют аккумуляторами: их можно перезаряжать и использовать многократно.
Практическое приложение ГЭ В гальванических элементах протекают необратимые реакции: их нельзя перезаряжать и можно использовать однократно. Химические источники тока, в которых протекают обратимые реакции, называют аккумуляторами: их можно перезаряжать и использовать многократно.
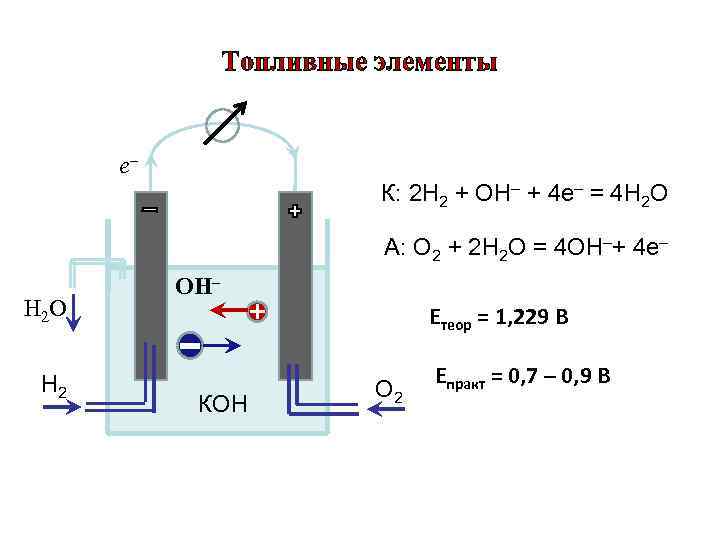 Топливные элементы е– К: 2 Н 2 + ОН– + 4 е– = 4 Н 2 О А: О 2 + 2 Н 2 О = 4 ОН–+ 4 е– ОН– Н 2 O + - Етеор = 1, 229 В Н 2 Епракт = 0, 7 – 0, 9 В О 2 КОН
Топливные элементы е– К: 2 Н 2 + ОН– + 4 е– = 4 Н 2 О А: О 2 + 2 Н 2 О = 4 ОН–+ 4 е– ОН– Н 2 O + - Етеор = 1, 229 В Н 2 Епракт = 0, 7 – 0, 9 В О 2 КОН
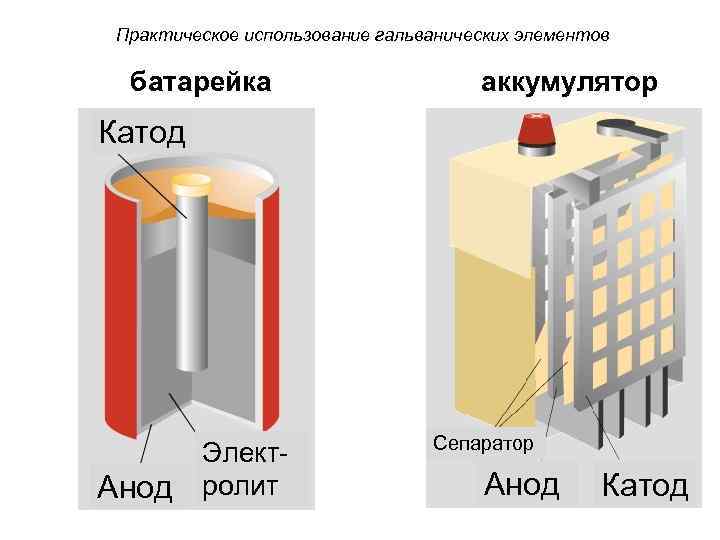 Практическое использование гальванических элементов батарейка аккумулятор Катод Сепаратор Элект- Анод ролит Анод Катод
Практическое использование гальванических элементов батарейка аккумулятор Катод Сепаратор Элект- Анод ролит Анод Катод
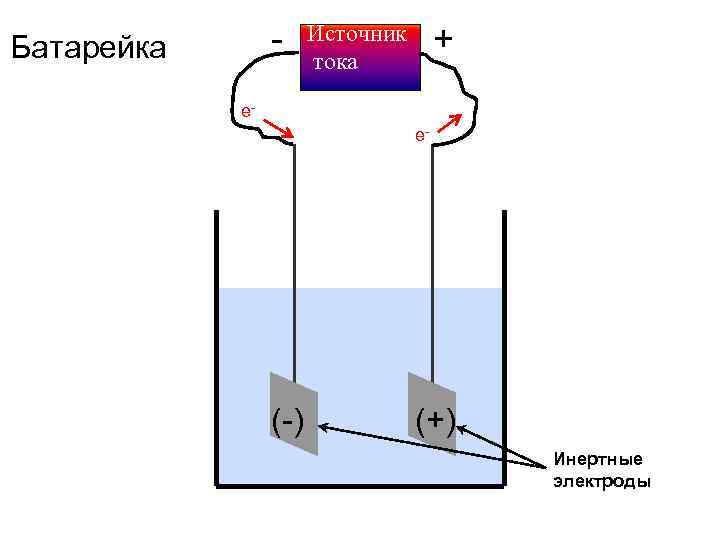 Батарейка - Источник + тока e- (-) (+) Инертные электроды
Батарейка - Источник + тока e- (-) (+) Инертные электроды
 Химические процессы при электролизе расплава хлорида натрия, Na. Cl? Na+ Cl-
Химические процессы при электролизе расплава хлорида натрия, Na. Cl? Na+ Cl-
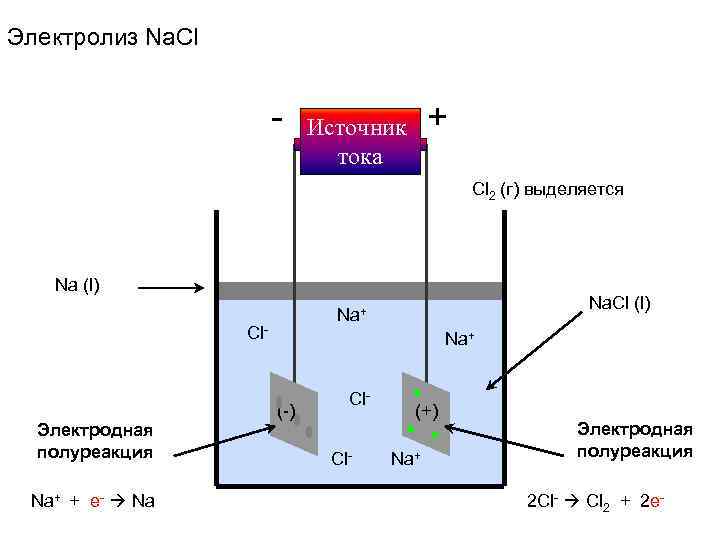 Электролиз Na. Cl - Источник + тока Cl 2 (г) выделяется Na (l) Na. Cl (l) Na+ Cl- Na+ Cl- (-) (+) Электродная полуреакция Cl- Na+ полуреакция Na+ + e- Na 2 Cl- Cl 2 + 2 e-
Электролиз Na. Cl - Источник + тока Cl 2 (г) выделяется Na (l) Na. Cl (l) Na+ Cl- Na+ Cl- (-) (+) Электродная полуреакция Cl- Na+ полуреакция Na+ + e- Na 2 Cl- Cl 2 + 2 e-
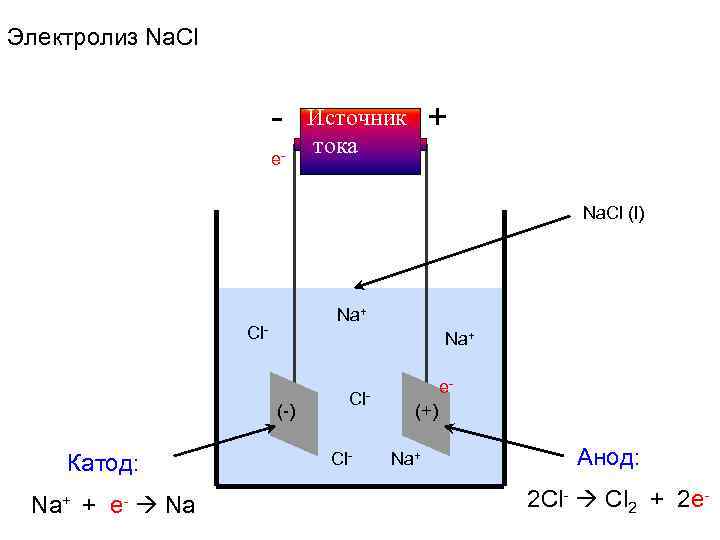 Электролиз Na. Cl - Источник + e- тока Na. Cl (l) Na+ Cl- Na+ e- Cl- (-) (+) Катод: Cl- Na+ Анод: Na+ + e- Na 2 Cl- Cl 2 + 2 e-
Электролиз Na. Cl - Источник + e- тока Na. Cl (l) Na+ Cl- Na+ e- Cl- (-) (+) Катод: Cl- Na+ Анод: Na+ + e- Na 2 Cl- Cl 2 + 2 e-
 Электродные процессы Катод (-) ВОССТАНОВЛЕНИЕ Na+ + e- Na Анод (+) ОКИСЛЕНИЕ 2 Cl- Cl 2 + 2 e- Суммарная реакция: 2 Na+ + 2 Cl- 2 Na + Cl 2
Электродные процессы Катод (-) ВОССТАНОВЛЕНИЕ Na+ + e- Na Анод (+) ОКИСЛЕНИЕ 2 Cl- Cl 2 + 2 e- Суммарная реакция: 2 Na+ + 2 Cl- 2 Na + Cl 2
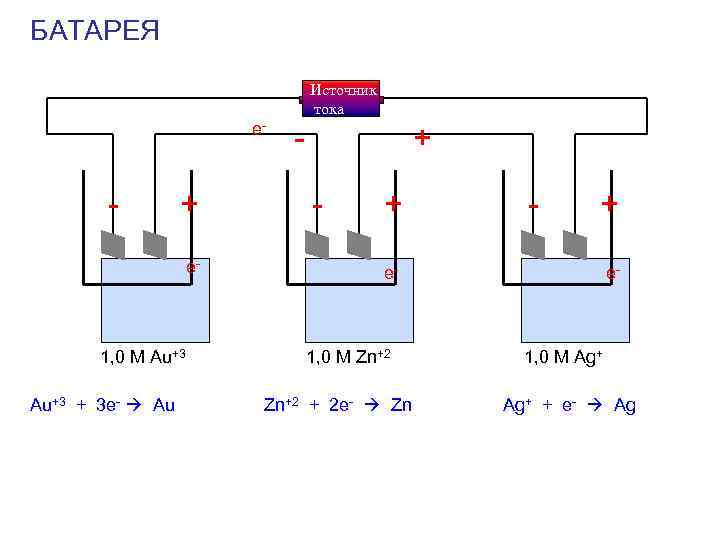 БАТАРЕЯ Источник тока e- - + - + - + - + e- 1, 0 M Au+3 1, 0 M Zn+2 1, 0 M Ag+ Au+3 + 3 e- Au Zn+2 + 2 e- Zn Ag+ + e- Ag
БАТАРЕЯ Источник тока e- - + - + - + - + e- 1, 0 M Au+3 1, 0 M Zn+2 1, 0 M Ag+ Au+3 + 3 e- Au Zn+2 + 2 e- Zn Ag+ + e- Ag
 Вопросы для самоконтроля 1. Сформулируйте правило «правого плюса» . 2. Укажите области применения гальванических элементов. 3. В чем сущность потенциометрического метода анализа? 4. Как определяется направление окислительно- восстановительных процессов?
Вопросы для самоконтроля 1. Сформулируйте правило «правого плюса» . 2. Укажите области применения гальванических элементов. 3. В чем сущность потенциометрического метода анализа? 4. Как определяется направление окислительно- восстановительных процессов?
 БЛАГОДАРЮ ЗА ВАШЕ ВНИМАНИЕ!
БЛАГОДАРЮ ЗА ВАШЕ ВНИМАНИЕ!


