тесты диссоциация.pptx
- Количество слайдов: 38
 ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ Тесты «Электролитическая диссоциация» Составитель: доктор биологических наук, профессор, зав. кафедрой химии Ирина Петровна Степанова
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ Тесты «Электролитическая диссоциация» Составитель: доктор биологических наук, профессор, зав. кафедрой химии Ирина Петровна Степанова
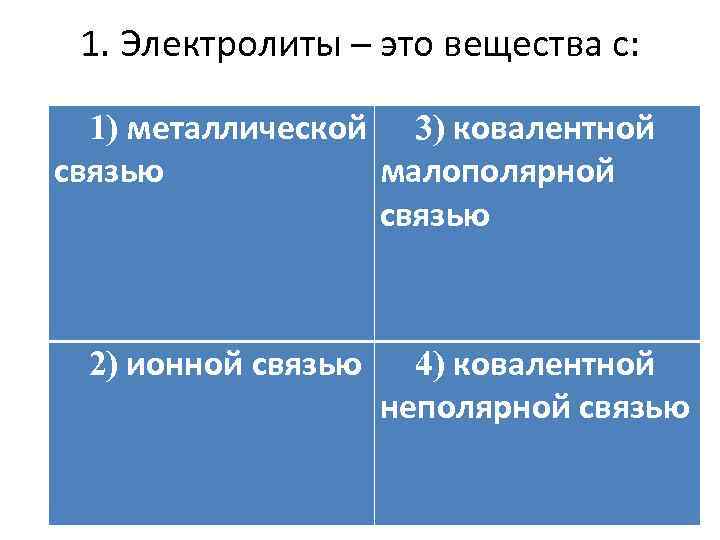 1. Электролиты – это вещества с: 1) металлической 3) ковалентной связью малополярной связью 2) ионной связью 4) ковалентной неполярной связью
1. Электролиты – это вещества с: 1) металлической 3) ковалентной связью малополярной связью 2) ионной связью 4) ковалентной неполярной связью
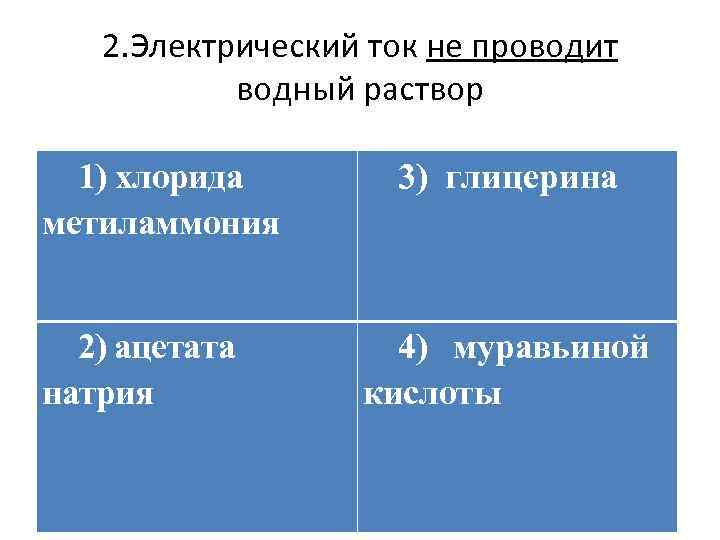 2. Электрический ток не проводит водный раствор 1) хлорида метиламмония 2) ацетата натрия 3) глицерина 4) муравьиной кислоты
2. Электрический ток не проводит водный раствор 1) хлорида метиламмония 2) ацетата натрия 3) глицерина 4) муравьиной кислоты
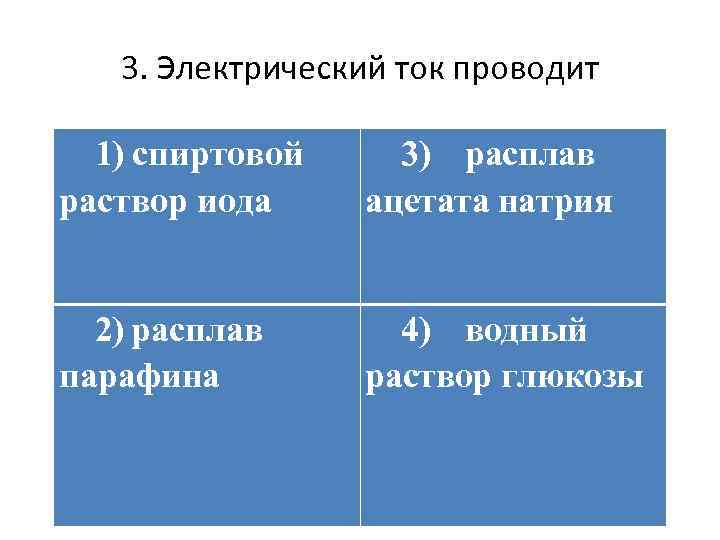 3. Электрический ток проводит 1) спиртовой раствор иода 3) расплав ацетата натрия 2) расплав парафина 4) водный раствор глюкозы
3. Электрический ток проводит 1) спиртовой раствор иода 3) расплав ацетата натрия 2) расплав парафина 4) водный раствор глюкозы
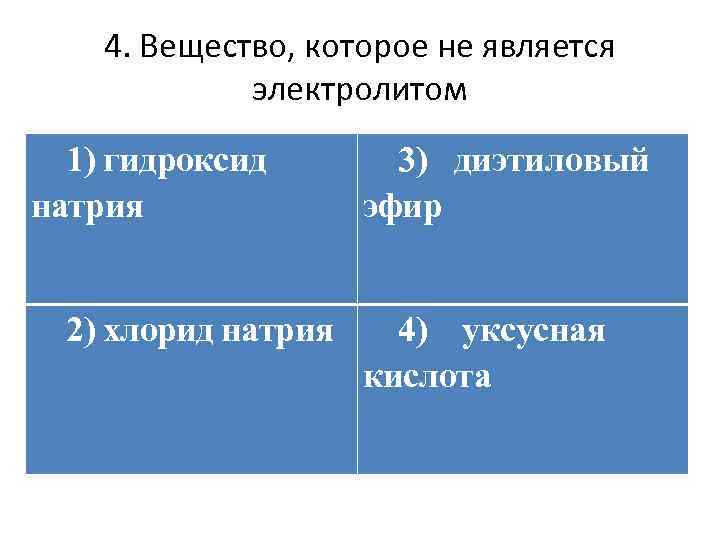 4. Вещество, которое не является электролитом 1) гидроксид натрия 2) хлорид натрия 3) диэтиловый эфир 4) уксусная кислота
4. Вещество, которое не является электролитом 1) гидроксид натрия 2) хлорид натрия 3) диэтиловый эфир 4) уксусная кислота
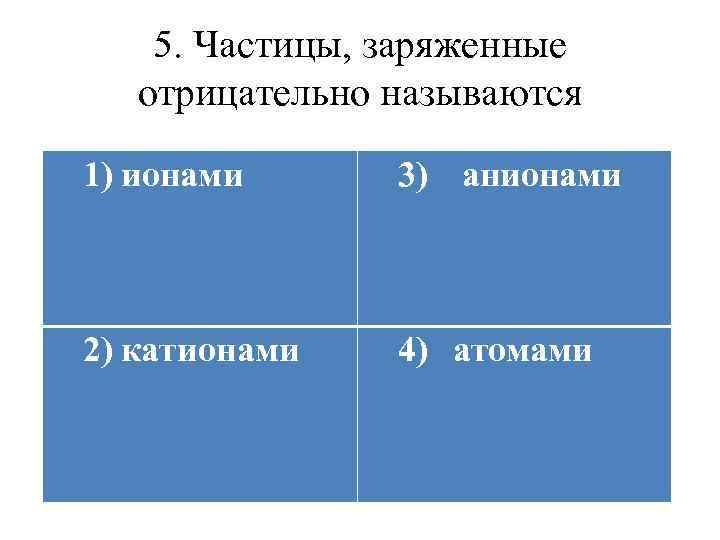 5. Частицы, заряженные отрицательно называются 1) ионами 3) анионами 2) катионами 4) атомами
5. Частицы, заряженные отрицательно называются 1) ионами 3) анионами 2) катионами 4) атомами
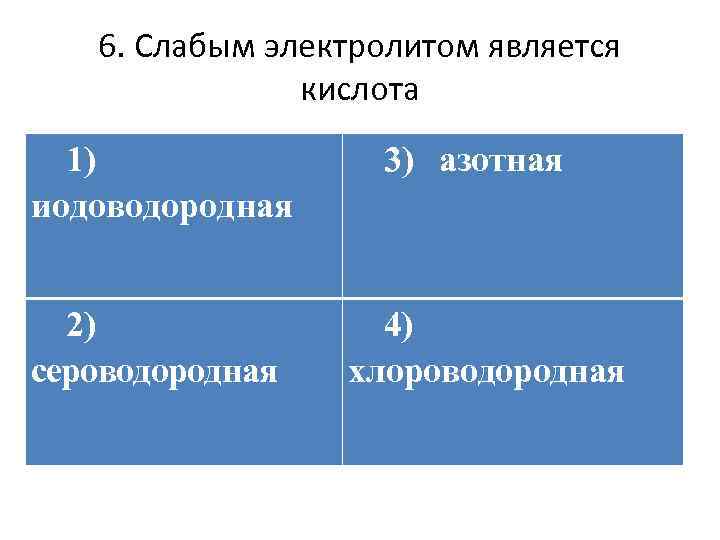 6. Слабым электролитом является кислота 1) иодоводородная 2) сероводородная 3) азотная 4) хлороводородная
6. Слабым электролитом является кислота 1) иодоводородная 2) сероводородная 3) азотная 4) хлороводородная
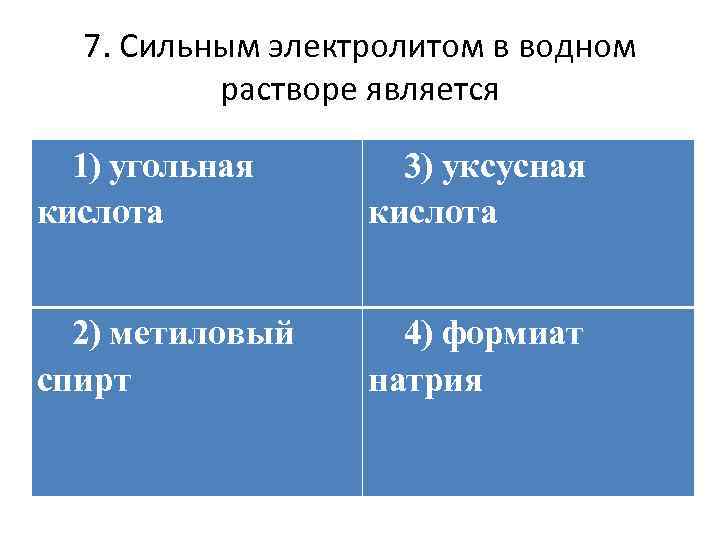 7. Сильным электролитом в водном растворе является 1) угольная кислота 3) уксусная кислота 2) метиловый спирт 4) формиат натрия
7. Сильным электролитом в водном растворе является 1) угольная кислота 3) уксусная кислота 2) метиловый спирт 4) формиат натрия
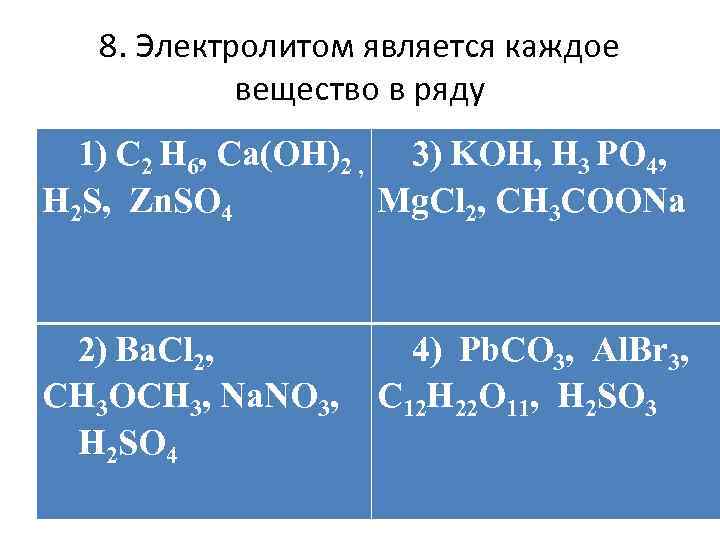 8. Электролитом является каждое вещество в ряду 1) C 2 H 6, Сa(OH)2 , 3) KOH, H 3 PO 4, H 2 S, Zn. SO 4 Mg. Cl 2, CH 3 COONa 2) Ba. Cl 2, CH 3 OCH 3, Na. NO 3, H 2 SO 4 4) Pb. CO 3, Al. Br 3, C 12 H 22 O 11, H 2 SO 3
8. Электролитом является каждое вещество в ряду 1) C 2 H 6, Сa(OH)2 , 3) KOH, H 3 PO 4, H 2 S, Zn. SO 4 Mg. Cl 2, CH 3 COONa 2) Ba. Cl 2, CH 3 OCH 3, Na. NO 3, H 2 SO 4 4) Pb. CO 3, Al. Br 3, C 12 H 22 O 11, H 2 SO 3
 9. Сильными электролитами являются все вещества, указанные в ряду 1) гидроксид 3) хлорид калия, азотная магния, уксусная кислота, серная кислота, гидроксид кислота натрия 2) сероводородная 4) кислота, сернистая сероводородная кислота, серная кислота, уксусная кислота, сернистая кислота
9. Сильными электролитами являются все вещества, указанные в ряду 1) гидроксид 3) хлорид калия, азотная магния, уксусная кислота, серная кислота, гидроксид кислота натрия 2) сероводородная 4) кислота, сернистая сероводородная кислота, серная кислота, уксусная кислота, сернистая кислота
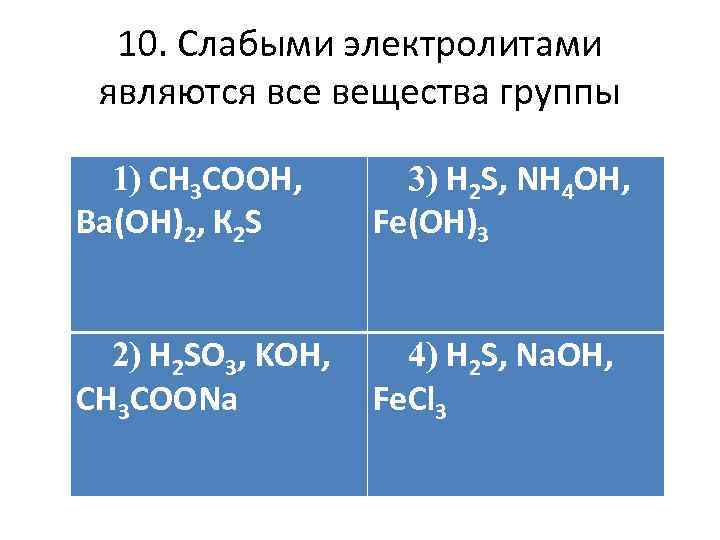 10. Слабыми электролитами являются все вещества группы 1) CH 3 COOH, Ва(ОН)2, К 2 S 3) H 2 S, NH 4 OH, Fe(OH)3 2) H 2 SO 3, KOH, CH 3 COONa 4) H 2 S, Na. OH, Fe. Cl 3
10. Слабыми электролитами являются все вещества группы 1) CH 3 COOH, Ва(ОН)2, К 2 S 3) H 2 S, NH 4 OH, Fe(OH)3 2) H 2 SO 3, KOH, CH 3 COONa 4) H 2 S, Na. OH, Fe. Cl 3
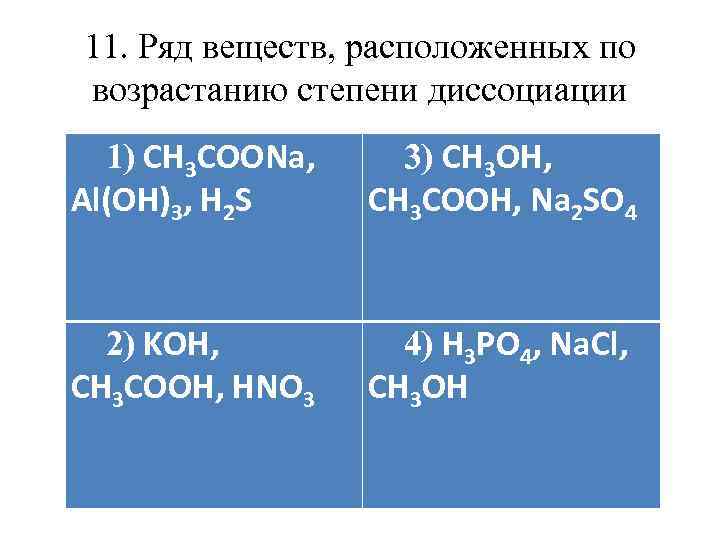 11. Ряд веществ, расположенных по возрастанию степени диссоциации 1) СН 3 СООNa, Al(OH)3, H 2 S 3) CH 3 OH, CH 3 COOH, Na 2 SO 4 2) KOH, CH 3 COOH, НNO 3 4) H 3 PO 4, Na. Cl, CH 3 OH
11. Ряд веществ, расположенных по возрастанию степени диссоциации 1) СН 3 СООNa, Al(OH)3, H 2 S 3) CH 3 OH, CH 3 COOH, Na 2 SO 4 2) KOH, CH 3 COOH, НNO 3 4) H 3 PO 4, Na. Cl, CH 3 OH
 12. Кислоты в растворе и расплаве диссоциируют на 1) анион 3) катион кислотного остатка металла 2) катион водорода 4) анион гидроксогруппы
12. Кислоты в растворе и расплаве диссоциируют на 1) анион 3) катион кислотного остатка металла 2) катион водорода 4) анион гидроксогруппы
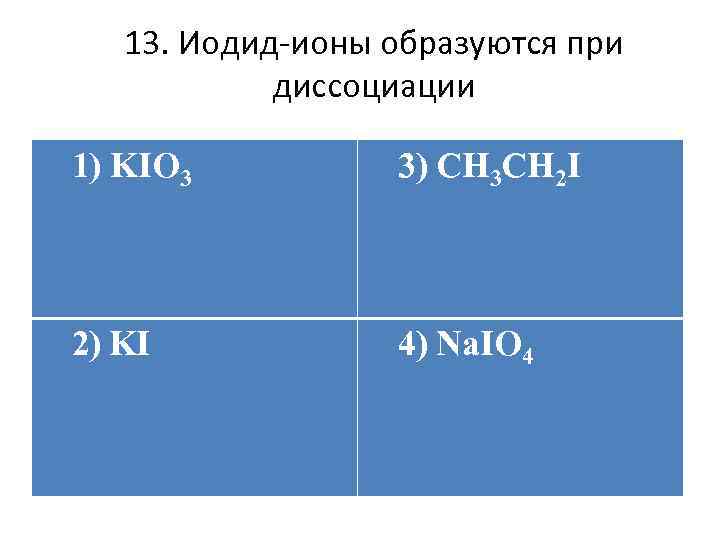 13. Иодид-ионы образуются при диссоциации 1) KIO 3 3) CH 3 CH 2 I 2) KI 4) Na. IO 4
13. Иодид-ионы образуются при диссоциации 1) KIO 3 3) CH 3 CH 2 I 2) KI 4) Na. IO 4
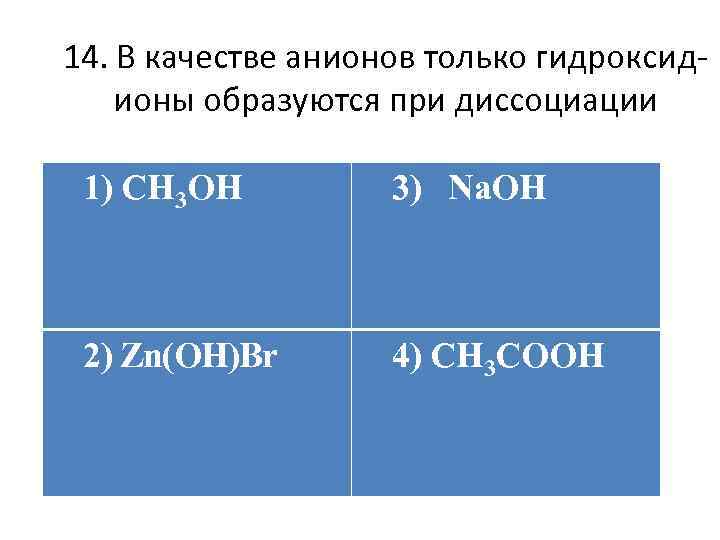 14. В качестве анионов только гидроксидионы образуются при диссоциации 1) CH 3 OH а) +(0, 06– 1, 00); б) +(0, 8– 1, 40); 2) Zn(OH)Br 3) Na. OH в) +(1, 02– 1, 30); г) +(0, 6– 0, 90). 4) CH 3 COOH
14. В качестве анионов только гидроксидионы образуются при диссоциации 1) CH 3 OH а) +(0, 06– 1, 00); б) +(0, 8– 1, 40); 2) Zn(OH)Br 3) Na. OH в) +(1, 02– 1, 30); г) +(0, 6– 0, 90). 4) CH 3 COOH
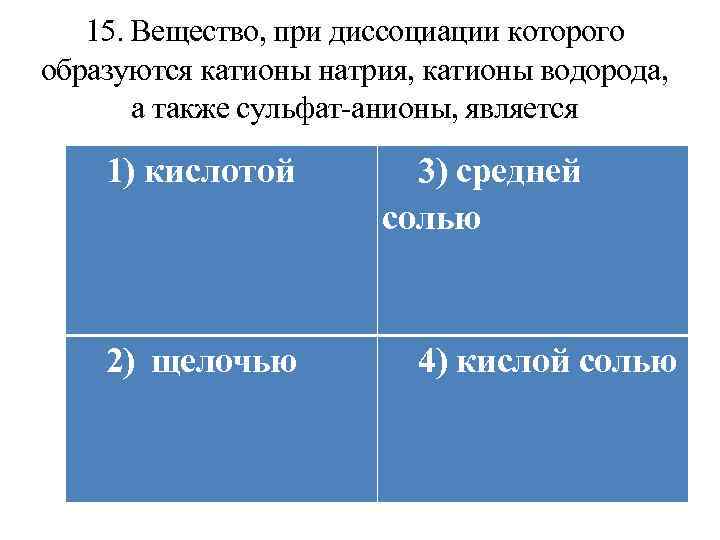 15. Вещество, при диссоциации которого образуются катионы натрия, катионы водорода, а также сульфат-анионы, является 1) кислотой 2) щелочью 3) средней солью 4) кислой солью
15. Вещество, при диссоциации которого образуются катионы натрия, катионы водорода, а также сульфат-анионы, является 1) кислотой 2) щелочью 3) средней солью 4) кислой солью
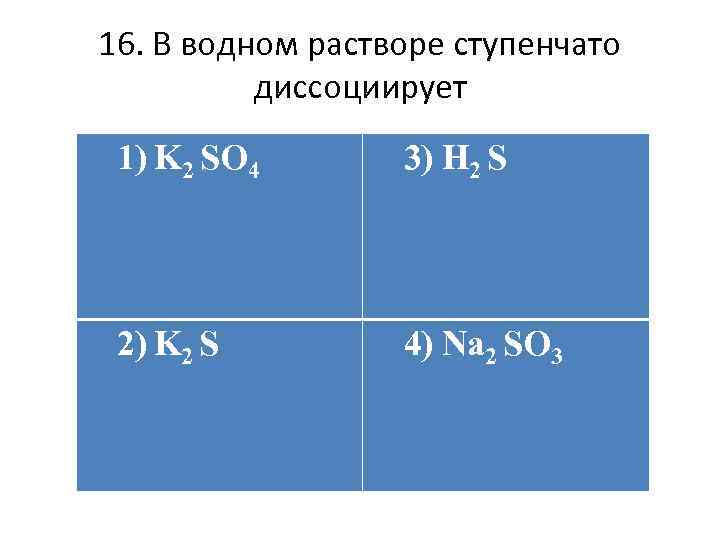 16. В водном растворе ступенчато диссоциирует 1) K 2 SO 4 3) H 2 S 2) K 2 S 4) Na 2 SO 3
16. В водном растворе ступенчато диссоциирует 1) K 2 SO 4 3) H 2 S 2) K 2 S 4) Na 2 SO 3
 17. Диссоциация по трем ступеням возможна в растворе 1) хлорида алюминия 3) ортофосфата калия 2) нитрата алюминия 4) ортофосфорной кислоты
17. Диссоциация по трем ступеням возможна в растворе 1) хлорида алюминия 3) ортофосфата калия 2) нитрата алюминия 4) ортофосфорной кислоты
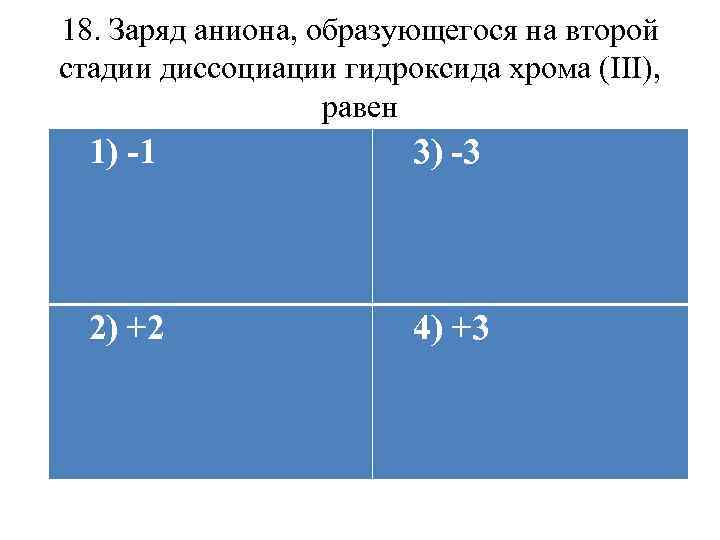 18. Заряд аниона, образующегося на второй стадии диссоциации гидроксида хрома (III), равен 1) -1 3) -3 2) +2 4) +3
18. Заряд аниона, образующегося на второй стадии диссоциации гидроксида хрома (III), равен 1) -1 3) -3 2) +2 4) +3
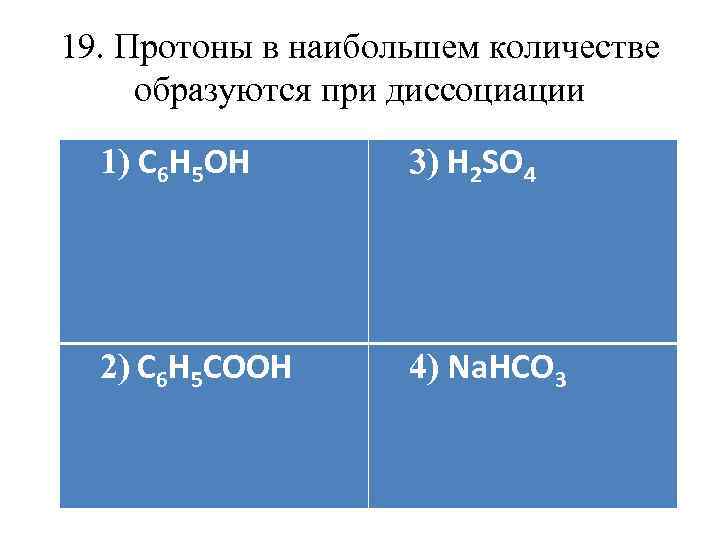 19. Протоны в наибольшем количестве образуются при диссоциации 1) С 6 Н 5 ОН 3) Н 2 SO 4 2) С 6 Н 5 СООН 4) Na. HCO 3
19. Протоны в наибольшем количестве образуются при диссоциации 1) С 6 Н 5 ОН 3) Н 2 SO 4 2) С 6 Н 5 СООН 4) Na. HCO 3
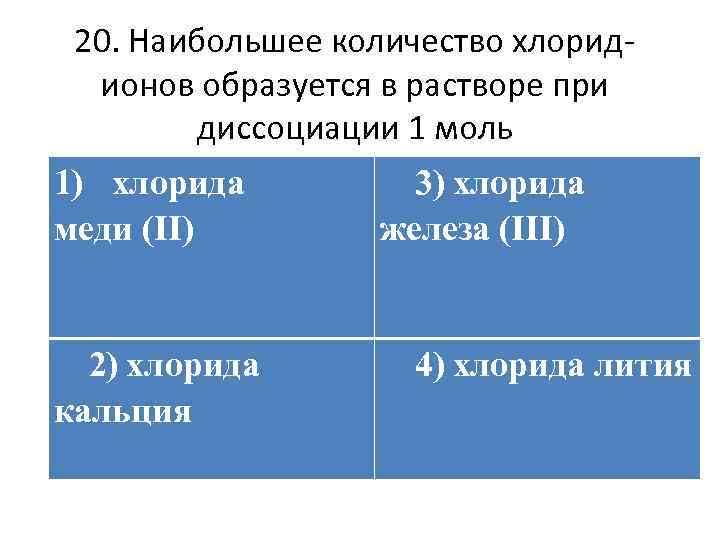 20. Наибольшее количество хлоридионов образуется в растворе при диссоциации 1 моль 1) хлорида меди (II) 2) хлорида кальция 3) хлорида железа (III) 4) хлорида лития
20. Наибольшее количество хлоридионов образуется в растворе при диссоциации 1 моль 1) хлорида меди (II) 2) хлорида кальция 3) хлорида железа (III) 4) хлорида лития
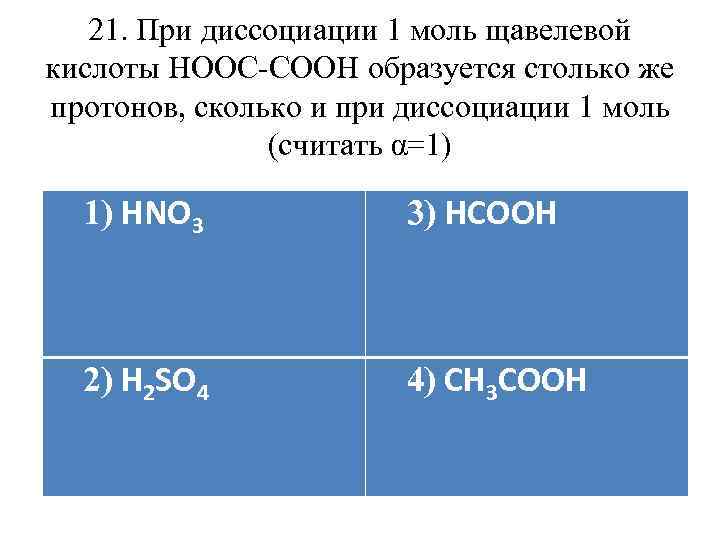 21. При диссоциации 1 моль щавелевой кислоты НООС-СООН образуется столько же протонов, сколько и при диссоциации 1 моль (считать α=1) 1) НNO 3 3) HCOOH 2) H 2 SO 4 4) CH 3 COOH
21. При диссоциации 1 моль щавелевой кислоты НООС-СООН образуется столько же протонов, сколько и при диссоциации 1 моль (считать α=1) 1) НNO 3 3) HCOOH 2) H 2 SO 4 4) CH 3 COOH
 22. Какие из утверждений о диссоциации оснований в водных растворах верны? А. Основания в воде диссоциируют на катионы металла (или подобный им катионаммония) и гидроксид-анионы. Б. Никаких других анионов, кроме гидроксиданионов, основания не образуют. 1) верно только А 3) верны оба утверждения 2) верно только Б 4) оба утверждения неверны
22. Какие из утверждений о диссоциации оснований в водных растворах верны? А. Основания в воде диссоциируют на катионы металла (или подобный им катионаммония) и гидроксид-анионы. Б. Никаких других анионов, кроме гидроксиданионов, основания не образуют. 1) верно только А 3) верны оба утверждения 2) верно только Б 4) оба утверждения неверны
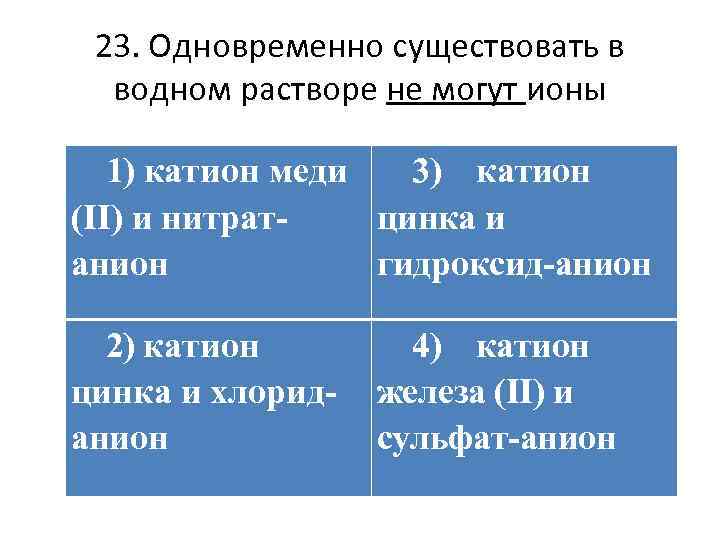 23. Одновременно существовать в водном растворе не могут ионы 1) катион меди 3) катион (II) и нитратцинка и анион гидроксид-анион 2) катион цинка и хлориданион 4) катион железа (II) и сульфат-анион
23. Одновременно существовать в водном растворе не могут ионы 1) катион меди 3) катион (II) и нитратцинка и анион гидроксид-анион 2) катион цинка и хлориданион 4) катион железа (II) и сульфат-анион
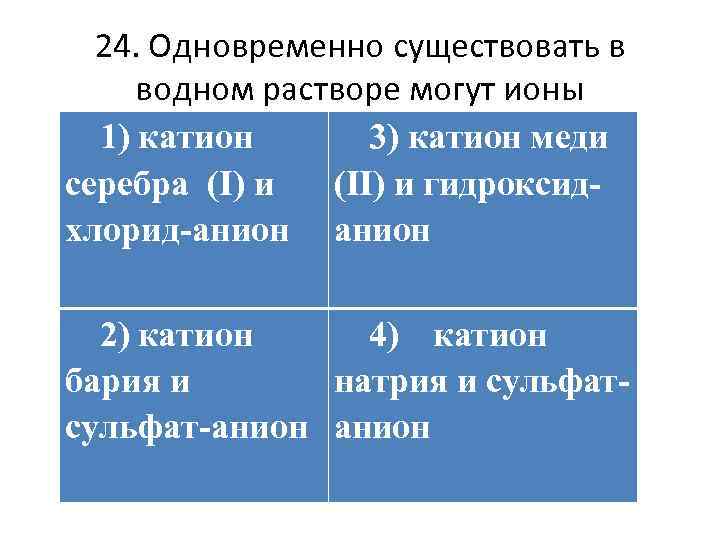 24. Одновременно существовать в водном растворе могут ионы 1) катион 3) катион меди серебра (I) и (II) и гидроксидхлорид-анион 2) катион 4) катион бария и натрия и сульфат-анион
24. Одновременно существовать в водном растворе могут ионы 1) катион 3) катион меди серебра (I) и (II) и гидроксидхлорид-анион 2) катион 4) катион бария и натрия и сульфат-анион
 25. Реакция ионного обмена идет до конца в результате образования нерастворимого в воде вещества при взаимодействии 1) Na. OH и Mg. Cl 2 3) KOH и HNO 3 2) Na. Cl и Cu. SO 4 4) Ca. CO 3 HCl(р-р) и
25. Реакция ионного обмена идет до конца в результате образования нерастворимого в воде вещества при взаимодействии 1) Na. OH и Mg. Cl 2 3) KOH и HNO 3 2) Na. Cl и Cu. SO 4 4) Ca. CO 3 HCl(р-р) и
 26. Практически до конца идет реакция 1) Na 2 SO 4 + KCl = 2) H 2 SO 4 + Ba. Cl 2 = 3) KNO 3 + Na. OH = 4) Cu. Cl 2 + Na 2 SO 4 =
26. Практически до конца идет реакция 1) Na 2 SO 4 + KCl = 2) H 2 SO 4 + Ba. Cl 2 = 3) KNO 3 + Na. OH = 4) Cu. Cl 2 + Na 2 SO 4 =
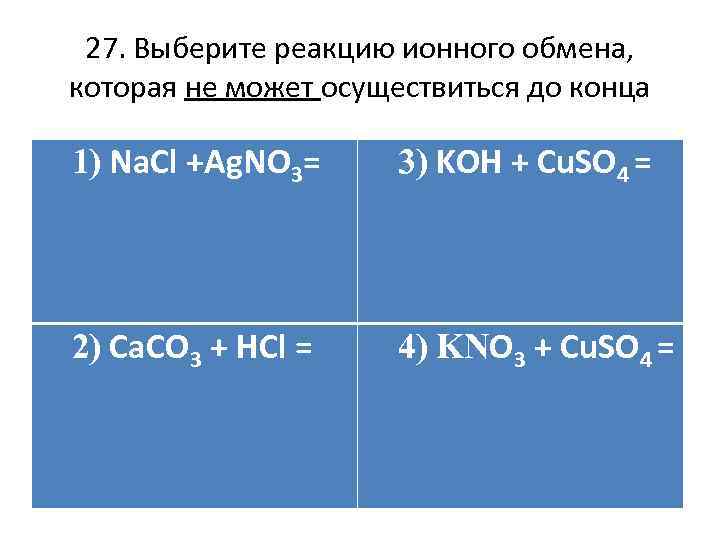 27. Выберите реакцию ионного обмена, которая не может осуществиться до конца 1) Na. Cl +Ag. NO 3= 3) KOH + Cu. SO 4 = 2) Ca. CO 3 + HCl = 4) KNO 3 + Cu. SO 4 =
27. Выберите реакцию ионного обмена, которая не может осуществиться до конца 1) Na. Cl +Ag. NO 3= 3) KOH + Cu. SO 4 = 2) Ca. CO 3 + HCl = 4) KNO 3 + Cu. SO 4 =
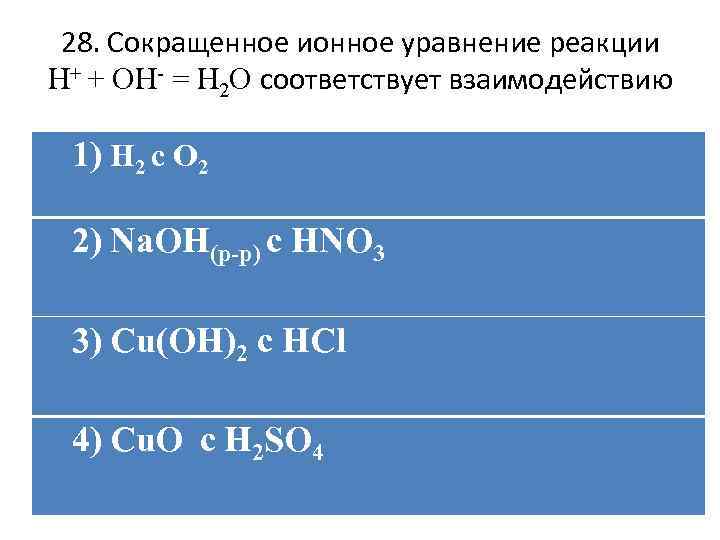 28. Сокращенное ионное уравнение реакции H+ + OH- = H 2 O соответствует взаимодействию 1) H 2 c O 2 2) Na. OH(р-р) c HNO 3 3) Cu(OH)2 c HCl 4) Cu. O с H 2 SO 4
28. Сокращенное ионное уравнение реакции H+ + OH- = H 2 O соответствует взаимодействию 1) H 2 c O 2 2) Na. OH(р-р) c HNO 3 3) Cu(OH)2 c HCl 4) Cu. O с H 2 SO 4
 29. Выберите реакцию ионного обмена, которая соответствует сокращенному ионному уравнению 2 H+ + CO 32 - = H 2 O + CO 2 1) Na 2 CO 3 + HCl = 2) Na 2 CO 3 + Ca. Cl 2 = 3) Na 2 CO 3 + Al. Cl 3 = 4) Na 2 CO 3 + Cr. Cl 3 =
29. Выберите реакцию ионного обмена, которая соответствует сокращенному ионному уравнению 2 H+ + CO 32 - = H 2 O + CO 2 1) Na 2 CO 3 + HCl = 2) Na 2 CO 3 + Ca. Cl 2 = 3) Na 2 CO 3 + Al. Cl 3 = 4) Na 2 CO 3 + Cr. Cl 3 =
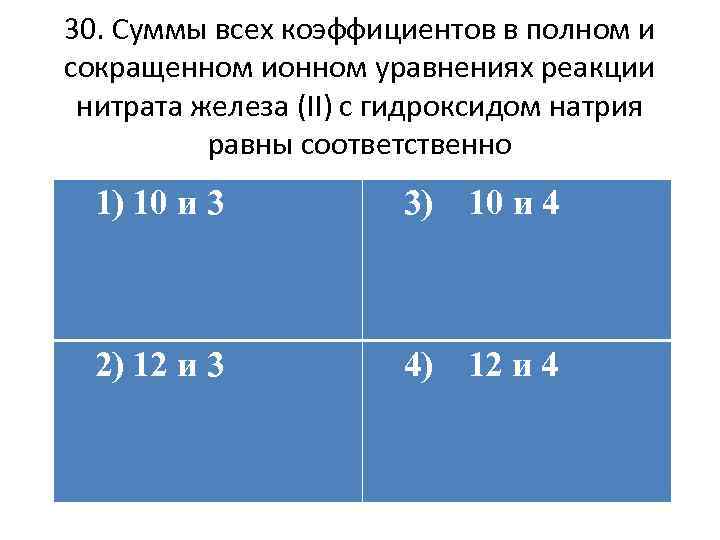 30. Суммы всех коэффициентов в полном и сокращенном ионном уравнениях реакции нитрата железа (II) с гидроксидом натрия равны соответственно 1) 10 и 3 3) 10 и 4 2) 12 и 3 4) 12 и 4
30. Суммы всех коэффициентов в полном и сокращенном ионном уравнениях реакции нитрата железа (II) с гидроксидом натрия равны соответственно 1) 10 и 3 3) 10 и 4 2) 12 и 3 4) 12 и 4
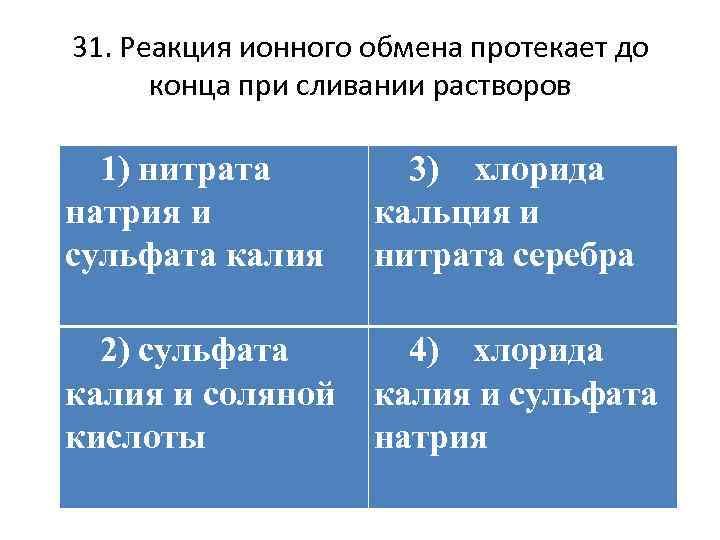 31. Реакция ионного обмена протекает до конца при сливании растворов 1) нитрата натрия и сульфата калия 3) хлорида кальция и нитрата серебра 2) сульфата калия и соляной кислоты 4) хлорида калия и сульфата натрия
31. Реакция ионного обмена протекает до конца при сливании растворов 1) нитрата натрия и сульфата калия 3) хлорида кальция и нитрата серебра 2) сульфата калия и соляной кислоты 4) хлорида калия и сульфата натрия
 32. Установите соответствие между исходными веществами, вступающими в реакции обмена, и сокращенным ионным a) карбонат калия и хлорид кальция b) нитрат серебра и хлорид лития в) сульфат меди (II) и сульфид натрия г) сульфат меди (II) и гидроксид натрия 1) Cu 2+ + S 2 - = Cu. S 2) Cu 2+ + 2 OH- = Cu(OH)2 3) Ag+ + Cl- = Ag. Cl 4) Ca 2+ + CO 32 - = Ca. CO 3
32. Установите соответствие между исходными веществами, вступающими в реакции обмена, и сокращенным ионным a) карбонат калия и хлорид кальция b) нитрат серебра и хлорид лития в) сульфат меди (II) и сульфид натрия г) сульфат меди (II) и гидроксид натрия 1) Cu 2+ + S 2 - = Cu. S 2) Cu 2+ + 2 OH- = Cu(OH)2 3) Ag+ + Cl- = Ag. Cl 4) Ca 2+ + CO 32 - = Ca. CO 3
 33. Установите соответствие между исходными веществами, вступающими в реакции обмена, и сокращенными ионными уравнениями а) Сu(NO 3)2 + K 2 S 1) NH 4+ + OH- = NH 3 + H 2 O б) NH 4 Cl + Na. OH 2) Al 3+ + 3 OH- = Al(OH)3 3) Ba 2+ + SO 42 - = Ba. SO 4 4) Cu 2+ + S 2 - = Cu. S г) Ba. Cl 2 + Na 2 SO 4 в) Al. Cl 3 + KOH
33. Установите соответствие между исходными веществами, вступающими в реакции обмена, и сокращенными ионными уравнениями а) Сu(NO 3)2 + K 2 S 1) NH 4+ + OH- = NH 3 + H 2 O б) NH 4 Cl + Na. OH 2) Al 3+ + 3 OH- = Al(OH)3 3) Ba 2+ + SO 42 - = Ba. SO 4 4) Cu 2+ + S 2 - = Cu. S г) Ba. Cl 2 + Na 2 SO 4 в) Al. Cl 3 + KOH
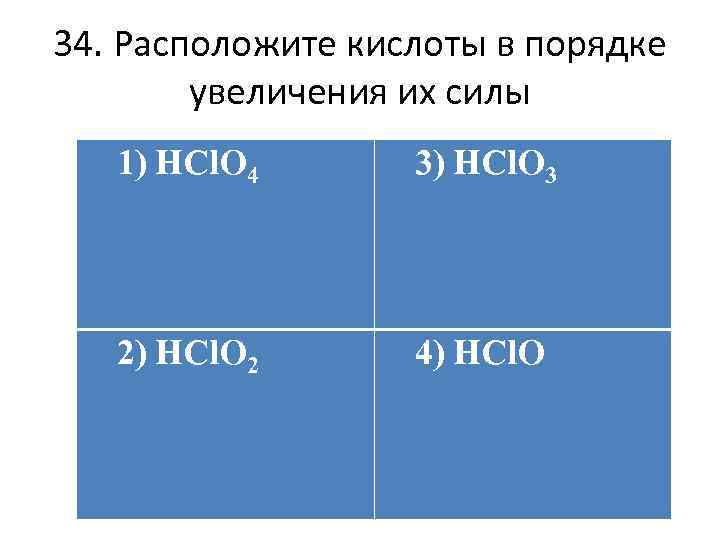 34. Расположите кислоты в порядке увеличения их силы 1) HCl. O 4 3) HCl. O 3 2) HCl. O 2 4) HCl. O
34. Расположите кислоты в порядке увеличения их силы 1) HCl. O 4 3) HCl. O 3 2) HCl. O 2 4) HCl. O
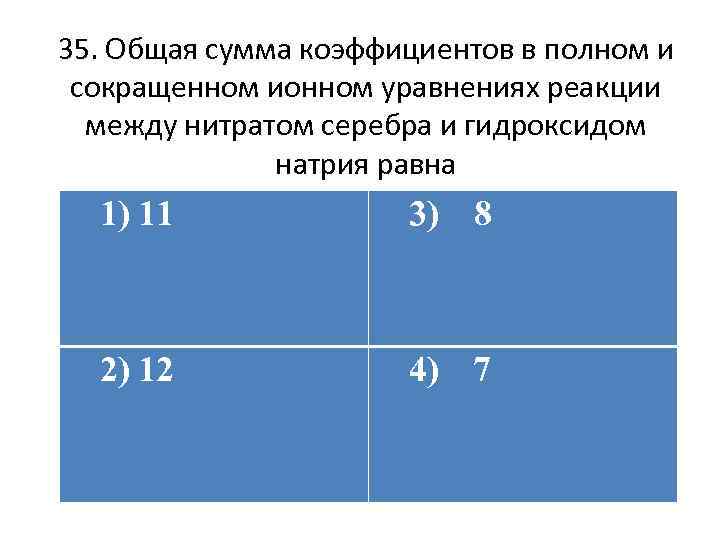 35. Общая сумма коэффициентов в полном и сокращенном ионном уравнениях реакции между нитратом серебра и гидроксидом натрия равна 1) 11 3) 8 2) 12 4) 7
35. Общая сумма коэффициентов в полном и сокращенном ионном уравнениях реакции между нитратом серебра и гидроксидом натрия равна 1) 11 3) 8 2) 12 4) 7
 Задача 16, 8 л сероводорода (н. у. ) прореагировали без остатка с 221 мл 12%-ного раствора гидроксида натрия (плотность 1, 131 г/мл). Определите, какое соединение образовалось в растворе и рассчитаете его массовую долю в этом растворе.
Задача 16, 8 л сероводорода (н. у. ) прореагировали без остатка с 221 мл 12%-ного раствора гидроксида натрия (плотность 1, 131 г/мл). Определите, какое соединение образовалось в растворе и рассчитаете его массовую долю в этом растворе.
 Задача Какую массу гидрида лития нужно растворить в 100 мл воды, чтобы получить раствор с массовой долей гидроксида 5%?
Задача Какую массу гидрида лития нужно растворить в 100 мл воды, чтобы получить раствор с массовой долей гидроксида 5%?


