Курсы Растворы. Диссоциация.pptx
- Количество слайдов: 103
 Омская государственная медицинская академия Кафедра химии РАСТВОРЫ. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ 1. Общие свойства растворов. 2. Электролитическая диссоциация в водных растворах. 3. Реакции ионного обмена в растворах электролитов. Лектор: Степанова Ирина Петровна, доктор биологических наук, профессор, зав. кафедрой химии
Омская государственная медицинская академия Кафедра химии РАСТВОРЫ. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ 1. Общие свойства растворов. 2. Электролитическая диссоциация в водных растворах. 3. Реакции ионного обмена в растворах электролитов. Лектор: Степанова Ирина Петровна, доктор биологических наук, профессор, зав. кафедрой химии
 Медико-биологическое значение темы Растворы играют большую роль в процессах жизнедеятельности. Важнейшие физиологические жидкости – кровь, лимфа, желудочное и кишечное содержимое, моча, слюна – являются растворами.
Медико-биологическое значение темы Растворы играют большую роль в процессах жизнедеятельности. Важнейшие физиологические жидкости – кровь, лимфа, желудочное и кишечное содержимое, моча, слюна – являются растворами.
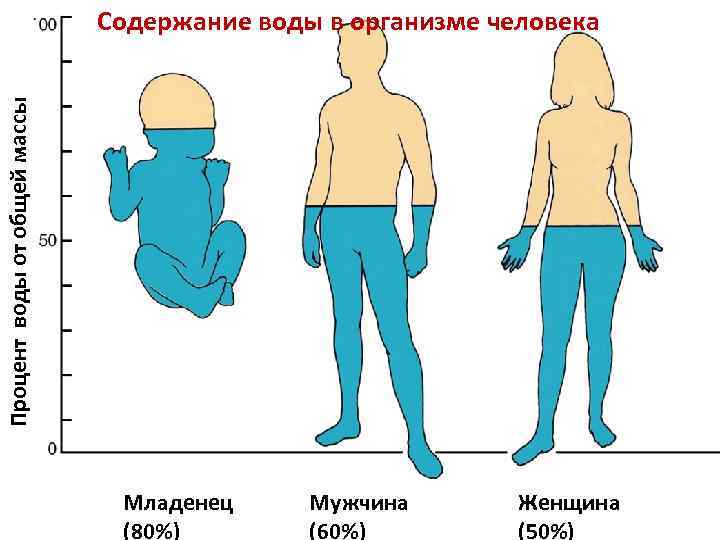 Процент воды от общей массы Содержание воды в организме человека Младенец (80%) Мужчина (60%) Женщина (50%)
Процент воды от общей массы Содержание воды в организме человека Младенец (80%) Мужчина (60%) Женщина (50%)
 Медико-биологическое значение темы Процессы усвоения пищи, действие ферментов, лекарственных препаратов и др. реакции в организме обычно протекают в растворах.
Медико-биологическое значение темы Процессы усвоения пищи, действие ферментов, лекарственных препаратов и др. реакции в организме обычно протекают в растворах.
 Растворы Раствор – физико-химическая система, состоящая из двух или большего числа веществ и имеющая переменный состав в некотором интервале соотношения компонентов.
Растворы Раствор – физико-химическая система, состоящая из двух или большего числа веществ и имеющая переменный состав в некотором интервале соотношения компонентов.
 Растворы занимают промежуточное положение между смесями веществ и химическими соединениями. С механическими смесями растворы сближает переменность по составу, а с химическими соединениями - тепловые эффекты, сопровождающие растворение большинства веществ.
Растворы занимают промежуточное положение между смесями веществ и химическими соединениями. С механическими смесями растворы сближает переменность по составу, а с химическими соединениями - тепловые эффекты, сопровождающие растворение большинства веществ.
 Растворы Компоненты раствора Растворитель Среда Растворенное вещество Вещество, равномерно распределяемое в растворителе в виде молекул и ионов.
Растворы Компоненты раствора Растворитель Среда Растворенное вещество Вещество, равномерно распределяемое в растворителе в виде молекул и ионов.
 Растворы Растворитель = A Раствор = A = B В растворах электролитов независимо от концентрации электролит рассматривается как растворенное вещество. Например, в 70%-ном растворе азотной кислоты растворенным веществом является HNO 3, хотя HNO 3 находится в большем количестве (70% по массе), а растворителем – вода.
Растворы Растворитель = A Раствор = A = B В растворах электролитов независимо от концентрации электролит рассматривается как растворенное вещество. Например, в 70%-ном растворе азотной кислоты растворенным веществом является HNO 3, хотя HNO 3 находится в большем количестве (70% по массе), а растворителем – вода.
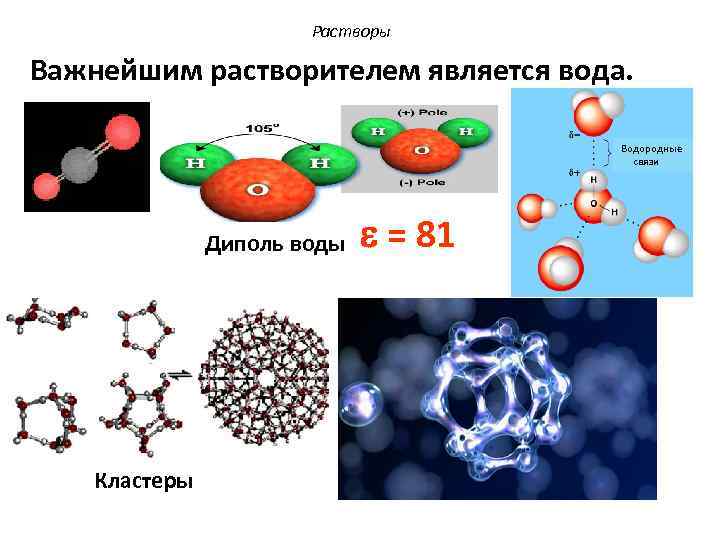 Растворы Важнейшим растворителем является вода. Водородные связи Диполь воды Кластеры = 81
Растворы Важнейшим растворителем является вода. Водородные связи Диполь воды Кластеры = 81
 Классификация растворов Растворы классифицируют по нескольким признакам. I. По агрегатному состоянию различают: Твердые Жидкие Газообразные растворы воздух, наркозные смеси кровь моча сплавы, применяемые в хирургии
Классификация растворов Растворы классифицируют по нескольким признакам. I. По агрегатному состоянию различают: Твердые Жидкие Газообразные растворы воздух, наркозные смеси кровь моча сплавы, применяемые в хирургии
 Классификация растворов II. По молярной массе растворенного вещества различают: растворы НМВ М(Х) < 5000 г/моль растворы ВМВ М(Х)> 5000 г/моль Главной особенностью растворов ВМВ является существенное различие в размерах между макромолекулами полимеров и молекулами низкомолекулярного растворителя.
Классификация растворов II. По молярной массе растворенного вещества различают: растворы НМВ М(Х) < 5000 г/моль растворы ВМВ М(Х)> 5000 г/моль Главной особенностью растворов ВМВ является существенное различие в размерах между макромолекулами полимеров и молекулами низкомолекулярного растворителя.
 Классификация растворов III. По размеру частиц растворенного вещества различают : Истинные растворы d ˂ 10 -7 см Коллоидные растворы и растворы ВМВ d: 10 -5 – 10 -7 см Грубодисперсные растворы d ˃ 10 -5 см
Классификация растворов III. По размеру частиц растворенного вещества различают : Истинные растворы d ˂ 10 -7 см Коллоидные растворы и растворы ВМВ d: 10 -5 – 10 -7 см Грубодисперсные растворы d ˃ 10 -5 см
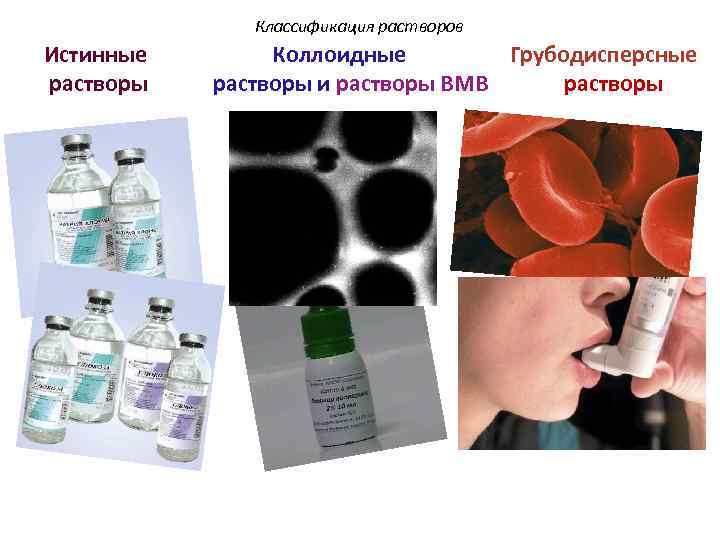 Классификация растворов Истинные растворы Коллоидные Грубодисперсные растворы и растворы ВМВ растворы
Классификация растворов Истинные растворы Коллоидные Грубодисперсные растворы и растворы ВМВ растворы
 Растворение — физико-химический процесс, протекающий между твердой и жидкой фазами и характеризующийся переходами твердого вещества в раствор. При растворении образуются: • соединения, называемые сольватами; • если растворителем является вода, то полученные соединения называются гидратами; • если гидратная вода входит в состав кристаллов, то соединения называются кристаллогидратами. Например,
Растворение — физико-химический процесс, протекающий между твердой и жидкой фазами и характеризующийся переходами твердого вещества в раствор. При растворении образуются: • соединения, называемые сольватами; • если растворителем является вода, то полученные соединения называются гидратами; • если гидратная вода входит в состав кристаллов, то соединения называются кристаллогидратами. Например,
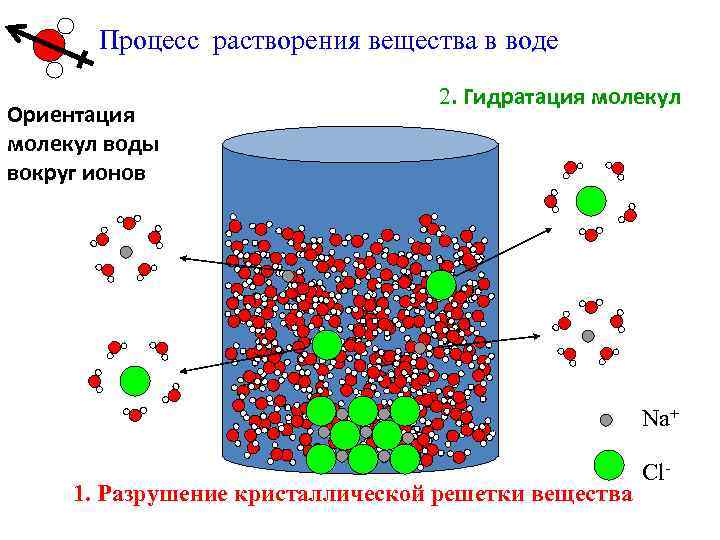 Процесс растворения вещества в воде Ориентация молекул воды вокруг ионов 2. Гидратация молекул Na+ 1. Разрушение кристаллической решетки вещества Cl-
Процесс растворения вещества в воде Ориентация молекул воды вокруг ионов 2. Гидратация молекул Na+ 1. Разрушение кристаллической решетки вещества Cl-
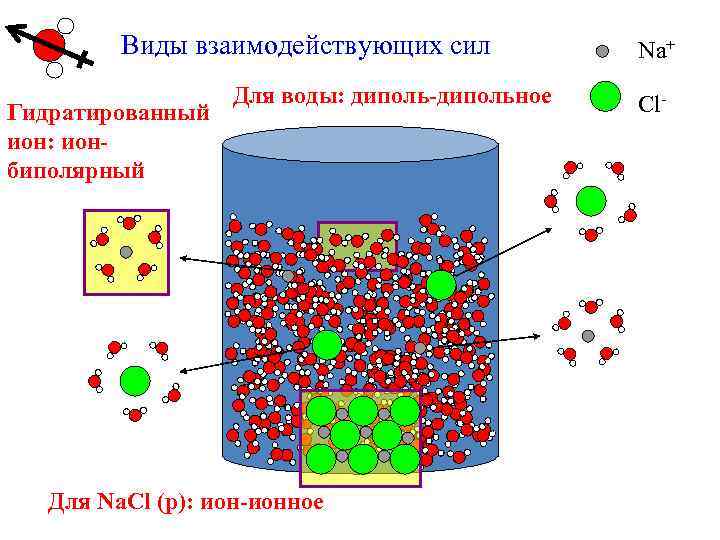 Виды взаимодействующих сил Гидратированный ион: ионбиполярный Для воды: диполь-дипольное Для Na. Cl (р): ион-ионное Na+ Cl-
Виды взаимодействующих сил Гидратированный ион: ионбиполярный Для воды: диполь-дипольное Для Na. Cl (р): ион-ионное Na+ Cl-
 Концентрация вещества Концентрация - количество растворенного вещества, сосредоточенное в определенной массе или объеме раствора или растворителя.
Концентрация вещества Концентрация - количество растворенного вещества, сосредоточенное в определенной массе или объеме раствора или растворителя.
 Способы выражения концентрации растворов 1. Массовая доля ω - это отношение массы растворенного вещества к общей массе раствора:
Способы выражения концентрации растворов 1. Массовая доля ω - это отношение массы растворенного вещества к общей массе раствора:
 Растворимость веществ Растворимость свойство данного вещества растворяться в том или ином растворителе.
Растворимость веществ Растворимость свойство данного вещества растворяться в том или ином растворителе.
 Растворы насыщенные Раствор, в котором данное вещество при данной температуре больше не растворяется, т. е. раствор, находящийся в динамическом равновесии с избытком растворяемого вещества. ненасыщенные Раствор, в котором еще можно растворить добавочное количество данного вещества.
Растворы насыщенные Раствор, в котором данное вещество при данной температуре больше не растворяется, т. е. раствор, находящийся в динамическом равновесии с избытком растворяемого вещества. ненасыщенные Раствор, в котором еще можно растворить добавочное количество данного вещества.
 Растворимость веществ Количественно растворимость характеризуют концентрацией насыщенного раствора при определенной температуре и давлении (коэффициент растворимости); выражают в граммах вещества на 100 г растворителя.
Растворимость веществ Количественно растворимость характеризуют концентрацией насыщенного раствора при определенной температуре и давлении (коэффициент растворимости); выражают в граммах вещества на 100 г растворителя.
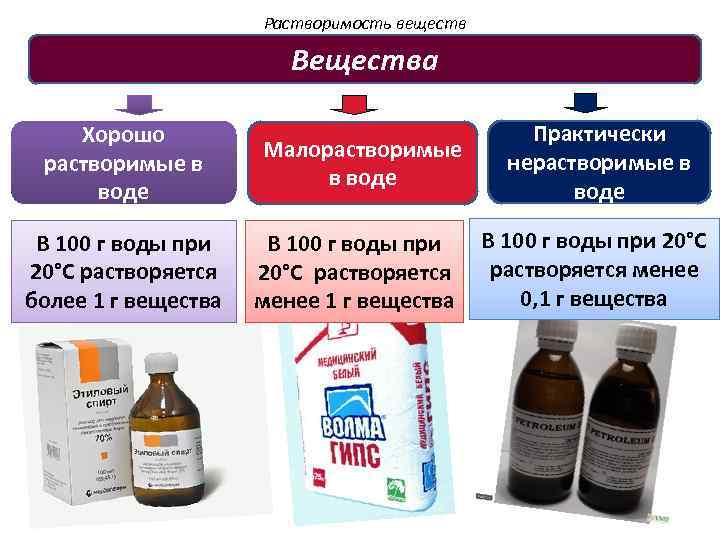 Растворимость веществ Вещества Хорошо растворимые в воде В 100 г воды при 20°C растворяется более 1 г вещества Малорастворимые в воде В 100 г воды при 20°C растворяется менее 1 г вещества Практически нерастворимые в воде В 100 г воды при 20°C растворяется менее 0, 1 г вещества
Растворимость веществ Вещества Хорошо растворимые в воде В 100 г воды при 20°C растворяется более 1 г вещества Малорастворимые в воде В 100 г воды при 20°C растворяется менее 1 г вещества Практически нерастворимые в воде В 100 г воды при 20°C растворяется менее 0, 1 г вещества
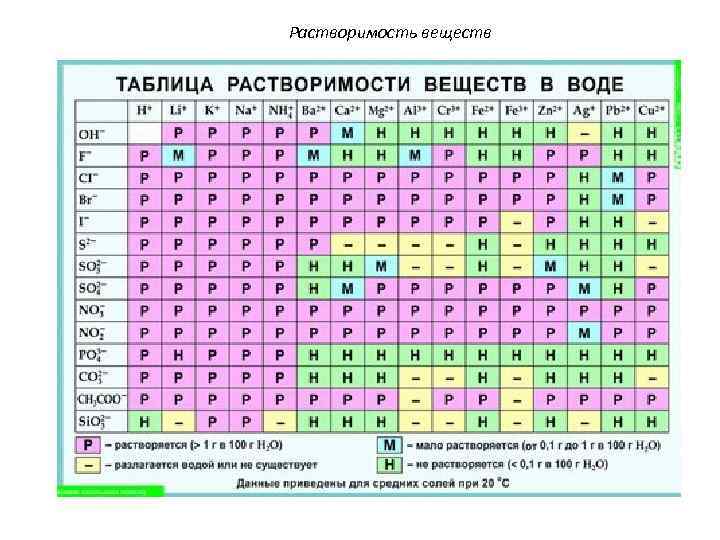 Растворимость веществ
Растворимость веществ
 Решение задач Задача 1. Требуется приготовить раствор массой 320 г с массовой долей KCl 3%. Рассчитайте массу KCl и массу воды, которые необходимы для приготовления раствора. Решение: 1) Определим массу KCl для приготовления раствора: 2) Найдем массу воды, необходимую для приготовления раствора Ответ:
Решение задач Задача 1. Требуется приготовить раствор массой 320 г с массовой долей KCl 3%. Рассчитайте массу KCl и массу воды, которые необходимы для приготовления раствора. Решение: 1) Определим массу KCl для приготовления раствора: 2) Найдем массу воды, необходимую для приготовления раствора Ответ:
 Задача 2. Какая масса раствора с массовой долей гидроксида натрия 4% потребуется для полной нейтрализации р-ра соляной кислоты массой 30 г с массовой долей соляной кислоты 5%. Решение: 1) Составим уравнение протекающей в растворе реакции: 2) Определим массу и количество соляной кислоты: 4) Найдем массу гидроксида натрия 5) Определяем массу раствора Na. OH с массовой долей 4%
Задача 2. Какая масса раствора с массовой долей гидроксида натрия 4% потребуется для полной нейтрализации р-ра соляной кислоты массой 30 г с массовой долей соляной кислоты 5%. Решение: 1) Составим уравнение протекающей в растворе реакции: 2) Определим массу и количество соляной кислоты: 4) Найдем массу гидроксида натрия 5) Определяем массу раствора Na. OH с массовой долей 4%
 Задача 3. Масса поваренной соли, которую нужно растворить в 200 г воды для получения 8% раствора, равна______г. 1. Пусть m(Na. Cl) = x г , тогда 1. Записываем формулу массовой доли вещества: 4. Найдем массу поваренной соли х= 16 + 0, 08 х 0, 92 х=16 х=17, 4 г.
Задача 3. Масса поваренной соли, которую нужно растворить в 200 г воды для получения 8% раствора, равна______г. 1. Пусть m(Na. Cl) = x г , тогда 1. Записываем формулу массовой доли вещества: 4. Найдем массу поваренной соли х= 16 + 0, 08 х 0, 92 х=16 х=17, 4 г.
 Задача 4. Масса спирта, которую нужно выпарить из 120 г 2% спиртового раствор иода, чтобы повысить его концентрацию до 5%, равна_______ г. Решение: 4) Определим массу спирта:
Задача 4. Масса спирта, которую нужно выпарить из 120 г 2% спиртового раствор иода, чтобы повысить его концентрацию до 5%, равна_______ г. Решение: 4) Определим массу спирта:
 С 4. Медь массой 6, 4 г обработали 100 мл 30% азотной кислотой (ρ=1, 153 г/мл), для полного связывания продуктов к полученному раствору добавили 200 г раствора гидроксида натрия. Определите массовую долю щелочи в используемом растворе. •
С 4. Медь массой 6, 4 г обработали 100 мл 30% азотной кислотой (ρ=1, 153 г/мл), для полного связывания продуктов к полученному раствору добавили 200 г раствора гидроксида натрия. Определите массовую долю щелочи в используемом растворе. •
 С 4. Смешали 250 мл раствора ортофосфата натрия (ρ=1, 03 г/мл) с массовой долей 10% и 100 мл раствора хлорида бария (ρ=1, 07 г/мл) с массовой долей 15%. определите массовую долю поваренной соли в образовавшемся растворе. 1) Уравнение химической реакции: 2 Na 3 PO 4 + 3 Ba. Cl 2 = 6 Nа. Сl + Ba 3(PO 4)2↓ 2) Рассчитаем количества веществ реагентов : • n(Na 3 PO 4)исх. =250∙ 1, 03∙ 0, 10/164= 0, 157 моль – в избытке • n(Ba. Cl 2)= 100∙ 1, 07∙ 0, 15/208=0, 077 моль – в недостатке 3)Рассчитаем массу раствора (с учётом массы выпавшего осадка фосфата бария) : • n(Ba 3(PO 4)2) = 1/3∙n(Ва. Сl 2)= 0, 0257 моль • m(Ba 3(PO 4)2)= 0, 0257 ∙ 601= 15, 45 г • m(ра-ра)= 250∙ 1, 03 + 100 ∙ 1, 07 – 15, 45 = 349, 05 г 4)Рассчитаем массовую долю хлорида натрия • n(Na. Cl)= 2 n(Ba. Cl 2)=0, 154 моль • m(Na. Cl)= 0, 154 ∙ 58, 5= 9, 01 г • ω(Na. Cl)= 9, 01/ 349, 05 = 0, 026 или 2, 6%
С 4. Смешали 250 мл раствора ортофосфата натрия (ρ=1, 03 г/мл) с массовой долей 10% и 100 мл раствора хлорида бария (ρ=1, 07 г/мл) с массовой долей 15%. определите массовую долю поваренной соли в образовавшемся растворе. 1) Уравнение химической реакции: 2 Na 3 PO 4 + 3 Ba. Cl 2 = 6 Nа. Сl + Ba 3(PO 4)2↓ 2) Рассчитаем количества веществ реагентов : • n(Na 3 PO 4)исх. =250∙ 1, 03∙ 0, 10/164= 0, 157 моль – в избытке • n(Ba. Cl 2)= 100∙ 1, 07∙ 0, 15/208=0, 077 моль – в недостатке 3)Рассчитаем массу раствора (с учётом массы выпавшего осадка фосфата бария) : • n(Ba 3(PO 4)2) = 1/3∙n(Ва. Сl 2)= 0, 0257 моль • m(Ba 3(PO 4)2)= 0, 0257 ∙ 601= 15, 45 г • m(ра-ра)= 250∙ 1, 03 + 100 ∙ 1, 07 – 15, 45 = 349, 05 г 4)Рассчитаем массовую долю хлорида натрия • n(Na. Cl)= 2 n(Ba. Cl 2)=0, 154 моль • m(Na. Cl)= 0, 154 ∙ 58, 5= 9, 01 г • ω(Na. Cl)= 9, 01/ 349, 05 = 0, 026 или 2, 6%
 Теория электролитической диссоциации Электролитическая диссоциация - процесс растворения или плавления электролитов с образованием заряженных частиц под действием молекул растворителя. С. А. Аррениус (1859 -1927)
Теория электролитической диссоциации Электролитическая диссоциация - процесс растворения или плавления электролитов с образованием заряженных частиц под действием молекул растворителя. С. А. Аррениус (1859 -1927)
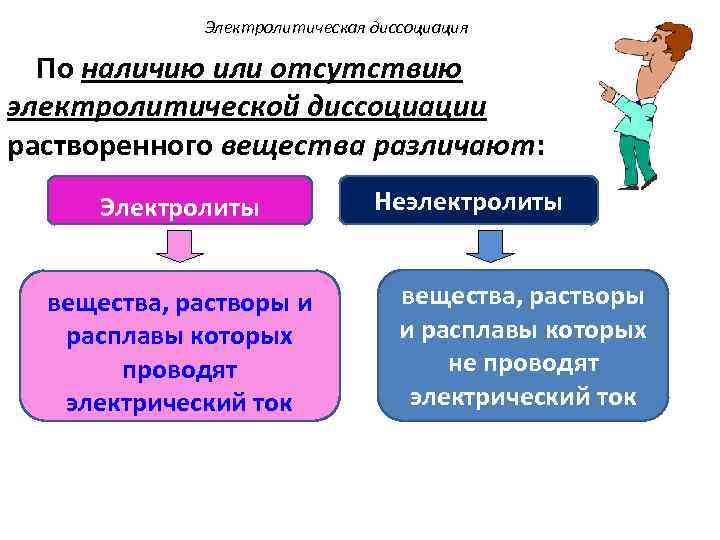 Электролитическая диссоциация По наличию или отсутствию электролитической диссоциации растворенного вещества различают: Электролиты вещества, растворы и расплавы которых проводят электрический ток Неэлектролиты вещества, растворы и расплавы которых не проводят электрический ток
Электролитическая диссоциация По наличию или отсутствию электролитической диссоциации растворенного вещества различают: Электролиты вещества, растворы и расплавы которых проводят электрический ток Неэлектролиты вещества, растворы и расплавы которых не проводят электрический ток
 Электролитическая диссоциация Электролиты Ионная или сильнополярная ковалентная связь • Основания Неэлектролиты Ковалентная неполярная или малополярная связь • Кислоты • Органические соединения • Соли • Газы • Неметаллы
Электролитическая диссоциация Электролиты Ионная или сильнополярная ковалентная связь • Основания Неэлектролиты Ковалентная неполярная или малополярная связь • Кислоты • Органические соединения • Соли • Газы • Неметаллы
 Основные положения теории электролитической диссоциации 1. Электролиты при плавлении или растворении в воде распадаются на положительные и отрицательно заряженные ионы – электролитическая диссоциация. 2. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу – катоду (катионы), отрицательно заряженные ионы к положительному полюсу - аноду (анионы). 3. Диссоциация - обратимый процесс. Наряду с распадом молекул на ионы может протекать процесс соединения ионов в молекулы (ассоциация).
Основные положения теории электролитической диссоциации 1. Электролиты при плавлении или растворении в воде распадаются на положительные и отрицательно заряженные ионы – электролитическая диссоциация. 2. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу – катоду (катионы), отрицательно заряженные ионы к положительному полюсу - аноду (анионы). 3. Диссоциация - обратимый процесс. Наряду с распадом молекул на ионы может протекать процесс соединения ионов в молекулы (ассоциация).
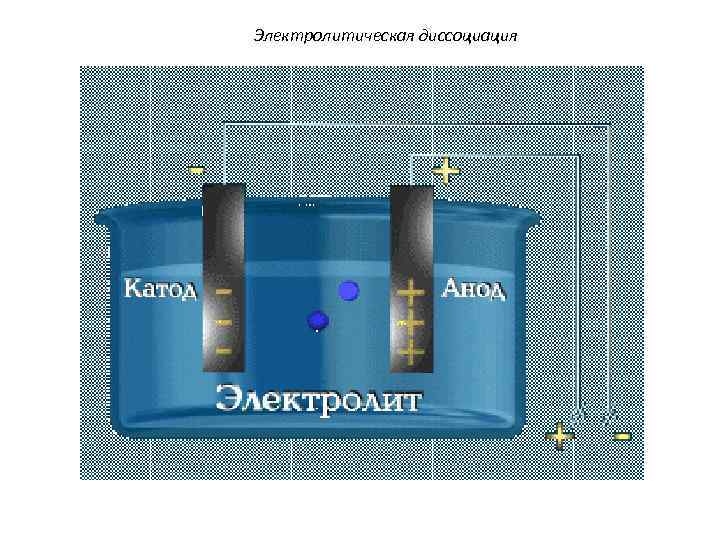 Электролитическая диссоциация
Электролитическая диссоциация
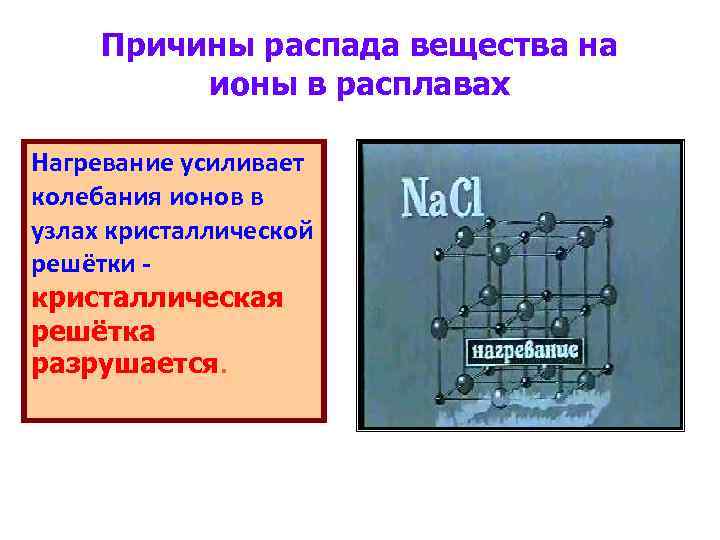 Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки кристаллическая решётка разрушается.
Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки кристаллическая решётка разрушается.
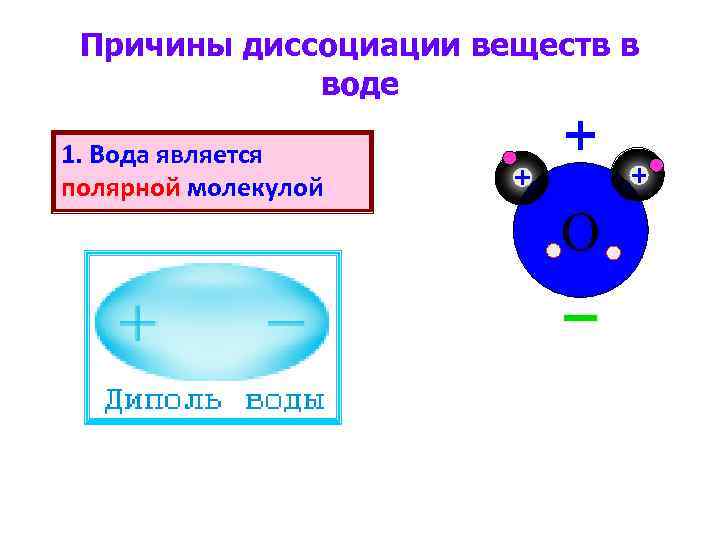 Причины диссоциации веществ в воде 1. Вода является полярной молекулой O
Причины диссоциации веществ в воде 1. Вода является полярной молекулой O
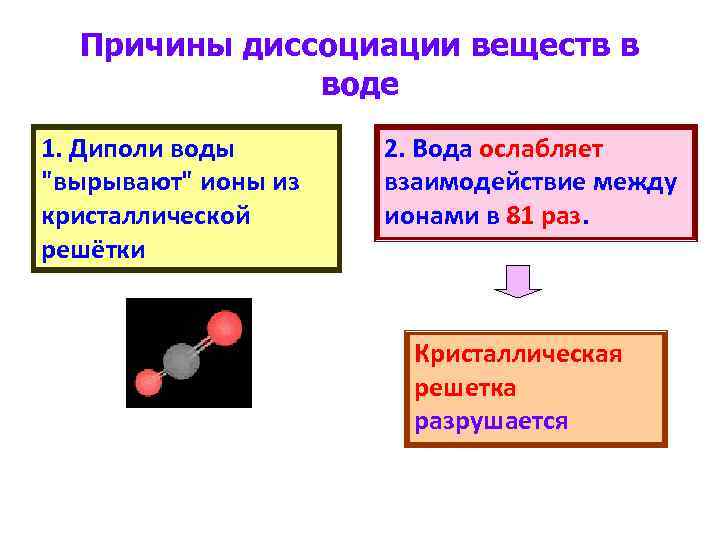 Причины диссоциации веществ в воде 1. Диполи воды "вырывают" ионы из кристаллической решётки 2. Вода ослабляет взаимодействие между ионами в 81 раз. Кристаллическая решетка разрушается
Причины диссоциации веществ в воде 1. Диполи воды "вырывают" ионы из кристаллической решётки 2. Вода ослабляет взаимодействие между ионами в 81 раз. Кристаллическая решетка разрушается
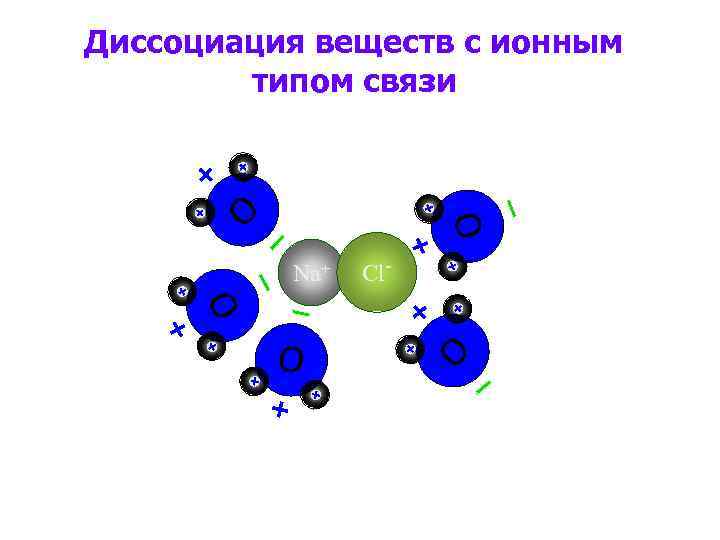 O O Диссоциация веществ с ионным типом связи Cl- O Na+ O O
O O Диссоциация веществ с ионным типом связи Cl- O Na+ O O
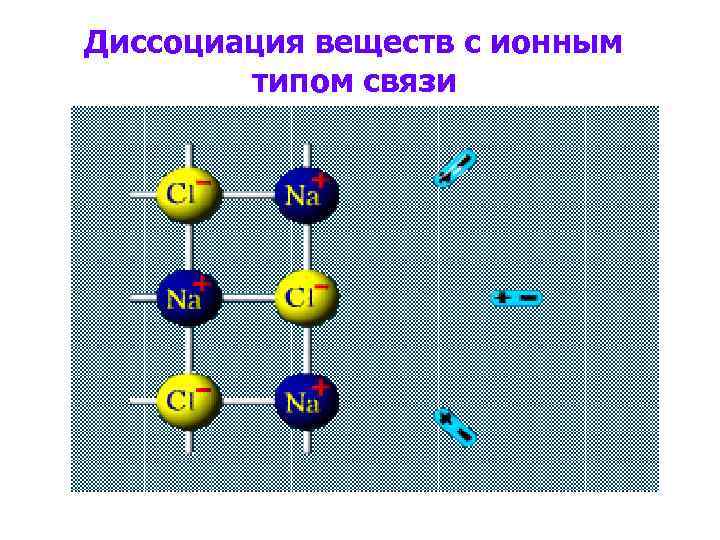 Диссоциация веществ с ионным типом связи
Диссоциация веществ с ионным типом связи
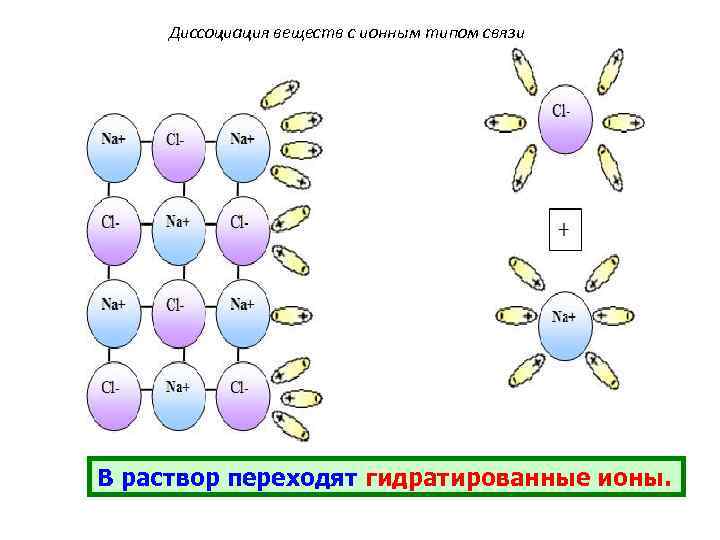 Диссоциация веществ с ионным типом связи В раствор переходят гидратированные ионы.
Диссоциация веществ с ионным типом связи В раствор переходят гидратированные ионы.
 Диссоциация веществ с ковалентной полярной связью
Диссоциация веществ с ковалентной полярной связью
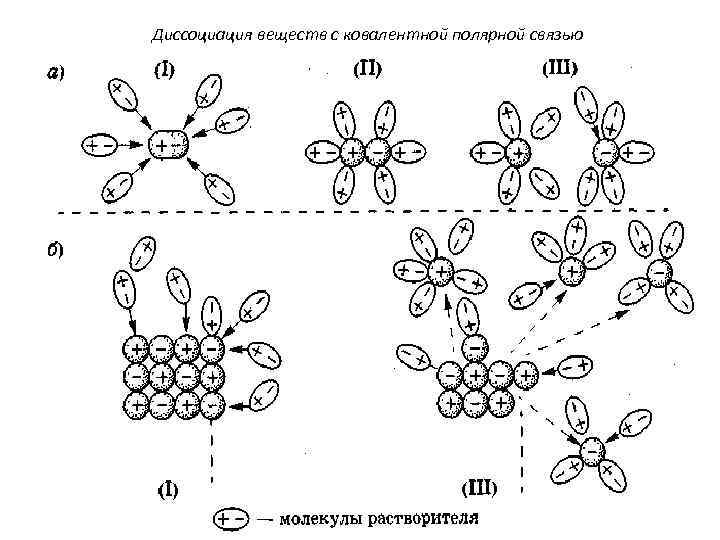 Диссоциация веществ с ковалентной полярной связью
Диссоциация веществ с ковалентной полярной связью
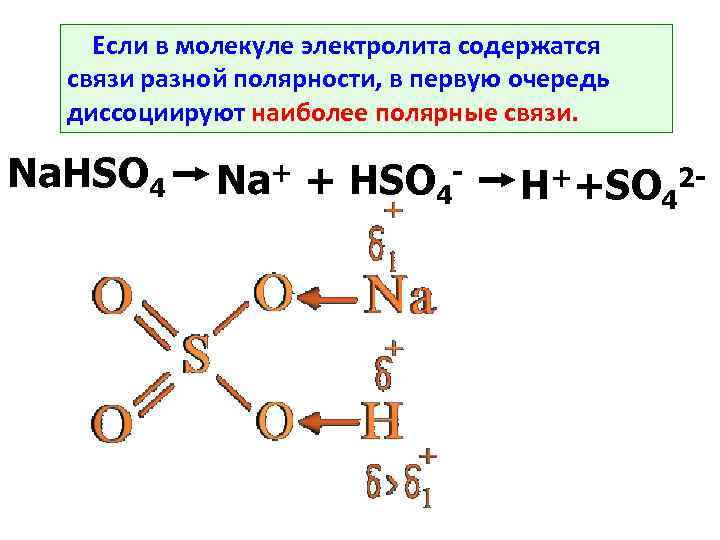 Если в молекуле электролита содержатся связи разной полярности, в первую очередь диссоциируют наиболее полярные связи. Na. HSO 4 Na+ + HSO 4 - H++SO 42 -
Если в молекуле электролита содержатся связи разной полярности, в первую очередь диссоциируют наиболее полярные связи. Na. HSO 4 Na+ + HSO 4 - H++SO 42 -
 Уравнения электролитической диссоциации Образование в результате распада электролитов гидратированных ионов отражается при написании уравнений диссоциации, однако, чаще эти уравнения записывают в более короткой форме
Уравнения электролитической диссоциации Образование в результате распада электролитов гидратированных ионов отражается при написании уравнений диссоциации, однако, чаще эти уравнения записывают в более короткой форме
 Количественная характеристика процесса диссоциации Степень диссоциации электролита (α) отношение числа распавшихся молекул (n) к общему числу молекул (N) в растворе: или Величина α зависит от природы электролита, температуры и концентрации вещества в растворе. Сила электролита
Количественная характеристика процесса диссоциации Степень диссоциации электролита (α) отношение числа распавшихся молекул (n) к общему числу молекул (N) в растворе: или Величина α зависит от природы электролита, температуры и концентрации вещества в растворе. Сила электролита
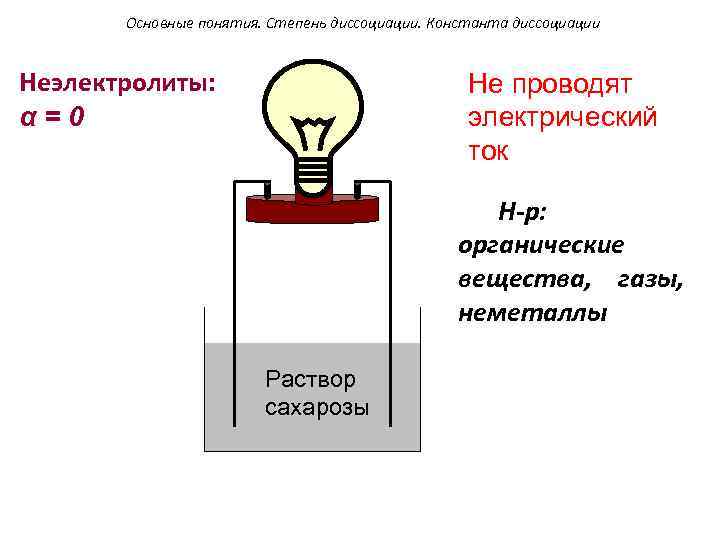 Основные понятия. Степень диссоциации. Константа диссоциации Неэлектролиты: α=0 Не проводят электрический ток Н-р: органические вещества, газы, неметаллы Раствор сахарозы
Основные понятия. Степень диссоциации. Константа диссоциации Неэлектролиты: α=0 Не проводят электрический ток Н-р: органические вещества, газы, неметаллы Раствор сахарозы
 Основные понятия. Степень диссоциации. Константа диссоциации По величине α электролиты классифицируют на: 1. Сильные электролиты: α > 0, 3 (больше 30%), в разбавленных растворах α→ 1 (100%) Н-р: НCl, HBr, HI, H 2 SO 4, HNO 3, HMn. O 4, HCl. O 4; Растворимые основания - щелочи; все растворимые соли.
Основные понятия. Степень диссоциации. Константа диссоциации По величине α электролиты классифицируют на: 1. Сильные электролиты: α > 0, 3 (больше 30%), в разбавленных растворах α→ 1 (100%) Н-р: НCl, HBr, HI, H 2 SO 4, HNO 3, HMn. O 4, HCl. O 4; Растворимые основания - щелочи; все растворимые соли.
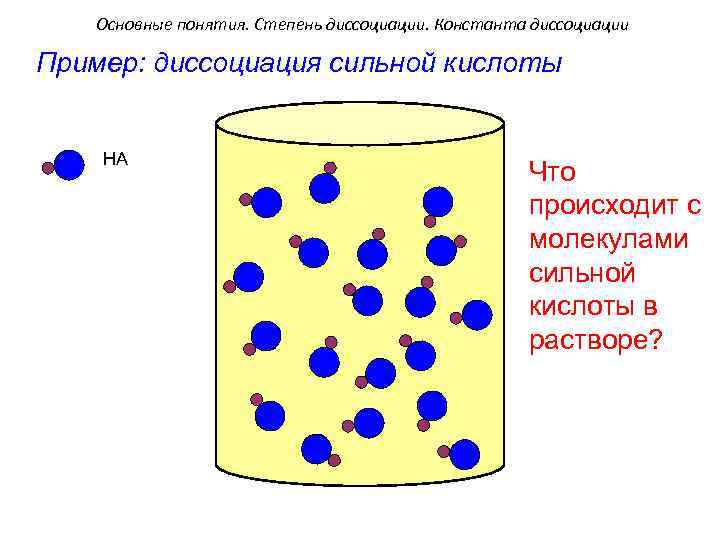 Основные понятия. Степень диссоциации. Константа диссоциации Пример: диссоциация сильной кислоты HA Что происходит с молекулами сильной кислоты в растворе?
Основные понятия. Степень диссоциации. Константа диссоциации Пример: диссоциация сильной кислоты HA Что происходит с молекулами сильной кислоты в растворе?
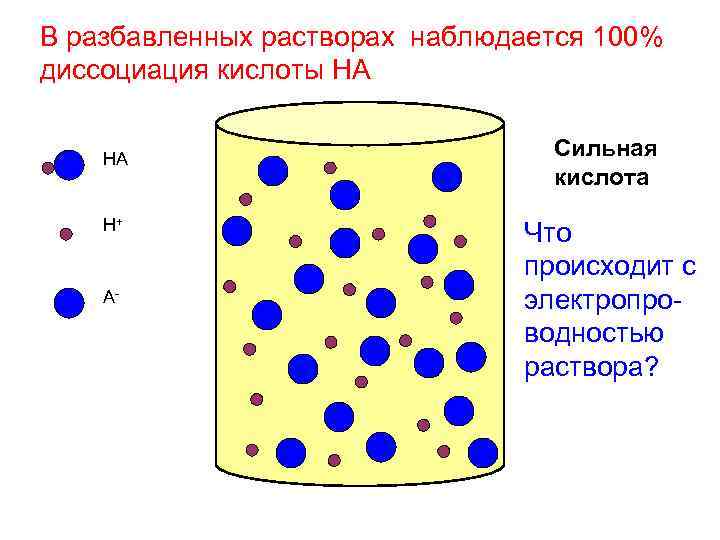 В разбавленных растворах наблюдается 100% диссоциация кислоты HA HA H+ A- Сильная кислота Что происходит с электропроводностью раствора?
В разбавленных растворах наблюдается 100% диссоциация кислоты HA HA H+ A- Сильная кислота Что происходит с электропроводностью раствора?
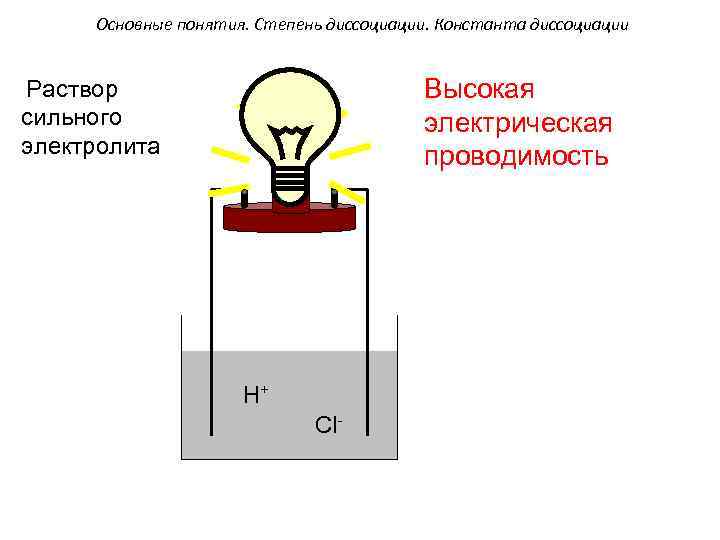 Основные понятия. Степень диссоциации. Константа диссоциации Высокая электрическая проводимость Раствор сильного электролита H+ Cl-
Основные понятия. Степень диссоциации. Константа диссоциации Высокая электрическая проводимость Раствор сильного электролита H+ Cl-
 Основные понятия. Степень диссоциации. Константа диссоциации 2. Средней силы электролиты 0, 3 > α > 0, 03 (от 3 до 30 %) Н-р: H 3 PO 4, H 2 SO 3, НF, H 2 C 2 O 4 и др. Средняя электрическая проводимость
Основные понятия. Степень диссоциации. Константа диссоциации 2. Средней силы электролиты 0, 3 > α > 0, 03 (от 3 до 30 %) Н-р: H 3 PO 4, H 2 SO 3, НF, H 2 C 2 O 4 и др. Средняя электрическая проводимость
 Основные понятия. Степень диссоциации. Константа диссоциации 3. Слабые электролиты α < 0, 03 (меньше 3%) Н-р: H 2 CO 3, H 2 Si. O 3, HNO 2, CH 3 COOH и др. органические кислоты, NH 4 OH и др. нерастворимые основания и соли.
Основные понятия. Степень диссоциации. Константа диссоциации 3. Слабые электролиты α < 0, 03 (меньше 3%) Н-р: H 2 CO 3, H 2 Si. O 3, HNO 2, CH 3 COOH и др. органические кислоты, NH 4 OH и др. нерастворимые основания и соли.
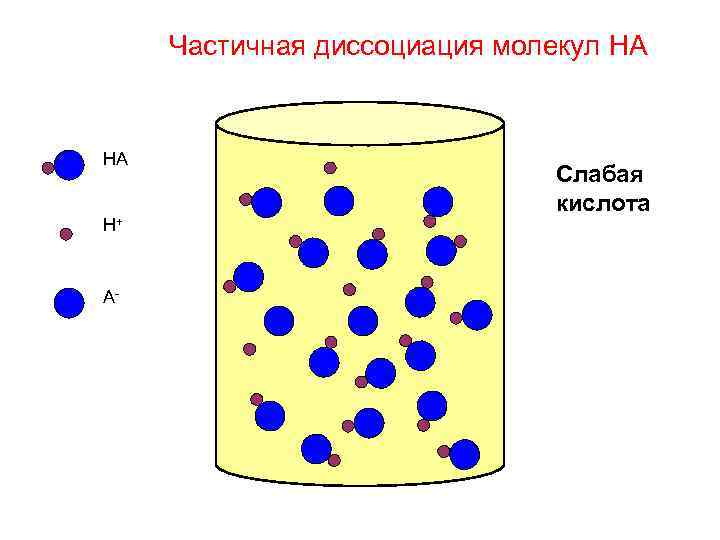 Частичная диссоциация молекул HA HA H+ A- Слабая кислота
Частичная диссоциация молекул HA HA H+ A- Слабая кислота
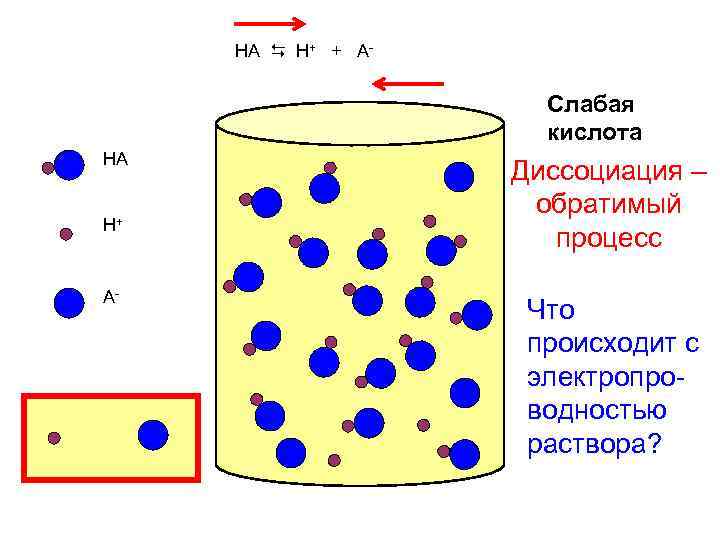 HA H+ + A- Слабая кислота HA H+ A- Диссоциация – обратимый процесс Что происходит с электропроводностью раствора?
HA H+ + A- Слабая кислота HA H+ A- Диссоциация – обратимый процесс Что происходит с электропроводностью раствора?
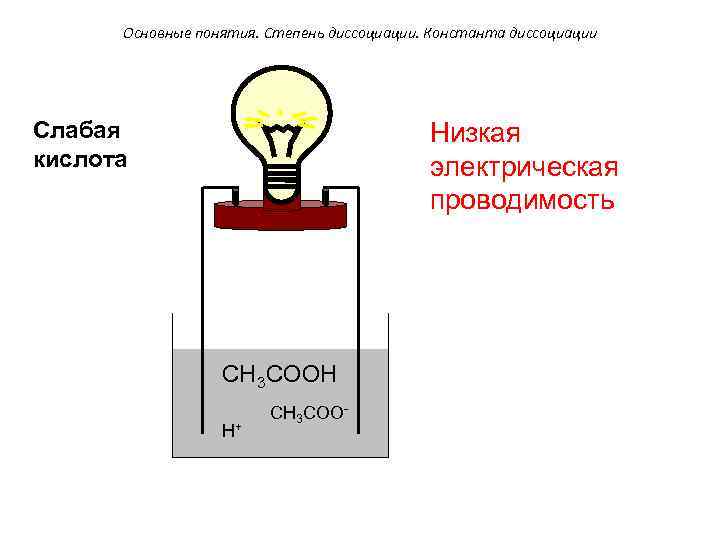 Основные понятия. Степень диссоциации. Константа диссоциации Слабая кислота Низкая электрическая проводимость CH 3 COOH H+ CH 3 COO-
Основные понятия. Степень диссоциации. Константа диссоциации Слабая кислота Низкая электрическая проводимость CH 3 COOH H+ CH 3 COO-
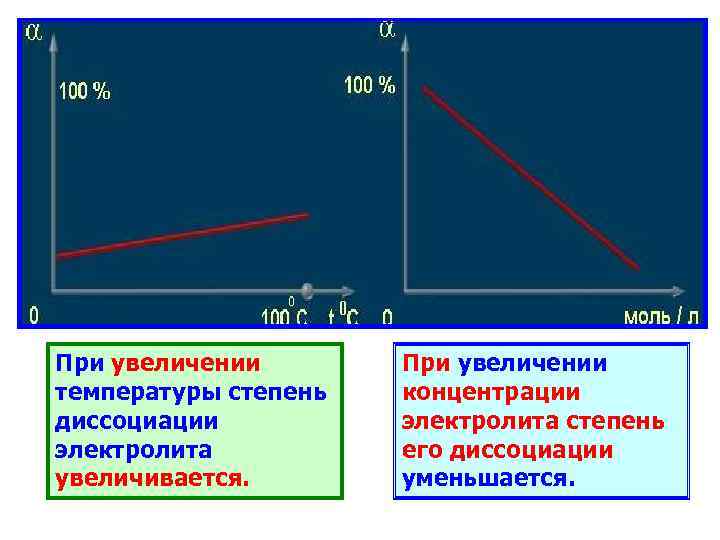 При увеличении температуры степень диссоциации электролита увеличивается. При увеличении концентрации электролита степень его диссоциации уменьшается.
При увеличении температуры степень диссоциации электролита увеличивается. При увеличении концентрации электролита степень его диссоциации уменьшается.
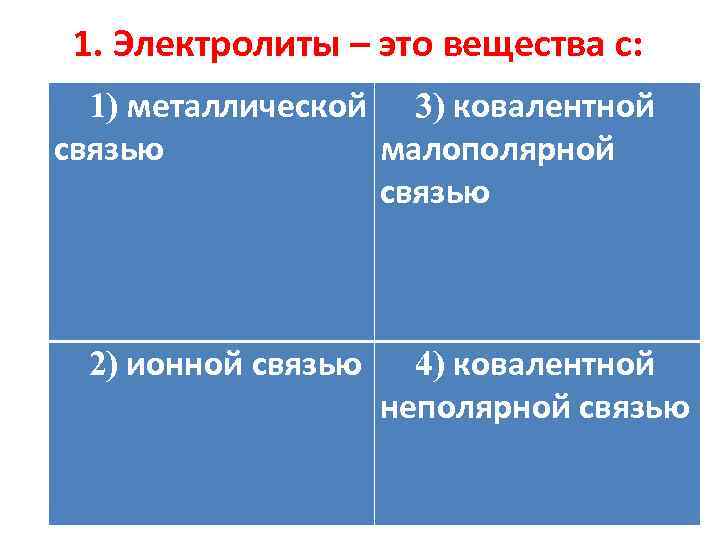 1. Электролиты – это вещества с: 1) металлической 3) ковалентной связью малополярной связью 2) ионной связью 4) ковалентной неполярной связью
1. Электролиты – это вещества с: 1) металлической 3) ковалентной связью малополярной связью 2) ионной связью 4) ковалентной неполярной связью
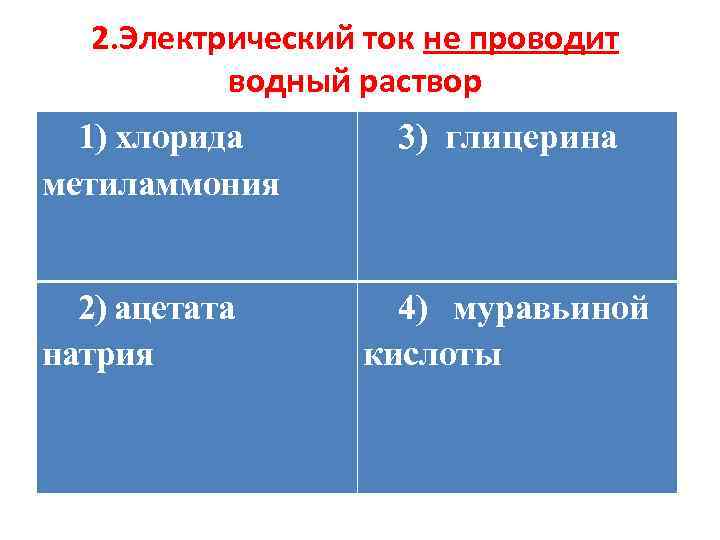 2. Электрический ток не проводит водный раствор 1) хлорида метиламмония 2) ацетата натрия 3) глицерина 4) муравьиной кислоты
2. Электрический ток не проводит водный раствор 1) хлорида метиламмония 2) ацетата натрия 3) глицерина 4) муравьиной кислоты
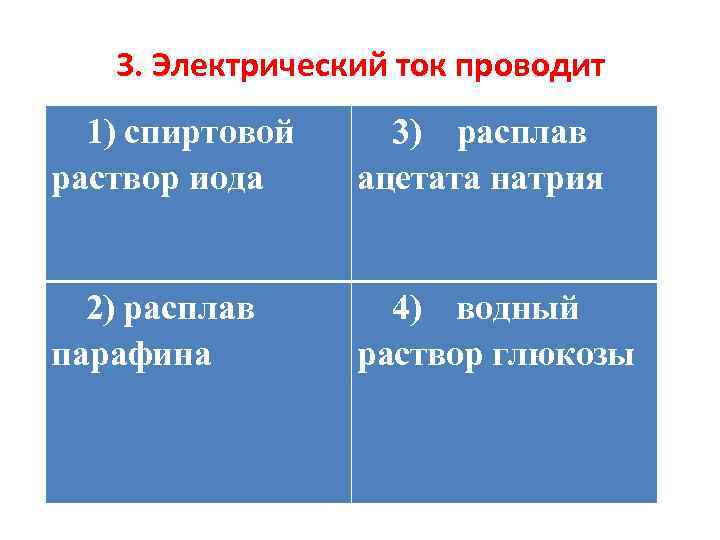 3. Электрический ток проводит 1) спиртовой раствор иода 3) расплав ацетата натрия 2) расплав парафина 4) водный раствор глюкозы
3. Электрический ток проводит 1) спиртовой раствор иода 3) расплав ацетата натрия 2) расплав парафина 4) водный раствор глюкозы
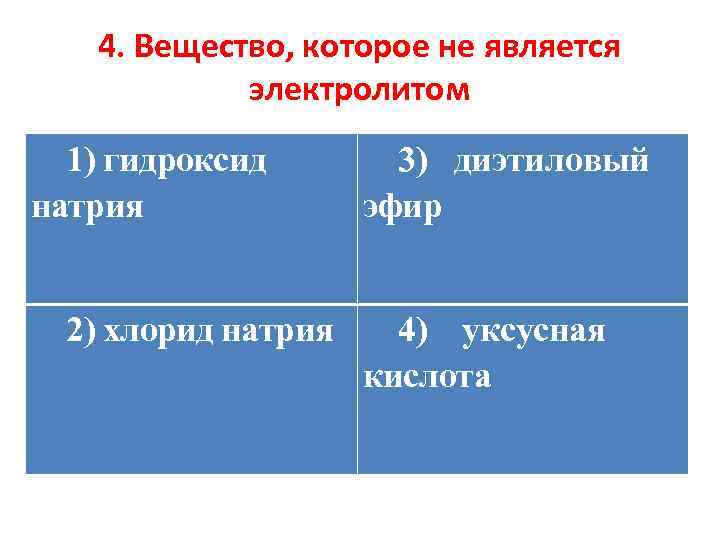 4. Вещество, которое не является электролитом 1) гидроксид натрия 2) хлорид натрия 3) диэтиловый эфир 4) уксусная кислота
4. Вещество, которое не является электролитом 1) гидроксид натрия 2) хлорид натрия 3) диэтиловый эфир 4) уксусная кислота
 5. Частицы, заряженные отрицательно, называются 1) ионами 3) анионами 2) катионами 4) атомами
5. Частицы, заряженные отрицательно, называются 1) ионами 3) анионами 2) катионами 4) атомами
 6. Слабым электролитом является кислота 1) иодоводородная 2) сероводородная 3) азотная 4) хлороводородная
6. Слабым электролитом является кислота 1) иодоводородная 2) сероводородная 3) азотная 4) хлороводородная
 7. Сильным электролитом в водном растворе является 1) угольная кислота 3) уксусная кислота 2) метиловый спирт 4) формиат натрия
7. Сильным электролитом в водном растворе является 1) угольная кислота 3) уксусная кислота 2) метиловый спирт 4) формиат натрия
 8. Электролитом является каждое вещество в ряду 1) C 2 H 6, Сa(OH)2 , 3) KOH, H 3 PO 4, H 2 S, Zn. SO 4 Mg. Cl 2, CH 3 COONa 2) Ba. Cl 2, CH 3 OCH 3, Na. NO 3, H 2 SO 4 4) Pb. CO 3, Al. Br 3, C 12 H 22 O 11, H 2 SO 3
8. Электролитом является каждое вещество в ряду 1) C 2 H 6, Сa(OH)2 , 3) KOH, H 3 PO 4, H 2 S, Zn. SO 4 Mg. Cl 2, CH 3 COONa 2) Ba. Cl 2, CH 3 OCH 3, Na. NO 3, H 2 SO 4 4) Pb. CO 3, Al. Br 3, C 12 H 22 O 11, H 2 SO 3
 9. Сильными электролитами являются все вещества, указанные в ряду 1) гидроксид 3) хлорид калия, азотная магния, уксусная кислота, серная кислота, гидроксид кислота натрия 2) сероводородная 4) кислота, сернистая сероводородная кислота, серная кислота, уксусная кислота, сернистая кислота
9. Сильными электролитами являются все вещества, указанные в ряду 1) гидроксид 3) хлорид калия, азотная магния, уксусная кислота, серная кислота, гидроксид кислота натрия 2) сероводородная 4) кислота, сернистая сероводородная кислота, серная кислота, уксусная кислота, сернистая кислота
 10. Слабыми электролитами являются все вещества группы 1) CH 3 COOH, Ва(ОН)2, К 2 S 3) H 2 S, NH 4 OH, Fe(OH)3 2) H 2 SO 3, KOH, CH 3 COONa 4) H 2 S, Na. OH, Fe. Cl 3
10. Слабыми электролитами являются все вещества группы 1) CH 3 COOH, Ва(ОН)2, К 2 S 3) H 2 S, NH 4 OH, Fe(OH)3 2) H 2 SO 3, KOH, CH 3 COONa 4) H 2 S, Na. OH, Fe. Cl 3
 Диссоциация кислот, оснований и солей Кислотами называются электролиты, диссоциирующие в водных растворах с образованием ионов водорода и не дающие никаких других положительно заряженных ионов. От наличия ионов водорода зависят кислотные свойства растворов. Кислота тем сильнее, чем больше в растворе концентрация ионов водорода.
Диссоциация кислот, оснований и солей Кислотами называются электролиты, диссоциирующие в водных растворах с образованием ионов водорода и не дающие никаких других положительно заряженных ионов. От наличия ионов водорода зависят кислотные свойства растворов. Кислота тем сильнее, чем больше в растворе концентрация ионов водорода.
 Диссоциация кислот, оснований и солей Основания – электролиты, диссоциирующие в водных растворах с отщеплением гидроксид-ионов и не дающие никаких других отрицательно заряженных ионов. Na. OH ↔ Na+ + OH- Носителем основных свойств является гидроксид -ион. Чем больше концентрация гидроксид-ионов в растворе, тем сильнее основание.
Диссоциация кислот, оснований и солей Основания – электролиты, диссоциирующие в водных растворах с отщеплением гидроксид-ионов и не дающие никаких других отрицательно заряженных ионов. Na. OH ↔ Na+ + OH- Носителем основных свойств является гидроксид -ион. Чем больше концентрация гидроксид-ионов в растворе, тем сильнее основание.
 Диссоциация кислот, оснований и солей Амфолиты – гидроксиды, которые могут диссоциировать как по типу основания, так и по типу кислоты.
Диссоциация кислот, оснований и солей Амфолиты – гидроксиды, которые могут диссоциировать как по типу основания, так и по типу кислоты.
 Диссоциация кислот, оснований и солей Соли – электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. При диссоциации средних солей в растворе образуются катионы металла и анионы кислотного остатка.
Диссоциация кислот, оснований и солей Соли – электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. При диссоциации средних солей в растворе образуются катионы металла и анионы кислотного остатка.
 Диссоциация кислот, оснований и солей При диссоциации кислых солей в растворе образуются катионы металла и сложные анионы. При диссоциации основных солей образуются анионы кислоты и сложные катионы. диссоциация основных солей
Диссоциация кислот, оснований и солей При диссоциации кислых солей в растворе образуются катионы металла и сложные анионы. При диссоциации основных солей образуются анионы кислоты и сложные катионы. диссоциация основных солей
 12. Кислоты в растворе и расплаве диссоциируют на 1) анион 3) катион кислотного остатка металла 2) катион водорода 4) анион гидроксогруппы
12. Кислоты в растворе и расплаве диссоциируют на 1) анион 3) катион кислотного остатка металла 2) катион водорода 4) анион гидроксогруппы
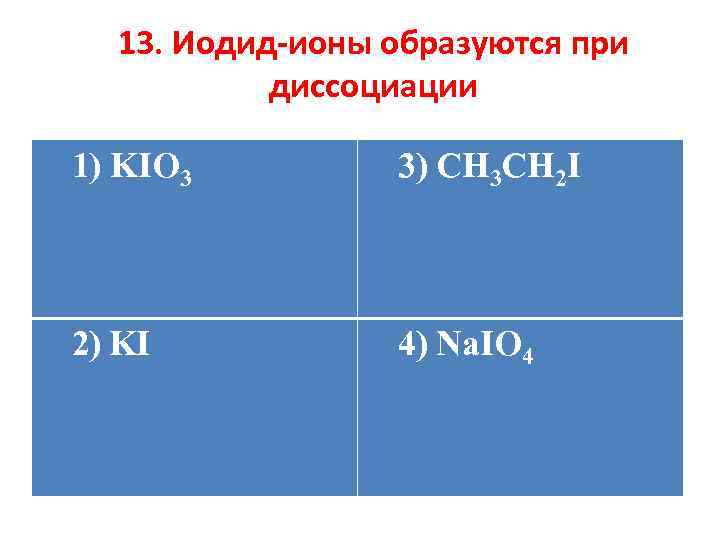 13. Иодид-ионы образуются при диссоциации 1) KIO 3 3) CH 3 CH 2 I 2) KI 4) Na. IO 4
13. Иодид-ионы образуются при диссоциации 1) KIO 3 3) CH 3 CH 2 I 2) KI 4) Na. IO 4
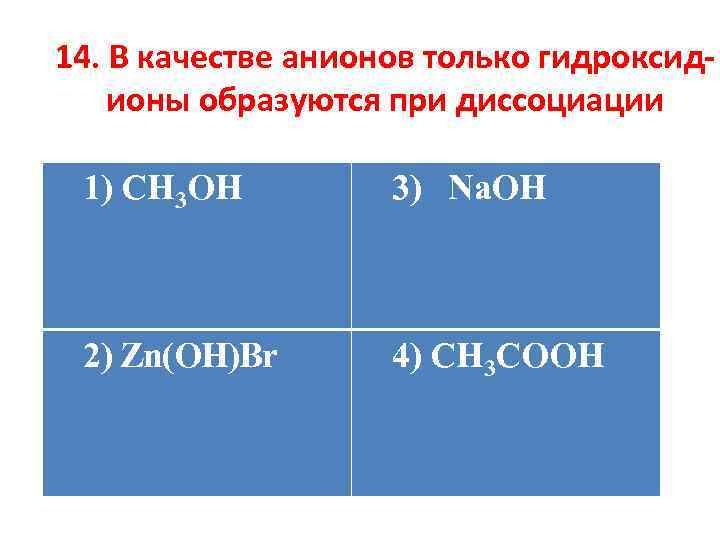 14. В качестве анионов только гидроксидионы образуются при диссоциации 1) CH 3 OH а) +(0, 06– 1, 00); б) +(0, 8– 1, 40); 2) Zn(OH)Br 3) Na. OH в) +(1, 02– 1, 30); г) +(0, 6– 0, 90). 4) CH 3 COOH
14. В качестве анионов только гидроксидионы образуются при диссоциации 1) CH 3 OH а) +(0, 06– 1, 00); б) +(0, 8– 1, 40); 2) Zn(OH)Br 3) Na. OH в) +(1, 02– 1, 30); г) +(0, 6– 0, 90). 4) CH 3 COOH
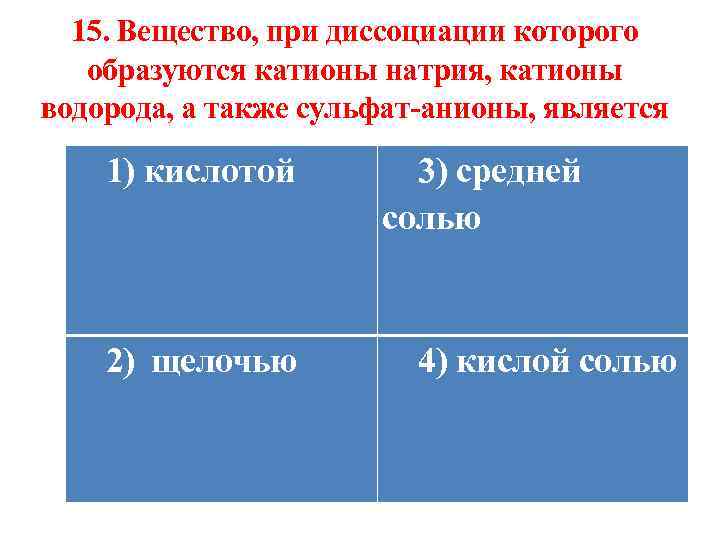 15. Вещество, при диссоциации которого образуются катионы натрия, катионы водорода, а также сульфат-анионы, является 1) кислотой 2) щелочью 3) средней солью 4) кислой солью
15. Вещество, при диссоциации которого образуются катионы натрия, катионы водорода, а также сульфат-анионы, является 1) кислотой 2) щелочью 3) средней солью 4) кислой солью
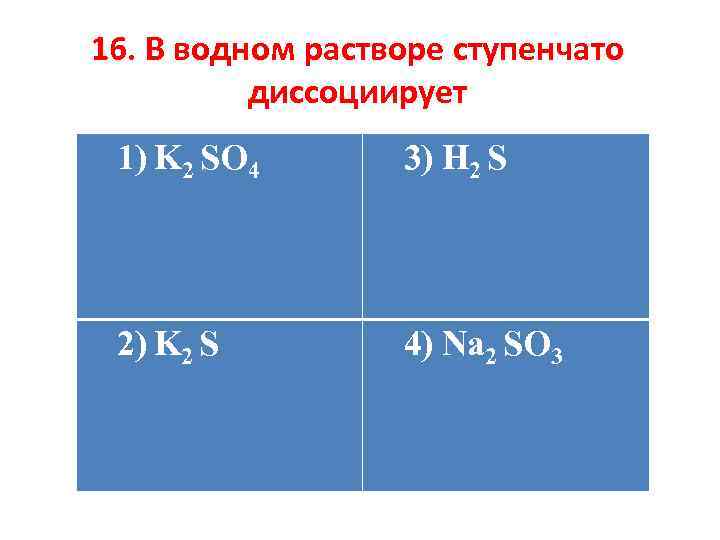 16. В водном растворе ступенчато диссоциирует 1) K 2 SO 4 3) H 2 S 2) K 2 S 4) Na 2 SO 3
16. В водном растворе ступенчато диссоциирует 1) K 2 SO 4 3) H 2 S 2) K 2 S 4) Na 2 SO 3
 17. Диссоциация по трем ступеням возможна в растворе 1) хлорида алюминия 3) ортофосфата калия 2) нитрата алюминия 4) ортофосфорной кислоты
17. Диссоциация по трем ступеням возможна в растворе 1) хлорида алюминия 3) ортофосфата калия 2) нитрата алюминия 4) ортофосфорной кислоты
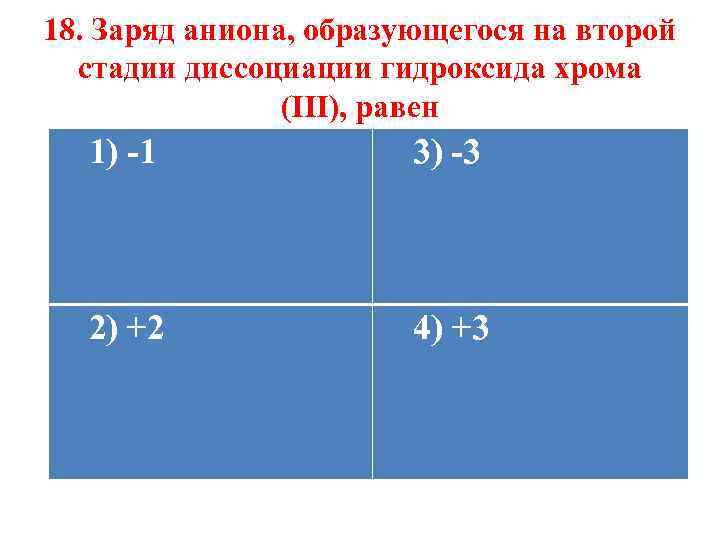 18. Заряд аниона, образующегося на второй стадии диссоциации гидроксида хрома (III), равен 1) -1 3) -3 2) +2 4) +3
18. Заряд аниона, образующегося на второй стадии диссоциации гидроксида хрома (III), равен 1) -1 3) -3 2) +2 4) +3
 19. Протоны в наибольшем количестве образуются при диссоциации 1) С 6 Н 5 ОН 3) Н 2 SO 4 2) С 6 Н 5 СООН 4) Na. HCO 3
19. Протоны в наибольшем количестве образуются при диссоциации 1) С 6 Н 5 ОН 3) Н 2 SO 4 2) С 6 Н 5 СООН 4) Na. HCO 3
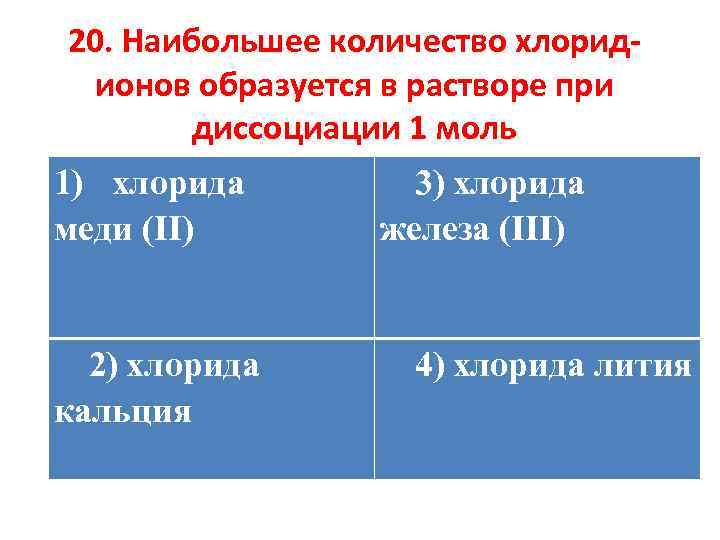 20. Наибольшее количество хлоридионов образуется в растворе при диссоциации 1 моль 1) хлорида меди (II) 2) хлорида кальция 3) хлорида железа (III) 4) хлорида лития
20. Наибольшее количество хлоридионов образуется в растворе при диссоциации 1 моль 1) хлорида меди (II) 2) хлорида кальция 3) хлорида железа (III) 4) хлорида лития
 22. Какие из утверждений о диссоциации оснований в водных растворах верны? А. Основания в воде диссоциируют на катионы металла (или подобный им катион-аммония) и гидроксид-анионы. Б. Никаких других анионов, кроме гидроксиданионов, основания не образуют. 1) верно только А 3) верны оба утверждения 2) верно только Б 4) оба утверждения неверны
22. Какие из утверждений о диссоциации оснований в водных растворах верны? А. Основания в воде диссоциируют на катионы металла (или подобный им катион-аммония) и гидроксид-анионы. Б. Никаких других анионов, кроме гидроксиданионов, основания не образуют. 1) верно только А 3) верны оба утверждения 2) верно только Б 4) оба утверждения неверны
 Реакции ионного обмена в растворах электролитов Реакции в растворах электролитов протекают между ионами. Их выражают в виде ионных уравнений. Факторы протекания реакций обмена в растворах электролитов: 1. Связывание ионов в молекулы труднорастворимых соединений. 2. Образование слабодиссоциирующих соединений (воды, слабой кислоты, слабого основания). 3. Связывание ионов в молекулы газообразных веществ.
Реакции ионного обмена в растворах электролитов Реакции в растворах электролитов протекают между ионами. Их выражают в виде ионных уравнений. Факторы протекания реакций обмена в растворах электролитов: 1. Связывание ионов в молекулы труднорастворимых соединений. 2. Образование слабодиссоциирующих соединений (воды, слабой кислоты, слабого основания). 3. Связывание ионов в молекулы газообразных веществ.
 Ионообменные реакции Пример1. Нейтрализация сильной кислоты HCl сильным основанием Na. OH Полная нейтрализация p. H=7
Ионообменные реакции Пример1. Нейтрализация сильной кислоты HCl сильным основанием Na. OH Полная нейтрализация p. H=7
 Ионообменные реакции Пример 2. Нейтрализация слабой кислоты CH 3 COOH сильным основанием Na. OH: p. H >7
Ионообменные реакции Пример 2. Нейтрализация слабой кислоты CH 3 COOH сильным основанием Na. OH: p. H >7
 Ионообменные реакции Пример 3. Нейтрализация слабого основания NH 4 OH сильной кислотой HNO 3: p. H <7
Ионообменные реакции Пример 3. Нейтрализация слабого основания NH 4 OH сильной кислотой HNO 3: p. H <7
 Ионообменные реакции Пример 4. Действие сильной кислоты HCl на соль слабой кислоты и сильного основания KCN: p. H ˃7
Ионообменные реакции Пример 4. Действие сильной кислоты HCl на соль слабой кислоты и сильного основания KCN: p. H ˃7
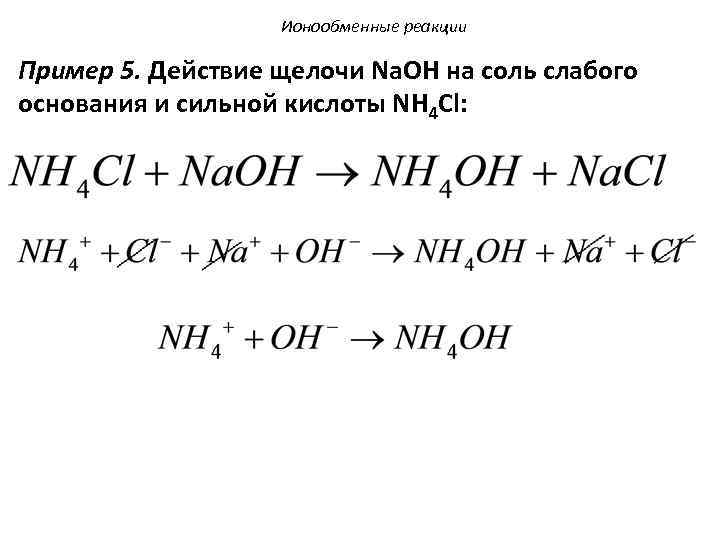 Ионообменные реакции Пример 5. Действие щелочи Na. OH на соль слабого основания и сильной кислоты NH 4 Cl:
Ионообменные реакции Пример 5. Действие щелочи Na. OH на соль слабого основания и сильной кислоты NH 4 Cl:
 23. Одновременно существовать в водном растворе не могут ионы 1) катион меди 3) катион (II) и нитратцинка и анион гидроксид-анион 2) катион цинка и хлориданион 4) катион железа (II) и сульфат-анион
23. Одновременно существовать в водном растворе не могут ионы 1) катион меди 3) катион (II) и нитратцинка и анион гидроксид-анион 2) катион цинка и хлориданион 4) катион железа (II) и сульфат-анион
 24. Одновременно существовать в водном растворе могут ионы 1) катион 3) катион меди серебра (I) и (II) и гидроксидхлорид-анион 2) катион 4) катион бария и натрия и сульфат-анион
24. Одновременно существовать в водном растворе могут ионы 1) катион 3) катион меди серебра (I) и (II) и гидроксидхлорид-анион 2) катион 4) катион бария и натрия и сульфат-анион
 25. Реакция ионного обмена идет до конца в результате образования нерастворимого в воде вещества при взаимодействии 1) Na. OH и Mg. Cl 2 3) KOH и HNO 3 2) Na. Cl и Cu. SO 4 4) Ca. CO 3 HCl(р-р) и
25. Реакция ионного обмена идет до конца в результате образования нерастворимого в воде вещества при взаимодействии 1) Na. OH и Mg. Cl 2 3) KOH и HNO 3 2) Na. Cl и Cu. SO 4 4) Ca. CO 3 HCl(р-р) и
 26. Практически до конца идет реакция 1) Na 2 SO 4 + KCl = 2) H 2 SO 4 + Ba. Cl 2 = 3) KNO 3 + Na. OH = 4) Cu. Cl 2 + Na 2 SO 4 =
26. Практически до конца идет реакция 1) Na 2 SO 4 + KCl = 2) H 2 SO 4 + Ba. Cl 2 = 3) KNO 3 + Na. OH = 4) Cu. Cl 2 + Na 2 SO 4 =
 27. Выберите реакцию ионного обмена, которая не может осуществиться до конца 1) Na. Cl +Ag. NO 3= 3) KOH + Cu. SO 4 = 2) Ca. CO 3 + HCl = 4) KNO 3 + Cu. SO 4 =
27. Выберите реакцию ионного обмена, которая не может осуществиться до конца 1) Na. Cl +Ag. NO 3= 3) KOH + Cu. SO 4 = 2) Ca. CO 3 + HCl = 4) KNO 3 + Cu. SO 4 =
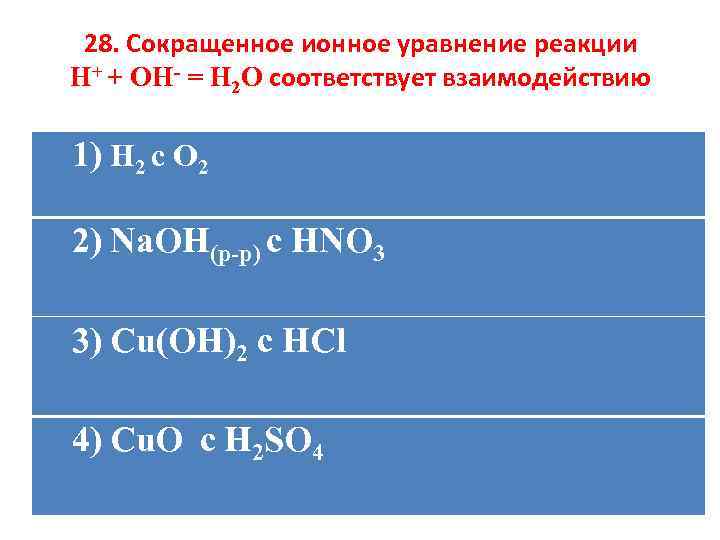 28. Сокращенное ионное уравнение реакции H+ + OH- = H 2 O соответствует взаимодействию 1) H 2 c O 2 2) Na. OH(р-р) c HNO 3 3) Cu(OH)2 c HCl 4) Cu. O с H 2 SO 4
28. Сокращенное ионное уравнение реакции H+ + OH- = H 2 O соответствует взаимодействию 1) H 2 c O 2 2) Na. OH(р-р) c HNO 3 3) Cu(OH)2 c HCl 4) Cu. O с H 2 SO 4
 29. Выберите реакцию ионного обмена, которая соответствует сокращенному ионному уравнению 2 H+ + CO 32 - = H 2 O + CO 2 1) Na 2 CO 3 + HCl = 2) Na 2 CO 3 + Ca. Cl 2 = 3) Na 2 CO 3 + Al. Cl 3 = 4) Na 2 CO 3 + Cr. Cl 3 =
29. Выберите реакцию ионного обмена, которая соответствует сокращенному ионному уравнению 2 H+ + CO 32 - = H 2 O + CO 2 1) Na 2 CO 3 + HCl = 2) Na 2 CO 3 + Ca. Cl 2 = 3) Na 2 CO 3 + Al. Cl 3 = 4) Na 2 CO 3 + Cr. Cl 3 =
 30. Суммы всех коэффициентов в полном и сокращенном ионном уравнениях реакции нитрата железа (II) с гидроксидом натрия равны соответственно 1) 10 и 3 3) 10 и 4 2) 12 и 3 4) 12 и 4
30. Суммы всех коэффициентов в полном и сокращенном ионном уравнениях реакции нитрата железа (II) с гидроксидом натрия равны соответственно 1) 10 и 3 3) 10 и 4 2) 12 и 3 4) 12 и 4
 31. Реакция ионного обмена протекает до конца при сливании растворов 1) нитрата натрия и сульфата калия 3) хлорида кальция и нитрата серебра 2) сульфата калия и соляной кислоты 4) хлорида калия и сульфата натрия
31. Реакция ионного обмена протекает до конца при сливании растворов 1) нитрата натрия и сульфата калия 3) хлорида кальция и нитрата серебра 2) сульфата калия и соляной кислоты 4) хлорида калия и сульфата натрия
 32. Установите соответствие между исходными веществами, вступающими в реакции обмена, и сокращенным ионным a) карбонат калия и хлорид кальция b) нитрат серебра и хлорид лития в) сульфат меди (II) и сульфид натрия г) сульфат меди (II) и гидроксид натрия 1) Cu 2+ + S 2 - = Cu. S 2) Cu 2+ + 2 OH- = Cu(OH)2 3) Ag+ + Cl- = Ag. Cl 4) Ca 2+ + CO 32 - = Ca. CO 3
32. Установите соответствие между исходными веществами, вступающими в реакции обмена, и сокращенным ионным a) карбонат калия и хлорид кальция b) нитрат серебра и хлорид лития в) сульфат меди (II) и сульфид натрия г) сульфат меди (II) и гидроксид натрия 1) Cu 2+ + S 2 - = Cu. S 2) Cu 2+ + 2 OH- = Cu(OH)2 3) Ag+ + Cl- = Ag. Cl 4) Ca 2+ + CO 32 - = Ca. CO 3
 33. Установите соответствие между исходными веществами, вступающими в реакции обмена, и сокращенными ионными уравнениями а) Сu(NO 3)2 + K 2 S 1) NH 4+ + OH- = NH 3 + H 2 O б) NH 4 Cl + Na. OH 2) Al 3+ + 3 OH- = Al(OH)3 3) Ba 2+ + SO 42 - = Ba. SO 4 4) Cu 2+ + S 2 - = Cu. S г) Ba. Cl 2 + Na 2 SO 4 в) Al. Cl 3 + KOH
33. Установите соответствие между исходными веществами, вступающими в реакции обмена, и сокращенными ионными уравнениями а) Сu(NO 3)2 + K 2 S 1) NH 4+ + OH- = NH 3 + H 2 O б) NH 4 Cl + Na. OH 2) Al 3+ + 3 OH- = Al(OH)3 3) Ba 2+ + SO 42 - = Ba. SO 4 4) Cu 2+ + S 2 - = Cu. S г) Ba. Cl 2 + Na 2 SO 4 в) Al. Cl 3 + KOH
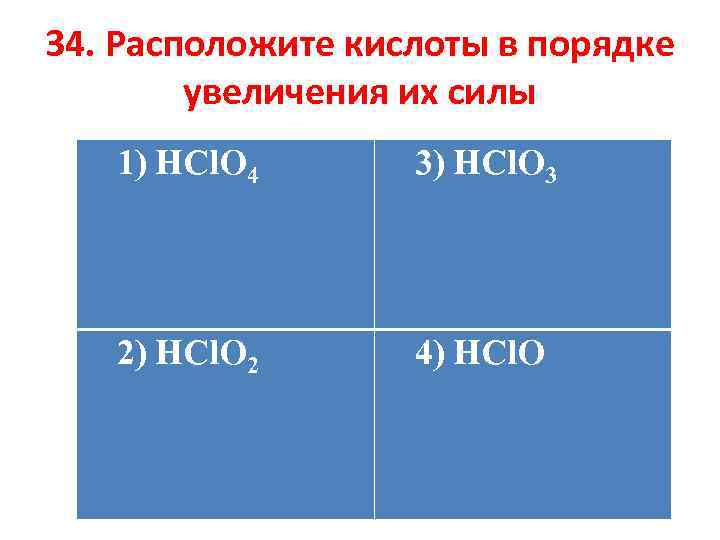 34. Расположите кислоты в порядке увеличения их силы 1) HCl. O 4 3) HCl. O 3 2) HCl. O 2 4) HCl. O
34. Расположите кислоты в порядке увеличения их силы 1) HCl. O 4 3) HCl. O 3 2) HCl. O 2 4) HCl. O
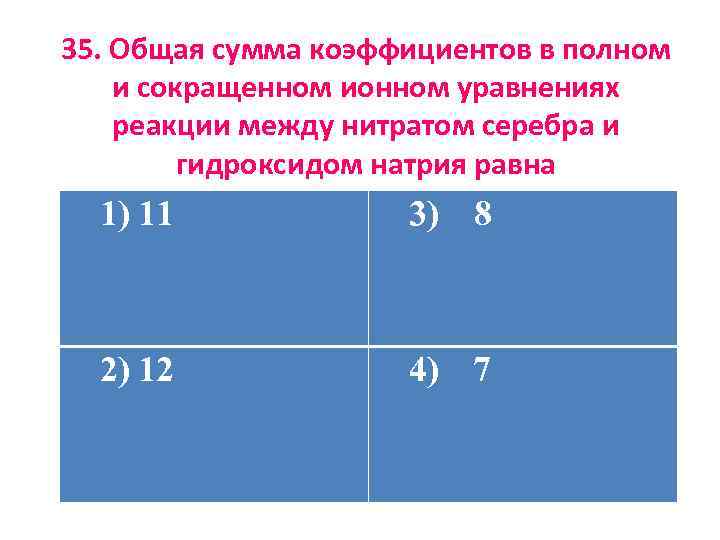 35. Общая сумма коэффициентов в полном и сокращенном ионном уравнениях реакции между нитратом серебра и гидроксидом натрия равна 1) 11 3) 8 2) 12 4) 7
35. Общая сумма коэффициентов в полном и сокращенном ионном уравнениях реакции между нитратом серебра и гидроксидом натрия равна 1) 11 3) 8 2) 12 4) 7
 С 4. Карбонат кальция массой 10 г растворили при нагревании в 150 мл хлороводородной кислоты (ρ=1, 04 г/мл) с массовой долей 9%. Какова массовая доля хлорида кальция в образовавшемся растворе? 1) Составим уравнение химической реакции: Ca. CO 3+2 HCl=H 2 O+Ca. Cl 2+CO 2↑ 2) Рассчитаем количества веществ реагентов: • n(HCL)исх. =150∙ 1, 04∙ 0, 009/36, 5= 0, 385 моль в избытке • n(Ca. CO 3)= 10/100=0, 1 моль 3)Рассчитаем массу раствора (с учётом массы выделившегося углекислого газа) : • n(CO 2) = n(Ca. CO 3)= 0, 1 моль • m(CO 2)= 0, 1 ∙ 44= 4, 4 г • m(ра-ра)= (V ∙q) + m(Ca. CO 3 ) – m(CO 2 ) =(150∙ 1, 04 + 10 - 4, 4 = 161, 6 г 4)Рассчитаем массовую долю хлорида кальция • n(Ca. Cl 2)= n(Ca. CO 3)=0, 1 моль • m(Ca. Cl 2)= 0, 1 ∙ 111= 11, 1 г • ω(Ca. Cl 2)= 11, 1/ 161, 6 = 0, 069 или 6, 9%
С 4. Карбонат кальция массой 10 г растворили при нагревании в 150 мл хлороводородной кислоты (ρ=1, 04 г/мл) с массовой долей 9%. Какова массовая доля хлорида кальция в образовавшемся растворе? 1) Составим уравнение химической реакции: Ca. CO 3+2 HCl=H 2 O+Ca. Cl 2+CO 2↑ 2) Рассчитаем количества веществ реагентов: • n(HCL)исх. =150∙ 1, 04∙ 0, 009/36, 5= 0, 385 моль в избытке • n(Ca. CO 3)= 10/100=0, 1 моль 3)Рассчитаем массу раствора (с учётом массы выделившегося углекислого газа) : • n(CO 2) = n(Ca. CO 3)= 0, 1 моль • m(CO 2)= 0, 1 ∙ 44= 4, 4 г • m(ра-ра)= (V ∙q) + m(Ca. CO 3 ) – m(CO 2 ) =(150∙ 1, 04 + 10 - 4, 4 = 161, 6 г 4)Рассчитаем массовую долю хлорида кальция • n(Ca. Cl 2)= n(Ca. CO 3)=0, 1 моль • m(Ca. Cl 2)= 0, 1 ∙ 111= 11, 1 г • ω(Ca. Cl 2)= 11, 1/ 161, 6 = 0, 069 или 6, 9%
 Задача 16, 8 л сероводорода (н. у. ) прореагировали без остатка с 221 мл 12%ного раствора гидроксида натрия (плотность 1, 131 г/мл). Определите, какое соединение образовалось в растворе и рассчитаете его массовую долю в этом растворе.
Задача 16, 8 л сероводорода (н. у. ) прореагировали без остатка с 221 мл 12%ного раствора гидроксида натрия (плотность 1, 131 г/мл). Определите, какое соединение образовалось в растворе и рассчитаете его массовую долю в этом растворе.
 Задача Какую массу гидрида лития нужно растворить в 100 мл воды, чтобы получить раствор с массовой долей гидроксида 5%?
Задача Какую массу гидрида лития нужно растворить в 100 мл воды, чтобы получить раствор с массовой долей гидроксида 5%?


