Строение атома и пер. закон.pptx
- Количество слайдов: 187
 ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ Лекция Строение атома. Периодический закон и периодическая система элементов • • • 1. История открытия строения атома. 2. Ядерная модель. 3. Распределение электронов в атоме. 4. Периодический закон, периодическая система. 6. Периодичность изменения химических свойств элементов. Лектор: Ирина Петровна Степанова, зав. кафедрой химии, доктор биологических наук, профессор
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ Лекция Строение атома. Периодический закон и периодическая система элементов • • • 1. История открытия строения атома. 2. Ядерная модель. 3. Распределение электронов в атоме. 4. Периодический закон, периодическая система. 6. Периодичность изменения химических свойств элементов. Лектор: Ирина Петровна Степанова, зав. кафедрой химии, доктор биологических наук, профессор
 Ученые древности о строении вещества Древнегреческий ученый Демокрит (2500 лет до нашей эры): Любое вещество состоит из мельчайших частиц. Долгое время считалось, что атом (от греч. неделимый) является неделимой частицей.
Ученые древности о строении вещества Древнегреческий ученый Демокрит (2500 лет до нашей эры): Любое вещество состоит из мельчайших частиц. Долгое время считалось, что атом (от греч. неделимый) является неделимой частицей.
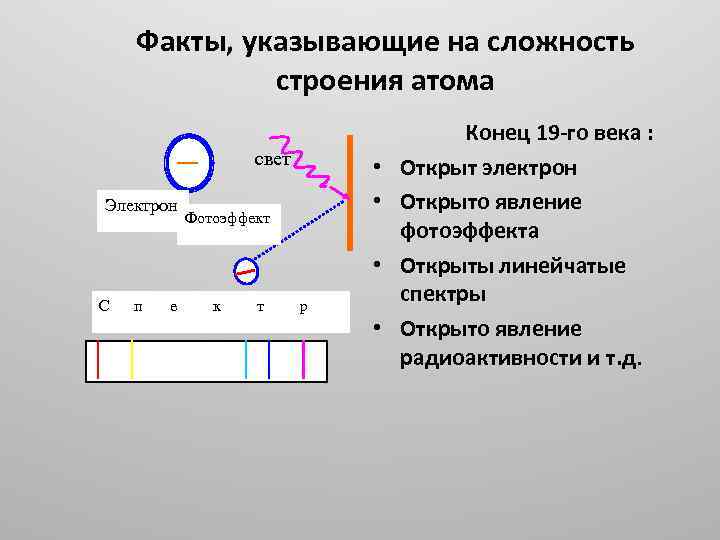 Факты, указывающие на сложность строения атома свет Электрон • • Фотоэффект • С п е к т р • Конец 19 го века : Открыт электрон Открыто явление фотоэффекта Открыты линейчатые спектры Открыто явление радиоактивности и т. д.
Факты, указывающие на сложность строения атома свет Электрон • • Фотоэффект • С п е к т р • Конец 19 го века : Открыт электрон Открыто явление фотоэффекта Открыты линейчатые спектры Открыто явление радиоактивности и т. д.
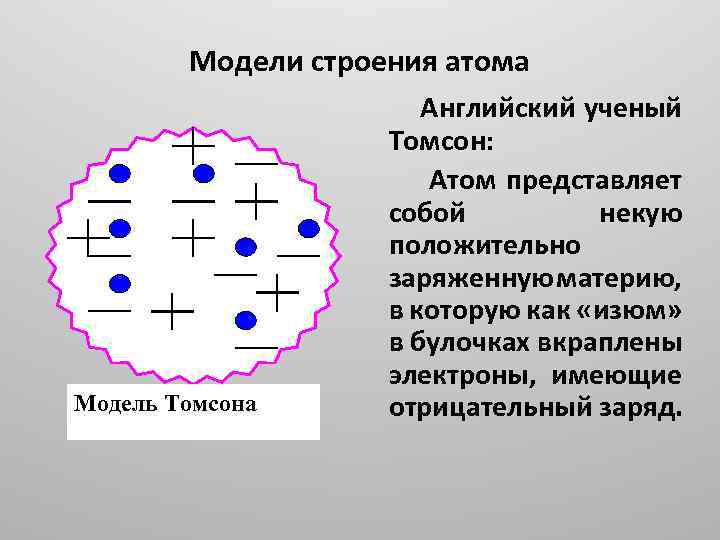 Модели строения атома Модель Томсона Английский ученый Томсон: Атом представляет собой некую положительно заряженную материю, в которую как «изюм» в булочках вкраплены электроны, имеющие отрицательный заряд.
Модели строения атома Модель Томсона Английский ученый Томсон: Атом представляет собой некую положительно заряженную материю, в которую как «изюм» в булочках вкраплены электроны, имеющие отрицательный заряд.
 Модель атома Резерфорда Английский физик Резерфорд впервые поставил опыт, позволивший установить строение атома. В 1906 г. зондировал атом с помощью α частиц. Эрнест Резерфорд (1871 – 1937)
Модель атома Резерфорда Английский физик Резерфорд впервые поставил опыт, позволивший установить строение атома. В 1906 г. зондировал атом с помощью α частиц. Эрнест Резерфорд (1871 – 1937)
 Опыт Резерфорда -частицы Светящийся экран Резерфорд направил узкий пучок -частиц на светящийся экран и видел, что светящиеся точки располагались кучно.
Опыт Резерфорда -частицы Светящийся экран Резерфорд направил узкий пучок -частиц на светящийся экран и видел, что светящиеся точки располагались кучно.
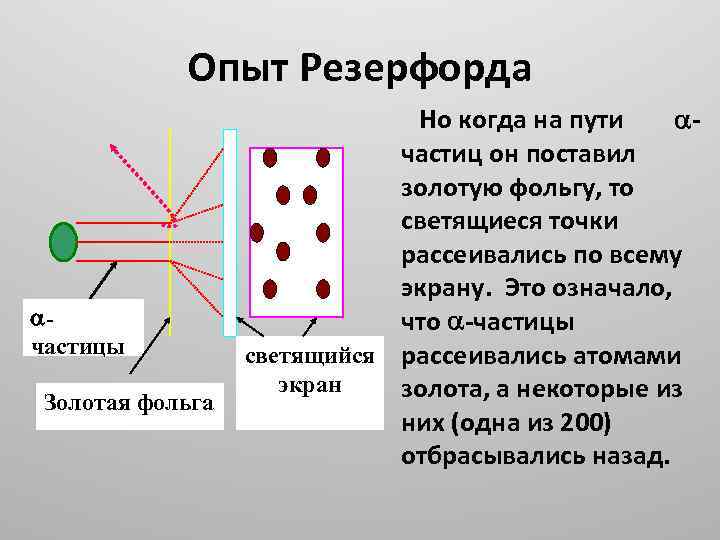 Опыт Резерфорда частицы Золотая фольга Но когда на пути частиц он поставил золотую фольгу, то светящиеся точки рассеивались по всему экрану. Это означало, что частицы светящийся рассеивались атомами экран золота, а некоторые из них (одна из 200) отбрасывались назад.
Опыт Резерфорда частицы Золотая фольга Но когда на пути частиц он поставил золотую фольгу, то светящиеся точки рассеивались по всему экрану. Это означало, что частицы светящийся рассеивались атомами экран золота, а некоторые из них (одна из 200) отбрасывались назад.
 Причины рассеивания частиц -частица Электрон, входящий в состав атома нет мог рассеивать частицы, так как масса частицы примерно в 8000 раз больше массы электрона. Значит частицы рассеивались положительным зарядом атома, в котором сосредоточена вся масса.
Причины рассеивания частиц -частица Электрон, входящий в состав атома нет мог рассеивать частицы, так как масса частицы примерно в 8000 раз больше массы электрона. Значит частицы рассеивались положительным зарядом атома, в котором сосредоточена вся масса.
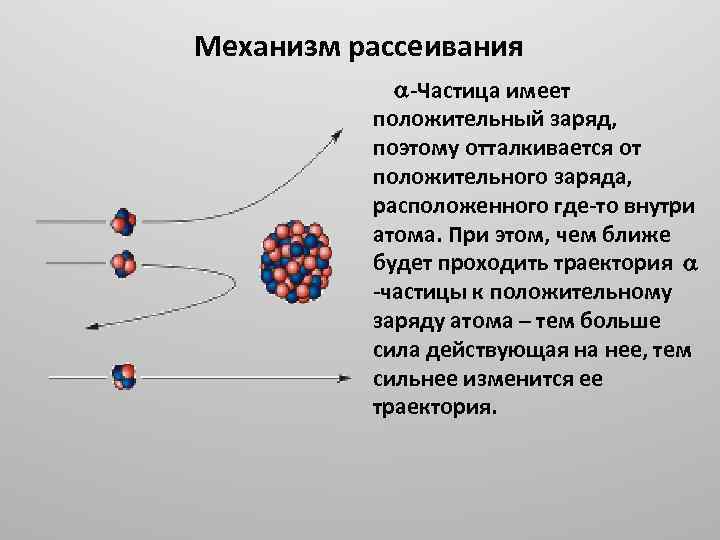 Механизм рассеивания Частица имеет положительный заряд, поэтому отталкивается от положительного заряда, расположенного где то внутри атома. При этом, чем ближе будет проходить траектория частицы к положительному заряду атома – тем больше сила действующая на нее, тем сильнее изменится ее траектория.
Механизм рассеивания Частица имеет положительный заряд, поэтому отталкивается от положительного заряда, расположенного где то внутри атома. При этом, чем ближе будет проходить траектория частицы к положительному заряду атома – тем больше сила действующая на нее, тем сильнее изменится ее траектория.
 Вывод из опыта Резерфорда Учитывая то, что из 2000 испущенных частиц только одна отбрасывалась назад Резерфорд сделал вывод, что положительный заряд в атоме занимает небольшое пространство, то есть в атоме есть положительно заряженное ядро, а электроны вращаются вокруг ядра.
Вывод из опыта Резерфорда Учитывая то, что из 2000 испущенных частиц только одна отбрасывалась назад Резерфорд сделал вывод, что положительный заряд в атоме занимает небольшое пространство, то есть в атоме есть положительно заряженное ядро, а электроны вращаются вокруг ядра.
 Планетарная модель строения атома Резерфорда Ядро В центре атома расположено положительно заряженное ядро, размер которого от 10 000 до 100 000 раз меньше размера атома, а по орбите вокруг ядра вращаются электроны. Заряд ядра по величине равен заряду всех электронов, поэтому атом нейтрален.
Планетарная модель строения атома Резерфорда Ядро В центре атома расположено положительно заряженное ядро, размер которого от 10 000 до 100 000 раз меньше размера атома, а по орбите вокруг ядра вращаются электроны. Заряд ядра по величине равен заряду всех электронов, поэтому атом нейтрален.
 Атом устойчивая микросистема элементарных частиц, состоящая из положительно заряженного ядра и электронов, движущихся в околоядерном пространстве.
Атом устойчивая микросистема элементарных частиц, состоящая из положительно заряженного ядра и электронов, движущихся в околоядерном пространстве.
 Строение атомного ядра Физики Д. Д. Иваненко и В. Гейзенберг предложили протонно-нейтронную модель ядра: ядра состоят из элементарных частиц двух сортов: протонов и нейтронов. Дмитрий Дмитриевич Иваненко (1904 -1994) Вернер Карл Гейзенберг (1901 -1976)
Строение атомного ядра Физики Д. Д. Иваненко и В. Гейзенберг предложили протонно-нейтронную модель ядра: ядра состоят из элементарных частиц двух сортов: протонов и нейтронов. Дмитрий Дмитриевич Иваненко (1904 -1994) Вернер Карл Гейзенберг (1901 -1976)
 Атом • Атом состоит из трёх видов частиц: 1. Электрон 2. Протон 3. Нейтрон
Атом • Атом состоит из трёх видов частиц: 1. Электрон 2. Протон 3. Нейтрон
 Элементарные частицы атома Частица поло жение Протон (p) ядро Нейтрон (n) ядро Электрон (е ) обо лочка заряд +1 0 1 масса (а. е. м. ) 1, 00728 1, 00867 0, 00055
Элементарные частицы атома Частица поло жение Протон (p) ядро Нейтрон (n) ядро Электрон (е ) обо лочка заряд +1 0 1 масса (а. е. м. ) 1, 00728 1, 00867 0, 00055
 Атомное ядро состоит из нуклонов: A=Z+N A – массовое число атома Z – заряд ядра (число протонов) N – число нейтронов
Атомное ядро состоит из нуклонов: A=Z+N A – массовое число атома Z – заряд ядра (число протонов) N – число нейтронов
 N=A Z А Z 27 АI 13 Э р=13; n= Аr – р= 14; ē =13.
N=A Z А Z 27 АI 13 Э р=13; n= Аr – р= 14; ē =13.
 Натрий 23 11 Протонов: 11 Нейтронов: 12 Электронов: 11 Na
Натрий 23 11 Протонов: 11 Нейтронов: 12 Электронов: 11 Na
 133 55 Cs В атоме цезия 55 протонов, 55 электронов, нейтронов: 133 – 55 = 78.
133 55 Cs В атоме цезия 55 протонов, 55 электронов, нейтронов: 133 – 55 = 78.
 Число протонов определяет заряд ядра и количество электронов в атоме (в ПС порядковый номер элемента). Порядковый номер эл. = число протонов Число протонов = число электронов Порядковый номер эл. = число электронов Нуклоны расположены на оболочках и подоболочках ядра и удерживаются ядерными силами.
Число протонов определяет заряд ядра и количество электронов в атоме (в ПС порядковый номер элемента). Порядковый номер эл. = число протонов Число протонов = число электронов Порядковый номер эл. = число электронов Нуклоны расположены на оболочках и подоболочках ядра и удерживаются ядерными силами.
 Изотопы атомы с различным массовым числом ядер, т. е. с различным числом нейтронов и одинаковым числом протонов. • Пример: 35 СI и 17 p=17 р=17 n=18 n=20 37 СI 17 изотопы
Изотопы атомы с различным массовым числом ядер, т. е. с различным числом нейтронов и одинаковым числом протонов. • Пример: 35 СI и 17 p=17 р=17 n=18 n=20 37 СI 17 изотопы
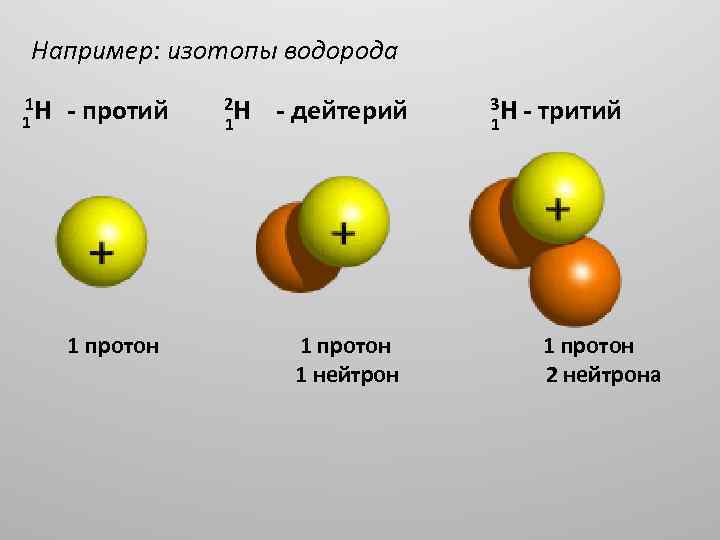 Например: изотопы водорода 1 H 1 протий 1 протон 2 H 1 дейтерий 1 протон 1 нейтрон 3 H 1 тритий 1 протон 2 нейтрона
Например: изотопы водорода 1 H 1 протий 1 протон 2 H 1 дейтерий 1 протон 1 нейтрон 3 H 1 тритий 1 протон 2 нейтрона
 Изотопы рения 186 75 Re Протоны: 75 Нейтроны: 111 Электроны: 75
Изотопы рения 186 75 Re Протоны: 75 Нейтроны: 111 Электроны: 75
 Изотопы рения 187 75 Re Протоны: 75 Нейтроны: 112 Электроны: 75
Изотопы рения 187 75 Re Протоны: 75 Нейтроны: 112 Электроны: 75
 Атомная масса элемента равна среднему значению масс его изотопов с учетом их распространенности в природе [w (х)%].
Атомная масса элемента равна среднему значению масс его изотопов с учетом их распространенности в природе [w (х)%].
 Атомная единица массы (а. е. м. ) • 1 а. е. м. равна массе одного протона.
Атомная единица массы (а. е. м. ) • 1 а. е. м. равна массе одного протона.
 Атомная единица массы (а. е. м. ) В 1 грамме 6 X 1023 или 600, 000, 00 0, 000 a. е. м. • (масса электрона в 2000 раз меньше, чем 1 а. е. м. ).
Атомная единица массы (а. е. м. ) В 1 грамме 6 X 1023 или 600, 000, 00 0, 000 a. е. м. • (масса электрона в 2000 раз меньше, чем 1 а. е. м. ).
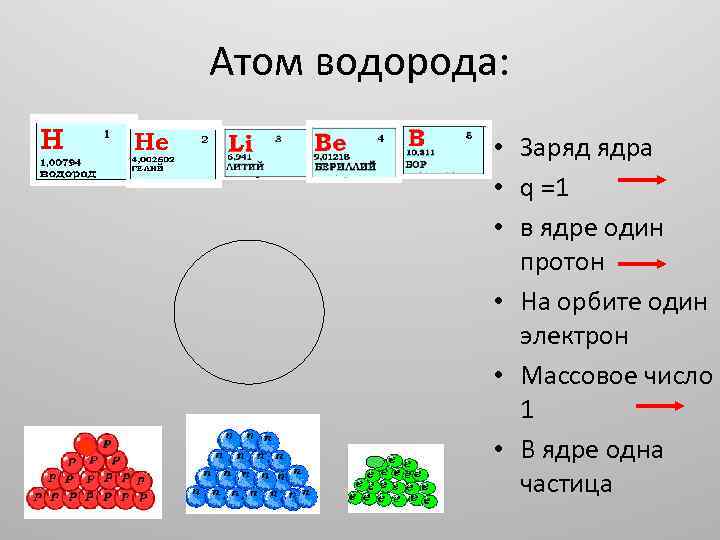 Атом водорода: • Заряд ядра • q =1 • в ядре один протон • На орбите один электрон • Массовое число 1 • В ядре одна частица
Атом водорода: • Заряд ядра • q =1 • в ядре один протон • На орбите один электрон • Массовое число 1 • В ядре одна частица
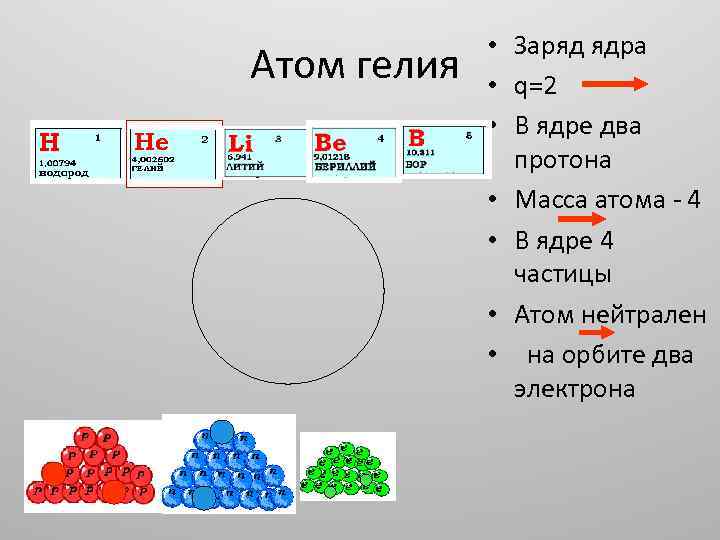 Атом гелия • Заряд ядра • q=2 • В ядре два протона • Масса атома - 4 • В ядре 4 частицы • Атом нейтрален • на орбите два электрона
Атом гелия • Заряд ядра • q=2 • В ядре два протона • Масса атома - 4 • В ядре 4 частицы • Атом нейтрален • на орбите два электрона
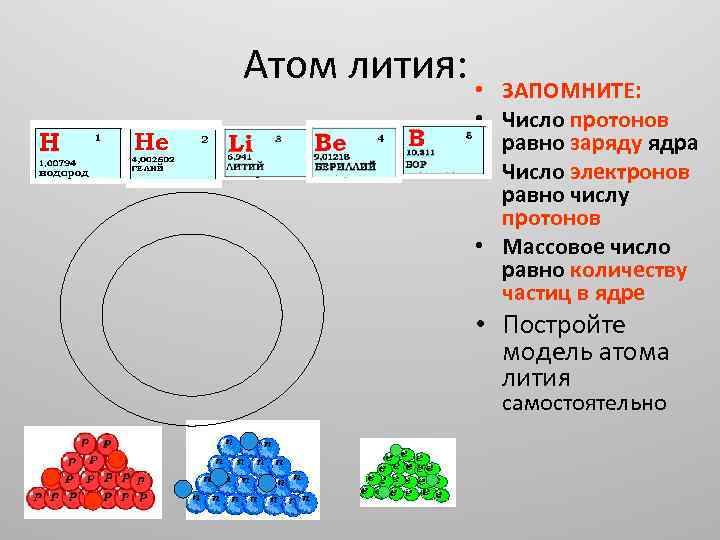 Атом лития: • ЗАПОМНИТЕ: • Число протонов равно заряду ядра • Число электронов равно числу протонов • Массовое число равно количеству частиц в ядре • Постройте модель атома лития самостоятельно
Атом лития: • ЗАПОМНИТЕ: • Число протонов равно заряду ядра • Число электронов равно числу протонов • Массовое число равно количеству частиц в ядре • Постройте модель атома лития самостоятельно
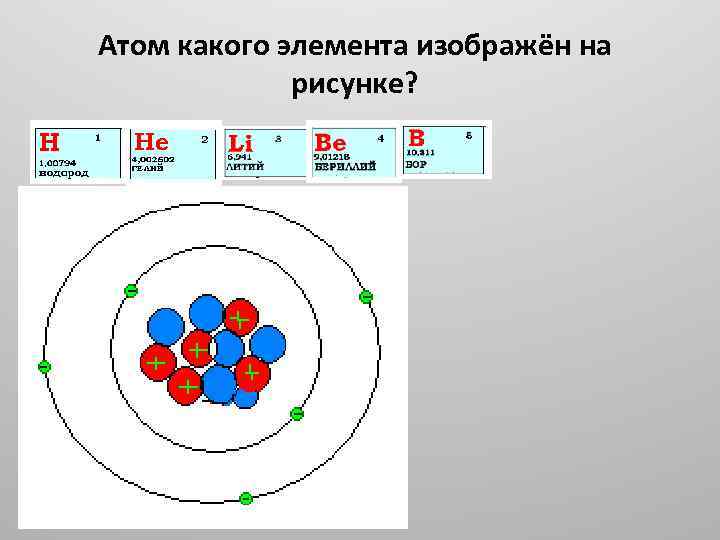 Атом какого элемента изображён на рисунке?
Атом какого элемента изображён на рисунке?
 Na - натрий: 11 протонов + + + - - -- - - +11 – 10 = +1 Na 0 - - 1 е → Na Ионы 11 электронов - 11 10 + Уменьшение числа электронов – образование положительно заряженных ионов
Na - натрий: 11 протонов + + + - - -- - - +11 – 10 = +1 Na 0 - - 1 е → Na Ионы 11 электронов - 11 10 + Уменьшение числа электронов – образование положительно заряженных ионов
 О - кислород: 8 протонов - + + + + + 8 электронов - - - +8 +8 – 10 = -2 0 - -- 10 8 2 - О + 2 е → О Увеличение числа электронов – образование отрицательно заряженных ионов
О - кислород: 8 протонов - + + + + + 8 электронов - - - +8 +8 – 10 = -2 0 - -- 10 8 2 - О + 2 е → О Увеличение числа электронов – образование отрицательно заряженных ионов
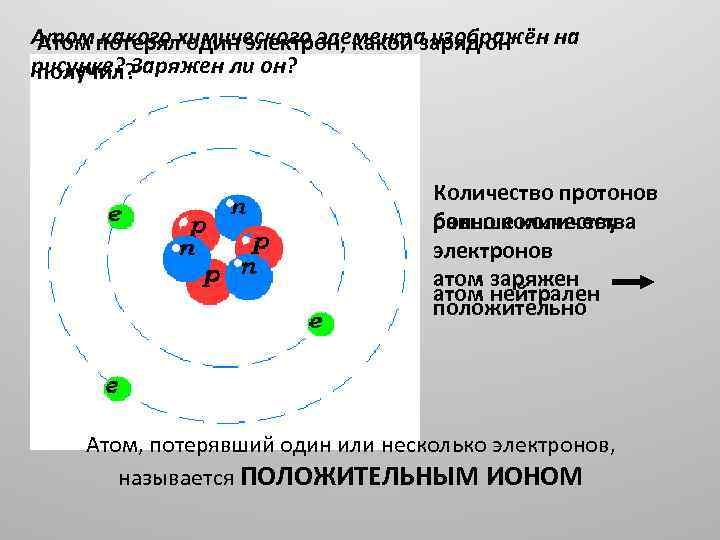 Атом потерялхимического элемента изображён на Атом какого один электрон, какой заряд он рисунке? Заряжен ли он? получил? Количество протонов больше количества равно количеству электронов атом заряжен атом нейтрален положительно Атом, потерявший один или несколько электронов, называется ПОЛОЖИТЕЛЬНЫМ ИОНОМ
Атом потерялхимического элемента изображён на Атом какого один электрон, какой заряд он рисунке? Заряжен ли он? получил? Количество протонов больше количества равно количеству электронов атом заряжен атом нейтрален положительно Атом, потерявший один или несколько электронов, называется ПОЛОЖИТЕЛЬНЫМ ИОНОМ
 Положительные и отрицательные ионы Элементы с 1 -3 электронами на последнем уровне (металлы) способны только отдавать электроны, превращаясь в положительно заряженные ионы. К + Са 2+ 3+ Аl K – 1 e → K + Al -3 e → Al 3+ 2+ Cu Fe 3+ - ион калия - ион алюминия
Положительные и отрицательные ионы Элементы с 1 -3 электронами на последнем уровне (металлы) способны только отдавать электроны, превращаясь в положительно заряженные ионы. К + Са 2+ 3+ Аl K – 1 e → K + Al -3 e → Al 3+ 2+ Cu Fe 3+ - ион калия - ион алюминия
 Положительные и отрицательные ионы Элементы с 4 -7 электронами (неметаллы) способны отдавать и принимать электроны, превращаясь в положительно или отрицательно заряженные ионы. - Cl S 2 - +6 S N -3 H + P Cl + 1 e → Cl - ион хлора - H -1 e → H водорода + - ион +5
Положительные и отрицательные ионы Элементы с 4 -7 электронами (неметаллы) способны отдавать и принимать электроны, превращаясь в положительно или отрицательно заряженные ионы. - Cl S 2 - +6 S N -3 H + P Cl + 1 e → Cl - ион хлора - H -1 e → H водорода + - ион +5
 Как образуется отрицательный ион? • Протон очень прочно связан с ядром, для его удаления потребовалась бы огромная энергия! Атом, захвативший один или несколько лишних электронов, называется отрицательным ионом
Как образуется отрицательный ион? • Протон очень прочно связан с ядром, для его удаления потребовалась бы огромная энергия! Атом, захвативший один или несколько лишних электронов, называется отрицательным ионом
 Какие частицы изображены на рисунках?
Какие частицы изображены на рисунках?
 Существенным шагом в развитии представлений о строении атома стала предложенная в 1913 г. Н. Бором теория, объединившая, по сути, ядерную модель атома с квантовой теорией света (Планк).
Существенным шагом в развитии представлений о строении атома стала предложенная в 1913 г. Н. Бором теория, объединившая, по сути, ядерную модель атома с квантовой теорией света (Планк).
 По строению атом похож… на Солнечную систему!
По строению атом похож… на Солнечную систему!
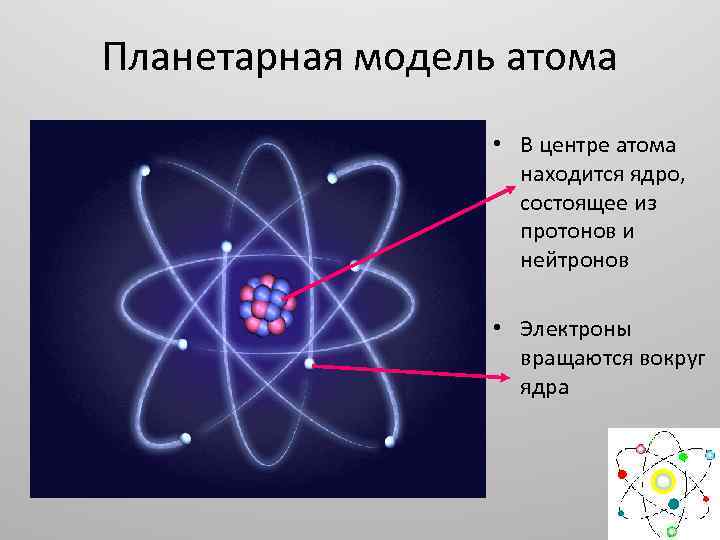 Планетарная модель атома • В центре атома находится ядро, состоящее из протонов и нейтронов • Электроны вращаются вокруг ядра
Планетарная модель атома • В центре атома находится ядро, состоящее из протонов и нейтронов • Электроны вращаются вокруг ядра
 Планетарная модель атома
Планетарная модель атома
 Упрощённая модель: • Химические свойства атома зависят от заряда его ядра. • Заряд ядра равен количеству протонов в нём и порядковому номеру элемента. • Количество электронов равно количеству протонов в ядре и порядковому номеру элемента.
Упрощённая модель: • Химические свойства атома зависят от заряда его ядра. • Заряд ядра равен количеству протонов в нём и порядковому номеру элемента. • Количество электронов равно количеству протонов в ядре и порядковому номеру элемента.
 Основные положения теории Бора 1) Электрон может вращаться вокруг ядра только по некоторым определенным круговым орбитам (стационарным орбитам). 2) Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
Основные положения теории Бора 1) Электрон может вращаться вокруг ядра только по некоторым определенным круговым орбитам (стационарным орбитам). 2) Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
 3) Если атом получает дополнительную порцию энергии, он переходит в возбужденное состояние, при этом электрон перемещается на более отдаленную орбиту. 4) Изменение энергии атома и излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую, расположенную ближе к ядру.
3) Если атом получает дополнительную порцию энергии, он переходит в возбужденное состояние, при этом электрон перемещается на более отдаленную орбиту. 4) Изменение энергии атома и излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую, расположенную ближе к ядру.
 Квантовая модель атома
Квантовая модель атома
 • Корпускулярно-волновые свойства электрона проявляется в том, что он, с одной стороны обладает свойствами частицы – имеет определенную массу покоя, с другой стороны – его движение напоминает волну с определенной амплитудой, длиной и т. д.
• Корпускулярно-волновые свойства электрона проявляется в том, что он, с одной стороны обладает свойствами частицы – имеет определенную массу покоя, с другой стороны – его движение напоминает волну с определенной амплитудой, длиной и т. д.
 Волновые свойства электрона Интерференция Дифракция
Волновые свойства электрона Интерференция Дифракция
 • Положение электрона характеризуется вероятностью пребывания частицы в конкретной области пространства. Область наиболее вероятного пребывания электрона в атоме называют атомной орбиталью – АО.
• Положение электрона характеризуется вероятностью пребывания частицы в конкретной области пространства. Область наиболее вероятного пребывания электрона в атоме называют атомной орбиталью – АО.
 Строение атома • Каждой АО соответствует область пространства с максимальной вероятностью нахождения электрона определённого размера, формы и ориентации, равноценная понятию электронного облака.
Строение атома • Каждой АО соответствует область пространства с максимальной вероятностью нахождения электрона определённого размера, формы и ориентации, равноценная понятию электронного облака.
 • Электронное облако не имеет чётких границ, в связи с этим введено понятие граничная поверхность, т. е. поверхность с равной электронной плотностью, ограничивающая объём, который включает 90% заряда и массы электрона. • Форма и размер граничной поверхности считается формой и размером электронного облака.
• Электронное облако не имеет чётких границ, в связи с этим введено понятие граничная поверхность, т. е. поверхность с равной электронной плотностью, ограничивающая объём, который включает 90% заряда и массы электрона. • Форма и размер граничной поверхности считается формой и размером электронного облака.

 S орбитали
S орбитали
 Три 2 p орбитали
Три 2 p орбитали
 Пять 3 d орбитали
Пять 3 d орбитали

 Распределение электронов в атоме • Электроны расположены на определенных электронных (энергетических) уровнях 1, 2, 3, 4 и т. д. Целое число n, обозначающее номер уровня, называется главным квантовым числом. Число энергетических уровней в атоме определяется № периода , в котором находится атом: 1 период один уровень 2 период два уровня и т. д.
Распределение электронов в атоме • Электроны расположены на определенных электронных (энергетических) уровнях 1, 2, 3, 4 и т. д. Целое число n, обозначающее номер уровня, называется главным квантовым числом. Число энергетических уровней в атоме определяется № периода , в котором находится атом: 1 период один уровень 2 период два уровня и т. д.
 Максимальное число электронов данного уровня n определяется формулой: N = 2 n 2 Т. о. на 1 ом уровне максимально может находиться 2 ē , на 2 ом 8 ē , на 3 ем 18 ē , на 4 ом – 32 ē и т. д.
Максимальное число электронов данного уровня n определяется формулой: N = 2 n 2 Т. о. на 1 ом уровне максимально может находиться 2 ē , на 2 ом 8 ē , на 3 ем 18 ē , на 4 ом – 32 ē и т. д.
 Каждый энергетический уровень содержит максимальное число электронов. Третий уровень содержит 18 e Четвертый уровень содержит 32 e В ядре находятся протоны и нейтроны Первый уровень содержит 2 e Второй уровень содержит 8 e
Каждый энергетический уровень содержит максимальное число электронов. Третий уровень содержит 18 e Четвертый уровень содержит 32 e В ядре находятся протоны и нейтроны Первый уровень содержит 2 e Второй уровень содержит 8 e
 12 6 С 6 pи 6 n находятся в ядре p+ = 6 no = 6 e- = 6
12 6 С 6 pи 6 n находятся в ядре p+ = 6 no = 6 e- = 6
 Элементы первого периода 1 1 2 3 4 5 6 7 0 H He 1 2
Элементы первого периода 1 1 2 3 4 5 6 7 0 H He 1 2
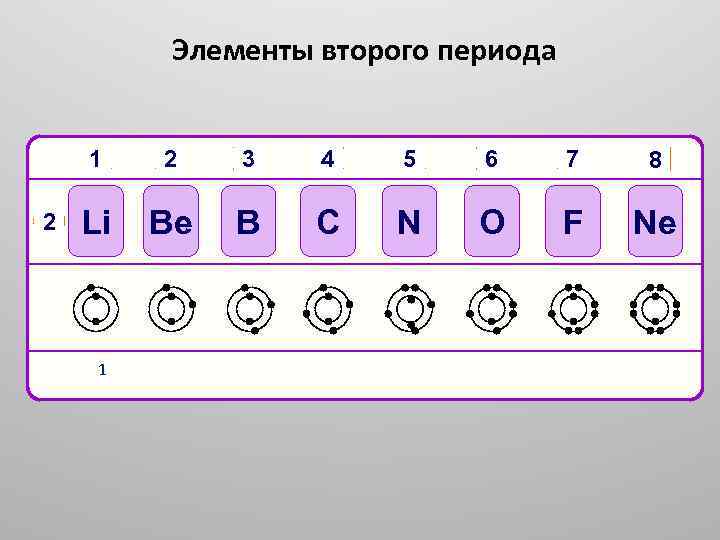 Элементы второго периода 1 2 2 3 4 5 6 7 8 Li Be B C N O F Ne 2, 1 2, 2 2, 3 2, 4 2, 5 2, 6 2, 7 2, 8
Элементы второго периода 1 2 2 3 4 5 6 7 8 Li Be B C N O F Ne 2, 1 2, 2 2, 3 2, 4 2, 5 2, 6 2, 7 2, 8
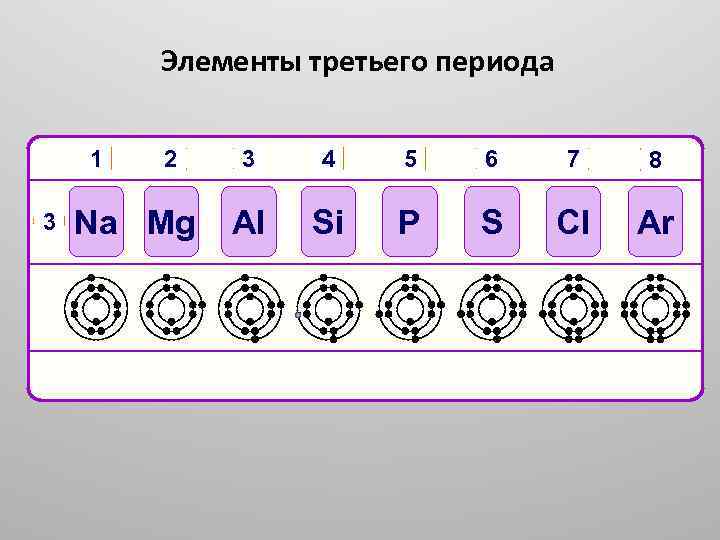 Элементы третьего периода 3 4 5 6 7 8 Na Mg Al Si P S Cl Ar 2, 8, 1 2, 8, 3 2, 8, 4 2, 8, 5 2, 8, 6 2, 8, 7 2, 8, 8 1 3 2 2, 8, 2
Элементы третьего периода 3 4 5 6 7 8 Na Mg Al Si P S Cl Ar 2, 8, 1 2, 8, 3 2, 8, 4 2, 8, 5 2, 8, 6 2, 8, 7 2, 8, 8 1 3 2 2, 8, 2
 • Энергетические уровни подразделяются на подуровни, число которых совпадает с № уровня: • 1 уровень один подуровень s • 2 уровень два подуровня s, р • 3 уровень три подуровня s, р, d • 4 уровень четыре подуровня s, р, d, f
• Энергетические уровни подразделяются на подуровни, число которых совпадает с № уровня: • 1 уровень один подуровень s • 2 уровень два подуровня s, р • 3 уровень три подуровня s, р, d • 4 уровень четыре подуровня s, р, d, f
 Подуровни состоят из орбиталей: • S одна орбиталь • Р –три орбитали • d– пять орбиталей • f – семь орбиталей • Для каждого значения n уровень содержит n 2 орбиталей.
Подуровни состоят из орбиталей: • S одна орбиталь • Р –три орбитали • d– пять орбиталей • f – семь орбиталей • Для каждого значения n уровень содержит n 2 орбиталей.
 • Атомную орбиталь обозначают с помощью ячейки Например: 1 s 2
• Атомную орбиталь обозначают с помощью ячейки Например: 1 s 2
 При заполнении АО действуют 3 принципа: 1. Правило Клечковского: при росте заряда ядра атома последовательное заполнение электронных орбиталей происходит по мере роста энергии орбитали: 1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p 6 s 4 f 5 d 6 p 7 s 5 f 6 d 7 p
При заполнении АО действуют 3 принципа: 1. Правило Клечковского: при росте заряда ядра атома последовательное заполнение электронных орбиталей происходит по мере роста энергии орбитали: 1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p 6 s 4 f 5 d 6 p 7 s 5 f 6 d 7 p


 2. Принцип Паули (или запрет Паули): в атоме не может быть двух электронов, с одинаковым набором всех энергетических характеристик. Основным следствием этого принципа является то, что на одной АО не может находиться более двух электронов. Состояние электронов одной орбитали отличается их спином. Принцип Паули определяет ёмкость уровня.
2. Принцип Паули (или запрет Паули): в атоме не может быть двух электронов, с одинаковым набором всех энергетических характеристик. Основным следствием этого принципа является то, что на одной АО не может находиться более двух электронов. Состояние электронов одной орбитали отличается их спином. Принцип Паули определяет ёмкость уровня.
 3. Правило Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально.
3. Правило Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально.
 Спин электрона характеризует собственный момент импульса и связанный с ним магнитный момент (т. е. вращение электрона вокруг оси по или против часовой стрелки), может принимать значения + 1/2 и 1/2.
Спин электрона характеризует собственный момент импульса и связанный с ним магнитный момент (т. е. вращение электрона вокруг оси по или против часовой стрелки), может принимать значения + 1/2 и 1/2.
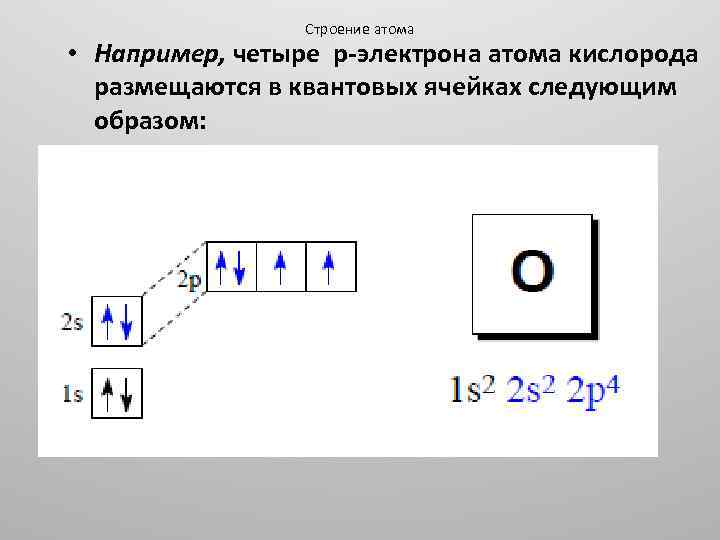 Строение атома • Например, четыре p электрона атома кислорода размещаются в квантовых ячейках следующим образом:
Строение атома • Например, четыре p электрона атома кислорода размещаются в квантовых ячейках следующим образом:
 Водород. Электронная формула 1 s 1 1 1 H Протоны: 1 Нейтроны: 0 Электроны: 1
Водород. Электронная формула 1 s 1 1 1 H Протоны: 1 Нейтроны: 0 Электроны: 1
 Водород
Водород
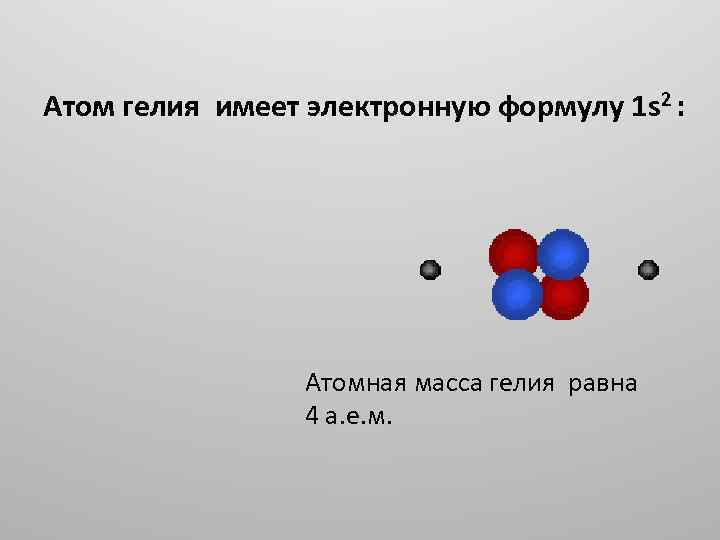 Атом гелия имеет электронную формулу 1 s 2 : Атомная масса гелия равна 4 а. е. м.
Атом гелия имеет электронную формулу 1 s 2 : Атомная масса гелия равна 4 а. е. м.
 s- и p-орбитали 1 s 2 s 2 p H: 1 s 1 n=1 l=0 ml = 0 n=2 l=0 ml = -1 n=2 l=0 ml = 1
s- и p-орбитали 1 s 2 s 2 p H: 1 s 1 n=1 l=0 ml = 0 n=2 l=0 ml = -1 n=2 l=0 ml = 1
 s- и p-орбитали 1 s 2 s 2 p He: 1 s 2 n=1 l=0 ml = 0 n=2 l=0 ml = -1 n=2 l=0 ml = 1
s- и p-орбитали 1 s 2 s 2 p He: 1 s 2 n=1 l=0 ml = 0 n=2 l=0 ml = -1 n=2 l=0 ml = 1
 s- и p-орбитали 1 s 2 s 2 p Li: 1 s 2 2 s 1 n=1 l=0 ml = 0 n=2 l=0 ml = -1 n=2 l=0 ml = 1
s- и p-орбитали 1 s 2 s 2 p Li: 1 s 2 2 s 1 n=1 l=0 ml = 0 n=2 l=0 ml = -1 n=2 l=0 ml = 1
 s- и p-орбитали 1 s 2 s 2 p Be: 1 s 2 2 s 2 n=1 l=0 ml = 0 n=2 l=0 ml = -1 n=2 l=0 ml = 1
s- и p-орбитали 1 s 2 s 2 p Be: 1 s 2 2 s 2 n=1 l=0 ml = 0 n=2 l=0 ml = -1 n=2 l=0 ml = 1
 s- и p-орбитали 1 s 2 s 2 p B: 1 s 2 2 s 22 p 1 Валентные электроны
s- и p-орбитали 1 s 2 s 2 p B: 1 s 2 2 s 22 p 1 Валентные электроны
 s- и p-орбитали 1 s C: 1 s 2 2 s 22 p 2 2 s 2 p
s- и p-орбитали 1 s C: 1 s 2 2 s 22 p 2 2 s 2 p
 s- и p-орбитали 1 s N: 1 s 2 2 s 22 p 3 O: 1 s 2 2 s 22 p 4 2 s 2 p
s- и p-орбитали 1 s N: 1 s 2 2 s 22 p 3 O: 1 s 2 2 s 22 p 4 2 s 2 p
 s- и p-орбитали 1 s F: 1 s 2 2 s 22 p 5 Ne: 1 s 2 2 s 22 p 6 2 s 2 p
s- и p-орбитали 1 s F: 1 s 2 2 s 22 p 5 Ne: 1 s 2 2 s 22 p 6 2 s 2 p
![s- и p-орбитали Na: 1 s 22 p 63 s 1 или [Ne]3 s s- и p-орбитали Na: 1 s 22 p 63 s 1 или [Ne]3 s](https://present5.com/presentation/1/138603543_331407230.pdf-img/138603543_331407230.pdf-85.jpg) s- и p-орбитали Na: 1 s 22 p 63 s 1 или [Ne]3 s 1 P: [Ne]3 s 23 p 3 Mg: 1 s 22 p 63 s 2 или [Ne]3 s 2 Ar: [Ne]3 s 23 p 6
s- и p-орбитали Na: 1 s 22 p 63 s 1 или [Ne]3 s 1 P: [Ne]3 s 23 p 3 Mg: 1 s 22 p 63 s 2 или [Ne]3 s 2 Ar: [Ne]3 s 23 p 6
 d-орбитали K: 1 s 22 p 63 s 23 p 64 s 1 или [Ar]4 s 1 Co: [Ar]4 s 23 d 7 Ca: [Ar]4 s 2 Cu: [Ar]4 s 13 d 10 Sc: [Ar]4 s 23 d 1 Zn: [Ar]4 s 23 d 10 V: [Ar]4 s 23 d 3 Ga: [Ar]4 s 23 d 104 p 1 Cr: [Ar]4 s 13 d 5 Kr: [Ar]4 s 23 d 104 p 6
d-орбитали K: 1 s 22 p 63 s 23 p 64 s 1 или [Ar]4 s 1 Co: [Ar]4 s 23 d 7 Ca: [Ar]4 s 2 Cu: [Ar]4 s 13 d 10 Sc: [Ar]4 s 23 d 1 Zn: [Ar]4 s 23 d 10 V: [Ar]4 s 23 d 3 Ga: [Ar]4 s 23 d 104 p 1 Cr: [Ar]4 s 13 d 5 Kr: [Ar]4 s 23 d 104 p 6
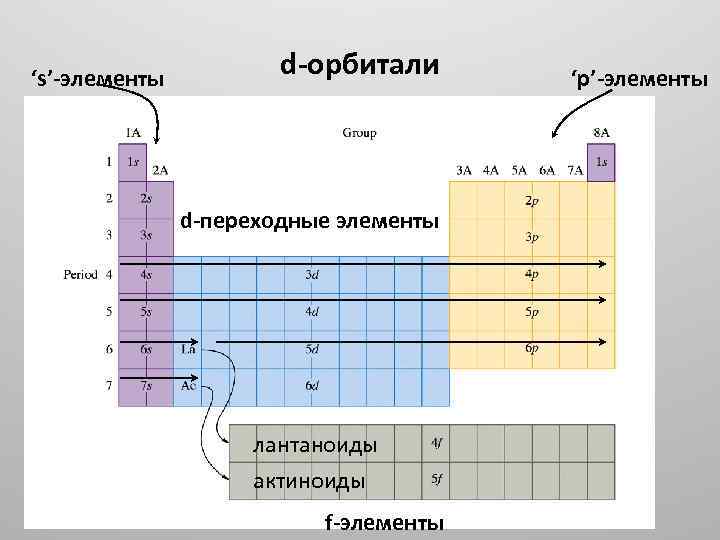 ‘s’ элементы d орбитали d переходные элементы лантаноиды aктиноиды f элементы ‘p’ элементы
‘s’ элементы d орбитали d переходные элементы лантаноиды aктиноиды f элементы ‘p’ элементы
 Электронные конфигурации Zr: 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 2 или [Kr]5 s 24 d 2 Te: 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 4 или [Kr]5 s 24 d 105 p 4
Электронные конфигурации Zr: 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 2 или [Kr]5 s 24 d 2 Te: 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 4 или [Kr]5 s 24 d 105 p 4
 • Принадлежность элемента к электронному семейству определяется характером заполнения энергетических подуровней: • s элементы – заполнение внешнего s – подуровня: Li 1 s 2 2 s 1 • s элементы являются активными металлами, характерные степени окисления которых численно равны количеству электронов на последнем уровне. • +1 для щелочных металлов и +2 для элементов второй группы.
• Принадлежность элемента к электронному семейству определяется характером заполнения энергетических подуровней: • s элементы – заполнение внешнего s – подуровня: Li 1 s 2 2 s 1 • s элементы являются активными металлами, характерные степени окисления которых численно равны количеству электронов на последнем уровне. • +1 для щелочных металлов и +2 для элементов второй группы.
 S элементы H 1 1 Водород Элемент первого периода 1 А группа 1 валентный электрон
S элементы H 1 1 Водород Элемент первого периода 1 А группа 1 валентный электрон
 S элементы 9 4 Be Бериллий Элемент второго периода 2 А группа 2 валентных электрона
S элементы 9 4 Be Бериллий Элемент второго периода 2 А группа 2 валентных электрона
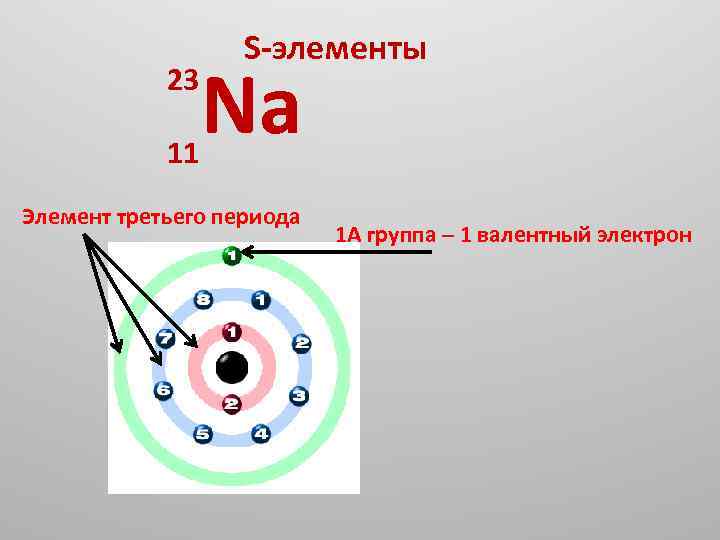 23 11 S элементы Na Элемент третьего периода 1 А группа – 1 валентный электрон
23 11 S элементы Na Элемент третьего периода 1 А группа – 1 валентный электрон
 S элементы 39 19 K Элемент четвертого периода 1 А группа = 1 валентный электрон
S элементы 39 19 K Элемент четвертого периода 1 А группа = 1 валентный электрон
 р Элементы – электроны заполняют внешний p подуровень. • Например: F 1 s 2 2 p 5 Элементы от В до Ne включительно образуют первую серию p элементов. Это элементы главных подгрупп.
р Элементы – электроны заполняют внешний p подуровень. • Например: F 1 s 2 2 p 5 Элементы от В до Ne включительно образуют первую серию p элементов. Это элементы главных подгрупп.
 12 6 C p элементы Элемент второго периода 4 А группа = 4 валентных электрона
12 6 C p элементы Элемент второго периода 4 А группа = 4 валентных электрона
 p элементы 20 10 Ne Элемент второго периода 8 А группа = 8 валентных электронов
p элементы 20 10 Ne Элемент второго периода 8 А группа = 8 валентных электронов
 p элементы 32 16 S Элемент третьего периода 6 А группа = 6 валентных электронов
p элементы 32 16 S Элемент третьего периода 6 А группа = 6 валентных электронов
 Максимальная валентность элементов главных подгрупп, как правило, совпадает с номером группы.
Максимальная валентность элементов главных подгрупп, как правило, совпадает с номером группы.
 d Элементы – электроны заполняют предвнешний d подуровень. • Заполнение электронами 3 d орбиталей начинается у атома скандия и заканчивается у цинка это элементы d семейства 4 го периода. Например: V 1 s 22 p 63 s 23 p 64 s 23 d 3 d Элементы занимают побочные подгруппы.
d Элементы – электроны заполняют предвнешний d подуровень. • Заполнение электронами 3 d орбиталей начинается у атома скандия и заканчивается у цинка это элементы d семейства 4 го периода. Например: V 1 s 22 p 63 s 23 p 64 s 23 d 3 d Элементы занимают побочные подгруппы.
 f Элементы – идет заполнение f подуровня второго снаружи уровня. • Например: Nd 1 s 22 p 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 10 5 p 6 6 s 2 4 f 4 • Это элементы семейств лантаноидов и актиноидов.
f Элементы – идет заполнение f подуровня второго снаружи уровня. • Например: Nd 1 s 22 p 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 10 5 p 6 6 s 2 4 f 4 • Это элементы семейств лантаноидов и актиноидов.
 Проскок электрона (Cr, Сu) Пример: z = 24; Cr Ожидаемая: 1 s 22 p 63 s 23 p 64 s 23 d 4 Действительная: 1 s 22 p 63 s 23 p 64 s 13 d 5
Проскок электрона (Cr, Сu) Пример: z = 24; Cr Ожидаемая: 1 s 22 p 63 s 23 p 64 s 23 d 4 Действительная: 1 s 22 p 63 s 23 p 64 s 13 d 5
 Электронная конфигурация внешнего уровня для элементов s и р семейств определяет валентность атома как число неспаренных электронов. • Эти электроны участвуют в образовании общей поделенной электронной пары химической связи при образовании соединения атома.
Электронная конфигурация внешнего уровня для элементов s и р семейств определяет валентность атома как число неспаренных электронов. • Эти электроны участвуют в образовании общей поделенной электронной пары химической связи при образовании соединения атома.
 • Если на валентных энергетических уровнях имеются вакантные АО, то при возбуждении атома становится возможным «распаривание» валентных электронов, то есть их переход на свободные орбитали того же уровня. • При этом «распаривание» и перемещение происходит последовательно по одному электрону, т. е. возможно несколько возбуждённых состояний. Возбуждение увеличивает валентное состояние атома (число его неспаренных электронов).
• Если на валентных энергетических уровнях имеются вакантные АО, то при возбуждении атома становится возможным «распаривание» валентных электронов, то есть их переход на свободные орбитали того же уровня. • При этом «распаривание» и перемещение происходит последовательно по одному электрону, т. е. возможно несколько возбуждённых состояний. Возбуждение увеличивает валентное состояние атома (число его неспаренных электронов).
 Строение атома • Пример: С 1 s 22 p 2 – основное электронное состояние; валентность равна II. • С* 1 s 22 s 12 p 3 возбужденное состояние атома; валентность равна IV.
Строение атома • Пример: С 1 s 22 p 2 – основное электронное состояние; валентность равна II. • С* 1 s 22 s 12 p 3 возбужденное состояние атома; валентность равна IV.
 Валентность определяется валентными электронами внешнего уровня в основном и возбужденном состояниях атома, поэтому высшая валентность элементов главных подгрупп равна номеру группы.
Валентность определяется валентными электронами внешнего уровня в основном и возбужденном состояниях атома, поэтому высшая валентность элементов главных подгрупп равна номеру группы.
 Валентные электроны
Валентные электроны
 ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА. ПЕРИОДИЧЕСКАЯ СИСТЕМА
ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА. ПЕРИОДИЧЕСКАЯ СИСТЕМА
 Д. И. Менделеев, сопоставляя свойства различных элементов и их соединений, обнаружил систематическую повторяемость этих свойств при увеличении атомной массы элемента (1869 г. ).
Д. И. Менделеев, сопоставляя свойства различных элементов и их соединений, обнаружил систематическую повторяемость этих свойств при увеличении атомной массы элемента (1869 г. ).
 • 1. Элементы, расположенные по возрастанию их атомного веса, представляют явственную периодичность свойств; • 2. Сходные по свойствам элементы имеют или близкие атомные веса (Os, Ir, Pt), или последовательно и однообразно увеличивающиеся (K, Rb, Cs); • 3. Сопоставление элементов или их групп по величине атомного веса отвечает их т. н. валентности;
• 1. Элементы, расположенные по возрастанию их атомного веса, представляют явственную периодичность свойств; • 2. Сходные по свойствам элементы имеют или близкие атомные веса (Os, Ir, Pt), или последовательно и однообразно увеличивающиеся (K, Rb, Cs); • 3. Сопоставление элементов или их групп по величине атомного веса отвечает их т. н. валентности;
 • 4. Элементы с малыми атомными весами имеют наиболее резко выраженные свойства, поэтому они являются типическими элементами; • 5. Величина атомного веса элемента может быть иногда исправлена, если знать аналоги данного элемента; • 6. Следует ожидать открытия ещё многих неизвестных элементов, например, сходных с Al или Si, с паем (атомной массой) 65 75.
• 4. Элементы с малыми атомными весами имеют наиболее резко выраженные свойства, поэтому они являются типическими элементами; • 5. Величина атомного веса элемента может быть иногда исправлена, если знать аналоги данного элемента; • 6. Следует ожидать открытия ещё многих неизвестных элементов, например, сходных с Al или Si, с паем (атомной массой) 65 75.
 Все известные в то время элементы он представил в виде таблицы.
Все известные в то время элементы он представил в виде таблицы.
 Периодическая система Д. И. Менделеева
Периодическая система Д. И. Менделеева
 Д. И. Менделеев
Д. И. Менделеев

 Современная формулировка периодического закона элементов Д. И. Менделеева: Свойства элементов и их однотипных соединений находятся в периодической зависимости от заряда атомных ядер элементов.
Современная формулировка периодического закона элементов Д. И. Менделеева: Свойства элементов и их однотипных соединений находятся в периодической зависимости от заряда атомных ядер элементов.
 • Теоретические выводы на основе сравнения электронных конфигураций атомов: 1. Строение внешней оболочки атома является периодической функцией зарядового числа атома Z. 2. Химические свойства элементов находятся в периодической зависимости от заряда ядра (поскольку химические свойства атома определяются строением внешней оболочки атома).
• Теоретические выводы на основе сравнения электронных конфигураций атомов: 1. Строение внешней оболочки атома является периодической функцией зарядового числа атома Z. 2. Химические свойства элементов находятся в периодической зависимости от заряда ядра (поскольку химические свойства атома определяются строением внешней оболочки атома).
 3. Номер периода в системе элементов Д. И. Менделеева равен номеру n энергетического уровня внешних n орбиталей заполняемых в этом , периоде. • Таким образом, по электронной формуле внешней оболочке атома можно определить, к какому периоду относится элемент, если даже о свойствах этого элемента ничего не известно.
3. Номер периода в системе элементов Д. И. Менделеева равен номеру n энергетического уровня внешних n орбиталей заполняемых в этом , периоде. • Таким образом, по электронной формуле внешней оболочке атома можно определить, к какому периоду относится элемент, если даже о свойствах этого элемента ничего не известно.
 4. Число элементов в периоде, т. е. его длина, равно удвоенному числу внешних орбиталей, заполняемых в этом периоде. 5. В одну группу периодической системы входят элементы с однотипной электронной конфигурацией внешней оболочки атомов.
4. Число элементов в периоде, т. е. его длина, равно удвоенному числу внешних орбиталей, заполняемых в этом периоде. 5. В одну группу периодической системы входят элементы с однотипной электронной конфигурацией внешней оболочки атомов.

 Период горизонтальная последовательность элементов, атомы которых имеют равное число энергетических уровней, частично или полностью заполненных электронами
Период горизонтальная последовательность элементов, атомы которых имеют равное число энергетических уровней, частично или полностью заполненных электронами
 Периоды 1 2 3 4 5 6 7
Периоды 1 2 3 4 5 6 7
 Периоды 1 ый Период = 1 Подуровень 2 ой Период = 2 Подуровня 3 ий Период = 3 Подуровня 4 ый Период = 4 Подуровня
Периоды 1 ый Период = 1 Подуровень 2 ой Период = 2 Подуровня 3 ий Период = 3 Подуровня 4 ый Период = 4 Подуровня
 Короткие периоды • 1 период (n=1): 2 элемента (1 s 1 -2) • 2 период (n=2): 8 элементов (2 s 1 -22 p 1 -6) • 3 период (n=3): 8 элементов (3 s 1 -23 p 1 -6 3 d 0 )
Короткие периоды • 1 период (n=1): 2 элемента (1 s 1 -2) • 2 период (n=2): 8 элементов (2 s 1 -22 p 1 -6) • 3 период (n=3): 8 элементов (3 s 1 -23 p 1 -6 3 d 0 )
 Длинные периоды: • 4 период (n=4): 18 элементов (4 s 1 -23 d 1 -104 p 1 -6) • 5 период (n=5): 18 элементов (5 s 24 d 105 p 6) • 6 период (n=6): 32 элемента (6 s 24 f 145 d 106 p 6) • 7 период (n=7): 32 элемента (7 s 25 f 146 d 107 p 6), незавершенный
Длинные периоды: • 4 период (n=4): 18 элементов (4 s 1 -23 d 1 -104 p 1 -6) • 5 период (n=5): 18 элементов (5 s 24 d 105 p 6) • 6 период (n=6): 32 элемента (6 s 24 f 145 d 106 p 6) • 7 период (n=7): 32 элемента (7 s 25 f 146 d 107 p 6), незавершенный
 Группа вертикальная последовательность элементов с однотипной электронной конфигурацией атомов, равным числом внешних электронов, одинаковой max валентностью и похожими химическими свойствами.
Группа вертикальная последовательность элементов с однотипной электронной конфигурацией атомов, равным числом внешних электронов, одинаковой max валентностью и похожими химическими свойствами.
 Расположение электронов 20 первых элементов 1 2 3 4 5 6 7 8 2 1 1 2 2, 1 2, 2 2, 3 2, 4 2, 5 2, 6 2, 7 2, 8 3 2, 8, 1 2, 8, 2 2, 8, 3 2, 8, 4 2, 8, 5 2, 8, 6 2, 8, 7 2, 8, 8 4 2, 8, 8, 1 2, 8, 8, 2
Расположение электронов 20 первых элементов 1 2 3 4 5 6 7 8 2 1 1 2 2, 1 2, 2 2, 3 2, 4 2, 5 2, 6 2, 7 2, 8 3 2, 8, 1 2, 8, 2 2, 8, 3 2, 8, 4 2, 8, 5 2, 8, 6 2, 8, 7 2, 8, 8 4 2, 8, 8, 1 2, 8, 8, 2
 • Общие электронные формулы валентного уровня в группах А: • 1 А группа ns 1 щелочные металлы • 2 А группа ns 2 • 3 А группа ns 2 np 1 • 4 А группа ns 2 np 2 • 5 А группа ns 2 np 3 • 6 А группа ns 2 np 4 • 7 А группа ns 2 np 5 - галогены • 8 А группа ns 2 np 6 - инертные газы
• Общие электронные формулы валентного уровня в группах А: • 1 А группа ns 1 щелочные металлы • 2 А группа ns 2 • 3 А группа ns 2 np 1 • 4 А группа ns 2 np 2 • 5 А группа ns 2 np 3 • 6 А группа ns 2 np 4 • 7 А группа ns 2 np 5 - галогены • 8 А группа ns 2 np 6 - инертные газы
 Группы IA IIB IIA VA 128
Группы IA IIB IIA VA 128
 1 2 Группы 3 4 5 6 7 8
1 2 Группы 3 4 5 6 7 8
 8 A 1 A 2 A 3 A 4 A 5 A 6 A 7 A
8 A 1 A 2 A 3 A 4 A 5 A 6 A 7 A
 8 A группа – инертные газы Группа 7 A - галогены
8 A группа – инертные газы Группа 7 A - галогены
 Группы u Лантоноиды u Актиноиды
Группы u Лантоноиды u Актиноиды
 1 A группа – щелочные металлы (но не H) 2 A группа (Ca, Sr, Ba – щелочноземельные металлы) H
1 A группа – щелочные металлы (но не H) 2 A группа (Ca, Sr, Ba – щелочноземельные металлы) H
 H Li 1 3 Na 11 K 19 Rb 37 Cs 55 Fr 87 1 s 1 1 s 22 s 22 p 63 s 1 Электронная конфигурация щелочных металлов 1 s 22 p 63 s 23 p 64 s 1 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 10 5 p 66 s 1 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 66 s 24 f 145 d 106 p 67 s 1
H Li 1 3 Na 11 K 19 Rb 37 Cs 55 Fr 87 1 s 1 1 s 22 s 22 p 63 s 1 Электронная конфигурация щелочных металлов 1 s 22 p 63 s 23 p 64 s 1 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 10 5 p 66 s 1 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 66 s 24 f 145 d 106 p 67 s 1
 s 1 Элементы s блока s 2 He
s 1 Элементы s блока s 2 He
 Переходные металлы – d блок Проскок электрона d 1 d 2 d 3 s 1 d 5 d 6 d 7 d 8 d 10
Переходные металлы – d блок Проскок электрона d 1 d 2 d 3 s 1 d 5 d 6 d 7 d 8 d 10
 P блок p 1 p 2 p 3 p 4 p 5 p 6
P блок p 1 p 2 p 3 p 4 p 5 p 6
 F блок f 1 f 2 f 3 f 4 f 5 f 6 f 7 f 8 f 9 f 10 f 11 f 12 f 1 3 f 14
F блок f 1 f 2 f 3 f 4 f 5 f 6 f 7 f 8 f 9 f 10 f 11 f 12 f 1 3 f 14
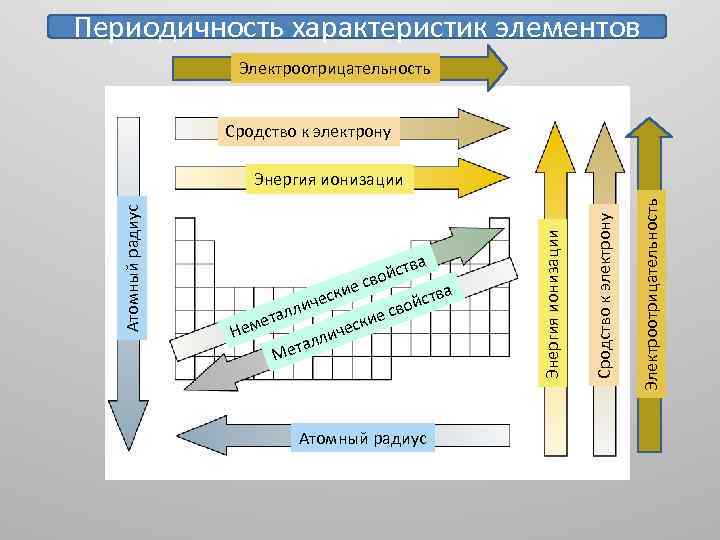
 • • • Периодичность характеристик элементов: атомные и ионные радиусы энергия ионизации сродство к электрону электроотрицательность валентность элементов
• • • Периодичность характеристик элементов: атомные и ионные радиусы энергия ионизации сродство к электрону электроотрицательность валентность элементов
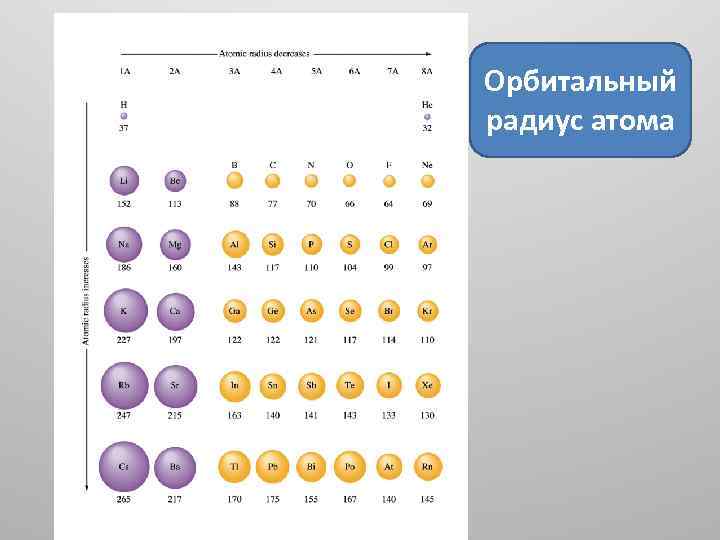
 1. Орбитальный радиус атома (иона) – это расстояние от ядра до максимума электронной плотности наиболее удаленной орбитали этого атома, нм. • В периодах слева направо радиус атома уменьшается. • В группах сверху вниз радиус атома растет.
1. Орбитальный радиус атома (иона) – это расстояние от ядра до максимума электронной плотности наиболее удаленной орбитали этого атома, нм. • В периодах слева направо радиус атома уменьшается. • В группах сверху вниз радиус атома растет.
 Орбитальный атомный радиус
Орбитальный атомный радиус
 Орбитальный радиус атома Радиус уменьшается Радиус увеличивается
Орбитальный радиус атома Радиус уменьшается Радиус увеличивается
 Орбитальный радиус атома
Орбитальный радиус атома
 Орбитальный атомный радиус H Li Na K Rb
Орбитальный атомный радиус H Li Na K Rb
 Орбитальный атомный радиус Na Mg Al Si P Cl Ar S
Орбитальный атомный радиус Na Mg Al Si P Cl Ar S
 Rb K Атомный радиус Период 2 Na Li Kr Ar Ne H 3 10 Порядковый номер
Rb K Атомный радиус Период 2 Na Li Kr Ar Ne H 3 10 Порядковый номер
 Превращение атома в катион – приводит к резкому уменьшению орбитального радиуса. Превращение атома в анион почти не изменяет орбитального радиуса. R кат < Rан Cl+ < Cl– 0, 099 0, 181 нм
Превращение атома в катион – приводит к резкому уменьшению орбитального радиуса. Превращение атома в анион почти не изменяет орбитального радиуса. R кат < Rан Cl+ < Cl– 0, 099 0, 181 нм
 Орбитальный ионный радиус Li 1+ Na 1+ K 1+ Rb 1+ Cs 1+
Орбитальный ионный радиус Li 1+ Na 1+ K 1+ Rb 1+ Cs 1+
 Орбитальный ионный радиус Al 3+ 13 Mg 2+ 1+ Na Ne 12 11 10 F 19 2 O 8 N 37
Орбитальный ионный радиус Al 3+ 13 Mg 2+ 1+ Na Ne 12 11 10 F 19 2 O 8 N 37
 Орбитальный ионный радиус Li 1+ Be B 3+ 2+ C 4+ N 3 - O 2 - F 1 -
Орбитальный ионный радиус Li 1+ Be B 3+ 2+ C 4+ N 3 - O 2 - F 1 -
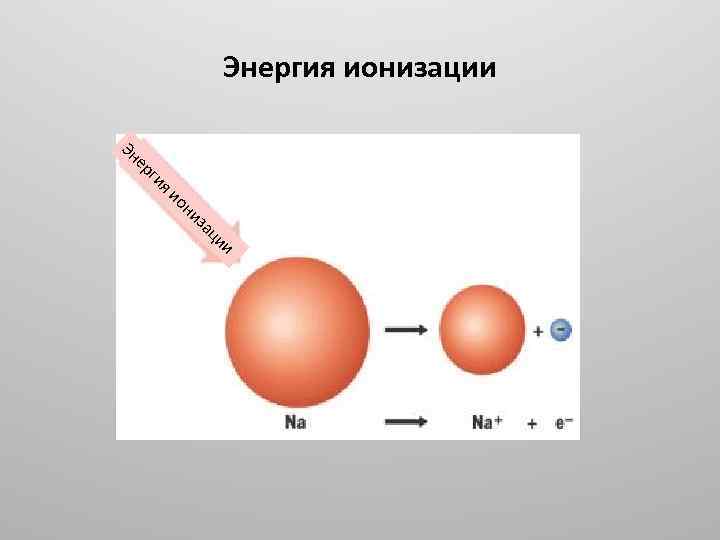
 2. Энергия ионизации – это энергия, необходимая для отрыва электрона от атома и превращение атома в положительно заряженный ион Э – е = Э+, Еион [к. Дж/моль]
2. Энергия ионизации – это энергия, необходимая для отрыва электрона от атома и превращение атома в положительно заряженный ион Э – е = Э+, Еион [к. Дж/моль]
 Энергия ионизации Эн ер ги яи он из ац ии
Энергия ионизации Эн ер ги яи он из ац ии
 Энергия отрыва каждого последующего электрона больше, чем предыдущего. С ростом радиуса энергия ионизации снижается.
Энергия отрыва каждого последующего электрона больше, чем предыдущего. С ростом радиуса энергия ионизации снижается.
 Энергия ионизации He H Порядковый номер
Энергия ионизации He H Порядковый номер
 Энергия ионизации He H Li Порядковый номер
Энергия ионизации He H Li Порядковый номер
 Энергия ионизации He H Be Li Порядковый номер
Энергия ионизации He H Be Li Порядковый номер
 Энергия ионизация He H Be Li B Порядковый номер
Энергия ионизация He H Be Li B Порядковый номер
 Энергия ионизации He H C Be Li B Порядковый номер
Энергия ионизации He H C Be Li B Порядковый номер
 Энергия ионизации He N H C Be Li B Порядковый номер
Энергия ионизации He N H C Be Li B Порядковый номер
 Энергия ионизация He N H C O Be Li B Порядковый номер
Энергия ионизация He N H C O Be Li B Порядковый номер
 Энергия ионизация He N F H C O Be Li B Порядковый номер
Энергия ионизация He N F H C O Be Li B Порядковый номер
 Энергия ионизации He Ne N F H C O Be Li B Порядковый номер
Энергия ионизации He Ne N F H C O Be Li B Порядковый номер
 Энергия ионизации He Ne N F H C O Be Li B Порядковый номер
Энергия ионизации He Ne N F H C O Be Li B Порядковый номер
 Ne Энергия ионизации He N F H C O Be Li B Na Порядковый номер
Ne Энергия ионизации He N F H C O Be Li B Na Порядковый номер
 Порядковый номер Энергия ионизация
Порядковый номер Энергия ионизация
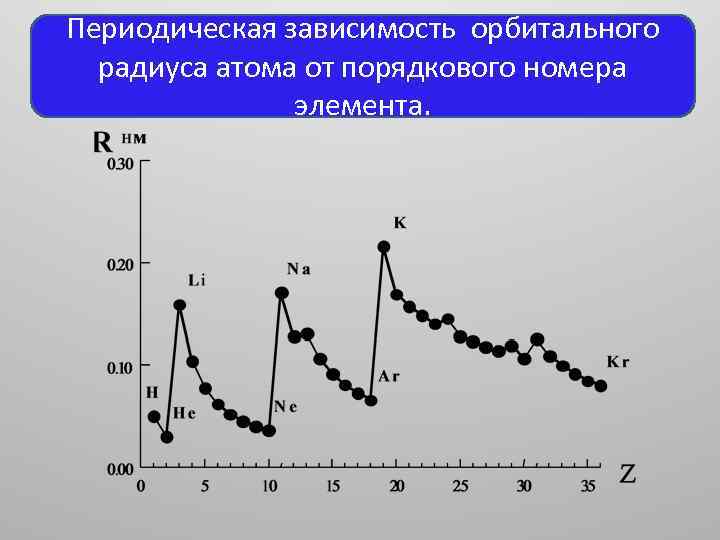 Периодическая зависимость орбитального радиуса атома от порядкового номера элемента.
Периодическая зависимость орбитального радиуса атома от порядкового номера элемента.
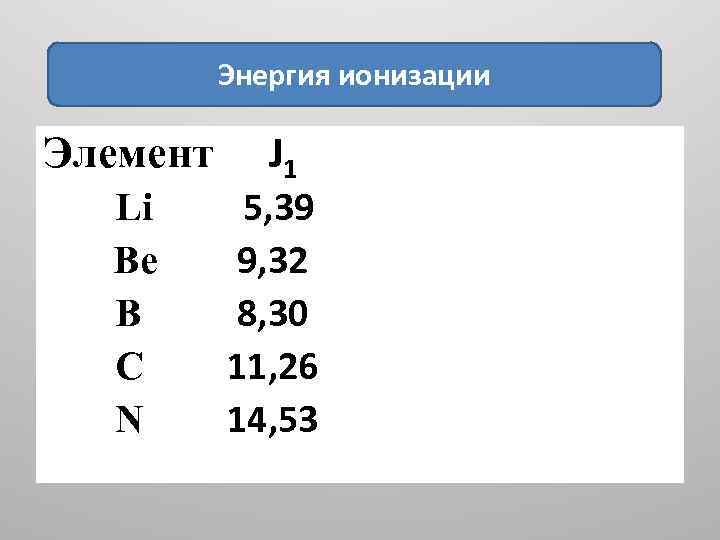 Энергия ионизации Элемент Li Be B C N J 1 5, 39 9, 32 8, 30 11, 26 14, 53
Энергия ионизации Элемент Li Be B C N J 1 5, 39 9, 32 8, 30 11, 26 14, 53
 3. Сродство к электрону - это энергия, выделяющаяся или поглощающаяся при захвате электрона атомом или энергия, необходимая для присоединения электрона к атому: Э + е = Э , F [к. Дж/моль]
3. Сродство к электрону - это энергия, выделяющаяся или поглощающаяся при захвате электрона атомом или энергия, необходимая для присоединения электрона к атому: Э + е = Э , F [к. Дж/моль]
 С ростом радиуса необходим более высокий уровень энергии для присоединения электрона. В группах сродство к электрону снижается, а в периодах растет.
С ростом радиуса необходим более высокий уровень энергии для присоединения электрона. В группах сродство к электрону снижается, а в периодах растет.
 Периодичность изменения F
Периодичность изменения F
 4. Электроотрицательность свойство атома притягивать электроны от других атомов, с которыми он образует химическую связь в соединениях; Э. О. [отн. усл. ед. ]. Э. О. = ½ (Еион + F) Электроотрицательность определяли Полинг, Малликен и др. ученые • Максимальную электроотрицательность имеет атом фтора.
4. Электроотрицательность свойство атома притягивать электроны от других атомов, с которыми он образует химическую связь в соединениях; Э. О. [отн. усл. ед. ]. Э. О. = ½ (Еион + F) Электроотрицательность определяли Полинг, Малликен и др. ученые • Максимальную электроотрицательность имеет атом фтора.

 Электроотрицательность элементов первых 3 х периодов
Электроотрицательность элементов первых 3 х периодов
 Периодичность характеристик элементов Электроотрицательность Сродство к электрону Атомный радиус Электроотрицательность Сродство к электрону а йств о е св ски тва иче ойс л в ие с етал еск Нем лич етал М Энергия ионизации Атомный радиус Энергия ионизации
Периодичность характеристик элементов Электроотрицательность Сродство к электрону Атомный радиус Электроотрицательность Сродство к электрону а йств о е св ски тва иче ойс л в ие с етал еск Нем лич етал М Энергия ионизации Атомный радиус Энергия ионизации
 Активность металлов Li Be Na Mg Al K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po Fr Ra Ac Rf Db Sg Bh Hs Mt Ds Rg Активность металлов
Активность металлов Li Be Na Mg Al K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po Fr Ra Ac Rf Db Sg Bh Hs Mt Ds Rg Активность металлов
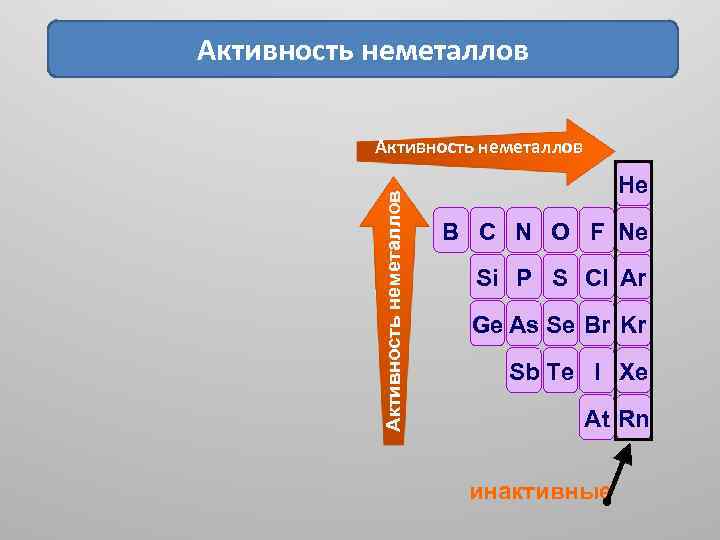 Активность неметаллов He B C N O F Ne Si P S Cl Ar Ge As Se Br Kr Sb Te I Xe At Rn инактивные
Активность неметаллов He B C N O F Ne Si P S Cl Ar Ge As Se Br Kr Sb Te I Xe At Rn инактивные
 Периодические свойства простых веществ и сложных соединений элементов • Кислотно-основные свойства оксидов и гидроксидов: В периодах основные свойства соединений уменьшаются, но увеличиваются кислотные свойства.
Периодические свойства простых веществ и сложных соединений элементов • Кислотно-основные свойства оксидов и гидроксидов: В периодах основные свойства соединений уменьшаются, но увеличиваются кислотные свойства.
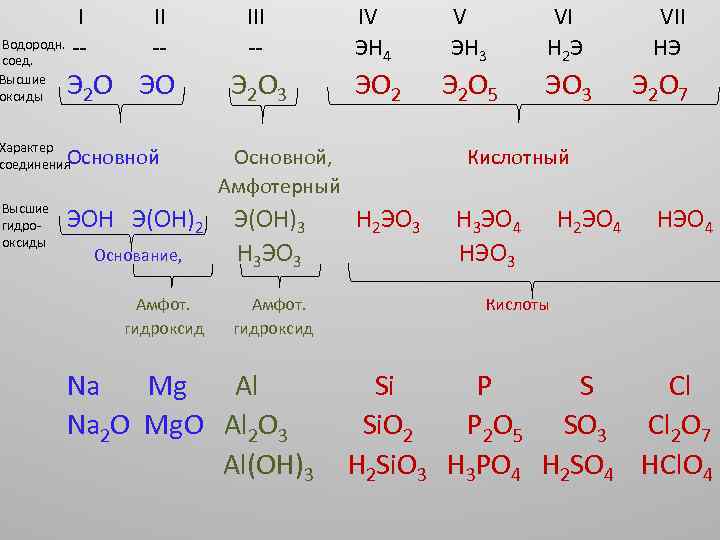 I Водородн. -соед. Высшие оксиды II -- Э 2 О ЭО Характер Основной соединения Высшие гидрооксиды ЭОН Э(ОН)2 Основание, Амфот. гидроксид III -- Э 2 О 3 IV ЭН 4 ЭО 2 Основной, Амфотерный Э(ОН)3 Н 3 ЭО 3 Амфот. гидроксид Na Mg Al Na 2 O Mg. O Al 2 O 3 Al(OH)3 V ЭН 3 Э 2 О 5 VI Н 2 Э ЭО 3 VII НЭ Э 2 О 7 Кислотный Н 2 ЭО 3 Н 3 ЭО 4 НЭО 3 Н 2 ЭО 4 НЭО 4 Кислоты Si P S Cl Si. O 2 P 2 O 5 SO 3 Cl 2 O 7 H 2 Si. O 3 H 3 PO 4 H 2 SO 4 HCl. O 4
I Водородн. -соед. Высшие оксиды II -- Э 2 О ЭО Характер Основной соединения Высшие гидрооксиды ЭОН Э(ОН)2 Основание, Амфот. гидроксид III -- Э 2 О 3 IV ЭН 4 ЭО 2 Основной, Амфотерный Э(ОН)3 Н 3 ЭО 3 Амфот. гидроксид Na Mg Al Na 2 O Mg. O Al 2 O 3 Al(OH)3 V ЭН 3 Э 2 О 5 VI Н 2 Э ЭО 3 VII НЭ Э 2 О 7 Кислотный Н 2 ЭО 3 Н 3 ЭО 4 НЭО 3 Н 2 ЭО 4 НЭО 4 Кислоты Si P S Cl Si. O 2 P 2 O 5 SO 3 Cl 2 O 7 H 2 Si. O 3 H 3 PO 4 H 2 SO 4 HCl. O 4
 Кислотные свойства кислот, образованных элементами одного периода: H 3 BO 3 H 2 CO 3 HNO 3
Кислотные свойства кислот, образованных элементами одного периода: H 3 BO 3 H 2 CO 3 HNO 3
 В группах основные свойства соединений увеличиваются, а кислотные уменьшаются.
В группах основные свойства соединений увеличиваются, а кислотные уменьшаются.
 Кислотные свойства кислородсодержащих кислот, образованных элементами одной подгруппы: • H 2 SO 4 • H 2 Se. O 3 • H 6 Te. O 6
Кислотные свойства кислородсодержащих кислот, образованных элементами одной подгруппы: • H 2 SO 4 • H 2 Se. O 3 • H 6 Te. O 6
 Кислотные свойства бескислородных кислот , образованных элементами одной подгруппы: • HF • HCl • HBr • HI
Кислотные свойства бескислородных кислот , образованных элементами одной подгруппы: • HF • HCl • HBr • HI
 Кислотно-основные свойства для одного элемента зависят от степени его окисления: Mn. O Mn 2 O 3 Mn. O 2 Mn. O 3 Mn 2 O 7 осн. слабо осн. амфот. кисл. С увеличением степени окисления элемента растут кислотные свойства оксидов и гидроксидов, но ослабляются основные свойства.
Кислотно-основные свойства для одного элемента зависят от степени его окисления: Mn. O Mn 2 O 3 Mn. O 2 Mn. O 3 Mn 2 O 7 осн. слабо осн. амфот. кисл. С увеличением степени окисления элемента растут кислотные свойства оксидов и гидроксидов, но ослабляются основные свойства.
 Окислительная способность простых веществ и однотипных соединений: в периодах увеличивается; в группах уменьшается. Термическая устойчивость однотипных солей: в периодах уменьшается и возрастает их склонность к гидролизу; в группах увеличивается.
Окислительная способность простых веществ и однотипных соединений: в периодах увеличивается; в группах уменьшается. Термическая устойчивость однотипных солей: в периодах уменьшается и возрастает их склонность к гидролизу; в группах увеличивается.
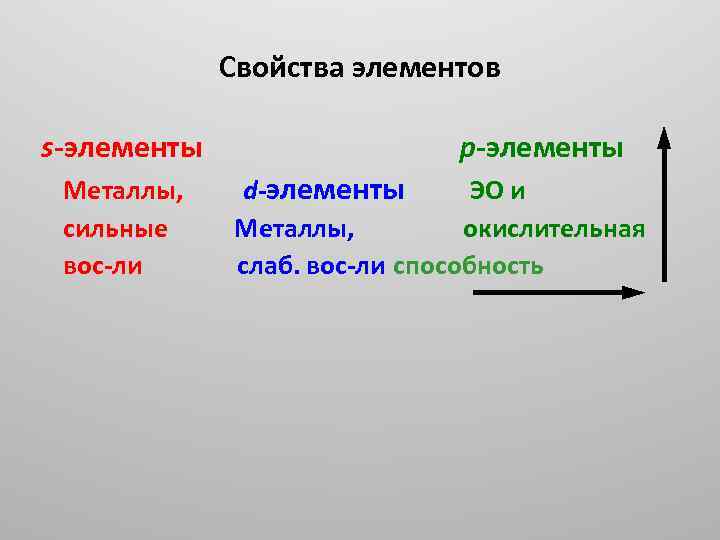 Свойства элементов s элементы Металлы, сильные вос ли p элементы d элементы ЭО и Металлы, окислительная слаб. вос ли способность
Свойства элементов s элементы Металлы, сильные вос ли p элементы d элементы ЭО и Металлы, окислительная слаб. вос ли способность
 • Периодическими являются многие другие свойства соединений: энергия химической связи, энтальпия, энергия Гиббса и др. • Место химического элемента в ПС определяет его свойства и свойства его многих соединений.
• Периодическими являются многие другие свойства соединений: энергия химической связи, энтальпия, энергия Гиббса и др. • Место химического элемента в ПС определяет его свойства и свойства его многих соединений.
 СПАСИБО ЗА ВАШЕ ВНИМАНИЕ!
СПАСИБО ЗА ВАШЕ ВНИМАНИЕ!


