оксиды.pptx
- Количество слайдов: 46
 ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ Лекция Классы неорганических веществ. Оксиды 1. 2. 3. 4. Общая характеристика и классификация оксидов. Способы получения оксидов. Химические свойства оксидов. Оксиды в природе. Лектор: Ирина Викторовна Ганзина кандидат биологических наук, доцент кафедры химии
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ Лекция Классы неорганических веществ. Оксиды 1. 2. 3. 4. Общая характеристика и классификация оксидов. Способы получения оксидов. Химические свойства оксидов. Оксиды в природе. Лектор: Ирина Викторовна Ганзина кандидат биологических наук, доцент кафедры химии
 Оксиды (о кисел, о кись) – это соединения, состоящие из атомов двух элементов, одним из которых является кислород в степени окисления -2. Состав оксидов выражается общей формулой: Эх. Оу -2 где х – число атомов элемента, у – число атомов кислорода.
Оксиды (о кисел, о кись) – это соединения, состоящие из атомов двух элементов, одним из которых является кислород в степени окисления -2. Состав оксидов выражается общей формулой: Эх. Оу -2 где х – число атомов элемента, у – число атомов кислорода.
 • В оксидах кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относится: дифторид кислорода OF 2.
• В оксидах кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относится: дифторид кислорода OF 2.
 Номенклатура оксидов • В названиях оксидов вначале указывают слово оксид (в именительном падеже), а затем – в родительном падеже название элемента: Zn. O – оксид цинка, Са. О – оксид кальция. • Если элемент образует несколько оксидов, то после названия элемента в скобках римской цифрой указывают численную величину его степени окисления: Fe 2 O 3 – оксид железа (III), P 2 O 5 – оксид фосфора (V)
Номенклатура оксидов • В названиях оксидов вначале указывают слово оксид (в именительном падеже), а затем – в родительном падеже название элемента: Zn. O – оксид цинка, Са. О – оксид кальция. • Если элемент образует несколько оксидов, то после названия элемента в скобках римской цифрой указывают численную величину его степени окисления: Fe 2 O 3 – оксид железа (III), P 2 O 5 – оксид фосфора (V)
 Часто используют и другие наименования оксидов по числу атомов кислорода: • если оксид содержит только один атом кислорода, то его называют монооксидом или моноокисью, • если два — диоксидом или двуокисью, • если три — триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО 2, триоксид серы SO 3. Также распространены исторически сложившиеся (тривиальные) названия оксидов. Например: угарный газ CO, серный ангидрид SO 3.
Часто используют и другие наименования оксидов по числу атомов кислорода: • если оксид содержит только один атом кислорода, то его называют монооксидом или моноокисью, • если два — диоксидом или двуокисью, • если три — триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО 2, триоксид серы SO 3. Также распространены исторически сложившиеся (тривиальные) названия оксидов. Например: угарный газ CO, серный ангидрид SO 3.
 Классификация оксидов по агрегатному состоянию : Оксиды неметаллов разделяются на: • твердые – Р 2 О 5 , Si. O 2 , N 2 O 5 и др. , • газообразные – СО 2 , SО 2 , NО и др. , • жидкие - Н 2 О , SO 3 , N 2 O 3. Все оксиды металлов – твердые вещества.
Классификация оксидов по агрегатному состоянию : Оксиды неметаллов разделяются на: • твердые – Р 2 О 5 , Si. O 2 , N 2 O 5 и др. , • газообразные – СО 2 , SО 2 , NО и др. , • жидкие - Н 2 О , SO 3 , N 2 O 3. Все оксиды металлов – твердые вещества.
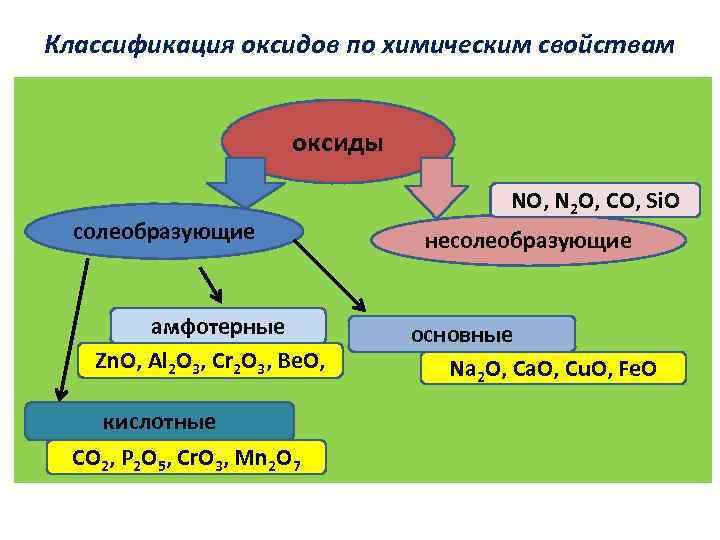 Классификация оксидов по химическим свойствам оксиды солеобразующие амфотерные Zn. O, Al 2 O 3, Cr 2 O 3, Ве. О, кислотные CO 2, Р 2 O 5, Сr. O 3, Mn 2 O 7 NO, N 2 O, CO, Si. O несолеобразующие основные Na 2 O, Ca. O, Cu. O, Fe. O
Классификация оксидов по химическим свойствам оксиды солеобразующие амфотерные Zn. O, Al 2 O 3, Cr 2 O 3, Ве. О, кислотные CO 2, Р 2 O 5, Сr. O 3, Mn 2 O 7 NO, N 2 O, CO, Si. O несолеобразующие основные Na 2 O, Ca. O, Cu. O, Fe. O
 • Кислотным оксидам соответствуют гидроксиды кислоты. Например: SO 3 → H 2 SO 4 • Кислотные оксиды образуют все неметаллы в любой положительной степени окисления, исключая несолеобразующие оксиды, и металлы со степенью окисления +5, +6, +7. Например: CO 2, N 2 O 5, Si. O 2, Mn 2 O 7, Cr. O 3.
• Кислотным оксидам соответствуют гидроксиды кислоты. Например: SO 3 → H 2 SO 4 • Кислотные оксиды образуют все неметаллы в любой положительной степени окисления, исключая несолеобразующие оксиды, и металлы со степенью окисления +5, +6, +7. Например: CO 2, N 2 O 5, Si. O 2, Mn 2 O 7, Cr. O 3.
 • Основным оксидам соответствуют гидроксиды основания. Например: Cu. O → Cu(OH)2 • Основные оксиды образуют только металлы со степенью окисления +1, +2. Например: Na 2 O, K 2 O, Ca. O, Mg. O, Cu. O, Cr. O.
• Основным оксидам соответствуют гидроксиды основания. Например: Cu. O → Cu(OH)2 • Основные оксиды образуют только металлы со степенью окисления +1, +2. Например: Na 2 O, K 2 O, Ca. O, Mg. O, Cu. O, Cr. O.
 • Амфотерным оксидам соответствуют гидроксиды, проявляющие амфотерные свойства, т. е. свойства как кислот, так и оснований. Например: Zn. O Zn(OH)2 • Амфотерные – оксиды металлов в степени окисления +2, +3, +4. Например: Zn. O, Ве. О, РЬО, Sn. О; Al 2 O 3, Cr 2 O 3; Мn. О 2
• Амфотерным оксидам соответствуют гидроксиды, проявляющие амфотерные свойства, т. е. свойства как кислот, так и оснований. Например: Zn. O Zn(OH)2 • Амфотерные – оксиды металлов в степени окисления +2, +3, +4. Например: Zn. O, Ве. О, РЬО, Sn. О; Al 2 O 3, Cr 2 O 3; Мn. О 2
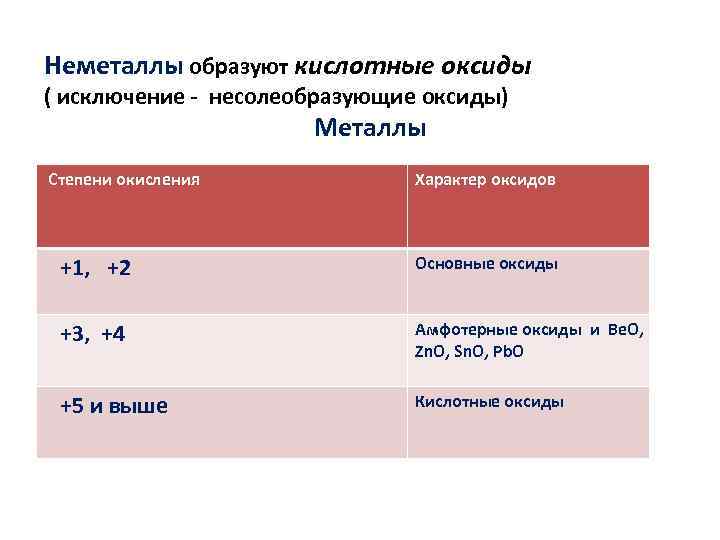 Неметаллы образуют кислотные оксиды ( исключение несолеобразующие оксиды) Металлы Степени окисления Характер оксидов +1, +2 Основные оксиды +3, +4 Амфотерные оксиды и Be. O, Zn. O, Sn. O, Pb. O +5 и выше Кислотные оксиды
Неметаллы образуют кислотные оксиды ( исключение несолеобразующие оксиды) Металлы Степени окисления Характер оксидов +1, +2 Основные оксиды +3, +4 Амфотерные оксиды и Be. O, Zn. O, Sn. O, Pb. O +5 и выше Кислотные оксиды
 • Если элемент образует несколько оксидов , в составе которых атом данного элемента имеет разную степень окисления, то выполняется правило: с увеличением степени окисления элемента происходит усиление кислотных свойств оксидов и соответствующих им гидроксидов. • Cr+2 О Основный оксид • Cr 2+3 О 3 Амфотерный оксид • Cr+6 О 3 Кислотный оксид
• Если элемент образует несколько оксидов , в составе которых атом данного элемента имеет разную степень окисления, то выполняется правило: с увеличением степени окисления элемента происходит усиление кислотных свойств оксидов и соответствующих им гидроксидов. • Cr+2 О Основный оксид • Cr 2+3 О 3 Амфотерный оксид • Cr+6 О 3 Кислотный оксид
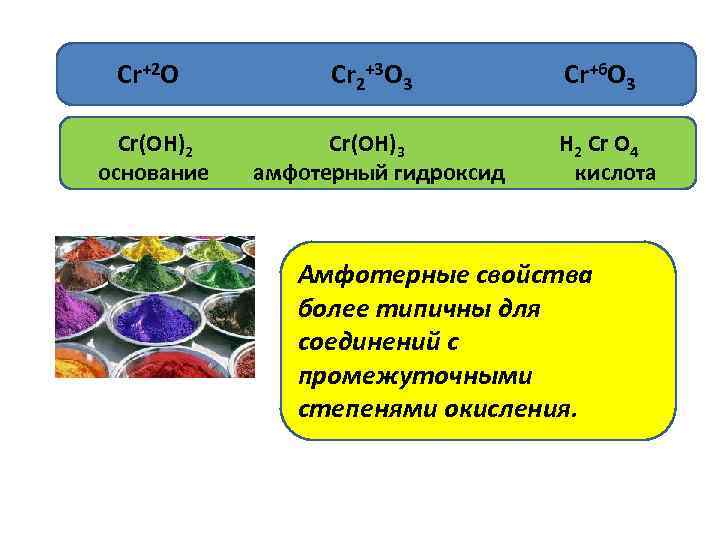 Cr+2 О Cr 2+3 О 3 Cr+6 О 3 Сr(ОН)2 Сr(ОН)3 Н 2 Сr О 4 основание амфотерный гидроксид кислота Амфотерные свойства более типичны для соединений с промежуточными степенями окисления.
Cr+2 О Cr 2+3 О 3 Cr+6 О 3 Сr(ОН)2 Сr(ОН)3 Н 2 Сr О 4 основание амфотерный гидроксид кислота Амфотерные свойства более типичны для соединений с промежуточными степенями окисления.
 Строение оксидов • Оксиды типичных металлов имеют ионное строение кристаллической решетки (тв) Na 2 O, K 2 O, Ca. O, Mg. O, Cu. O, Cr. O. • Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
Строение оксидов • Оксиды типичных металлов имеют ионное строение кристаллической решетки (тв) Na 2 O, K 2 O, Ca. O, Mg. O, Cu. O, Cr. O. • Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
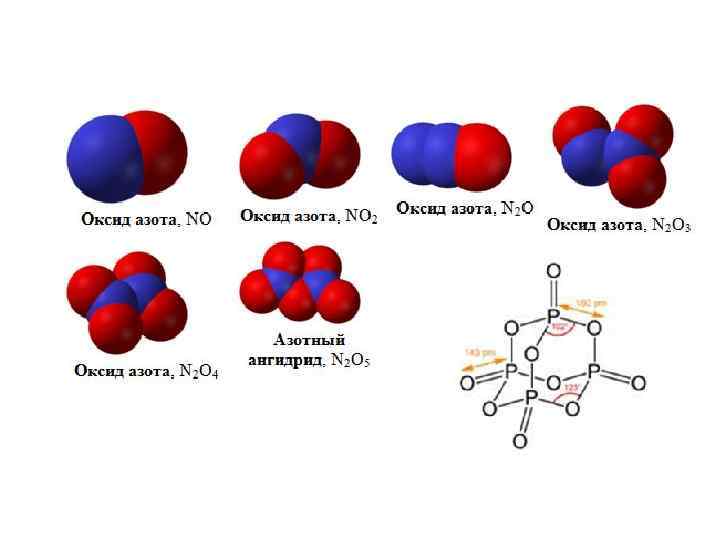
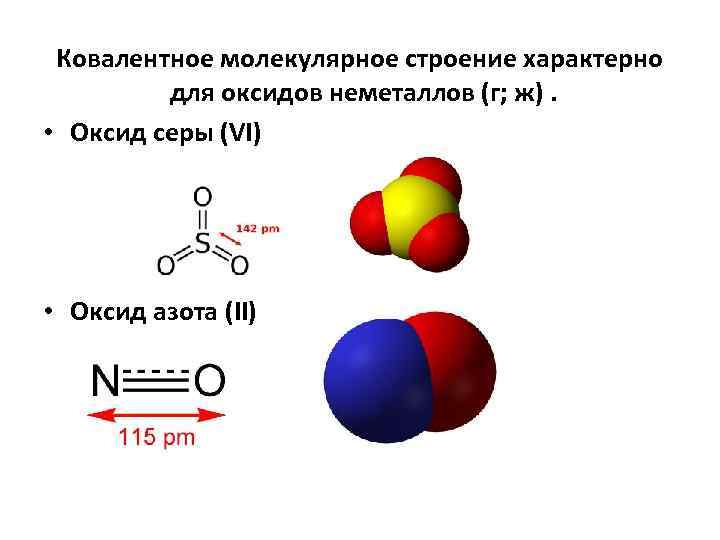 Ковалентное молекулярное строение характерно для оксидов неметаллов (г; ж). • Оксид серы (VI) • Оксид азота (II)
Ковалентное молекулярное строение характерно для оксидов неметаллов (г; ж). • Оксид серы (VI) • Оксид азота (II)
 Si. O 2 (песок, кварц)-имеет атомную кристаллическую решетку. Атомы кремния и кислорода связаны между собой прочными полярными ковалентными связями. При этом атомы связаны только простыми связями и структура Si. O 2 совсем не такая, как углекислого газа СO 2, который состоит из отдельных молекул O=C=O с двойными связями. Большой диаметр атомов кремния препятствует образованию кратных связей.
Si. O 2 (песок, кварц)-имеет атомную кристаллическую решетку. Атомы кремния и кислорода связаны между собой прочными полярными ковалентными связями. При этом атомы связаны только простыми связями и структура Si. O 2 совсем не такая, как углекислого газа СO 2, который состоит из отдельных молекул O=C=O с двойными связями. Большой диаметр атомов кремния препятствует образованию кратных связей.
 Способы получения оксидов 1. Взаимодействие простых веществ с кислородом: С + O 2 = CO 2 2 Mg + O 2 = 2 Mg O Реакции горения сопровождаются выделением теплоты, относятся к экзотермическим реакциям.
Способы получения оксидов 1. Взаимодействие простых веществ с кислородом: С + O 2 = CO 2 2 Mg + O 2 = 2 Mg O Реакции горения сопровождаются выделением теплоты, относятся к экзотермическим реакциям.

 2. Горение на воздухе сложных веществ: CH 4 + 2 O 2 = CO 2 + 2 H 2 O 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2
2. Горение на воздухе сложных веществ: CH 4 + 2 O 2 = CO 2 + 2 H 2 O 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2
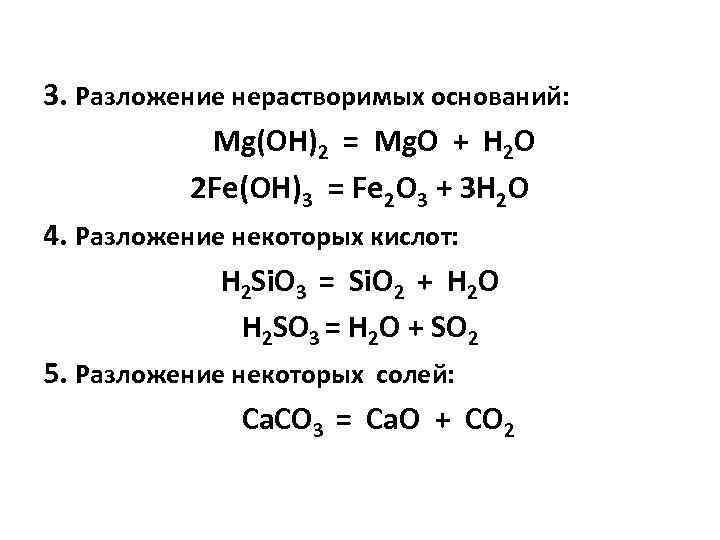 3. Разложение нерастворимых оснований: Mg(OH)2 = Mg. O + H 2 O 2 Fe(OH)3 = Fe 2 O 3 + ЗН 2 O 4. Разложение некоторых кислот: H 2 Si. O 3 = Si. O 2 + H 2 O H 2 SO 3 = H 2 O + SO 2 5. Разложение некоторых солей: Ca. CO 3 = Ca. O + CO 2
3. Разложение нерастворимых оснований: Mg(OH)2 = Mg. O + H 2 O 2 Fe(OH)3 = Fe 2 O 3 + ЗН 2 O 4. Разложение некоторых кислот: H 2 Si. O 3 = Si. O 2 + H 2 O H 2 SO 3 = H 2 O + SO 2 5. Разложение некоторых солей: Ca. CO 3 = Ca. O + CO 2
 6. Нагревание высших оксидов 4 Cr. O 3= 2 Cr 2 O 3+3 O 2 7. Окисление низших оксидов в высшие и восстановление высших в низшие: 4 Fe. O + O 2 = 2 Fe 2 O 3 + Fе = 3 Fе. О 8. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами: Na 2 CO 3+ 2 HCl = 2 Na. Cl + CO 2 + Н 2 О
6. Нагревание высших оксидов 4 Cr. O 3= 2 Cr 2 O 3+3 O 2 7. Окисление низших оксидов в высшие и восстановление высших в низшие: 4 Fe. O + O 2 = 2 Fe 2 O 3 + Fе = 3 Fе. О 8. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами: Na 2 CO 3+ 2 HCl = 2 Na. Cl + CO 2 + Н 2 О
 Химические свойства оксидов I. Кислотные оксиды 1. С водой большинство оксидов образуют кислоты: SO 3 + H 2 O = H 2 SO 4 Cr. O 3 + H 2 O = H 2 Cr. O 4 Исключением является нерастворимый в воде оксид кремния (IV) Si. O 2. Кремниевую кислоту, нерастворимую в воде, получают косвенно, осаждением из растворов солей сильными кислотами. Na 2 Si. O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 Si. O 3↓
Химические свойства оксидов I. Кислотные оксиды 1. С водой большинство оксидов образуют кислоты: SO 3 + H 2 O = H 2 SO 4 Cr. O 3 + H 2 O = H 2 Cr. O 4 Исключением является нерастворимый в воде оксид кремния (IV) Si. O 2. Кремниевую кислоту, нерастворимую в воде, получают косвенно, осаждением из растворов солей сильными кислотами. Na 2 Si. O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 Si. O 3↓
 N 02 хорошо растворяется в воде с обра зованием смеси кислот : 2 N+402 + Н 20 = HN+302 + HN+503 азотистая азотная кислоты Эта реакция свидетельствует о том, что N 02 является смешанным кислотным оксидом.
N 02 хорошо растворяется в воде с обра зованием смеси кислот : 2 N+402 + Н 20 = HN+302 + HN+503 азотистая азотная кислоты Эта реакция свидетельствует о том, что N 02 является смешанным кислотным оксидом.
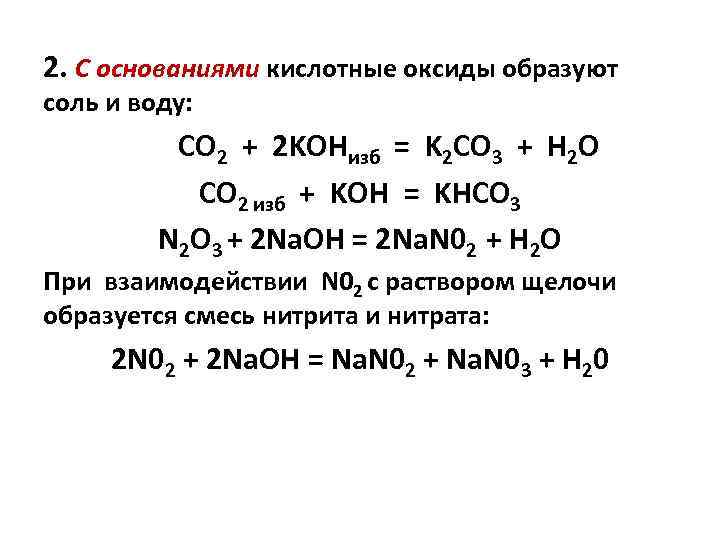 2. С основаниями кислотные оксиды образуют соль и воду: CO 2 + 2 KOHизб = K 2 CO 3 + H 2 O CO 2 изб + KOH = KНCO 3 N 2 O 3 + 2 Nа. OН = 2 Nа. N 02 + H 2 O При взаимодействии N 02 с раствором щелочи образуется смесь нитрита и нитрата: 2 N 02 + 2 Na. OH = Na. N 02 + Na. N 03 + H 20
2. С основаниями кислотные оксиды образуют соль и воду: CO 2 + 2 KOHизб = K 2 CO 3 + H 2 O CO 2 изб + KOH = KНCO 3 N 2 O 3 + 2 Nа. OН = 2 Nа. N 02 + H 2 O При взаимодействии N 02 с раствором щелочи образуется смесь нитрита и нитрата: 2 N 02 + 2 Na. OH = Na. N 02 + Na. N 03 + H 20
 3. С основными и амфотерными оксидами образуют соли: CO 2 + Mg. O = Mg. CO 3 Zn. O + SO 3 = Zn. SO 4 Al 2 O 3 + 3 SO 3 = Al 2(SO 4)3
3. С основными и амфотерными оксидами образуют соли: CO 2 + Mg. O = Mg. CO 3 Zn. O + SO 3 = Zn. SO 4 Al 2 O 3 + 3 SO 3 = Al 2(SO 4)3
 II. Основные оксиды 1. С водой реагируют только оксиды щелочных и щелочно земельных металлов: Na 2 O + H 2 O = 2 Na. OH Оксиды остальных металлов нерастворимы Cu. O + Н 2 O ≠
II. Основные оксиды 1. С водой реагируют только оксиды щелочных и щелочно земельных металлов: Na 2 O + H 2 O = 2 Na. OH Оксиды остальных металлов нерастворимы Cu. O + Н 2 O ≠
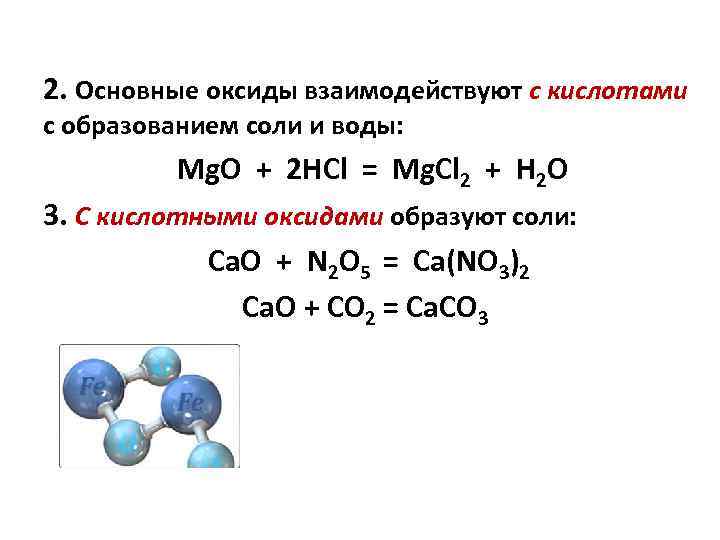 2. Основные оксиды взаимодействуют с кислотами с образованием соли и воды: Mg. O + 2 HCl = Mg. Cl 2 + H 2 O 3. С кислотными оксидами образуют соли: Ca. O + N 2 O 5 = Ca(NO 3)2 Са. О + CO 2 = Ca. CO 3
2. Основные оксиды взаимодействуют с кислотами с образованием соли и воды: Mg. O + 2 HCl = Mg. Cl 2 + H 2 O 3. С кислотными оксидами образуют соли: Ca. O + N 2 O 5 = Ca(NO 3)2 Са. О + CO 2 = Ca. CO 3
 III. Амфотерные оксиды 1. Амфотерные оксиды нерастворимы в воде Zn. O + H 2 O ≠ 2. Амфотерные оксиды растворяются в кислотах с образованием растворов солей Zn. O + 2 HCl = Zn. Cl 2 + Н 2 O
III. Амфотерные оксиды 1. Амфотерные оксиды нерастворимы в воде Zn. O + H 2 O ≠ 2. Амфотерные оксиды растворяются в кислотах с образованием растворов солей Zn. O + 2 HCl = Zn. Cl 2 + Н 2 O
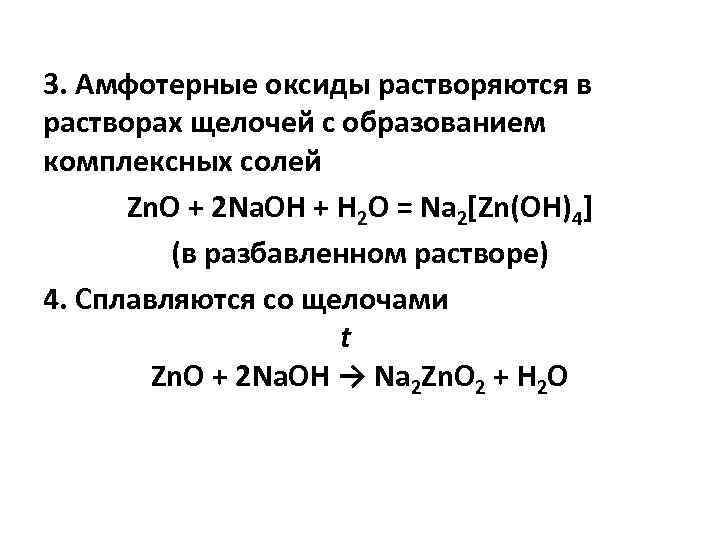 3. Амфотерные оксиды растворяются в растворах щелочей с образованием комплексных солей Zn. O + 2 Na. OH + H 2 O = Na 2[Zn(OH)4] (в разбавленном растворе) 4. Сплавляются со щелочами t Zn. O + 2 Na. OH → Na 2 Zn. O 2 + Н 2 O
3. Амфотерные оксиды растворяются в растворах щелочей с образованием комплексных солей Zn. O + 2 Na. OH + H 2 O = Na 2[Zn(OH)4] (в разбавленном растворе) 4. Сплавляются со щелочами t Zn. O + 2 Na. OH → Na 2 Zn. O 2 + Н 2 O
 5. Реагируют как с кислотными, так и с основными оксидами Zn. O + Ca. O = Ca. Zn. O 2 Zn. O + Si. O 2 = Zn. Si. O 3
5. Реагируют как с кислотными, так и с основными оксидами Zn. O + Ca. O = Ca. Zn. O 2 Zn. O + Si. O 2 = Zn. Si. O 3
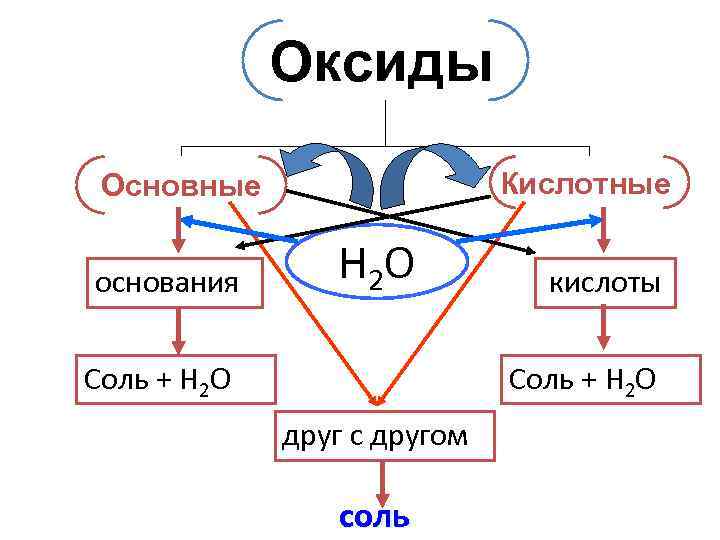 Оксиды Кислотные Основные основания Н 2 О Соль + Н 2 О кислоты Соль + Н 2 О друг с другом соль
Оксиды Кислотные Основные основания Н 2 О Соль + Н 2 О кислоты Соль + Н 2 О друг с другом соль
 IV. Несолеобразующие оксиды N 2 O – оксид азота (I), закись азота или «веселящий газ» , возбуждающе действует на нервную систему человека, используют в медицине как анестезирующее средство. Проявляет окислительные свойства, легко разлагается. 2 N 2 O = 2 N 2 + О 2 •
IV. Несолеобразующие оксиды N 2 O – оксид азота (I), закись азота или «веселящий газ» , возбуждающе действует на нервную систему человека, используют в медицине как анестезирующее средство. Проявляет окислительные свойства, легко разлагается. 2 N 2 O = 2 N 2 + О 2 •
 NO – оксид азота (II) бесцветный газ, термически устойчивый, плохо растворим в воде, практически мгновенно взаимодействует с кислородом (при комнатной температуре). 2 NO+ O 2= 2 NO 2 Оксид азота (II) образуется при каталитическом окис лении ммиака. а 4 NH 3 + 5 О 2 = 4 NО + 6 Н 2 О •
NO – оксид азота (II) бесцветный газ, термически устойчивый, плохо растворим в воде, практически мгновенно взаимодействует с кислородом (при комнатной температуре). 2 NO+ O 2= 2 NO 2 Оксид азота (II) образуется при каталитическом окис лении ммиака. а 4 NH 3 + 5 О 2 = 4 NО + 6 Н 2 О •
 • СО монооксид углерода представляет собой бесцветный газ без вкуса и запаха. Горюч. Токсичен. Основными типами химических реакций, в которых участвует оксид углерода (II), являются реакции присоединения и окислительно восстановительные реакции, в которых он проявляет восстановительные свойства. Fe 3 O 4 + CO = 3 Fe. O + CO 2 Fe. O + CO = Fe + CO 2 Оксид углерода (II) реагирует с галогенами. СО + СI 2 → СОСI 2
• СО монооксид углерода представляет собой бесцветный газ без вкуса и запаха. Горюч. Токсичен. Основными типами химических реакций, в которых участвует оксид углерода (II), являются реакции присоединения и окислительно восстановительные реакции, в которых он проявляет восстановительные свойства. Fe 3 O 4 + CO = 3 Fe. O + CO 2 Fe. O + CO = Fe + CO 2 Оксид углерода (II) реагирует с галогенами. СО + СI 2 → СОСI 2
 Оксиды в природе Вода Н 2 О – оксид водорода • В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде. • В природе происходит непрерывный круговорот воды.
Оксиды в природе Вода Н 2 О – оксид водорода • В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде. • В природе происходит непрерывный круговорот воды.
 • Один из распространенных оксидов – диоксид углерода CO 2 – содержится в составе вулканических газов. • Углекислый газ бесцветен и тяжелее воздуха. • Он не пригоден для поддержания жизни. •
• Один из распространенных оксидов – диоксид углерода CO 2 – содержится в составе вулканических газов. • Углекислый газ бесцветен и тяжелее воздуха. • Он не пригоден для поддержания жизни. •
 Углерод постоянно циркулирует в земной биосфере по замкнутым взаимосвязанным путям. т • В природе совершается естественный круговорот углекислого газа.
Углерод постоянно циркулирует в земной биосфере по замкнутым взаимосвязанным путям. т • В природе совершается естественный круговорот углекислого газа.
 • Углекислый газ замерзает при температуре − 78. 5°C с образованием снега, состоящего из двуокиси углерода. • Сухой лед в отличие от водяного льда плотный. Он тонет в воде, резко охлаждая ее. • Горящий бензин можно быстро потушить, бросив в пламя несколько кусочков сухого льда. • Главное применение сухого льда — хранение и перевозка продуктов: рыбы, мяса, мороженого. • Ценность сухого льда заключается не только в его охлаждающем действии но и в том, что продукты в углекислом газе не плесневеют, не гниют.
• Углекислый газ замерзает при температуре − 78. 5°C с образованием снега, состоящего из двуокиси углерода. • Сухой лед в отличие от водяного льда плотный. Он тонет в воде, резко охлаждая ее. • Горящий бензин можно быстро потушить, бросив в пламя несколько кусочков сухого льда. • Главное применение сухого льда — хранение и перевозка продуктов: рыбы, мяса, мороженого. • Ценность сухого льда заключается не только в его охлаждающем действии но и в том, что продукты в углекислом газе не плесневеют, не гниют.
 Оксид кремния (IV) Si. О 2 • Диоксид кремния — главный компонент почти всех земных горных пород. Из кремнезёма и силикатов состоит 87% массы литосферы. • Аморфный непористый диоксид кремния применяется в пищевой промышленности в качестве вспомогательного вещества E 551, препятствующего слёживанию и комкованию, в фармацевтике (зубные пасты), а также как пищевая добавка. • Искусственно полученные плёнки диоксида кремния используются в качестве изолятора при производстве микросхем и других электронных компонентов.
Оксид кремния (IV) Si. О 2 • Диоксид кремния — главный компонент почти всех земных горных пород. Из кремнезёма и силикатов состоит 87% массы литосферы. • Аморфный непористый диоксид кремния применяется в пищевой промышленности в качестве вспомогательного вещества E 551, препятствующего слёживанию и комкованию, в фармацевтике (зубные пасты), а также как пищевая добавка. • Искусственно полученные плёнки диоксида кремния используются в качестве изолятора при производстве микросхем и других электронных компонентов.

 • Оксид цинка Zn. O – вещество белого цвета, используется для приготовления белой масляной краски (цинковые белила). • Цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. • Фармацевты делают из оксида цинка вяжущий и подсушивающий порошок для наружного применения. • Такими же ценными свойствами обладает оксид титана (IV) – Ti. O 2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил.
• Оксид цинка Zn. O – вещество белого цвета, используется для приготовления белой масляной краски (цинковые белила). • Цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. • Фармацевты делают из оксида цинка вяжущий и подсушивающий порошок для наружного применения. • Такими же ценными свойствами обладает оксид титана (IV) – Ti. O 2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил.
 Оксид алюминия Al 2 O 3 — в природе распространён как глинозём. Al 2 O 3 как минерал, называется корунд. Крупные прозрачные кристаллы корунда используются как драгоценные камни. Из за примесей корунд бывает окрашен в разные цвета: красный корунд называется рубином, синий, традиционно — сапфиром. Также корунд применяется как огнеупорный материал. Остальные кристаллические формы используются, как правило, в качестве катализаторов, адсорбентов, инертных наполнителей в физических исследованиях и химической промышленности.
Оксид алюминия Al 2 O 3 — в природе распространён как глинозём. Al 2 O 3 как минерал, называется корунд. Крупные прозрачные кристаллы корунда используются как драгоценные камни. Из за примесей корунд бывает окрашен в разные цвета: красный корунд называется рубином, синий, традиционно — сапфиром. Также корунд применяется как огнеупорный материал. Остальные кристаллические формы используются, как правило, в качестве катализаторов, адсорбентов, инертных наполнителей в физических исследованиях и химической промышленности.
 ОКСИД ХРОМА Cr 2 O 3 • Оксид хрома(III) – Cr 2 O 3 – кристаллы зеленого цвета, нерастворимые в воде. • Cr 2 O 3 используют как пигмент при изготовлении декоративного зеленого стекла и керамики. • Паста ГОИ (“Государственный оптический институт”) на основе Cr 2 O 3 применяется для шлифовки и полировки оптических изделий, в ювелирном деле.
ОКСИД ХРОМА Cr 2 O 3 • Оксид хрома(III) – Cr 2 O 3 – кристаллы зеленого цвета, нерастворимые в воде. • Cr 2 O 3 используют как пигмент при изготовлении декоративного зеленого стекла и керамики. • Паста ГОИ (“Государственный оптический институт”) на основе Cr 2 O 3 применяется для шлифовки и полировки оптических изделий, в ювелирном деле.
 БЛАГОДАРЮ ЗА ВНИМАНИЕ!
БЛАГОДАРЮ ЗА ВНИМАНИЕ!


