D-elementy.pptx
- Количество слайдов: 101

ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ Лекция Биогенные элементы. D – элементы 1. Общая характеристика элементов d-блока. 2. D –элементы I-Б группы. 3. D –элементы II-Б группы. Лектор: Ганзина Ирина Викторовна кандидат биологических наук, доцент кафедры химии

ОБЩАЯ ХАРАКТЕРИСТИКА D-ЭЛЕМЕНТОВ К элементам d - семейства относятся 32 элемента периодической системы. Они входят в 4 - 7 -ой большие периоды. Строение внешних электронных оболочек атомов описывается общей формулой nsy (n-1)dx , где х - от 1 до 10, у - от 1 до 2. У атомов III - Б группы появляется первый электрон на d - орбитали Sc - скандий - 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 1. В последующих Б группах происходит заполнение d - подуровня до 10 электронов. Отсюда и название - d - семейство.

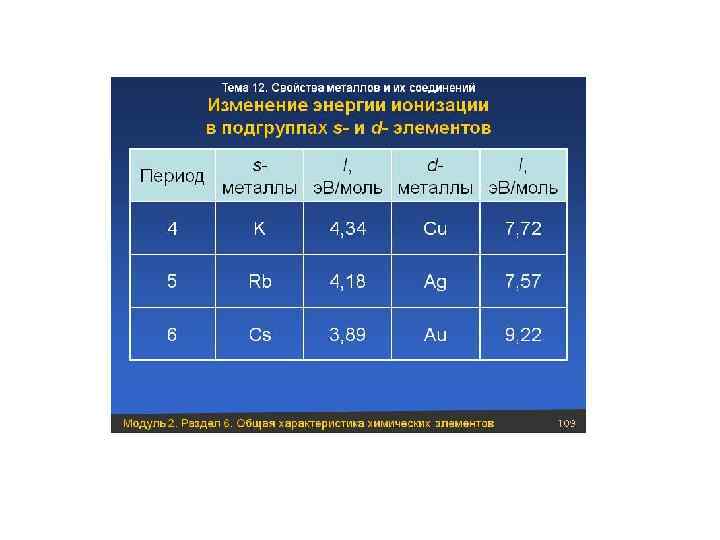
• В периодах с увеличением заряда ядра очень незначительно изменяется радиус, энергия ионизации атома. Это объясняется проникновением n. S - электронов под d - электронный слой в соответствии с принципом наименьшей энергии (лантаноидное сжатие). • В группах Б сверху вниз уменьшаются металлические свойства, хотя все d - элементы металлы, и, образуемые ими простые вещества, способны выступать в окислительно-восстановительных реакциях только восстановителями.

d - элементы отличаются набором разных степеней окисления элементов: Mn от +2 до +7 (+2; +3; +4; +6; +7) Ti от +2 до +4 (+2; +3; +4) Cr от +2 до +6 (+2; +3; +4; +6) Низшая степень окисления обусловливает основные и восстановительные свойства, ей соответствует катионная форма d - элемента: Mn 2+; Mn(ОН)2; Mn+2 - 5 e →Mn+7.

С увеличением степень окисления элемента происходит усиление окислительной способности и кислотных свойств соединения. • Амфотерные свойства более типичны для соединений с промежуточными степенями окисления: • Cr+2 О Основный оксид • Cr 2+3 О 3 Амфотерный оксид • Cr+6 О 3 Кислотный оксид

В периоде с увеличением заряда ядра уменьшается устойчивость соединений с высшей степенью окисления атома, и одновременно возрастают их окислительные свойства. • Сильными окислителями являются: (Cr+62 О 7)2 - - бихромат - ион; =+1, 33 В; (Mn+7 О 4)- - перманганат - ион; =+1, 51 В; (Fe+6 О 4)2 - - феррат - ион; =+1, 90 В; Возрастание о-в потенциала свидетельствует о возрастании окислительной способности.

Биологическая роль d-элементов В организме d - элементы представлены как микроэлементы. К "металлам жизни" относят: Cu, Zn, Mn, Fe, Co, Mn. К биогенным элементам относят Ti, V, Cr, Ni, Ag, Cd, Hg. Они существуют в виде ионов и в виде комплексных соединений.
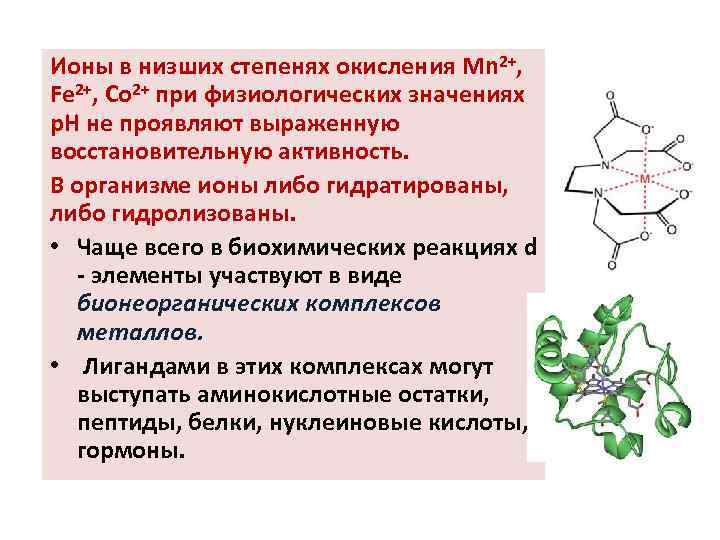
Ионы в низших степенях окисления Mn 2+, Fe 2+, Co 2+ при физиологических значениях р. Н не проявляют выраженную восстановительную активность. В организме ионы либо гидратированы, либо гидролизованы. • Чаще всего в биохимических реакциях d - элементы участвуют в виде бионеорганических комплексов металлов. • Лигандами в этих комплексах могут выступать аминокислотные остатки, пептиды, белки, нуклеиновые кислоты, гормоны.

Бионеорганические комплексы d - элементов с белками называются биокластерами. Внутри биокластера находится полость, в которую входит ион металла подходящий по размеру к размеру полости. Он образует донорно-акцепторные связи с - ОН, - SH, - NH 2, - COOH группами аминокислот.
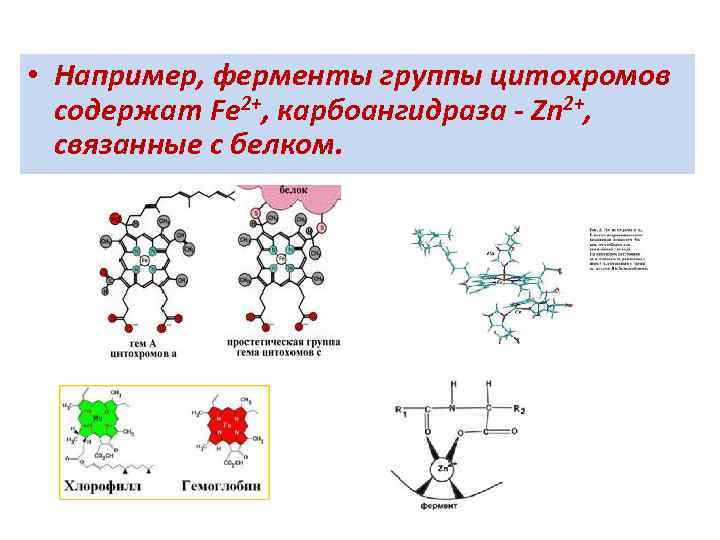
• Например, ферменты группы цитохромов содержат Fe 2+, карбоангидраза - Zn 2+, связанные с белком.

В зависимости от выполняемой биологической функции биокомплексы металлов условно подразделяют на группы: а) транспортные - доставляют в организм кислород и биометаллы; б) аккумуляторы - (накопители) - например ферритин - "депо" железа в организме; в) биокатализаторы - металлоферменты, регулирующие содержание веществ в организме и скорость биохимических превращений.

Реакции, катализируемые этими ферментами, можно разделить на две группы: а) кислотно-основные реакции - например процесс обратимой гидратации с участием цинксодержащей (Zn 2+) карбоангидразы. CO 2+H 2 O ↔ H 2 CO 3 б) окислительно-восстановительные реакции, в которых металл фермента изменяет свою степень окисления. Например, в цитохромах в процессе переноса электрона изменяется степень окисления железа: Fe 3++e- ↔ Fe 2+
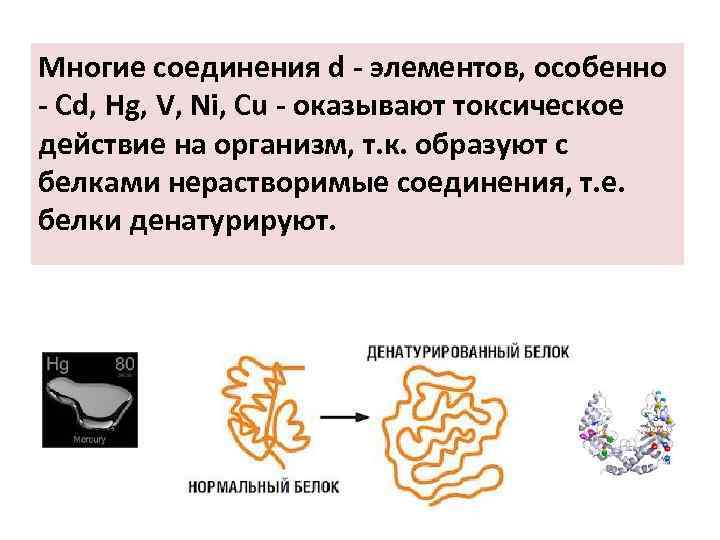
Многие соединения d - элементов, особенно - Cd, Hg, V, Ni, Cu - оказывают токсическое действие на организм, т. к. образуют с белками нерастворимые соединения, т. е. белки денатурируют.

d - ЭЛЕМЕНТЫ I-Б ГРУППЫ: МЕДЬ(Cu), СЕРЕБРО(Ag), ЗОЛОТО(Au) 29 Cu; 47 Ag; 79 Au - составляют I Б подгруппу П. С. Общая электронная формула с учётом эффекта "провала электрона": ns 1(n-1)d 10 np 0, где ns и (n-1)d электроны, близки по энергии и участвуют в образовании химических связей.

Элементы относятся к неактивным металлам и в электрохимическом ряду напряжений стоят после водорода. • В природе существуют как в виде соединений (оксидов, сульфидов), так и в элементной форме, проявляя высокую стойкость к окислению кислородом. От Cu к Au основные и восстановительные свойства убывают, так: а) медь образует оксиды и гидроксиды основного характера; б) гидроксид золота Au(OH)3 имеет амфотерный характер.

Степени окисления: Cu: +1; +2; - (Cu 2 O, Cu. OH, Cu. O, Cu(OH)2); редко +3. Ag: +1; - (Ag 2 O); редко+2. Au: +3; +1; +2 - (Au(OH)3, неустойчив) Имеются данные, что в биологических системах медь входит в состав соединений со степенью окисления +1 и +2, при этом Cu(I) прочно связывается с серосодержащими лигандами, а Cu(II) - с карбоксильными, фенольными и аминогруппами белков. Эти элементы являются хорошими комплексообразователями, что определяет их биологическую роль.

Медь (Cu) - медь принадлежит к числу микроэлементов, необходимых для и нормального развития. В растениях и животных содержание меди варьируется от 10 -15 до 10 -3%. Мышечная ткань человека содержит 1· 10 -3 % меди, костная ткань — 1, 26· 10 -4%, в плазме крови – 7, 5 - 20 мг/л. Всего в организме среднего человека (масса тела 70 кг) содержится 72 мг меди ( 1, 1 ммоль) - в печени, головном мозге, крови.

Биологическая роль меди: 1. Медь служит активатором ряда реакций и входит в состав медьсодержащих ферментов. Известно около 25 медьсодержащих белков и ферментов, которые составляют группу оксигеназ и гидроксилаз. Эти ферменты активируют молекулу кислорода, которая далее активно окисляет органические соединения. Например, цитохромоксидаза (ЦХО), завершающая этап тканевого дыхания. • В ходе каталитического действия ЦХО обратимо изменяется степень окисления меди: Cu 2+ ↔ Cu+

2. в присутствии меди повышается устойчивость тканей к недостатку кислорода, 3. медь является частью ферментных систем, которые участвуют в синтезе миелиновых оболочек всех нервных волокон, 4. медь отвечает за утилизацию фосфора и способствует удалению фосфатов из плазмы крови при повышенном поступлении фосфора в организм (что особенно актуально сегодня, когда пищевая промышленность добавляет фосфаты практически во все продукты питания), а это положительно сказывается на обмене кальция и фосфора,

5. известны медьсодержащие белки, разлагающие супероксид - ион- O 2 - - свободный радикал, разрушающий клетку. К ним относится супероксиддисмутаза (СОД), которая переводит O 2 - в пероксид водорода, который далее разлагается в организме под действием каталазы: [COД Cu+] + O 2 - + 2 Н+↔ [COД Cu 2+] + Н 2 O 2

6. В плазме крови млекопитающих содержится церулоплазмин (ЦП) ("голубая" оксидаза), в составе которого на 1 молекулу белка приходится 8 атомов меди. Этот медьсодержащий (ЦП) белок принимает участие в окислении железа, восстановлении кислорода до воды и транспорте меди в организме. Он регулирует баланс меди, участвует в синтезе гемоглобина и обеспечивает выведение избытка меди из организма.

Недостаток меди в организме приводит: 1. к патологическому росту костей, 2. дефектам в соединительных тканях, 3. нарушается обмен железом между плазмой крови и эритроцитами, 4. возникает медная анемия (нарушение координации движения). Избыточное количество меди в организме ведет к развитию тяжелых заболеваний. При болезни Вильсона, связанной с нарушением метаболизма меди, содержание меди увеличивается в 100 раз. Повышение меди в крови встречается при таких заболеваниях, как лейкемия, лимфома, ревматоидный артрит, цирроз, нефрит.

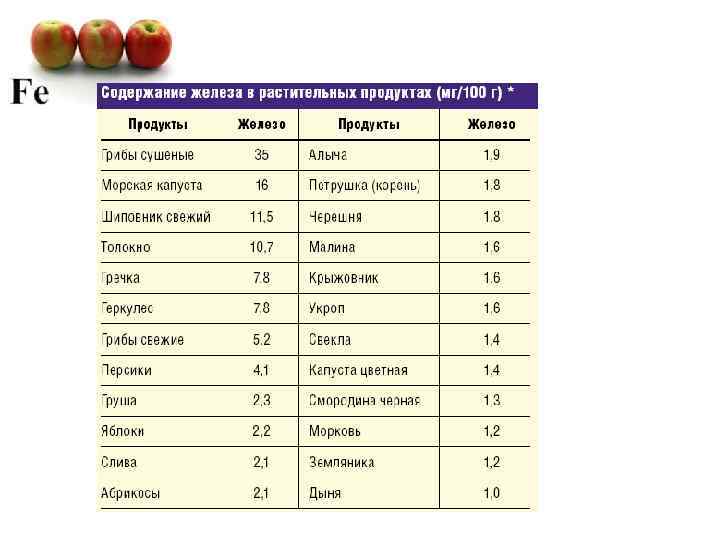
Наиболее богаты медью мясо и субпродукты (говяжья либо свиная печень), а также печень трески и морепродукты (мидии, устрицы, креветки, морская капуста). Медь содержится практически во всех овощах и фруктах, ее много в гречневой и овсяной крупе, в бобовых, в картофеле и яблоках, в грибах и орехах, в шоколаде и какао. Много меди в тыквенных семечках, в пшеничных отрубях и хлебе с отрубями, в капусте, моркови и т. д. Потребность человека в меди - 2, 3 мг в сутки, что полностью обеспечивается потребляемой пищей растительного и животного происхождения.

В больших количествах соли меди токсичны. • Сульфат меди и другие соединения меди используют в сельском хозяйстве в качестве микроудобрений и для борьбы с различными вредителями растений. Однако при использовании соединений меди, при работах с ними нужно учитывать, что они ядовиты. Попадание солей меди в организм приводит к различным заболеваниям человека. ПДК для аэрозолей меди составляет 1 мг/м 3, для питьевой воды содержание меди должно быть не выше 1, 0 мг/л. • Сульфат меди массой до 2 г. вызывает сильное отравление с возможным смертельным исходом. • Токсическое действие соединений меди объясняют образованием нерастворимых хелатов-альбуминатов Cu 2+ с белками.

Серебро (Ag)- примесный микроэлемент, его содержание в организме составляет до 7, 3 ммоль. • Концентрируется в печени, гипофизе, эритроцитах, пигментной оболочке глаза. • При попадании в организм оказывает токсическое действие, т. к. соединяется с белками, содержащими серу и таким образом инактивирует ферменты и разрушает белки.

Этим же свойством объясняется и бактерицидное действие соединений серебра Ag+. Доказано, что содержание Ag+ около 10 -8 ммоль/л придает воде бактерицидные свойства. Поэтому все используемые в медицине соединения серебра –это препараты наружного действия, обладающие вяжущим, прижигающим, бактерицидным действием. Их применяют • при коньюктивитах, • инфекционных заболеваниях слизистых оболочек, • для лечения кожных и венерических заболеваний (протаргол, колларгол).

Золото (Au) – примесный микроэлемент, не – имеет выраженной биологической роли. • Соединения золота применяются в химиотерапии для лечения полиартрита, туберкулеза, кожных заболеваний (кризонал, санокризин). • Соединения золота обладают бактерицидным действием. бактерицидным

d - ЭЛЕМЕНТЫ II -Б ГРУППЫ: ЦИНК(Zn), КАДМИЙ(Cd), РТУТЬ(Hg) 30 Zn ; 48 Cd; 80 Hg - составляют Б подгруппу II группы П. С. Общая электронная формула валентных подуровней: …ns 2(n-1)d 10 np 0, Валентность элементов II, что определяется ионизацией ns 2 -электронов, степень окисления +2.

Атомы ртути способны к образованию связи друг с другом, что определяет степень окисления +1 при двухвалентном состоянии (Hg 2 Cl 2) - каломель: Cl-Hg-Hg-Cl От Zn к Hg ослабляются металлические и восстановительные свойства атомов. Zn - активный металл, Hg - не активный. Соединения Zn, Cd амфотерны, поэтому в растворах солей находятся как в катионных Zn 2+ , так и анионных [Zn(OH)4]2 - гидратированных формах.

Все эти элементы активные комплексообразователи с координационными числами: Zn 2+ к. ч. = 4 Cd 2+ к. ч. = 4, 6 Hg 2+ к. ч. = 4 Все эти элементы относятся к микроэлементам. Содержание в организме: Zn - 10, 8 ммоль; (1, 5 -3 г) Cd - 0, 6 ммоль; Hg - 0, 18 ммоль;

Цинк (Zn) - в организме содержится 10, 8 ммоль; (1, 5 -3 г); концентрируется в мышцах, печени, поджелудочной железе, волосах. Входит в состав более 40 металлоферментов, катализирующих гидролиз пептидов, белков, эфиров и реакции гидратации. Например, - карбоангидраза крови, содержащаяся в эритроцитах, состоит из 260 аминокислотных остатков и Zn 2+, расположенного в полости комплекса с к. ч. = 4.

Цинк в активном центре фермента координирует молекулу воды или ОН-, связывающих СО 2, образующийся в тканях: Н 2 О + СО 2 ↔ H 2 CO 3 ↔ HCO 3 - + H+ OH- + CO 2 ↔ HCO 3 Эти процессы координируют скорость дыхания и газообмен в организме. Zn 2+ входит в состав гормона инсулина, который влияет на содержание сахара в крови.

Недостаток цинка в организме проявляется следующими симптомами: - замедление роста у детей - позднее половое созревание - импотенция у мужчин и стерильность у женщин - плохое заживление ран - раздражительность и потеря памяти - появление угрей - очаговое выпадение волос - потеря аппетита, вкусовых ощущений и обоняния - ломкость ногтей - частые инфекции - нарушение усвоения витаминов А, С и Е - повышение уровня холестерина. Важную роль цинк играет в заживлении ран. При дефиците цинка этот процесс идёт медленно в следствии снижения синтеза белка коллагена.

Потребность в цинке (~10 -20 мг/сутки) компенсируется продуктами питания.

Соединения Zn 2+ применяются как вяжущие и прижигающие препараты: • Zn. Cl 2 - прижигающее средство в стоматологии; • Zn. О - в составе присыпок; • 0, 25% Zn. SO 4 - в глазных каплях.
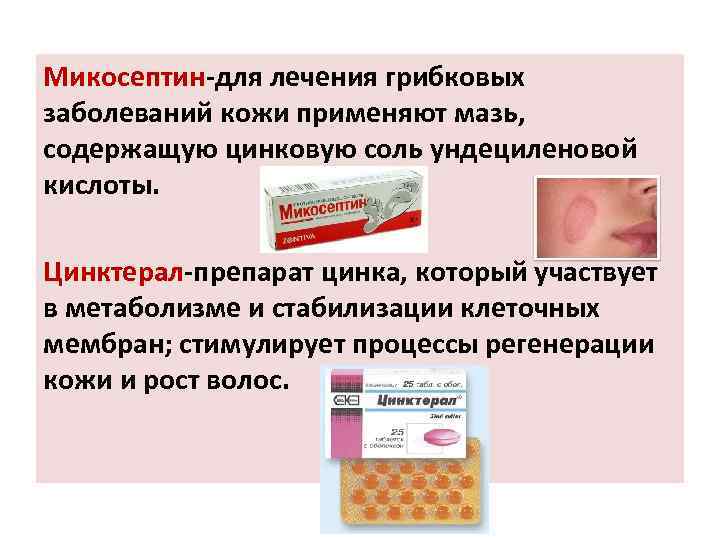
Микосептин-для лечения грибковых заболеваний кожи применяют мазь, содержащую цинковую соль ундециленовой кислоты. Цинктерал-препарат цинка, который участвует в метаболизме и стабилизации клеточных мембран; стимулирует процессы регенерации кожи и рост волос.

Глюконат цинка-входит в состав фермента - Глюконат цинка супероксид дисмутазы, препятствующего внутриклеточному образованию свободных радикалов в процессе окислительновосстановительных реакций; способствует синтезу белка и формированию соединительной ткани; нормализует функцию предстательной железы; Ацизол- препятствует образованию Ацизолкарбоксигемоглобина снижает выраженность интоксикации при отравлении оксидом углерода восполняет дефицит цинка в организме.

Кадмий (Cd) и ртуть (Hg) содержание Cd - 0, 6 ммоль; Hg - 0, 18 ммоль; примесные микроэлементы, обнаруживаются в печени и почках. Их участие в ферментативных процессах до конца не изучено, но при попадании в организм они оказывают ингибирующее действие на целый ряд ферментов. • Сулема (Hg. Cl 2) - один из сильнейших ядов и доза 0, 2 - 0, 3 г является смертельной. • Токсичны металлические Hg и Cd.

Это объясняется тем, что ионы этих металлов взаимодействуют с - SH группами аминокислотных остатков, образуя нерастворимые соединения, и т. о. разрушают белки. Кроме того, ионы этих металлов могут замещать Cа 2+ в составе гидроксиапатита костной ткани и нарушать фосфорно-кальциевый обмен организма. ПДК Hg = 0, 0005 мг/дм 3; ПДК Cd = 0, 001 мг/дм 3.
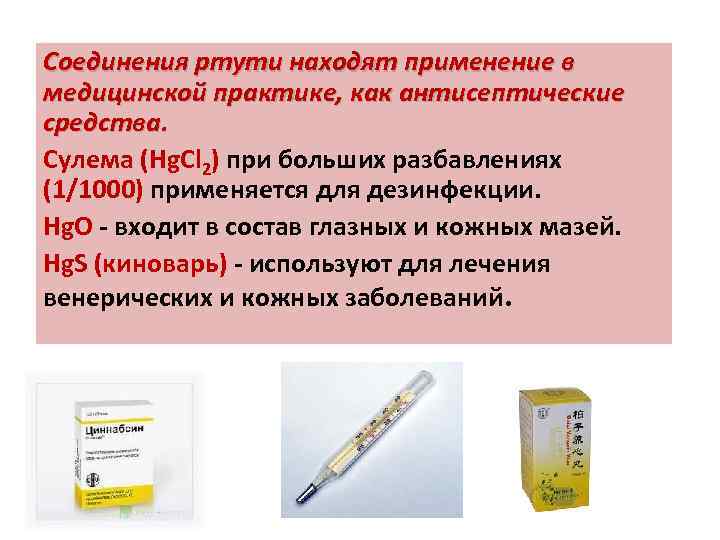
Соединения ртути находят применение в медицинской практике, как антисептические средства. Сулема (Hg. Cl 2) при больших разбавлениях (1/1000) применяется для дезинфекции. Hg. О - входит в состав глазных и кожных мазей. Hg. S (киноварь) - используют для лечения венерических и кожных заболеваний.
![d - ЭЛЕМЕНТЫ VI -Б ГРУППЫ: ХРОМ(Cr), МОЛИБДЕН(Mo), ВОЛЬФРАМ(W) Cr [Ar] 4 s 13 d - ЭЛЕМЕНТЫ VI -Б ГРУППЫ: ХРОМ(Cr), МОЛИБДЕН(Mo), ВОЛЬФРАМ(W) Cr [Ar] 4 s 13](https://present5.com/presentation/101821962_180068675/image-44.jpg)
d - ЭЛЕМЕНТЫ VI -Б ГРУППЫ: ХРОМ(Cr), МОЛИБДЕН(Mo), ВОЛЬФРАМ(W) Cr [Ar] 4 s 13 d 54 p 0 - провал электрона Mo [Kr] 5 s 14 d 55 p 0 - провал электрона W [Xe] 6 s 25 d 46 p 0 Сумма валентных электронов = 6, что определяет максимальную валентность VI и степень окисления +6 в соединениях. Самым активным металлом является хром.

Общий набор степеней окисления от +2 до +6. Наиболее устойчивы соединения со степенью окисления +3 и +6. Например оксиды Cr 2 O 3, Cr. O 3. Им соответствуют гидроксиды – Cr(OH)3 - амфотерный гидроксид и H 2 Cr 2 O 7 – кислота.
d - элементы VI -Б группы образуют комплексные соединения, проявляя координационное число 6, что соответствует sp 3 d 2 - гибридизации, хотя известны комплексы с к. ч. = 4; 8; 9. Все три металла являются микроэлементами живых организмов.

Хром (Cr) -в организме человека содержится около Хром (Cr) 6 мг хрома, при этом в тканях органов содержание хрома больше, чем в крови. Наибольшее количество хрома присутствует в почках( 0, 6 мкг/кг) щитовидной железе (0, 3 мкг/кг) печени( 0, 2 мкг/кг) легких(в случае поступления с воздухом). Выводится из организма через мочеполовую систему(80%), кожные покровы и легкие (19%)

• Биологическая роль Cr 3+ связана с его влиянием на фактор толерантности к глюкозе, активность которого падает при дефиците хрома, что проявляется в гипергликемии и гликозурии. • Хром способен влиять на гомеостаз холестерина и некоторых аминокислот, способствует выведению из организма токсинов. • Потребность в хроме ~50 -200 мкг/сутки. • Содержится в овощах, ягодах, фруктах, рыбе, печени, яйцах, чёрном перце. • Его соединения оказывают токсичное и канцерогенное действие, вызывая дерматиты.

Биологическая роль хрома Участвует в регуляции углеводного и липидного обмена. ü Поддерживает нормальную толерантность к глюкозе. ü Образует активный комплекс с инсулином. ü Участвует в регуляции метаболизма холестерина. ü Активатор ряда ферментов(трипсина, фосфоглюкомутазы ит. д. ) ü Способствует нормальному формированию детского организма. ü

ДЕФИЦИТ ХРОМА Причины дефицита: Ø Недостаточное поступление извне; Ø Ø Нарушение регуляции обмена; Повышенное расходование (напр. , беременность); Усиленное выведение из организма, в условиях повышенного содержания в пище углеводов; Увеличение выведения с мочой в результате повышенных физических нагрузок Проявления дефицита Ø Утомляемость, беспокойство, бессонница; Ø Невралгии и сниженные чувствительности конечностей; Ø Нарушение мышечной координации; Ø Повышение уровня холестерина, триглицеридов в крови; Ø Изменение массы тела; Ø Изменение уровня глюкозы в крови (гипергликемия, гипогликемия); Ø Увеличение риска развития сахарного диабета; Ø Увеличение риска развития ишемической болезни сердца;

Повышенное содержание хрома в организме Причины избытка: избыточное поступление извне (повышенная концентрация в воздухе, избыточный прием с хромсодержащими биодобавками); Ø Проявление избытка: Воспалительные заболевания с тенденцией к изъязвлению слизистых оболочек (перфорации носовой перегородки); ØАллергизирующее действие; Ø Дерматиты и экземы; Ø усиленное всасывание при недостатке цинка и железа; Ø нарушение регуляции обмена хрома. Ø Ø Астматический бронхит, бронхиальная астма; Ø Астеноневротические расстройства

Коррекция содержания хрома в организме При недостатке: Рекомендуется применять биологически активные добавки, содержащие аспаргинат(Cr³⁺). При интоксикации хромом и его соединениями: Необходимо прекратить его поступление в организм, провести соответствующее лечение. При прямом контакте с соединениями хрома необходимо принимать душ с раствором Сa. Na₂ЭДТА. Норма содержания хрома в организме человека: 6 -12 мг; Токсическая доза - 200 мг; Летальная доза – более 3, 0 гр.

Основные пищевые источники хрома: пивные дрожжи, мясо птицы, печень, яичный желток, проросшие зерна пшеницы, сыр, кукурузное масло, моллюски, некоторые спиртные напитки.

Молибден (Mo) - один из десяти металлов жизни, общее содержание в организме ~ 4, 2 мг (0, 044 ммоль). Он является единственным тяжёлым металлом V периода относящимся к металлам жизни. Благодаря набору различных степеней окисления (от +2 до +6), молибден участвует в различных биохимических процессах и существует в различных формах.

Биологическая роль молибдена 1. Для молибдена характерно большое сродство к кислороду, что определяет существование оксосоединений - комплексов: [Mo+6 O 3[En]2]0. 2. Молибден связывается с аминокислотами и белками через - SH-группы, -OH, - COOH-группы. 3. Он входит в состав семи ферментов организма, которые катализируют окислительно -восстановительные реакции - т. е. оксидазы. 4. Молибденсодержащие ксантиндегидрогеназа, ксантиноксидаза и другие ферменты катализируют реакции, связанные с переносом кислорода.
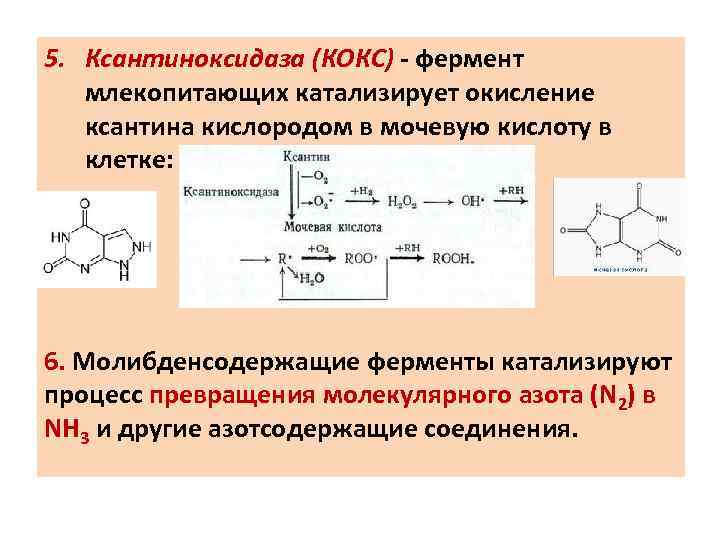
5. Ксантиноксидаза (КОКС) - фермент млекопитающих катализирует окисление ксантина кислородом в мочевую кислоту в клетке: 6. Молибденсодержащие ферменты катализируют процесс превращения молекулярного азота (N 2) в NH 3 и другие азотсодержащие соединения.

Человеку в сутки требуются 75 -250 мкг молибдена, в зависимости от физической нагрузки и массы тела. При обычном пищевом рационе в наш организм попадает от 50 до 100 мкг молибдена, то есть обычный рацион питания обеспечивает минимально необходимое потребление данного микроэлемента. Наибольшее количества молибдена содержится в молочных продуктах, высушенных бобах, капусте, шпинате, крыжовнике, черной смородине, печени, почках.

d-элементы VII-Б группы Mn ( марганец), Tc ( технеций), Re (рений) Из элементов этой группы в природе наиболее распространен Mn. Re относится к редким и рассеянным элементам. Tc- радиоактивный элемент, в природе практически не встречается, получен искусственным путем. Общая электронная формула: n. S 2 (n-1)d 5 Возможны валентные состояния II, IV, VII и переменные степени окисления: +2, +3, +4, +6, +7.

Соединения с низшей степенью окисления +2 проявляют основные и восстановительные свойства: Mn(OH)2; Mn+2 -5 e ←→ Mn+7 В растворах существуют в виде кaтионов (Mn+2 ). Соединения с высшей степенью окисления проявляют кислотные и окислительные свойства. В растворах существуют в виде анионов. HMn+7 O 4 - марганцевая кислота Mn. O-4+ 8 H++5 e- = Mn 2++ 4 H 2 O Еов =+ 1, 52 В

Соединения с промежуточными степенями окисления проявляют амфотерные свойства: Mn+4 O 2 - амфотерный оксид В биологических системах не существуют соединения Mn в высших степенях окисления +6 и +7, что объясняется их сильными окислительными свойствами.

Mn -марганец- биогенный Mn марганец элемент, один из десяти металлов жизни, с общим содержанием в органах и тканях взрослого человека (масса тела 70 кг) содержится около 20 мг марганца (~ 0, 36 ммоль). Концентрируется в костной ткани, печени, почках, поджелудочной железе. Наиболее богаты марганцем трубчатые кости и печень (на 100 г свежего вещества в трубчатых костях марганца содержится 0, 3 мг, в печени - 0, 205 -0, 170 мг).

БИОЛОГИЧЕСКАЯ РОЛЬ МАРГАНЦА 1. В организме Mn 2+ образует комплексы с белками, нуклеиновыми кислотами (РНК, ДНК), АК, проявляя координационные числа 4, 6. 2. Эти комплексы являются составной частью металлоферментов, участвующих в синтезе витаминов, гемоглобина, мочевины и других процессах. • Аргиназа (АРГ) - фермент крови, участвует в процессе ее свертывания. • Фосфоглюкомутаза - участвует углеводном обмене на стадии распада гликогена.

3. Известны данные, что Mn участвует в процессах аккумуляции и переносе энергии в организме, расщеплении нуклеиновых кислот в двенадцатиперстной кишке. 4. Марганец важен для репродуктивных функций и нормальной работы центральной нервной системы. 5. Марганец помогает устранить половое бессилие, улучшить мышечные рефлексы, предотвратить остеопороз, улучшить память и уменьшить нервную раздражительность.

Суточная потребность в марганце составляет 5 -7 мг. Наиболее богаты марганцем чай, красная свекла, морковь, печень, картофель.


Причины дефицита марганца в организме: 1. Недостаточное поступление марганца извне (неадекватное питание, снижение потребления богатых марганцем продуктов, в частности, растительной пищи). 2. Избыточное поступление в организм фосфатов (лимонады, консервы) и усиленное выведение марганца под влиянием избыточного содержания в организме кальция, меди и железа. 3. Загрязнение организма различными токсинами (цезий, ванадий).

Основные проявления дефицита марганца: 1. Утомляемость, слабость, головокружение, плохое настроение. 2. Ухудшение процессов мышления, способности к принятию быстрых решений, снижение памяти. 3. Нарушения сократительной функции мышц, склонность к спазмам и судорогам, боли в мышцах, двигательные расстройства. 4. Дегенеративные изменения суставов, задержка роста ногтей и волос. 5. Снижение уровня "полезного" холестерина в крови, нарушение толерантности к глюкозе, нарастание избыточного веса, ожирение.

Токсичность соединений марганца 1. Токсическая доза для человека: 40 мг марганца в день. 2. Главные признаки интоксикации марганца у животных – угнетение роста, сниженный аппетит, нарушение метаболизма железа и изменение функции мозга. 3. Интоксикация у людей наблюдается в результате хронической ингаляции больших количеств марганца на производстве. Возникают тяжелые нарушения психики, включая гиперраздражительность, гипермоторику и галлюцинации – "марганцевое безумие".

В медицинской практике наиболее широкое применение находят: KMn. O 4 - 5% раствор - кровеостанавливающее средства, обладает коагулирующим действием на белки. KMn. O 4 - 0, 01% раствор - антисептический раствор, благодаря сильным окислительным характеристикам. Mn. Cl 2 и Mn. SО 4 -в комплексе с другими компонентами применяются для лечения анемии.

Опасность соединений марганца 1. Соединения марганца относятся к числу сильных протоплазматических ядов. Они действуют на центральную нервную систему, вызывая в ней органические изменения, поражают почки, легкие, органы кровообращения и т. д. 2. При использовании концентрированных растворов перманганата калия для полоскания горла может наступить отек слизистых оболочек рта и глотки. 3. Прием внутрь концентрированных растворов соединений марганца может быть причиной перфорации желудка. 4. Соединения марганца могут вызвать отек голосовых связок и т. д. При попадании концентрированных растворов соединений марганца в матку, влагалище, мочевой пузырь может появиться угроза перитонита.

d-элементы VIII-Б группы Эту группу составляют 9 элементов: n=4 Fe, Со, Ni железо кобальт никель n=5 Ru, Rh, Pd рутений родий палладий n=6 Os, Jr Pt осмий иридий платина

Они объединены в VII-Б группу по совокупности физико-химических свойств, при этом общие закономерности более четко проявляются по горизонтали, чем по вертикали. • Поэтому Fe, Co, Ni объединены в семейство железа. • Остальные 6 элементов образуют семейство платины.
![Семейство железа Fe [Ar]4 s 23 d 64 p 0 Co [Ar]4 s 23 Семейство железа Fe [Ar]4 s 23 d 64 p 0 Co [Ar]4 s 23](https://present5.com/presentation/101821962_180068675/image-73.jpg)
Семейство железа Fe [Ar]4 s 23 d 64 p 0 Co [Ar]4 s 23 d 74 p 0 Ni [Ar]4 s 23 d 84 p 0 В этом ряду незначительно уменьшается радиус атома и энергия ионизации, а увеличение электроотрицательности указывает на некоторое уменьшение основных и восстановительных свойств. Химически наиболее активный металл - железо.

• В соединениях проявляют степени окисления +2 и +3. Для железа и кобальта наиболее устойчивы соединения +3, а для никеля +2. • Восстановительные свойства в ряду. Fe 2+→Co 2+→Ni 2+ уменьшаются. • Образуют комплексы с координационными числами 4 и 6. • Для Fe 2+ , Fe 3+ , Cо 3+ в биологических системах присутствуют комплексы с координационным числом 6.

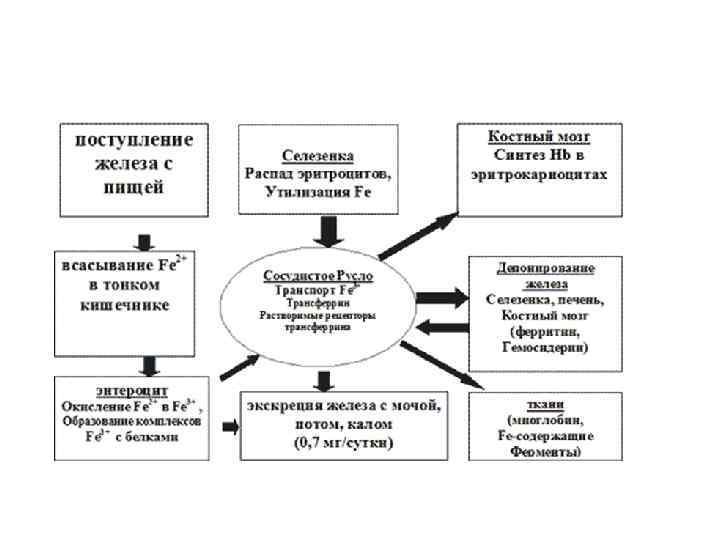
Fe -железо- металл жизни, елезо- Содержание в организме примерно 4 -5 г, около 65% всего железа организма входит в состав крови (гемоглобин и миоглобин). Остаток содержится в селезенке, печени и костном мозге.

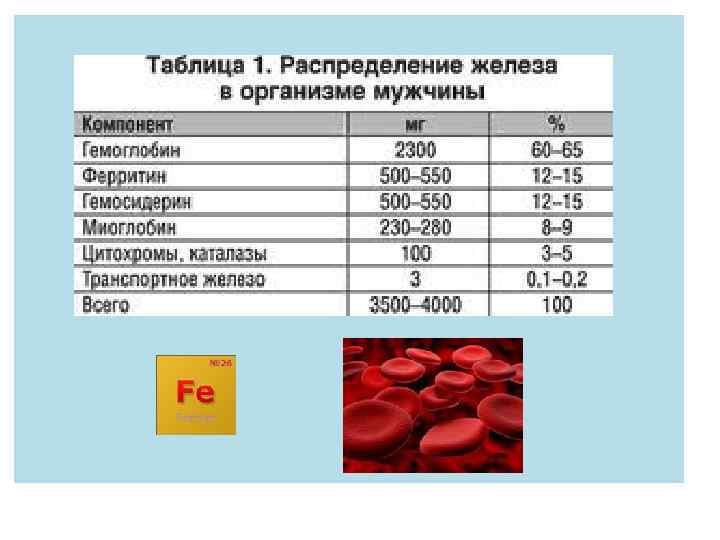

Биологическая роль железа 1. Железо незаменимо в процессах кроветворения и внутриклеточного обмена. 2. входит в состав миоглобина и гемоглобина крови, отвечающего за транспорт кислорода и выполнение окислительных реакций, 3. является составной частью цитохромов и ферментов, принимающих участие в окислительно-восстановительных реакциях, 4. участвует в процессах кроветворения и внутриклеточного обмена 5. нормализует работу щитовидной железы, 6. влияет на метаболизм витаминов группы В,

7. входит в состав некоторых ферментов (в том числе рибонуклеотид-редуктазы, который участвует в синтезе ДНК), 8. необходимо для процессов роста организма. 9. регулирует иммунитет (обеспечивает активность интерферона и клеток-киллеров), 10. оказывает детоксикационное действие (входит в состав печени и принимает участие в обезвреживании токсинов), 11. является компонентом многих окислительных ферментов, 12. предупреждает развитие анемии, 13. улучшает состояние кожи, ногтей, волос.
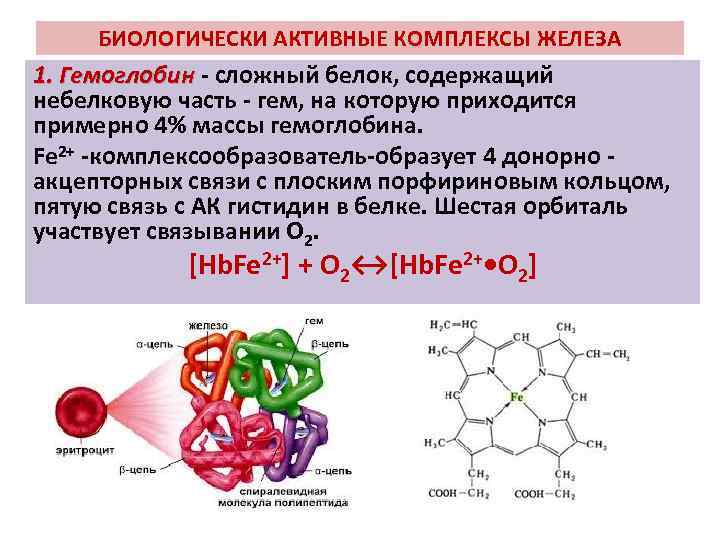
БИОЛОГИЧЕСКИ АКТИВНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА 1. Гемоглобин - сложный белок, содержащий 1. Гемоглобин небелковую часть - гем, на которую приходится примерно 4% массы гемоглобина. Fe 2+ -комплексообразователь-образует 4 донорно - акцепторных связи с плоским порфириновым кольцом, пятую связь с АК гистидин в белке. Шестая орбиталь участвует связывании О 2. [Hb. Fe 2+] + O 2↔[Hb. Fe 2+ • O 2]

2. Структуру подобную гемоглобину имеет миоглобин. Который связывает кислород в мышцах по подобному механизму: Mb. Fe 2+ + O 2 ↔ Mb. Fe 2+·O 2 3. Существует группа железосодержащих ферментов, катализирующих перенос электронов в митохондриях - цитохромы, известно около 50 цитохромов. цитохромы Наиболее изучен цитохром С ЦХ·Fe 3+ +1 e- ↔ ЦХ·Fe 2+

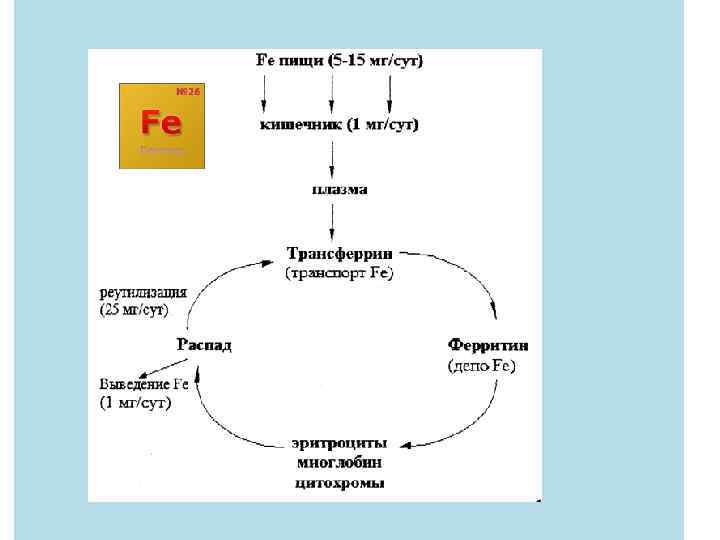
4. Группу ферментов, катализирующих окисление пероксидом водорода называется каталазами и пероксидазами. Они имеют в структуре гем с Fe 3+, который не , восстанавливается. За 1 сек 1 молекула каталазы разлагает до 10 тыс. молекул Н 2 О 2 2 Н 2 О 2 каталаза→ 2 Н 2 О+О 2 5. Железо в организме депонируется в биокластере с белком ферритином. Транспорт железа в организме осуществляется с помощью аминокислотных комплексов, проходящих через клеточные мембраны.

В организм животных и человека железо поступает с пищей (печень, мясо, яйца, бобовые, хлеб, крупы, свёкла). Суточная потребность человека в железе 10 -15 мг.
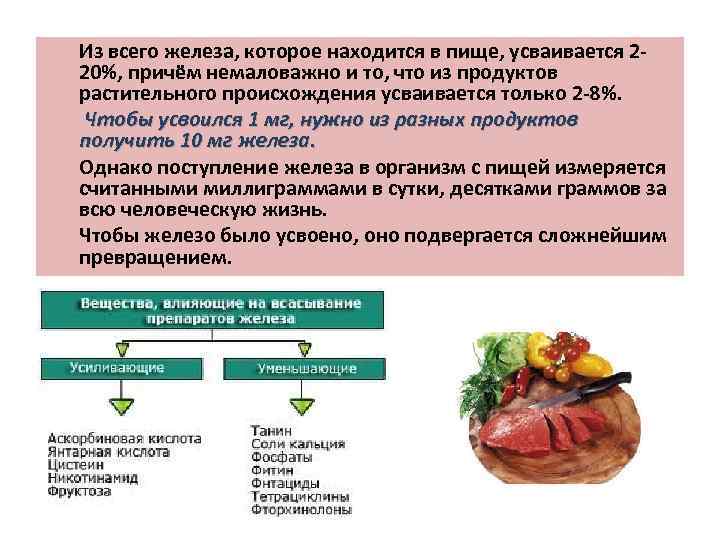
Из всего железа, которое находится в пище, усваивается 220%, причём немаловажно и то, что из продуктов растительного происхождения усваивается только 2 -8%. Чтобы усвоился 1 мг, нужно из разных продуктов получить 10 мг железа. Однако поступление железа в организм с пищей измеряется считанными миллиграммами в сутки, десятками граммов за всю человеческую жизнь. Чтобы железо было усвоено, оно подвергается сложнейшим превращением.
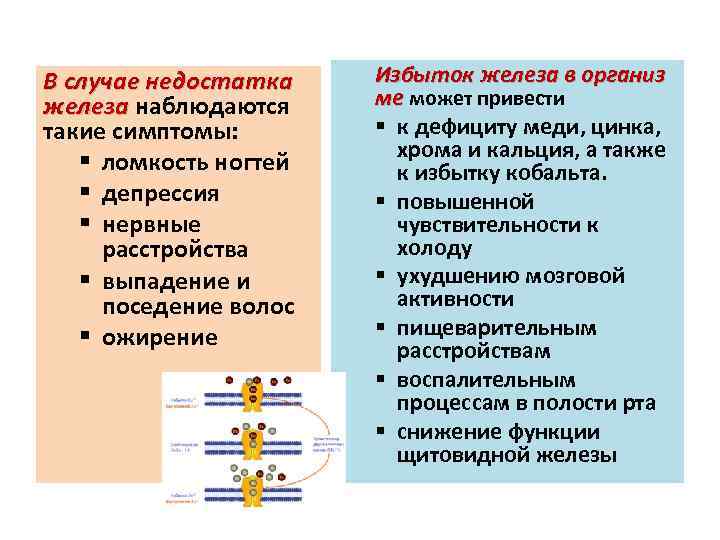
В случае недостатка железа наблюдаются железа такие симптомы: § ломкость ногтей § депрессия § нервные расстройства § выпадение и поседение волос § ожирение Избыток железа в организ ме может привести § к дефициту меди, цинка, хрома и кальция, а также к избытку кобальта. § повышенной чувствительности к холоду § ухудшению мозговой активности § пищеварительным расстройствам § воспалительным процессам в полости рта § снижение функции щитовидной железы

Препараты железа— группа лекарственных средств, содержащих соли или комплексы двух- и трёхвалентного железа. В основном используются для лечения и профилактики железодефицитной анемии. Комбинированные препараты должны содержать не менее 30 мг основного действующего вещества в пересчёте на элементарное железо.

• Fe. Cl 2 - используется в качестве лекарственного средства для лечения и профилактики железодефицитной анемии. В России зарегистрирован под торговой маркой «Гемофер» . • Fe. SO 4 - используется в качестве лекарственного средства для лечения и профилактики железодефицитной анемии. В России зарегистрирован под торговыми марками «Гемофер пролонгатум» , «Тардиферон» .
• Глюконат железа — препарат железа, Глюконат железа восполняет нехватку железа в организме, восстанавливает гемоглобин. При курсовом лечении способствует регрессии клинических и лабораторных симптомов анемии, является высоко абсорбируемой и хорошо переносимой формой железа. • Fe. Cl 3 - кровеостанавливающее средство. -

Кобальт- содержание в Кобальторганизме примерно 1, 5 мг (печень, кости, жировая ткань). Представлен в виде витамина В 12. 12 Это биоэнергетическое комплексное соединение порфирина и Со 3+ с координационным числом 6. В 12 (цианкобаламин)относят к антианемическим витаминам, при его недостатке развивается макроцитарная анемия.

Витамин В 12 - самый удивительный среди всех витаминов, поскольку является единственным, в составе которого присутствует металл - ион кобальта. ü Он активно защищает наш организм от накопления лишнего жира в печени и от ожирения; ü укрепляет иммунитет, приводит в норму пониженное кровяное давление, а также недавно стало известно, что он очень важен и для образования костной ткани. ü От витамина В 12 зависят также работа мозга и эмоциональное равновесие, поэтому он предотвращает развитие депрессии, снижает раздражительность, избавляет от бессонницы, помогает адаптироваться к смене режима дня, поддерживает нервную систему в здоровом состоянии.

ü Витамин В 12 обеспечивает также здоровье пищеварительной системы, регулирует процесс кроветворения, улучшает концентрацию, память и равновесие. ü Цианокобаламин является одним из веществ, необходимых для здоровья репродуктивных органов мужчин и женщин. ü Это единственный витамин, синтез которого осуществляется исключительно микроорганизмами. ü Депо В 12 в организме человека - печень, он синтезируется микрофлорой кишечника или поступает с животной пищей.

В природе источником образования витамина В 12 является синтез его бактериями и синезелеными водорослями, питаясь которыми различные водные животные (рыбы, моллюски) накапливают его в своем организме, а затем служат источником витамина В 12 в питании других животных и человека. Пивные дрожжи – это живые микроорганизмы, которые также могут синтезировать витамин В 12. Больше всего находится в говяжьей и телячьей печени, яичных желтках, почках, молоке, сардинах, сельди, лососе , устрицах, крабах, немного меньше в мясе – свинине, говядине, курице, кисломолочных продуктах, твёрдом сыре.

Суточная потребность в витамине - 2, 5 -5 мкг.

Недостаток витамина В 12 Явными признаками недостаточного количества витамина В 12 в организме являются • сонливость и раздражительность, • головные боли, расстройства памяти и зрения, нарушение координации движений, • частые респираторные инфекции дыхательных путей, а значительное снижение витамина В 12 может привести • к серьезному повреждению нервной системы и мозга, развитию нервных заболеваний, в том числе и тяжёлых • к образованию поврежденных ДНК, что может привести к анемии (малокровию) • вызывает заболевания желудочно-кишечного тракта, так как пища усваивается хуже, нарушается свертываемость крови.
Соединения Co применяют для лечения анемии (коамид). • 60 Co- применяют для лечения злокачественных опухолей.

СЕМЕЙСТВО ПЛАТИНЫ • Семейство платины - это шесть элементов VIII -Б группы: рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir, платина Pt. В природе рассеяны, встречаются редко, относятся к тяжёлым металлам. • Небольшие радиусы атомов и стабильность d - подуровня определяют их низкую химическую активность, их соединения проявляют амфотерные свойства.

Образуют комплексные соединения с к. ч. = 4 и 6. В организме элементы не играют существенной роли. Соединения Pt 4+ и Pt 2+ в комплексах с С 6 Н 5 NH 2, Cl-, NH 3 обладают противоопухолевым действием, например цис – ДДП. Платину используют для изготовления электродов, термометров.

Благодарю за внимание!
D-elementy.pptx