Коллоидная химия Ч2.ppt
- Количество слайдов: 53
 ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ Коллоидные растворы (часть 2) 1. Электрические свойства коллоидных растворов 2. Молекулярно-кинетические свойства коллоидных растворов. 3. Оптические свойства коллоидных растворов. Лектор: Ирина Петровна Степанова, зав. кафедрой химии, доктор биологических наук, профессор
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ Коллоидные растворы (часть 2) 1. Электрические свойства коллоидных растворов 2. Молекулярно-кинетические свойства коллоидных растворов. 3. Оптические свойства коллоидных растворов. Лектор: Ирина Петровна Степанова, зав. кафедрой химии, доктор биологических наук, профессор
 Электрические свойства коллоидных растворов • Наличие электрического заряда на коллоидных частицах впервые было установлено Ф. Ф. Рейссом (1807 г. ). • Опыт Рейсса заключался в следующем: В слой влажной глины помещали две стеклянные трубки заполненные водой. В трубки опускали электроды, подключенные к источнику постоянного тока.
Электрические свойства коллоидных растворов • Наличие электрического заряда на коллоидных частицах впервые было установлено Ф. Ф. Рейссом (1807 г. ). • Опыт Рейсса заключался в следующем: В слой влажной глины помещали две стеклянные трубки заполненные водой. В трубки опускали электроды, подключенные к источнику постоянного тока.
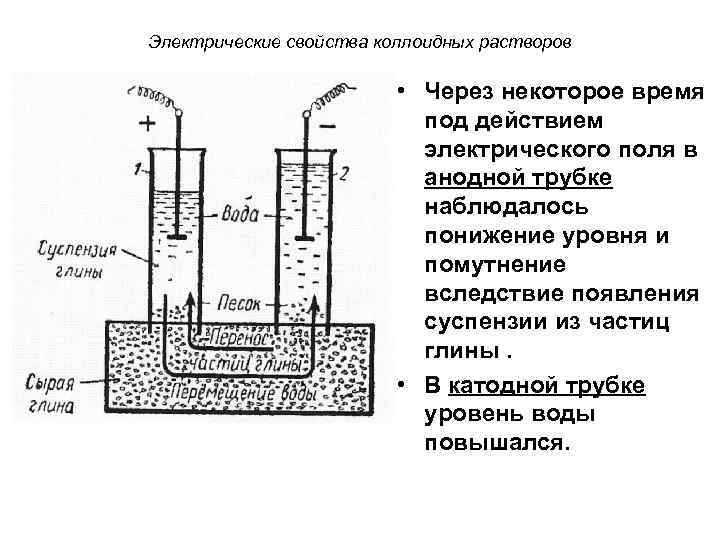 Электрические свойства коллоидных растворов • Через некоторое время под действием электрического поля в анодной трубке наблюдалось понижение уровня и помутнение вследствие появления суспензии из частиц глины. • В катодной трубке уровень воды повышался.
Электрические свойства коллоидных растворов • Через некоторое время под действием электрического поля в анодной трубке наблюдалось понижение уровня и помутнение вследствие появления суспензии из частиц глины. • В катодной трубке уровень воды повышался.
 Электрические свойства коллоидных растворов • Результаты опыта свидетельствовали о том, что коллоидные частицы глины несут отрицательный заряд, так как перемещаются к положительно заряженному электроду – аноду.
Электрические свойства коллоидных растворов • Результаты опыта свидетельствовали о том, что коллоидные частицы глины несут отрицательный заряд, так как перемещаются к положительно заряженному электроду – аноду.
 Электрические свойства коллоидных растворов • Перемещение дисперсной фазы или дисперсионной среды под действием внешнего электрического поля называют электрокинетическими явлениями. • Причина электрокинетических явлений – образование ДЭС на границе раздела дисперсной фазы и дисперсионной среды и, как следствие, наличие электрического заряда у частиц дисперсной фазы и дисперсионной среды.
Электрические свойства коллоидных растворов • Перемещение дисперсной фазы или дисперсионной среды под действием внешнего электрического поля называют электрокинетическими явлениями. • Причина электрокинетических явлений – образование ДЭС на границе раздела дисперсной фазы и дисперсионной среды и, как следствие, наличие электрического заряда у частиц дисперсной фазы и дисперсионной среды.
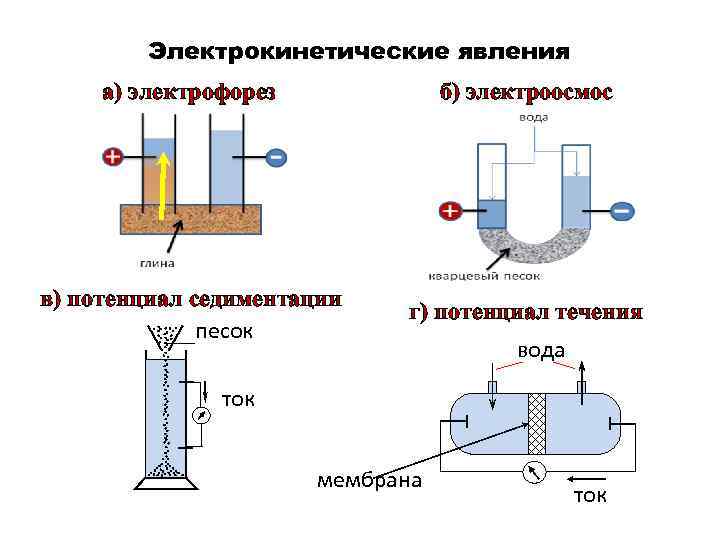 Электрокинетические явления а) электрофорез б) электроосмос в) потенциал седиментации г) потенциал течения песок вода ток мембрана ток
Электрокинетические явления а) электрофорез б) электроосмос в) потенциал седиментации г) потенциал течения песок вода ток мембрана ток
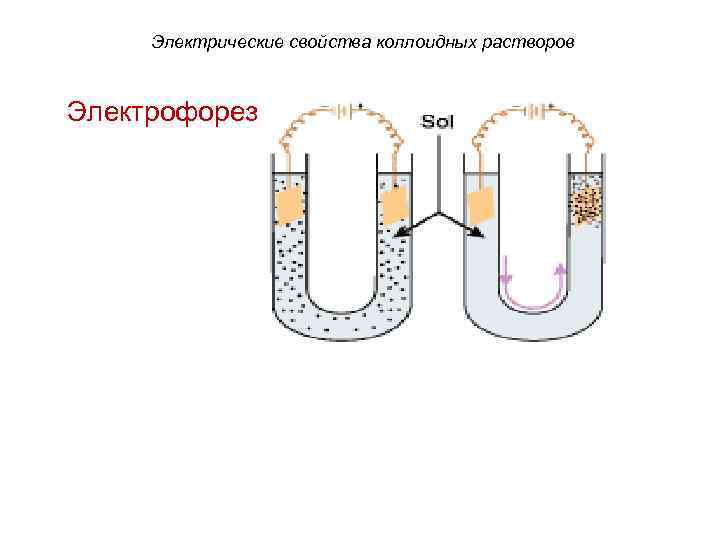
 Электрические свойства коллоидных растворов Направленное движение частиц дисперсной фазы относительно неподвижной дисперсионной среды под действием внешнего электрического поля называют электрофорезом, а перемещение дисперсионной среды относительно неподвижной дисперсной фазы – электроосмосом.
Электрические свойства коллоидных растворов Направленное движение частиц дисперсной фазы относительно неподвижной дисперсионной среды под действием внешнего электрического поля называют электрофорезом, а перемещение дисперсионной среды относительно неподвижной дисперсной фазы – электроосмосом.
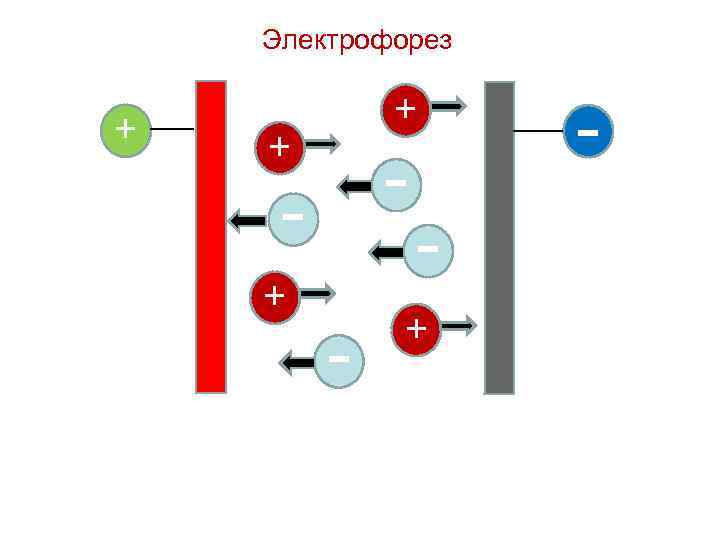 Электрофорез + + - - + - +
Электрофорез + + - - + - +
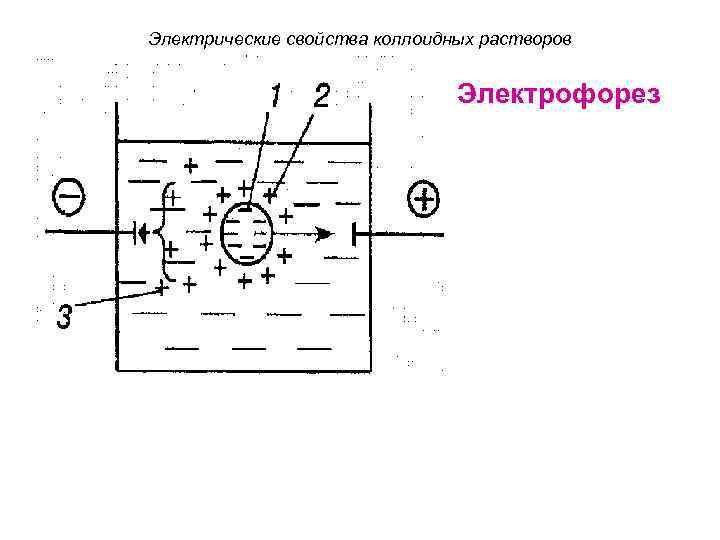 Электрические свойства коллоидных растворов Электрофорез
Электрические свойства коллоидных растворов Электрофорез
 Электрические свойства коллоидных растворов Электрофорез
Электрические свойства коллоидных растворов Электрофорез
 Уравнение Гельмгольца-Смолуховского: где U 0 – скорость электрофореза, м/с; ε – относительная диэлектрическая проницаемость среды; ε 0 – электрическая постоянная, 8, 9∙ 10 -12 А с/В м; Δφ – разность потенциалов, В; ζ – электрокинетический потенциал, В; k – коэффициент, зависящий от формы частиц; η – вязкость дисперсионной среды, Н с/м 2 ; l –расстояние между электродами, м;
Уравнение Гельмгольца-Смолуховского: где U 0 – скорость электрофореза, м/с; ε – относительная диэлектрическая проницаемость среды; ε 0 – электрическая постоянная, 8, 9∙ 10 -12 А с/В м; Δφ – разность потенциалов, В; ζ – электрокинетический потенциал, В; k – коэффициент, зависящий от формы частиц; η – вязкость дисперсионной среды, Н с/м 2 ; l –расстояние между электродами, м;
 Электрофорез Для сравнения способности к электрофорезу различных ДС пользуются величиной, называемой электрофоретической подвижностью (Uэф). Это отношение скорости электрофореза U 0 к разности потенциалов электрического поля Δφ. Выражается в м 2/с В.
Электрофорез Для сравнения способности к электрофорезу различных ДС пользуются величиной, называемой электрофоретической подвижностью (Uэф). Это отношение скорости электрофореза U 0 к разности потенциалов электрического поля Δφ. Выражается в м 2/с В.
 Электрические свойства коллоидных растворов. • Явления электрофореза и электроосмоса позволяют определять знак и величину заряда дисперсных частиц. • Установлено что поверхность биомембран несет отрицательный заряд.
Электрические свойства коллоидных растворов. • Явления электрофореза и электроосмоса позволяют определять знак и величину заряда дисперсных частиц. • Установлено что поверхность биомембран несет отрицательный заряд.
 Электрические свойства коллоидных растворов • Электрофорез широко используется в биологии и медицине: • для диагностики многих заболеваний; • разделения аминокислот; • изучения ферментов, антибиотиков и других объектов. • Явления электроосмоса используют • для снятия отеков; • в технике – для осушения болотистых участков местности.
Электрические свойства коллоидных растворов • Электрофорез широко используется в биологии и медицине: • для диагностики многих заболеваний; • разделения аминокислот; • изучения ферментов, антибиотиков и других объектов. • Явления электроосмоса используют • для снятия отеков; • в технике – для осушения болотистых участков местности.
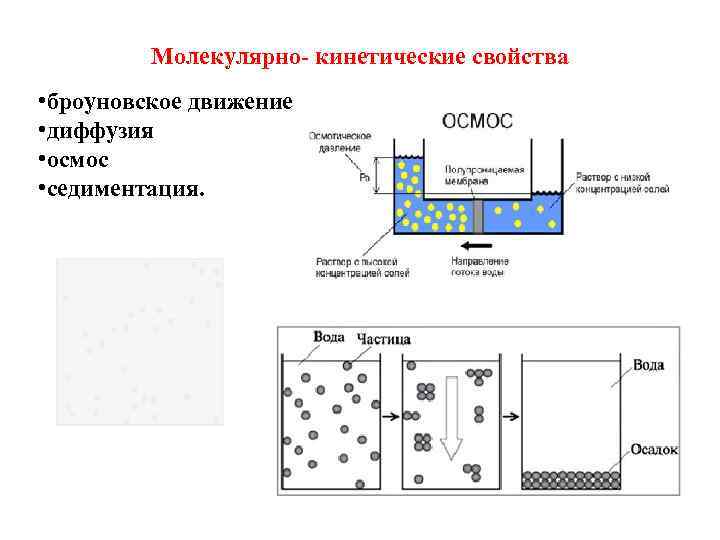
 Молекулярно-кинетические свойства коллоидных растворов Молекулярно- К ним относятся: кинетические • броуновское свойства движение частиц обусловлены • диффузия хаотическим • осмос тепловым движением частиц. • седиментация
Молекулярно-кинетические свойства коллоидных растворов Молекулярно- К ним относятся: кинетические • броуновское свойства движение частиц обусловлены • диффузия хаотическим • осмос тепловым движением частиц. • седиментация
 Молекулярно- кинетические свойства • броуновское движение • диффузия • осмос • седиментация.
Молекулярно- кинетические свойства • броуновское движение • диффузия • осмос • седиментация.
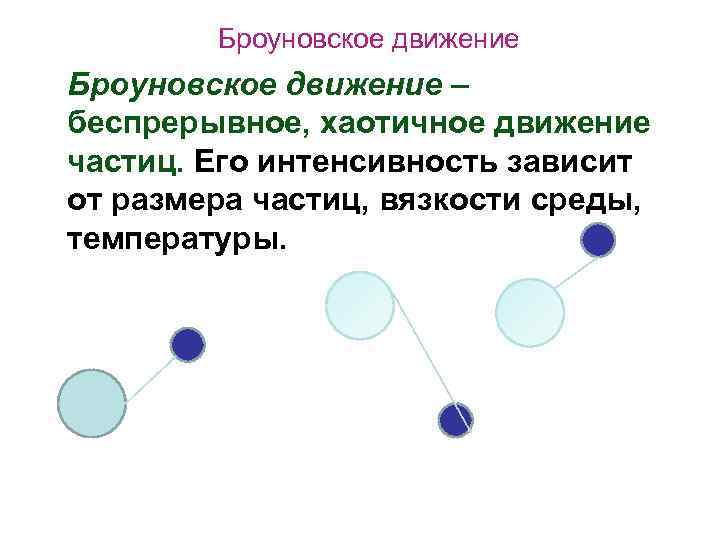 Броуновское движение – беспрерывное, хаотичное движение частиц. Его интенсивность зависит от размера частиц, вязкости среды, температуры.
Броуновское движение – беспрерывное, хаотичное движение частиц. Его интенсивность зависит от размера частиц, вязкости среды, температуры.
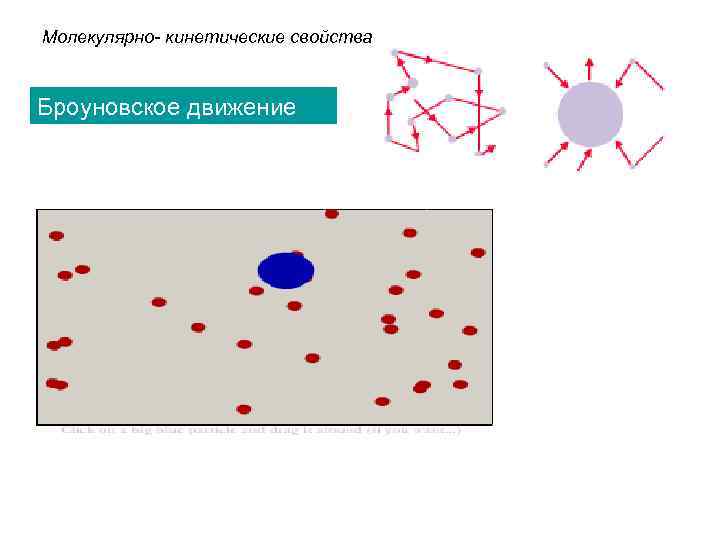 Молекулярно- кинетические свойства Броуновское движение
Молекулярно- кинетические свойства Броуновское движение
 Диффузия • Диффузия – процесс самопроизвольного выравнивания концентрации диспергированного вещества под влиянием теплового хаотичного движения частиц. • Скорость диффузии коллоидных частиц (из-за больших размеров) во много раз меньше скорости диффузии молекул и ионов низкомолекулярных веществ. • Поэтому по скорости диффузии можно определить радиус и степень дисперсности коллоидных частиц.
Диффузия • Диффузия – процесс самопроизвольного выравнивания концентрации диспергированного вещества под влиянием теплового хаотичного движения частиц. • Скорость диффузии коллоидных частиц (из-за больших размеров) во много раз меньше скорости диффузии молекул и ионов низкомолекулярных веществ. • Поэтому по скорости диффузии можно определить радиус и степень дисперсности коллоидных частиц.
 Осмос – это односторонняя диффузия молекул чистого растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в более концентрированный раствор.
Осмос – это односторонняя диффузия молекул чистого растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в более концентрированный раствор.
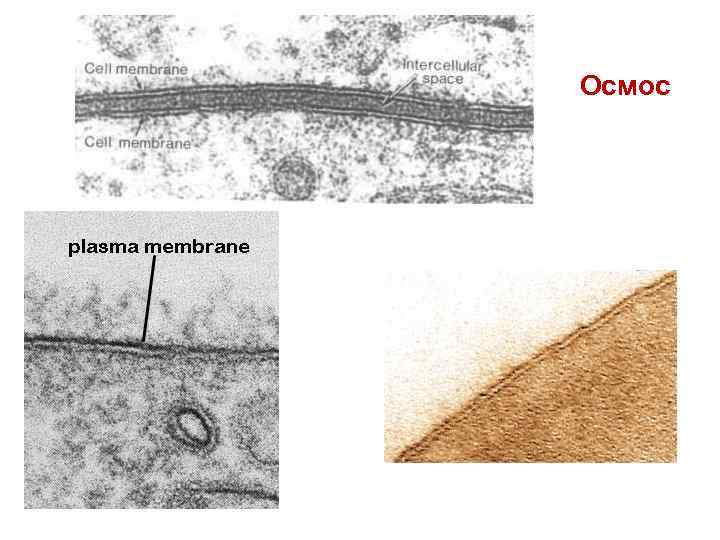 Осмос
Осмос
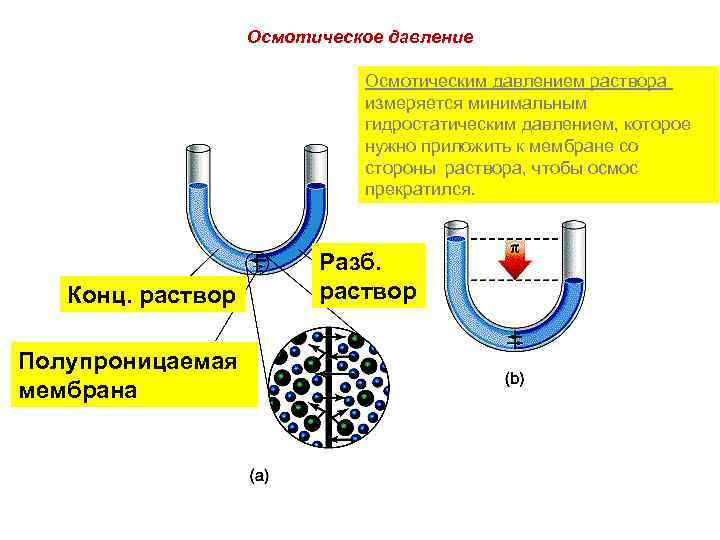 Oсмотическое давление Осмотическим давлением раствора измеряется минимальным гидростатическим давлением, которое нужно приложить к мембране со стороны раствора, чтобы осмос прекратился. Разб. Конц. раствор Полупроницаемая мембрана
Oсмотическое давление Осмотическим давлением раствора измеряется минимальным гидростатическим давлением, которое нужно приложить к мембране со стороны раствора, чтобы осмос прекратился. Разб. Конц. раствор Полупроницаемая мембрана
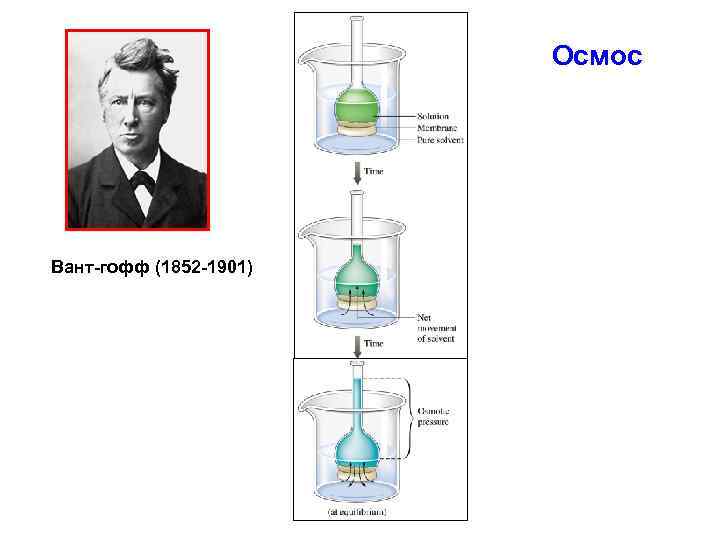 Осмос Вант-гофф (1852 -1901)
Осмос Вант-гофф (1852 -1901)
 Осмотическое давление определяется законом Вант-Гоффа: π = К Б · Сν · Т π – осмотическое давление [Па] КБ - константа Больцмана, КБ = 1, 38 · 10 -23 [Дж· К-1] Сν - частичная концентрация частиц золя [м-3]; Т - абсолютная температура [К].
Осмотическое давление определяется законом Вант-Гоффа: π = К Б · Сν · Т π – осмотическое давление [Па] КБ - константа Больцмана, КБ = 1, 38 · 10 -23 [Дж· К-1] Сν - частичная концентрация частиц золя [м-3]; Т - абсолютная температура [К].
 Осмотическое давление • Осмотическое давление коллоидных растворов имеет особенности: - является низким (из-за больших размеров частиц и низкой концентрации); - меняется во времени (из-за агрегации коллоидных частиц).
Осмотическое давление • Осмотическое давление коллоидных растворов имеет особенности: - является низким (из-за больших размеров частиц и низкой концентрации); - меняется во времени (из-за агрегации коллоидных частиц).
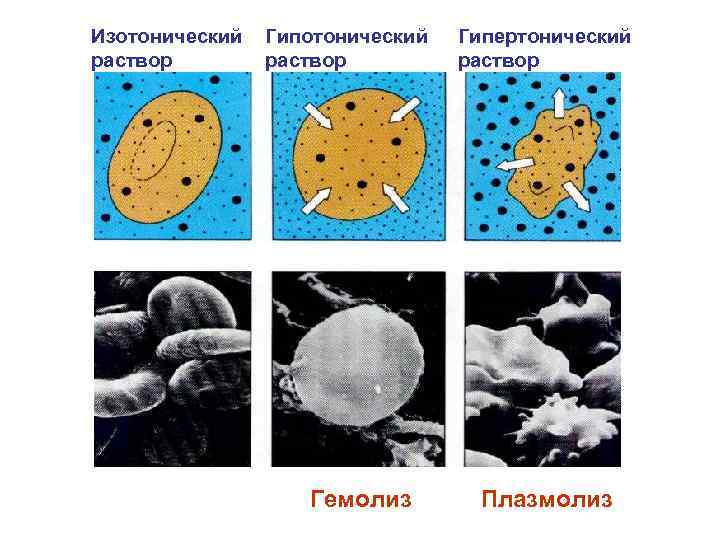 Изотонический Гипертонический раствор Гемолиз Плазмолиз
Изотонический Гипертонический раствор Гемолиз Плазмолиз
 Осмотическое давление
Осмотическое давление
 Седиментация Седиментацией называется оседание коллоидных частиц под действием сил разной природы (гравитационной, центростремительной и др. ).
Седиментация Седиментацией называется оседание коллоидных частиц под действием сил разной природы (гравитационной, центростремительной и др. ).
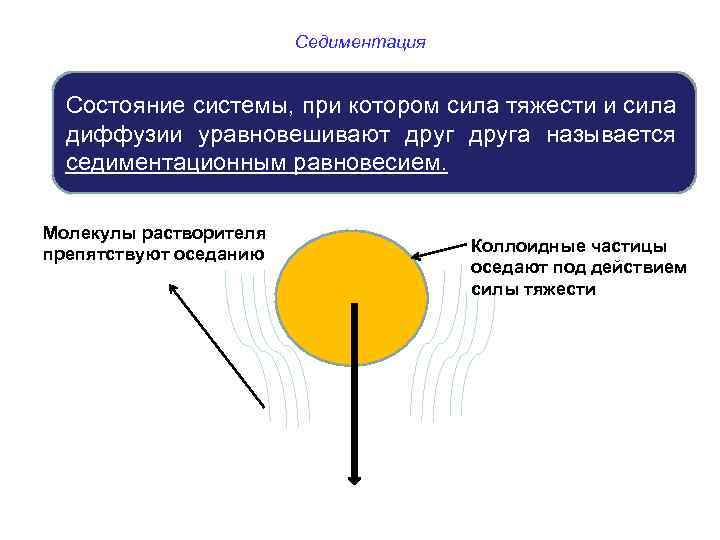 Седиментация Состояние системы, при котором сила тяжести и сила диффузии уравновешивают друга называется седиментационным равновесием. Молекулы растворителя препятствуют оседанию Коллоидные частицы оседают под действием силы тяжести
Седиментация Состояние системы, при котором сила тяжести и сила диффузии уравновешивают друга называется седиментационным равновесием. Молекулы растворителя препятствуют оседанию Коллоидные частицы оседают под действием силы тяжести
 Седиментационное равновесие n 0 – общее число коллоидных частиц; nh - число коллоидных частиц на высоте h; NA=6, 02 · 1023 моль-1; постоянная Авогадро m – масса частиц [кг]; g – ускорение свободного падения. g = 9, 8 м · c-2; h – высота [м]; R – универсальная газовая постоянная T - абсолютная температура [К].
Седиментационное равновесие n 0 – общее число коллоидных частиц; nh - число коллоидных частиц на высоте h; NA=6, 02 · 1023 моль-1; постоянная Авогадро m – масса частиц [кг]; g – ускорение свободного падения. g = 9, 8 м · c-2; h – высота [м]; R – универсальная газовая постоянная T - абсолютная температура [К].
 Седиментация Из уравнения следует, что с увеличением высоты концентрация коллоидных частиц уменьшается (более выражена эта зависимость для тяжелых частиц). Способность дисперсной системы сохранять равномерное распределение частиц по всему объему называется седиментационной или кинетической устойчивостью.
Седиментация Из уравнения следует, что с увеличением высоты концентрация коллоидных частиц уменьшается (более выражена эта зависимость для тяжелых частиц). Способность дисперсной системы сохранять равномерное распределение частиц по всему объему называется седиментационной или кинетической устойчивостью.
 Седиментационная устойчивость
Седиментационная устойчивость
 Седиментация • Биологические жидкости организма – кровь, спинномозговая жидкость, лимфа, слюна и др. – это сложные растворы, содержащие ионы электролитов, коллоидные частицы и макромолекулы ВМВ. • Цельную кровь можно рассматривать как дисперсную систему, в которой форменные элементы: эритроциты, лейкоциты, тромбоциты составляют ДФ, а плазма – ДСр.
Седиментация • Биологические жидкости организма – кровь, спинномозговая жидкость, лимфа, слюна и др. – это сложные растворы, содержащие ионы электролитов, коллоидные частицы и макромолекулы ВМВ. • Цельную кровь можно рассматривать как дисперсную систему, в которой форменные элементы: эритроциты, лейкоциты, тромбоциты составляют ДФ, а плазма – ДСр.
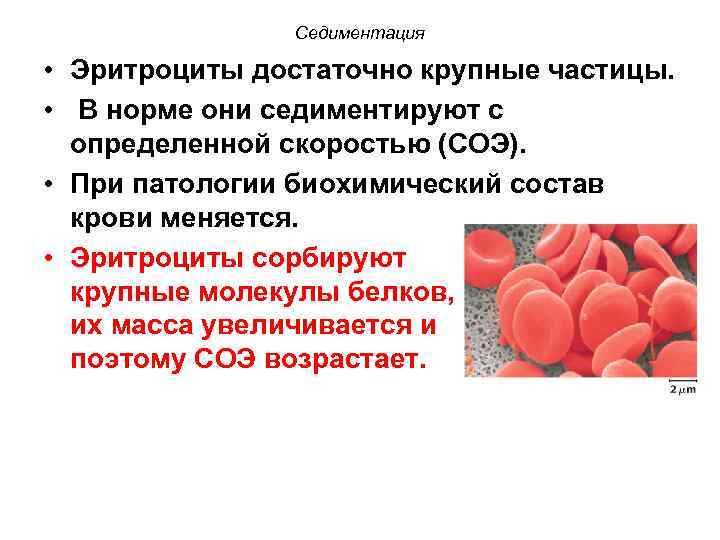 Седиментация • Эритроциты достаточно крупные частицы. • В норме они седиментируют с определенной скоростью (СОЭ). • При патологии биохимический состав крови меняется. • Эритроциты сорбируют крупные молекулы белков, их масса увеличивается и поэтому СОЭ возрастает.
Седиментация • Эритроциты достаточно крупные частицы. • В норме они седиментируют с определенной скоростью (СОЭ). • При патологии биохимический состав крови меняется. • Эритроциты сорбируют крупные молекулы белков, их масса увеличивается и поэтому СОЭ возрастает.
 Оптические свойства коллоидных растворов Для коллоидных растворов диаметр частиц примерно равен длине волны падающего света. В этом случае преобладает дифракционное рассеяние света, так каждая коллоидная частица становится вторичным источником света.
Оптические свойства коллоидных растворов Для коллоидных растворов диаметр частиц примерно равен длине волны падающего света. В этом случае преобладает дифракционное рассеяние света, так каждая коллоидная частица становится вторичным источником света.
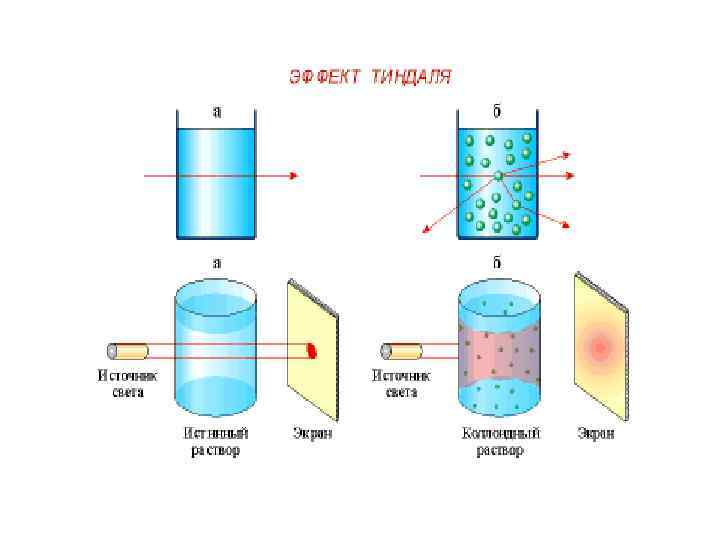
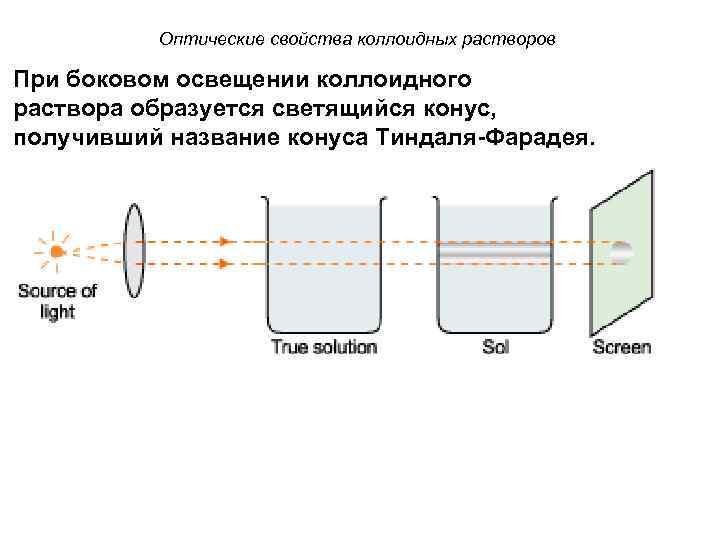 Оптические свойства коллоидных растворов При боковом освещении коллоидного раствора образуется светящийся конус, получивший название конуса Тиндаля-Фарадея.
Оптические свойства коллоидных растворов При боковом освещении коллоидного раствора образуется светящийся конус, получивший название конуса Тиндаля-Фарадея.
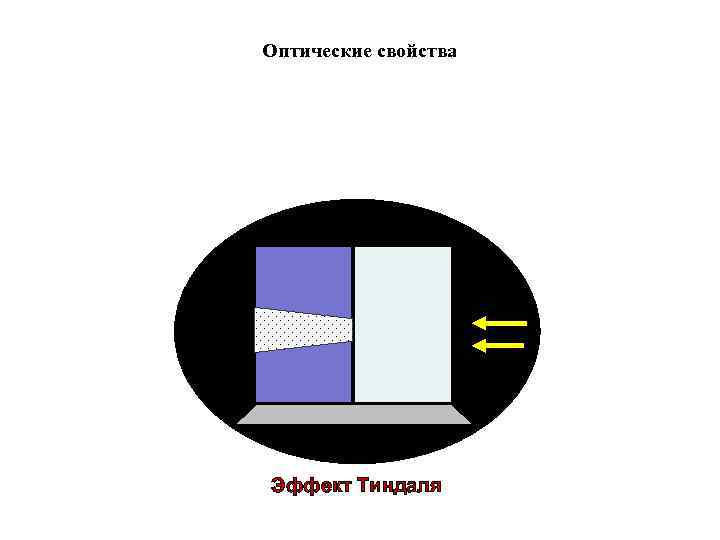 Оптические свойства Эффект Тиндаля
Оптические свойства Эффект Тиндаля




 Оптические свойства Коллоидные растворы серебра, золота, серебра-золота
Оптические свойства Коллоидные растворы серебра, золота, серебра-золота
 Оптические свойства коллоидных растворов Математически рассеяние света выражают уравнением Рэлея: I = I 0 k Сν V 2 / λ 4 I - интенсивность рассеяного света; I 0 - интенсивность падающего света; Сν - частичная концентрация коллоидных частиц [м-3]; V – объем одной коллоидной частицы [м 3]; λ – длина волны падающего света [м]; k – константа, зависящая от показателей преломления ДСр и ДФ.
Оптические свойства коллоидных растворов Математически рассеяние света выражают уравнением Рэлея: I = I 0 k Сν V 2 / λ 4 I - интенсивность рассеяного света; I 0 - интенсивность падающего света; Сν - частичная концентрация коллоидных частиц [м-3]; V – объем одной коллоидной частицы [м 3]; λ – длина волны падающего света [м]; k – константа, зависящая от показателей преломления ДСр и ДФ.
 Оптические свойства коллоидных растворов • Из уравнения Рэлея следует, что интенсивность светорассеяния обратно пропорционально длине волны. • Какая часть спектра лучше рассеивается? • Ответ: Лучше рассеивается коротковолновая часть спектра (синяя и фиолетовая), хуже – длинноволновая (оранжево-красная).
Оптические свойства коллоидных растворов • Из уравнения Рэлея следует, что интенсивность светорассеяния обратно пропорционально длине волны. • Какая часть спектра лучше рассеивается? • Ответ: Лучше рассеивается коротковолновая часть спектра (синяя и фиолетовая), хуже – длинноволновая (оранжево-красная).
 Оптические свойства коллоидных растворов • Визуально наблюдают опалесценцию, т. е. окраска коллоидных растворов в рассеянном свете (при рассмотрении сбоку) и в проходящем свете неодинакова. • Конус Тиндаля при рассмотрении сбоку имеет голубой оттенок, на просвет – красный. • Оптические явления лежат в основе методов изучения дисперсных систем – нефелометрии и ультрамикроскопии.
Оптические свойства коллоидных растворов • Визуально наблюдают опалесценцию, т. е. окраска коллоидных растворов в рассеянном свете (при рассмотрении сбоку) и в проходящем свете неодинакова. • Конус Тиндаля при рассмотрении сбоку имеет голубой оттенок, на просвет – красный. • Оптические явления лежат в основе методов изучения дисперсных систем – нефелометрии и ультрамикроскопии.
 Оптические свойства коллоидных растворов Нефелометрия – метод, используемый для изучения дисперсных систем по интенсивности рассеянного света, которая прямо пропорциональна частичной концентрации коллоидных частиц.
Оптические свойства коллоидных растворов Нефелометрия – метод, используемый для изучения дисперсных систем по интенсивности рассеянного света, которая прямо пропорциональна частичной концентрации коллоидных частиц.
 Оптические свойства коллоидных растворов • Коллоидные частицы видны только в ультрамикроскоп (прибор, позволяющий наблюдать отсветы частиц на темном фоне при боковом освещении).
Оптические свойства коллоидных растворов • Коллоидные частицы видны только в ультрамикроскоп (прибор, позволяющий наблюдать отсветы частиц на темном фоне при боковом освещении).
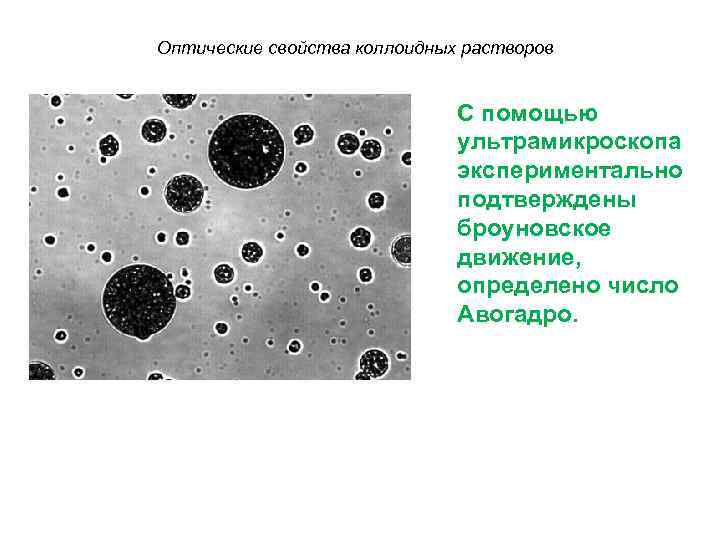 Оптические свойства коллоидных растворов С помощью ультрамикроскопа экспериментально подтверждены броуновское движение, определено число Авогадро.
Оптические свойства коллоидных растворов С помощью ультрамикроскопа экспериментально подтверждены броуновское движение, определено число Авогадро.
 Электронный микроскоп
Электронный микроскоп
 Вопросы для самоконтроля 1. В чем сущность электрофореза и электроосмоса? 2. В чем состоит сущность броуновского движения, диффузии, осмоса? 3. От каких факторов зависит интенсивность каждого из молекулярно- кинетических свойств? 4. Перечислите факторы, от которых зависит интенсивность рассеянного света. 5. Охарактеризуйте оптический метод исследования дисперсных систем - нефелометрию?
Вопросы для самоконтроля 1. В чем сущность электрофореза и электроосмоса? 2. В чем состоит сущность броуновского движения, диффузии, осмоса? 3. От каких факторов зависит интенсивность каждого из молекулярно- кинетических свойств? 4. Перечислите факторы, от которых зависит интенсивность рассеянного света. 5. Охарактеризуйте оптический метод исследования дисперсных систем - нефелометрию?
 Рекомендуемая литература Основная: Физическая и коллоидная химия : учебник для фарм. вузов и фармац. фак. мед. высш. учеб. зав. / Под ред. А. П. Беляева – СПб: ГЭОТАР-Медиа, 2010. - 700 с. Дополнительная: 1. Мушкамбаров Н. Н. Физическая и коллоидная химия : учебник для студ. мед вузов / Н. Н. Мушкамбаров. – СПб: ГЭОТАР-Медиа, 2010. - 440 с. 2. Физическая и коллоидная химия : учебник для студ. фармац. ин-тов и фармац. фак. мед. ин- тов / Под ред. К. И. Евстратовой. – М: Высш. шк. , 1990. - 486 с.
Рекомендуемая литература Основная: Физическая и коллоидная химия : учебник для фарм. вузов и фармац. фак. мед. высш. учеб. зав. / Под ред. А. П. Беляева – СПб: ГЭОТАР-Медиа, 2010. - 700 с. Дополнительная: 1. Мушкамбаров Н. Н. Физическая и коллоидная химия : учебник для студ. мед вузов / Н. Н. Мушкамбаров. – СПб: ГЭОТАР-Медиа, 2010. - 440 с. 2. Физическая и коллоидная химия : учебник для студ. фармац. ин-тов и фармац. фак. мед. ин- тов / Под ред. К. И. Евстратовой. – М: Высш. шк. , 1990. - 486 с.
 Спасибо за Ваше внимание!
Спасибо за Ваше внимание!


