ОМЛ-лекция-студенты.ppt
- Количество слайдов: 48

 ОМЛ у детей Группа разнородных по • патогенезу • клиническому течению и • ответу на цитотоксическую терапию заболеваний в основе которых лежит пролиферация • малигнизированных • более или менее ранних миелоидных предшественников
ОМЛ у детей Группа разнородных по • патогенезу • клиническому течению и • ответу на цитотоксическую терапию заболеваний в основе которых лежит пролиферация • малигнизированных • более или менее ранних миелоидных предшественников
 ОМЛ у детей Эпидемиология 6 -8 / 1 000 в год 20% от всех лейкемий 6% от всех опухолей у детей Взрослые 12 - 20/ 1 000 в год Пожилые 40 -60/ 1 000 в год
ОМЛ у детей Эпидемиология 6 -8 / 1 000 в год 20% от всех лейкемий 6% от всех опухолей у детей Взрослые 12 - 20/ 1 000 в год Пожилые 40 -60/ 1 000 в год
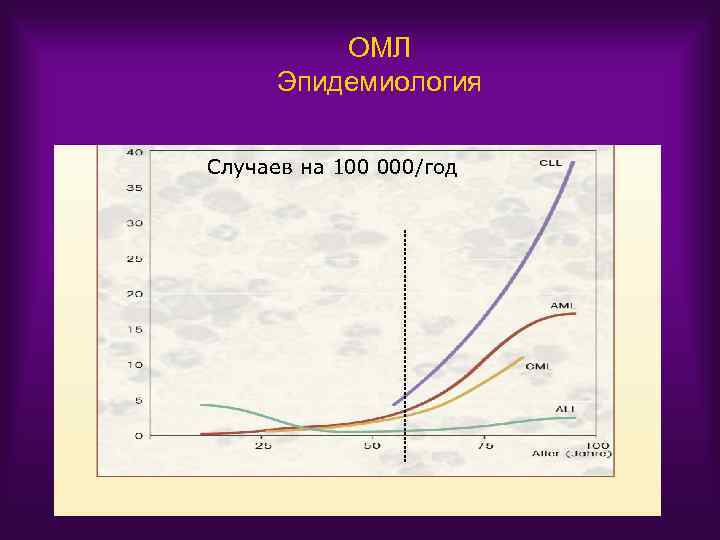 ОМЛ Эпидемиология Случаев на 100 000/год
ОМЛ Эпидемиология Случаев на 100 000/год
 ОМЛ у детей FAB - классификация 1985 ОМЛ – бласты ≥ 30% М 0 - недифферендированный М 1 - миелобластный без дозревания М 2 - миелобластный с дозреванием М 3 - промиелоцитарный М 4 - миеломонобластный М 5 -монобластный М 5 а монобласты > 80% М 5 в монобласты <80% промоноциты >10% М 6 -эритромиелоз М 7 -мегакариоцитарный
ОМЛ у детей FAB - классификация 1985 ОМЛ – бласты ≥ 30% М 0 - недифферендированный М 1 - миелобластный без дозревания М 2 - миелобластный с дозреванием М 3 - промиелоцитарный М 4 - миеломонобластный М 5 -монобластный М 5 а монобласты > 80% М 5 в монобласты <80% промоноциты >10% М 6 -эритромиелоз М 7 -мегакариоцитарный
 ОМЛ у детей Классификация Недостаток FAB-классификации Выделение только 15 - 25% пациентов требующих особого лечения М 4 Ео М 3 М 2 с дозреванием
ОМЛ у детей Классификация Недостаток FAB-классификации Выделение только 15 - 25% пациентов требующих особого лечения М 4 Ео М 3 М 2 с дозреванием
 ОМЛ: Классификация ВОЗ, 1999 год Диагноз ОМЛ • бласты ≥ 20% • любой % бластов при наличии патогномоничных аномалий t (8; 21) inv 16 t(15; 17) t(1; 22)
ОМЛ: Классификация ВОЗ, 1999 год Диагноз ОМЛ • бласты ≥ 20% • любой % бластов при наличии патогномоничных аномалий t (8; 21) inv 16 t(15; 17) t(1; 22)
 ОМЛ: Классификация ВОЗ, 1999 год • Диагноз ОМЛ - бласты 20% • или при любом % бластов при наличии аномалий патогномоничных аномалий ОМЛ с характерными ц/г аномалиями ОМЛ с мультилинейной дисплазией ОМЛ после цитотоксической терапии ОМЛ не вошедшие в другие категории Острый бифенотипический лейкоз
ОМЛ: Классификация ВОЗ, 1999 год • Диагноз ОМЛ - бласты 20% • или при любом % бластов при наличии аномалий патогномоничных аномалий ОМЛ с характерными ц/г аномалиями ОМЛ с мультилинейной дисплазией ОМЛ после цитотоксической терапии ОМЛ не вошедшие в другие категории Острый бифенотипический лейкоз
 ОМЛ: Классификация ВОЗ, 1999 год ОМЛ с характерными ц/г аномалиями t (8; 21)(q 22; q 22) AML/ETO t (15; 17)(q 12; q 11 -12) PML/RAR-α inv 16 или t (16; 16)( p 12; q 23) CBF/MYH 11 аномалии 11 q 23 (MLL)
ОМЛ: Классификация ВОЗ, 1999 год ОМЛ с характерными ц/г аномалиями t (8; 21)(q 22; q 22) AML/ETO t (15; 17)(q 12; q 11 -12) PML/RAR-α inv 16 или t (16; 16)( p 12; q 23) CBF/MYH 11 аномалии 11 q 23 (MLL)
 ОМЛ: Классификация ВОЗ, 1999 год ОМЛ с мультилинейной дисплазией После предшествующего МДС Без предшествующего МДС ОМЛ после цитотоксической терапии после алкилирующих агентов после эпиподофилотоксинов другие ОМЛ не вошедшие в другие категории FAB-субварианты базофильный лейкоз
ОМЛ: Классификация ВОЗ, 1999 год ОМЛ с мультилинейной дисплазией После предшествующего МДС Без предшествующего МДС ОМЛ после цитотоксической терапии после алкилирующих агентов после эпиподофилотоксинов другие ОМЛ не вошедшие в другие категории FAB-субварианты базофильный лейкоз
 ОМЛ: Классификация ВОЗ, 1999 год ОМЛ после цитотоксической терапии ОМЛ после алкилирующих агентов • Через много лет после х/терапии (медиана 7 -9 лет) • Корреляция с N режимов • -7, abn 5, complex ОМЛ после эпиподофилотоксинов • Быстро (медиана 24 месяцев) • Корреляция с суммарной дозой и частотой введения • 85% - 11 q 23
ОМЛ: Классификация ВОЗ, 1999 год ОМЛ после цитотоксической терапии ОМЛ после алкилирующих агентов • Через много лет после х/терапии (медиана 7 -9 лет) • Корреляция с N режимов • -7, abn 5, complex ОМЛ после эпиподофилотоксинов • Быстро (медиана 24 месяцев) • Корреляция с суммарной дозой и частотой введения • 85% - 11 q 23
 ОМЛ у детей Вторичные ОМЛ Анемия Фанкони Синдром Дауна Нейрофиброматоз Синдром Костмана Синдром Швахмана-Даймонда С-м Блума
ОМЛ у детей Вторичные ОМЛ Анемия Фанкони Синдром Дауна Нейрофиброматоз Синдром Костмана Синдром Швахмана-Даймонда С-м Блума
 ОМЛ у детей: Диагностика Необходимые тесты Ан. крови с подсчетом моноцитов Миелограмма Цитохимическое исследование МПО или Судан НЭ ( -нафтил-ацетат) Цитогенетическое исследование Иммунофенотипирование (при (-) МПО) CD 41/CD 61, анти МПО, CD 13, CD 33, СD 7, CD 3, CD 22 Молекулярное исследование AML/ETO, PML/RAR- , CBF /MYH 11 X, 11 q 23 (MLL) flt 3 ITD, dup MLL Профиль экспрессии генов?
ОМЛ у детей: Диагностика Необходимые тесты Ан. крови с подсчетом моноцитов Миелограмма Цитохимическое исследование МПО или Судан НЭ ( -нафтил-ацетат) Цитогенетическое исследование Иммунофенотипирование (при (-) МПО) CD 41/CD 61, анти МПО, CD 13, CD 33, СD 7, CD 3, CD 22 Молекулярное исследование AML/ETO, PML/RAR- , CBF /MYH 11 X, 11 q 23 (MLL) flt 3 ITD, dup MLL Профиль экспрессии генов?
 ОМЛ у детей Клинические проявления Кровоточивость Слабость Боли в костях Лихорадка Бактериальные нфекции
ОМЛ у детей Клинические проявления Кровоточивость Слабость Боли в костях Лихорадка Бактериальные нфекции
 ОМЛ у детей Клинические особенности субвариантов
ОМЛ у детей Клинические особенности субвариантов
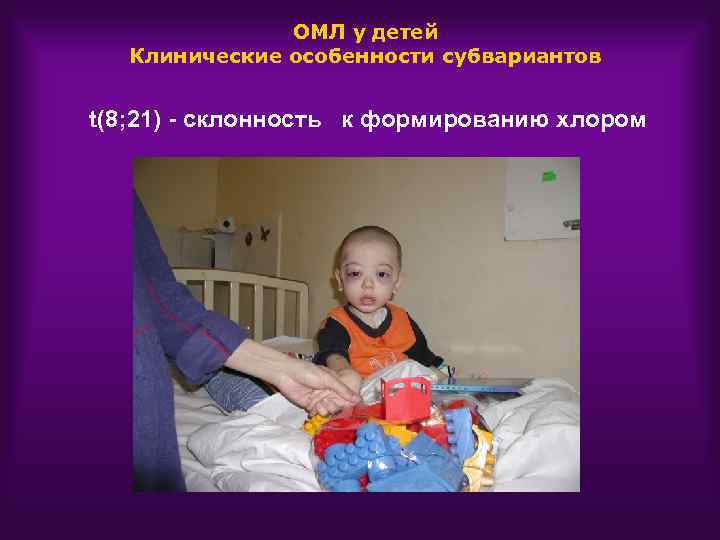 ОМЛ у детей Клинические особенности субвариантов t(8; 21) - склонность к формированию хлором
ОМЛ у детей Клинические особенности субвариантов t(8; 21) - склонность к формированию хлором
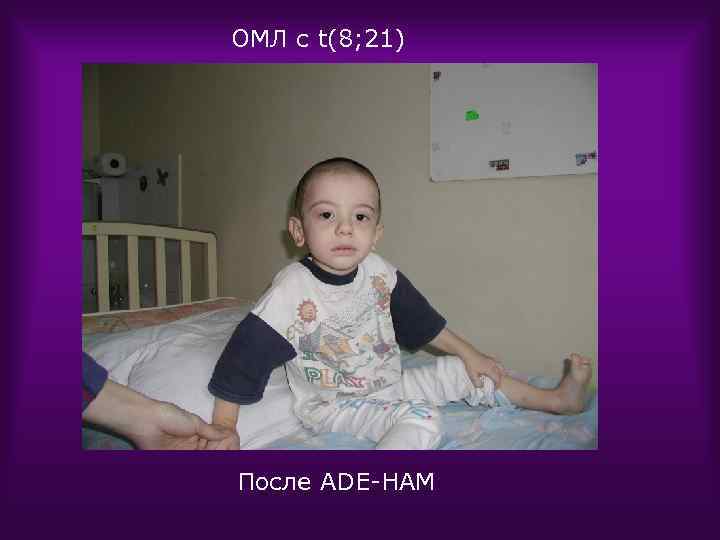 ОМЛ с t(8; 21) После ADE-HAM
ОМЛ с t(8; 21) После ADE-HAM
 ОМЛ у детей Клинические особенности субвариантов М 3 Лейкопения Коагулопатия Способность к дифференцировке (ATRA, As 2 O 3)
ОМЛ у детей Клинические особенности субвариантов М 3 Лейкопения Коагулопатия Способность к дифференцировке (ATRA, As 2 O 3)
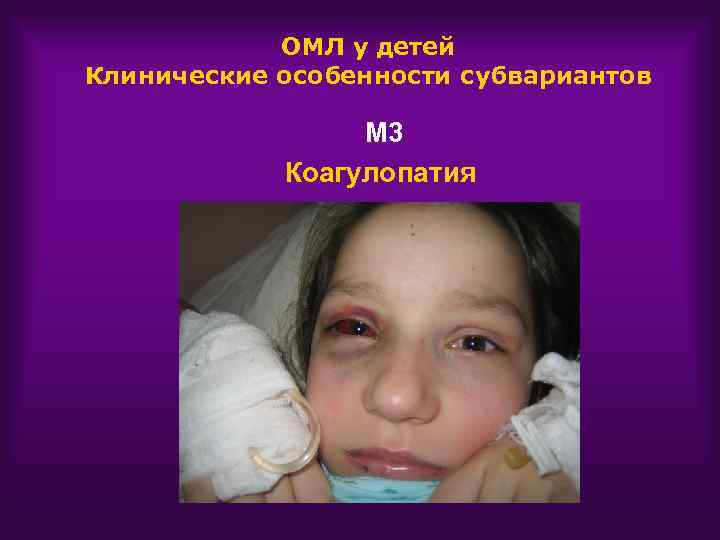 ОМЛ у детей Клинические особенности субвариантов М 3 Коагулопатия
ОМЛ у детей Клинические особенности субвариантов М 3 Коагулопатия
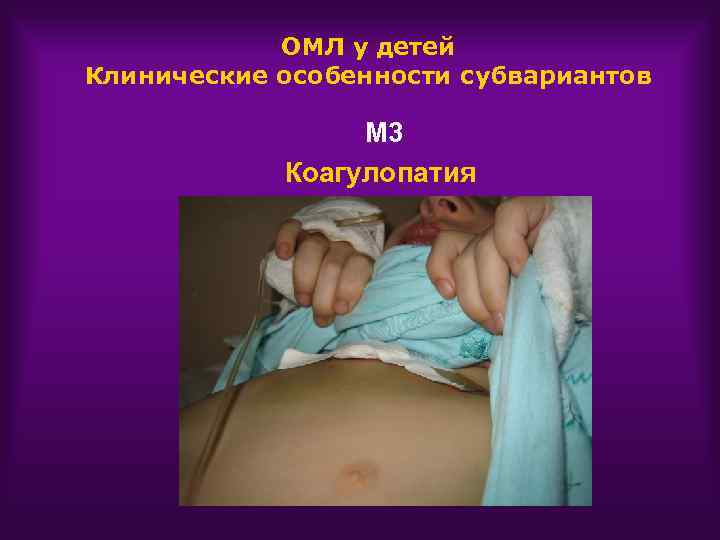 ОМЛ у детей Клинические особенности субвариантов М 3 Коагулопатия
ОМЛ у детей Клинические особенности субвариантов М 3 Коагулопатия
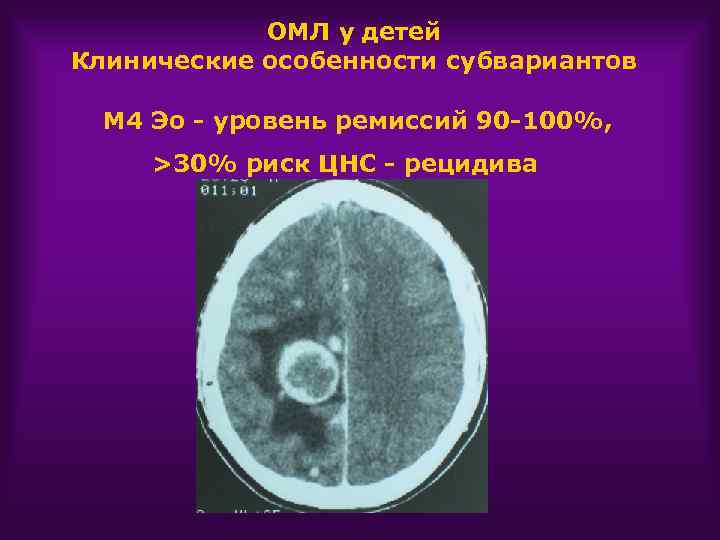 ОМЛ у детей Клинические особенности субвариантов М 4 Эо - уровень ремиссий 90 -100%, >30% риск ЦНС - рецидива
ОМЛ у детей Клинические особенности субвариантов М 4 Эо - уровень ремиссий 90 -100%, >30% риск ЦНС - рецидива
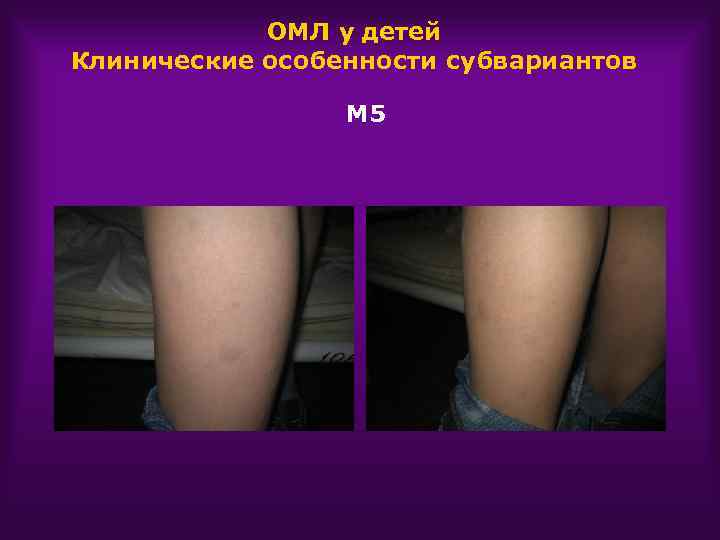
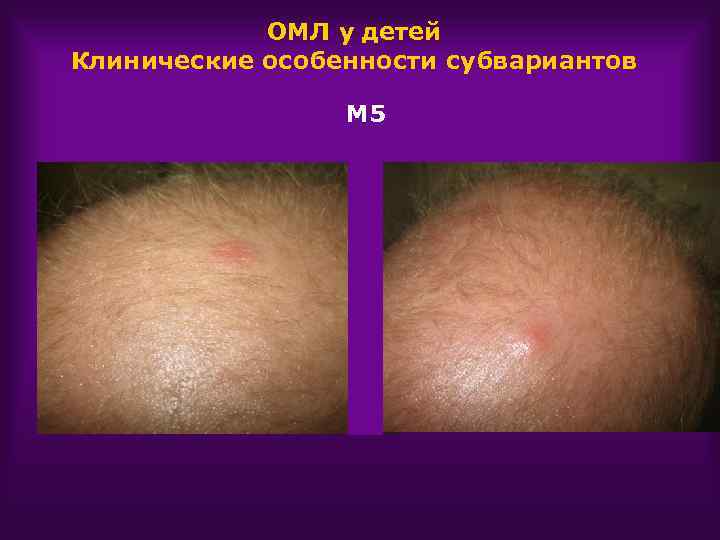 ОМЛ у детей Клинические особенности субвариантов М 5 Поражение кожи Поражение л/у Склонность к лейкостазу
ОМЛ у детей Клинические особенности субвариантов М 5 Поражение кожи Поражение л/у Склонность к лейкостазу
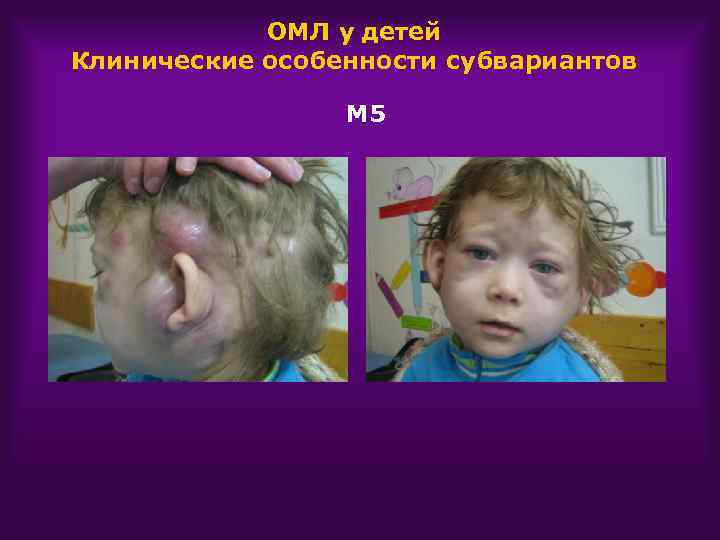 ОМЛ у детей Клинические особенности субвариантов М 5
ОМЛ у детей Клинические особенности субвариантов М 5
 ОМЛ у детей Клинические особенности субвариантов М 5
ОМЛ у детей Клинические особенности субвариантов М 5
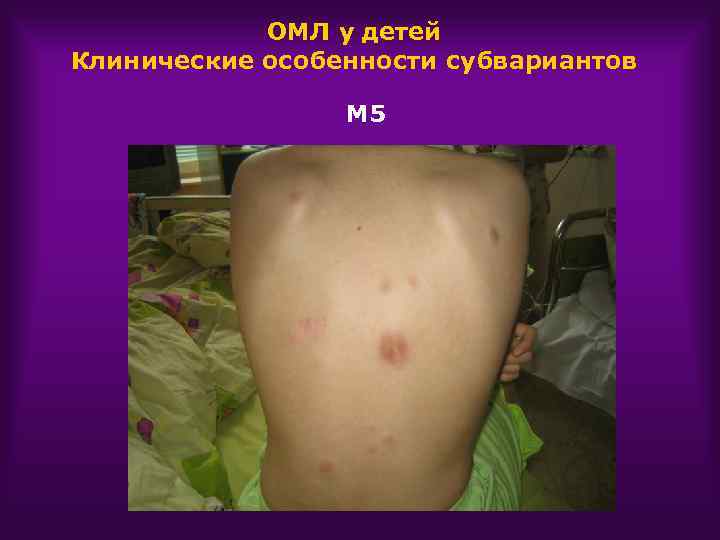 ОМЛ у детей Клинические особенности субвариантов М 5
ОМЛ у детей Клинические особенности субвариантов М 5
 ОМЛ у детей Клинические особенности субвариантов М 6 (эритромиелоз) Часто подострое начало Желтуха Анемия Нормобластоз Небольшая органомегалия Бластоз 30%
ОМЛ у детей Клинические особенности субвариантов М 6 (эритромиелоз) Часто подострое начало Желтуха Анемия Нормобластоз Небольшая органомегалия Бластоз 30%
 ОМЛ у детей Факторы прогноза Риск ранней смерти гиперлейкоцитоз, коагулопатия
ОМЛ у детей Факторы прогноза Риск ранней смерти гиперлейкоцитоз, коагулопатия
 ОМЛ у детей Факторы прогноза Риск невыхода в ремиссию и рецидива (резистентность) Высокий 60 -100% t(3; 3) -7, -5, del 5, вторичные ОМЛ, аномалии 11 q 23, t(6; 11) t(10; 11) FLT 3 ITD, MLL-dup, c-kit Промежуточный 40 -50% N кариотип, +8, +21, del 7, t(9; 11) Низкий 20 -30% t(8; 21), inv 16 Очень низкий 10 -15% t(15; 17) с-м Дауна
ОМЛ у детей Факторы прогноза Риск невыхода в ремиссию и рецидива (резистентность) Высокий 60 -100% t(3; 3) -7, -5, del 5, вторичные ОМЛ, аномалии 11 q 23, t(6; 11) t(10; 11) FLT 3 ITD, MLL-dup, c-kit Промежуточный 40 -50% N кариотип, +8, +21, del 7, t(9; 11) Низкий 20 -30% t(8; 21), inv 16 Очень низкий 10 -15% t(15; 17) с-м Дауна
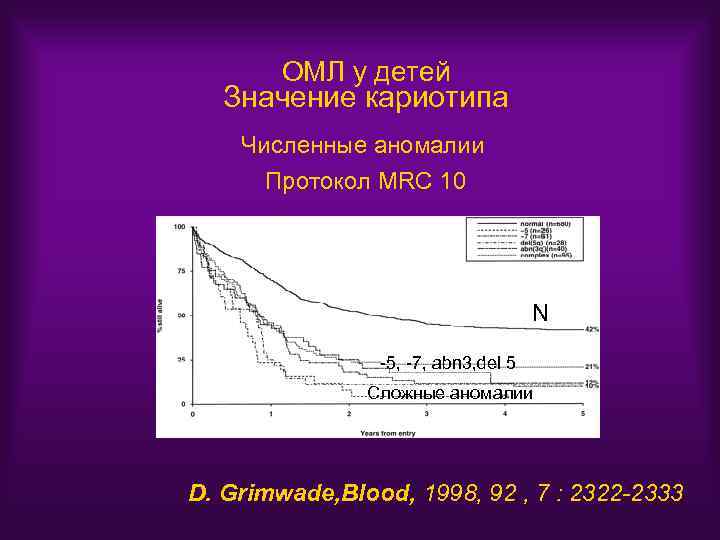 ОМЛ у детей Значение кариотипа Численные аномалии Протокол MRC 10 N -5, -7, abn 3, del 5 Сложные аномалии D. Grimwade, Blood, 1998, 92 , 7 : 2322 -2333
ОМЛ у детей Значение кариотипа Численные аномалии Протокол MRC 10 N -5, -7, abn 3, del 5 Сложные аномалии D. Grimwade, Blood, 1998, 92 , 7 : 2322 -2333
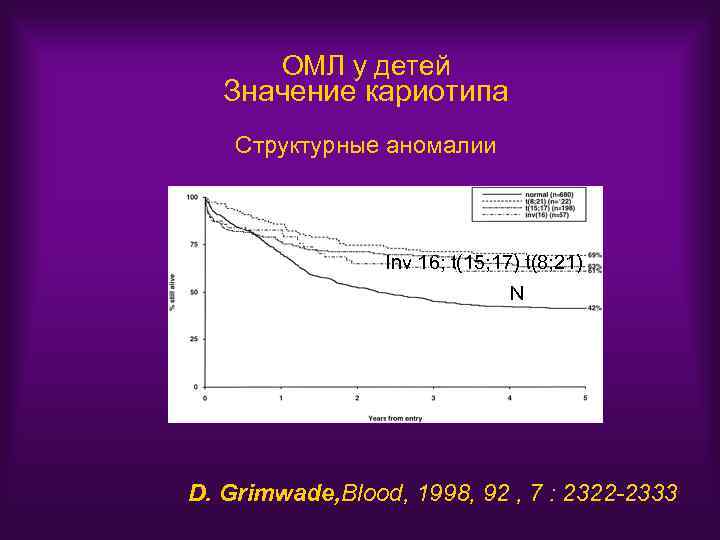 ОМЛ у детей Значение кариотипа Структурные аномалии Inv 16; t(15; 17) t(8; 21) N D. Grimwade, Blood, 1998, 92 , 7 : 2322 -2333
ОМЛ у детей Значение кариотипа Структурные аномалии Inv 16; t(15; 17) t(8; 21) N D. Grimwade, Blood, 1998, 92 , 7 : 2322 -2333
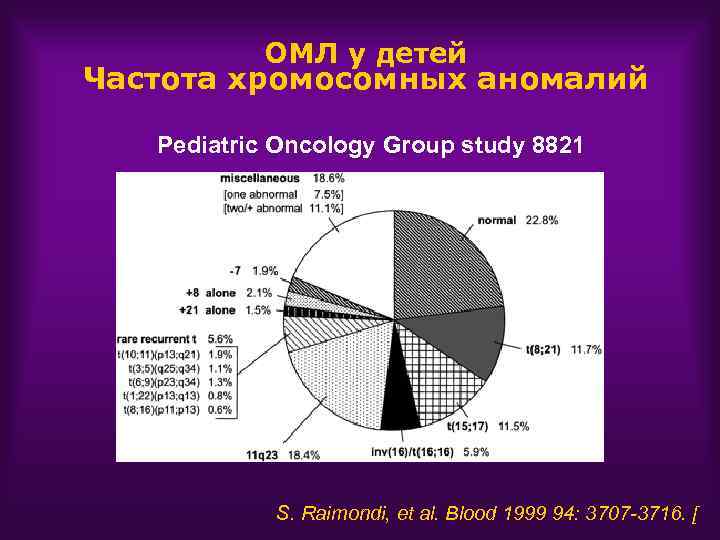 ОМЛ у детей Частота хромосомных аномалий Pediatric Oncology Group study 8821 S. Raimondi, et al. Blood 1999 94: 3707 -3716. [
ОМЛ у детей Частота хромосомных аномалий Pediatric Oncology Group study 8821 S. Raimondi, et al. Blood 1999 94: 3707 -3716. [
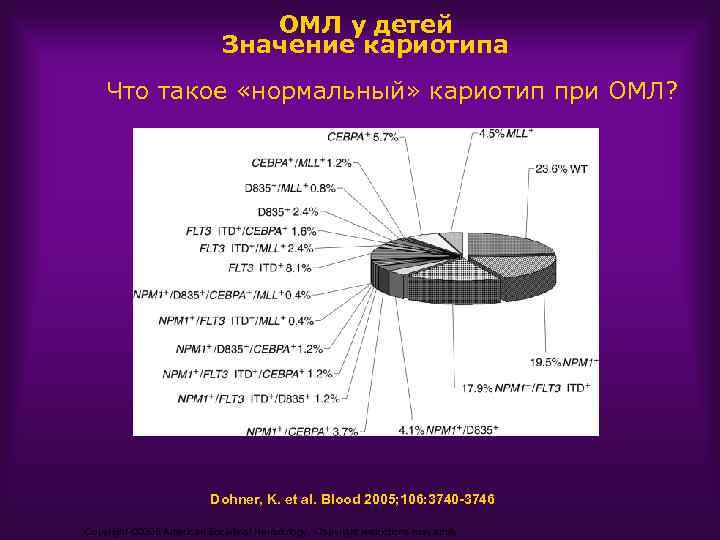 ОМЛ у детей Значение кариотипа Что такое «нормальный» кариотип при ОМЛ? Dohner, K. et al. Blood 2005; 106: 3740 -3746 Copyright © 2005 American Society of Hematology. Copyright restrictions may apply.
ОМЛ у детей Значение кариотипа Что такое «нормальный» кариотип при ОМЛ? Dohner, K. et al. Blood 2005; 106: 3740 -3746 Copyright © 2005 American Society of Hematology. Copyright restrictions may apply.
 лечение ОМЛ у детей современная концепция • Интенсивная индукция (SD Ara. C+ антрациклины Vp 16) • постремиссионная терапия с HDAra. C • ATRA для М 3 • Отстутствие поддерживающего лечения (кроме М 3) • Отсутствие краниального облучения • Аллогенная ТКМ в 1 ремиссии для промежуточного и плохого прогноза
лечение ОМЛ у детей современная концепция • Интенсивная индукция (SD Ara. C+ антрациклины Vp 16) • постремиссионная терапия с HDAra. C • ATRA для М 3 • Отстутствие поддерживающего лечения (кроме М 3) • Отсутствие краниального облучения • Аллогенная ТКМ в 1 ремиссии для промежуточного и плохого прогноза
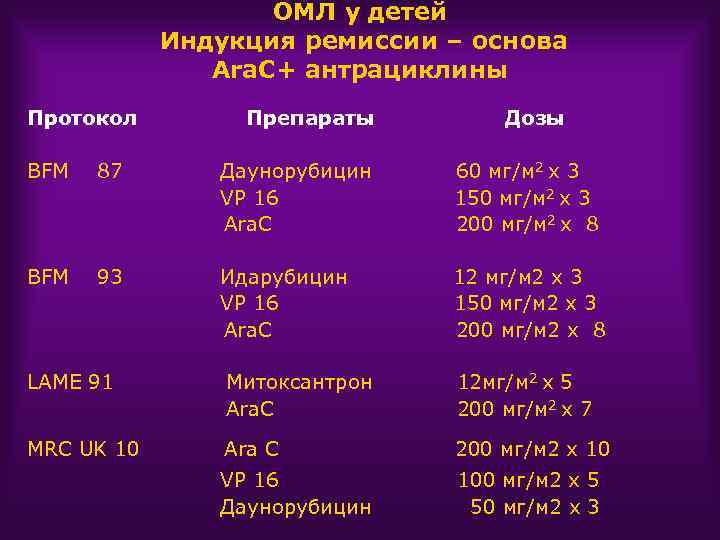 ОМЛ у детей Индукция ремиссии – основа Ara. C+ антрациклины Протокол Препараты Дозы BFM 87 Даунорубицин VP 16 Ara. C 60 мг/м 2 х 3 150 мг/м 2 х 3 200 мг/м 2 х 8 BFM 93 Идарубицин VP 16 Ara. C 12 мг/м 2 х 3 150 мг/м 2 х 3 200 мг/м 2 х 8 LAME 91 Митоксантрон Ara. C 12 мг/м 2 х 5 200 мг/м 2 х 7 MRC UK 10 Ara C 200 мг/м 2 х 10 VP 16 Даунорубицин 100 мг/м 2 х 5 50 мг/м 2 х 3
ОМЛ у детей Индукция ремиссии – основа Ara. C+ антрациклины Протокол Препараты Дозы BFM 87 Даунорубицин VP 16 Ara. C 60 мг/м 2 х 3 150 мг/м 2 х 3 200 мг/м 2 х 8 BFM 93 Идарубицин VP 16 Ara. C 12 мг/м 2 х 3 150 мг/м 2 х 3 200 мг/м 2 х 8 LAME 91 Митоксантрон Ara. C 12 мг/м 2 х 5 200 мг/м 2 х 7 MRC UK 10 Ara C 200 мг/м 2 х 10 VP 16 Даунорубицин 100 мг/м 2 х 5 50 мг/м 2 х 3
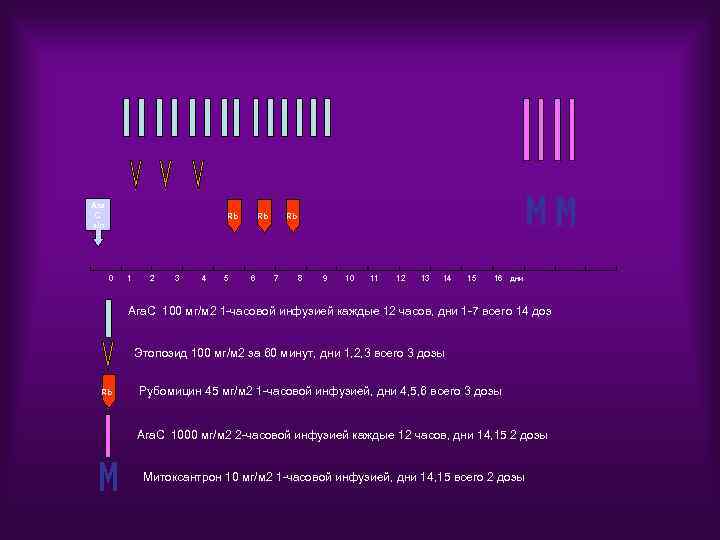 Ara C э/л Rb Rb 0 1 2 3 4 5 6 Rb 7 8 9 10 11 12 13 14 15 16 дни Ara. C 100 мг/м 2 1 -часовой инфузией каждые 12 часов, дни 1 -7 всего 14 доз Этопозид 100 мг/м 2 за 60 минут, дни 1, 2, 3 всего 3 дозы Rb Рубомицин 45 мг/м 2 1 -часовой инфузией, дни 4, 5, 6 всего 3 дозы Ara. C 1000 мг/м 2 2 -часовой инфузией каждые 12 часов, дни 14, 15 2 дозы Митоксантрон 10 мг/м 2 1 -часовой инфузией, дни 14, 15 всего 2 дозы
Ara C э/л Rb Rb 0 1 2 3 4 5 6 Rb 7 8 9 10 11 12 13 14 15 16 дни Ara. C 100 мг/м 2 1 -часовой инфузией каждые 12 часов, дни 1 -7 всего 14 доз Этопозид 100 мг/м 2 за 60 минут, дни 1, 2, 3 всего 3 дозы Rb Рубомицин 45 мг/м 2 1 -часовой инфузией, дни 4, 5, 6 всего 3 дозы Ara. C 1000 мг/м 2 2 -часовой инфузией каждые 12 часов, дни 14, 15 2 дозы Митоксантрон 10 мг/м 2 1 -часовой инфузией, дни 14, 15 всего 2 дозы
 ОМЛ у детей Индукция ремиссии ПОЛНАЯ РЕМИССИЯ – 85 -90% Бласты < 5% Клеточный костный мозг N анализ крови Отсутствие признаков лейкоза
ОМЛ у детей Индукция ремиссии ПОЛНАЯ РЕМИССИЯ – 85 -90% Бласты < 5% Клеточный костный мозг N анализ крови Отсутствие признаков лейкоза
 ОМЛ у детей: постремиссионная терапия Основа – высокие дозы Ara. C 1000 -3000 мг/м 2 3 -5 дней
ОМЛ у детей: постремиссионная терапия Основа – высокие дозы Ara. C 1000 -3000 мг/м 2 3 -5 дней
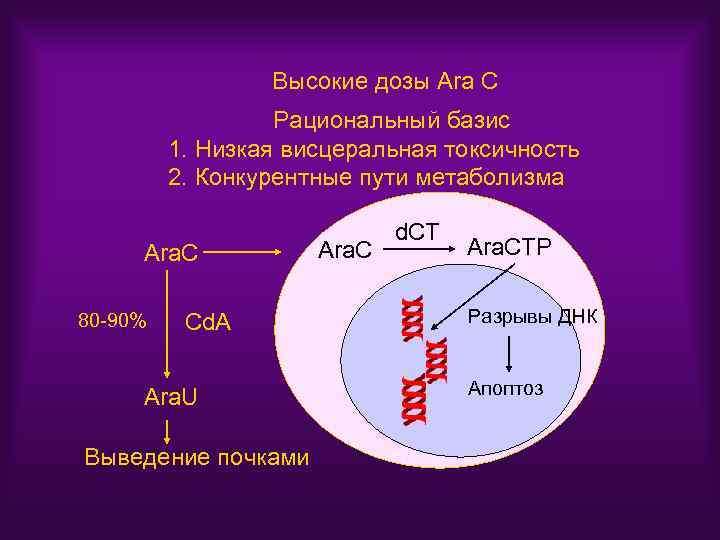 Высокие дозы Ara C Рациональный базис 1. Низкая висцеральная токсичность 2. Конкурентные пути метаболизма Ara. C 80 -90% Cd. A Ara. U Выведение почками Ara. C d. CT Ara. CTP Разрывы ДНК Апоптоз
Высокие дозы Ara C Рациональный базис 1. Низкая висцеральная токсичность 2. Конкурентные пути метаболизма Ara. C 80 -90% Cd. A Ara. U Выведение почками Ara. C d. CT Ara. CTP Разрывы ДНК Апоптоз
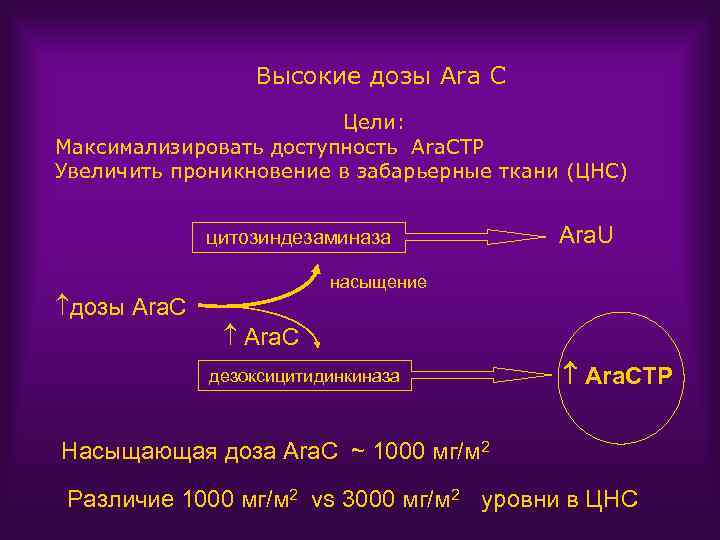 Высокие дозы Ara C Цели: Максимализировать доступность Ara. CTP Увеличить проникновение в забарьерные ткани (ЦНС) цитозиндезаминаза Ara. U насыщение дозы Ara. C дезоксицитидинкиназа Ara. CTP Насыщающая доза Ara. C ~ 1000 мг/м 2 Различие 1000 мг/м 2 vs 3000 мг/м 2 уровни в ЦНС
Высокие дозы Ara C Цели: Максимализировать доступность Ara. CTP Увеличить проникновение в забарьерные ткани (ЦНС) цитозиндезаминаза Ara. U насыщение дозы Ara. C дезоксицитидинкиназа Ara. CTP Насыщающая доза Ara. C ~ 1000 мг/м 2 Различие 1000 мг/м 2 vs 3000 мг/м 2 уровни в ЦНС
 ОМЛ у детей: постремиссионная терапия Основа – высокие дозы Ara. C 1000 -3000 мг/м 2 3 -5 дней Ara. C э/л 0 1 2 3 4 дни Ara. C 3000 мг/м 2 3 -х часовой инфузией каждые 12 часов, всего 8 доз Идарубицин 10 мг/м 2 1 -часовой инфузией, дни 2, 3, 4 всего 3 дозы
ОМЛ у детей: постремиссионная терапия Основа – высокие дозы Ara. C 1000 -3000 мг/м 2 3 -5 дней Ara. C э/л 0 1 2 3 4 дни Ara. C 3000 мг/м 2 3 -х часовой инфузией каждые 12 часов, всего 8 доз Идарубицин 10 мг/м 2 1 -часовой инфузией, дни 2, 3, 4 всего 3 дозы
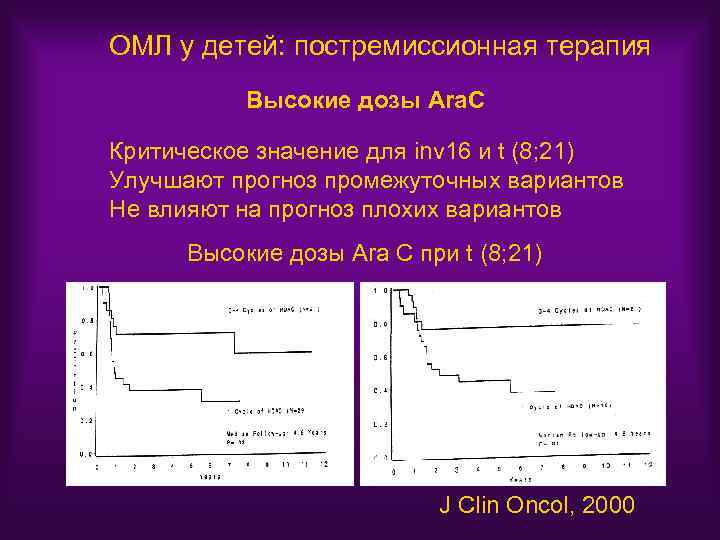 ОМЛ у детей: постремиссионная терапия Высокие дозы Ara. C Критическое значение для inv 16 и t (8; 21) Улучшают прогноз промежуточных вариантов Не влияют на прогноз плохих вариантов Высокие дозы Ara C при t (8; 21) J Clin Oncol, 2000
ОМЛ у детей: постремиссионная терапия Высокие дозы Ara. C Критическое значение для inv 16 и t (8; 21) Улучшают прогноз промежуточных вариантов Не влияют на прогноз плохих вариантов Высокие дозы Ara C при t (8; 21) J Clin Oncol, 2000
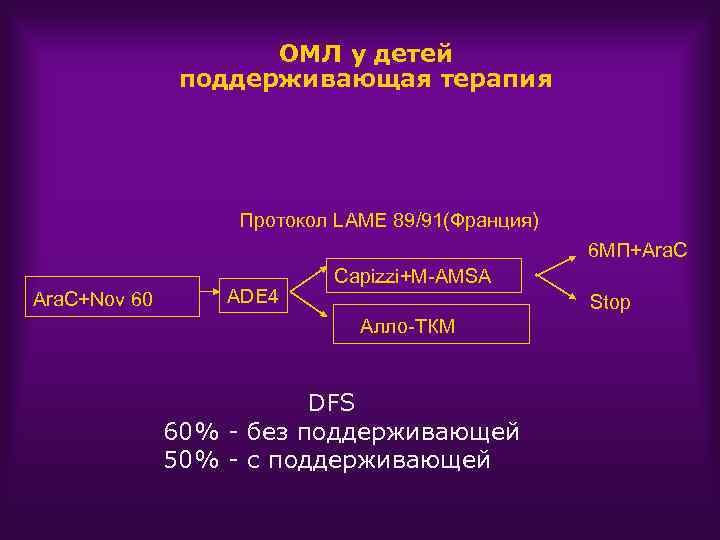 ОМЛ у детей поддерживающая терапия Протокол LAME 89/91(Франция) 6 МП+Ara. C+Nov 60 ADE 4 Сapizzi+M-AMSA Stop Алло-ТКМ DFS 60% - без поддерживающей 50% - с поддерживающей
ОМЛ у детей поддерживающая терапия Протокол LAME 89/91(Франция) 6 МП+Ara. C+Nov 60 ADE 4 Сapizzi+M-AMSA Stop Алло-ТКМ DFS 60% - без поддерживающей 50% - с поддерживающей
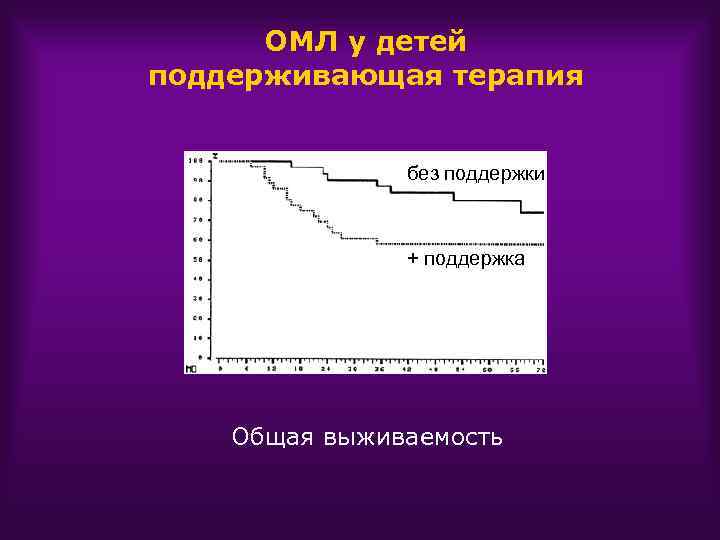 ОМЛ у детей поддерживающая терапия без поддержки + поддержка Общая выживаемость
ОМЛ у детей поддерживающая терапия без поддержки + поддержка Общая выживаемость
 ОМЛ у детей поддерживающая терапия • Низкодозная поддерживающая терапия не нужна после 3 -5 курсов интенсивной ХТ • Низкодозная поддерживающая терапия возможно полезна после ХТ стандартными дозами
ОМЛ у детей поддерживающая терапия • Низкодозная поддерживающая терапия не нужна после 3 -5 курсов интенсивной ХТ • Низкодозная поддерживающая терапия возможно полезна после ХТ стандартными дозами
 ОМЛ: алло -ТКМ Алло ТКМ против интенсивной ХТ • рецидивов • смертность от осложнений острая РТПХ инфекции VOD • поздняя токсичность хроническая РТПХ Эндокринопатии Бесплодие Катаракта • cтоимость
ОМЛ: алло -ТКМ Алло ТКМ против интенсивной ХТ • рецидивов • смертность от осложнений острая РТПХ инфекции VOD • поздняя токсичность хроническая РТПХ Эндокринопатии Бесплодие Катаракта • cтоимость
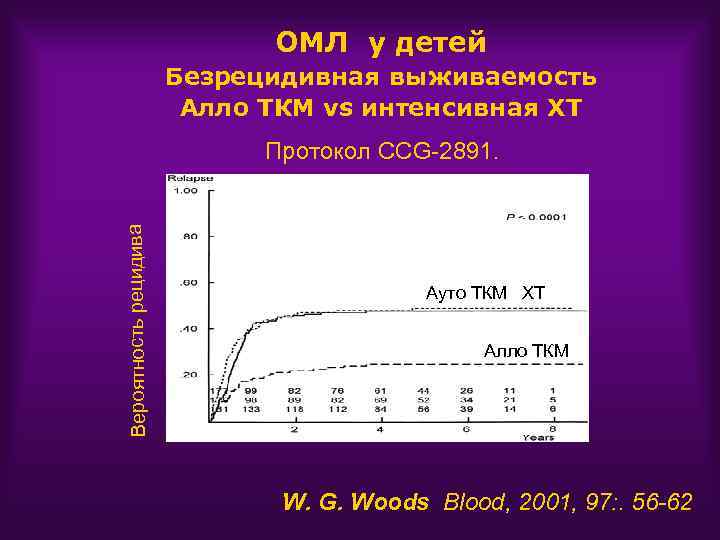 ОМЛ у детей Безрецидивная выживаемость Алло ТКМ vs интенсивная ХТ Вероятность рецидива Протокол CCG-2891. Ауто ТКМ ХТ Алло ТКМ W. G. Woods Blood, 2001, 97: . 56 -62
ОМЛ у детей Безрецидивная выживаемость Алло ТКМ vs интенсивная ХТ Вероятность рецидива Протокол CCG-2891. Ауто ТКМ ХТ Алло ТКМ W. G. Woods Blood, 2001, 97: . 56 -62
 ОМЛ у детей: результаты лечения Долгосрочная выживаемость ~50 -60 % Резерв стандартной интенсивной ХТ исчерпан!!!
ОМЛ у детей: результаты лечения Долгосрочная выживаемость ~50 -60 % Резерв стандартной интенсивной ХТ исчерпан!!!
 Пути улучшения результатов • Аллогенная ТГСК (неродственная, гаплоидентичная) • Эпигенетическая терапия (децитабин) • Новые антиметаболиты (клофарабин) • Иммунотерапия • Иммуноконъюгаты (милотарг) • Ингибиторы специфических путей метаболизма (flt-3 и т. д. )
Пути улучшения результатов • Аллогенная ТГСК (неродственная, гаплоидентичная) • Эпигенетическая терапия (децитабин) • Новые антиметаболиты (клофарабин) • Иммунотерапия • Иммуноконъюгаты (милотарг) • Ингибиторы специфических путей метаболизма (flt-3 и т. д. )


