 Оксиды. Химические свойства. 11 класс
Оксиды. Химические свойства. 11 класс
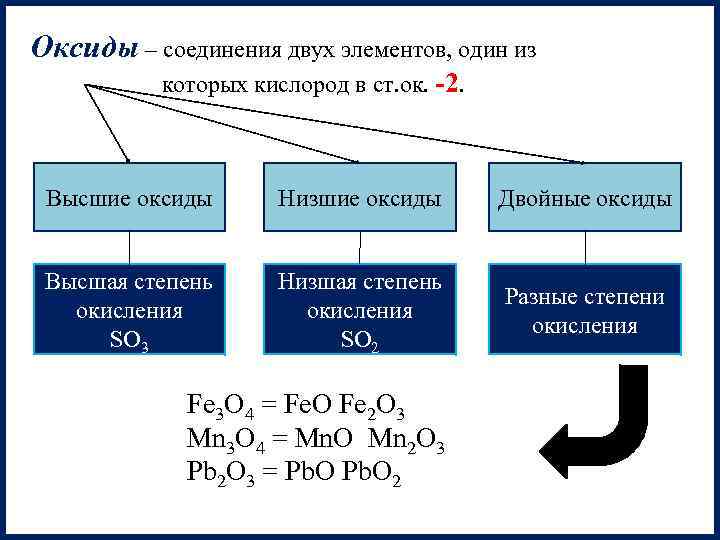 Оксиды – соединения двух элементов, один из которых кислород в ст. ок. -2. Высшие оксиды Низшие оксиды Двойные оксиды Высшая степень окисления SO 3 Низшая степень окисления SO 2 Разные степени окисления Fe 3 O 4 = Fe. O Fe 2 O 3 Mn 3 O 4 = Mn. O Mn 2 O 3 Pb 2 O 3 = Pb. O 2
Оксиды – соединения двух элементов, один из которых кислород в ст. ок. -2. Высшие оксиды Низшие оксиды Двойные оксиды Высшая степень окисления SO 3 Низшая степень окисления SO 2 Разные степени окисления Fe 3 O 4 = Fe. O Fe 2 O 3 Mn 3 O 4 = Mn. O Mn 2 O 3 Pb 2 O 3 = Pb. O 2
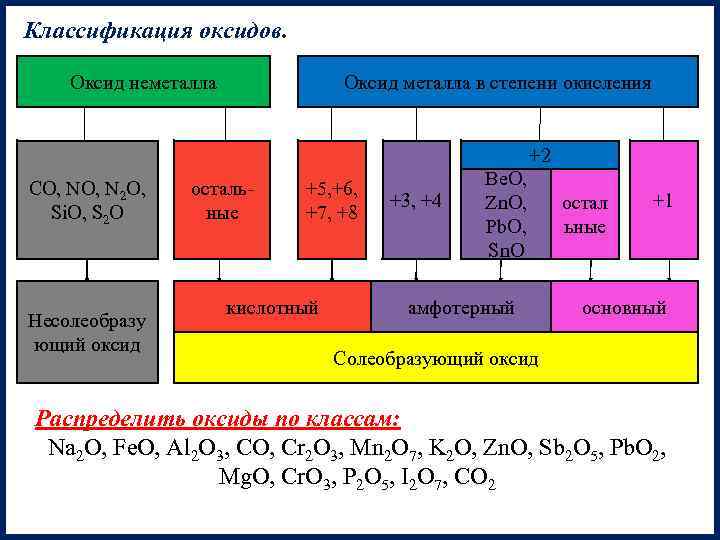 Классификация оксидов. Оксид неметалла CO, N 2 O, Si. O, S 2 O Несолеобразу ющий оксид Оксид металла в степени окисления остальные +5, +6, +7, +8 кислотный +3, +4 +2 Be. O, Zn. O, остал Pb. O, ьные Sn. O амфотерный +1 основный Солеобразующий оксид Распределить оксиды по классам: Na 2 O, Fe. O, Al 2 O 3, CO, Cr 2 O 3, Mn 2 O 7, K 2 O, Zn. O, Sb 2 O 5, Pb. O 2, Mg. O, Cr. O 3, P 2 O 5, I 2 O 7, CO 2
Классификация оксидов. Оксид неметалла CO, N 2 O, Si. O, S 2 O Несолеобразу ющий оксид Оксид металла в степени окисления остальные +5, +6, +7, +8 кислотный +3, +4 +2 Be. O, Zn. O, остал Pb. O, ьные Sn. O амфотерный +1 основный Солеобразующий оксид Распределить оксиды по классам: Na 2 O, Fe. O, Al 2 O 3, CO, Cr 2 O 3, Mn 2 O 7, K 2 O, Zn. O, Sb 2 O 5, Pb. O 2, Mg. O, Cr. O 3, P 2 O 5, I 2 O 7, CO 2
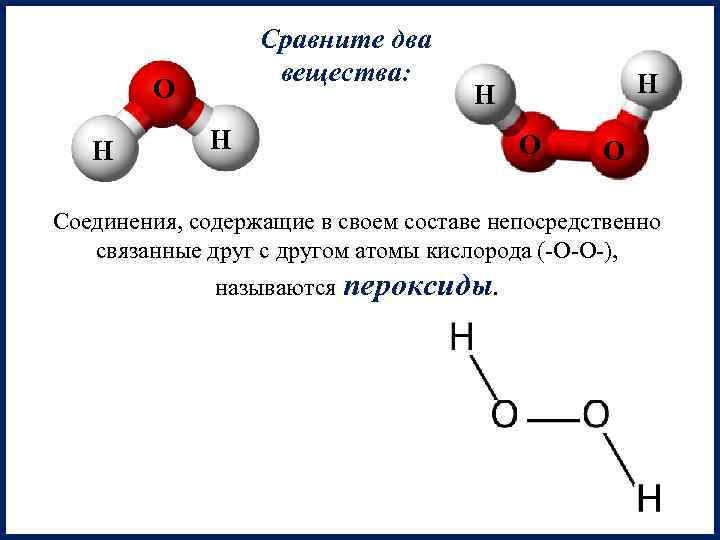 Сравните два вещества: О Н Н О О Соединения, содержащие в своем составе непосредственно связанные друг с другом атомы кислорода (-О-О-), называются пероксиды.
Сравните два вещества: О Н Н О О Соединения, содержащие в своем составе непосредственно связанные друг с другом атомы кислорода (-О-О-), называются пероксиды.
 1. Дать названия веществам, выделить оксиды: H 2 O, CO 2, As 2 O 3, P 2 O 5, I 2 O 7, SO 2, OF 2, H 2 O 2, HCl. O, SO 3, Na 2 O 2, KO 2, CO. Надпероксиды — неорганические соединения, содержащие анион О 2− (атомы О в степени окисления − 1/2) 2. Составить формулы оксидов, указать их характер: Углекислый газ, угарный газ, веселящий газ, негашеная известь, глинозем, жженая магнезия, кремнезем, сернистый газ. 3. Составь формулы и укажи их характер высших оксидов всех элементов: А) VIА группы Б) 3 периода Какая существует закономерность в изменении свойств высших оксидов элементов одного периода?
1. Дать названия веществам, выделить оксиды: H 2 O, CO 2, As 2 O 3, P 2 O 5, I 2 O 7, SO 2, OF 2, H 2 O 2, HCl. O, SO 3, Na 2 O 2, KO 2, CO. Надпероксиды — неорганические соединения, содержащие анион О 2− (атомы О в степени окисления − 1/2) 2. Составить формулы оксидов, указать их характер: Углекислый газ, угарный газ, веселящий газ, негашеная известь, глинозем, жженая магнезия, кремнезем, сернистый газ. 3. Составь формулы и укажи их характер высших оксидов всех элементов: А) VIА группы Б) 3 периода Какая существует закономерность в изменении свойств высших оксидов элементов одного периода?
 4. Определи элементы по следующим данным: 1) Элемент V группы, образует высший оксид, в котором суммарное число протонов в молекуле меньше 80, а суммарное число электронов больше 55. 2) Элемент Y образует два газообразных оксида (с. о. равны +2 и +4), один из них – несолеобразующий. 3) Элемент-металл Y образует два соединения с кислородом, одно из которых – амфотерный оксид. 4) Элемент Z в виде простого вещества входит в состав земной атмосферы, образует два несолеобразующих оксида и несколько солеобразующих. 1) P 2) С 3) Fe Cr 4) N
4. Определи элементы по следующим данным: 1) Элемент V группы, образует высший оксид, в котором суммарное число протонов в молекуле меньше 80, а суммарное число электронов больше 55. 2) Элемент Y образует два газообразных оксида (с. о. равны +2 и +4), один из них – несолеобразующий. 3) Элемент-металл Y образует два соединения с кислородом, одно из которых – амфотерный оксид. 4) Элемент Z в виде простого вещества входит в состав земной атмосферы, образует два несолеобразующих оксида и несколько солеобразующих. 1) P 2) С 3) Fe Cr 4) N
 Несолеобразующие оксиды CO, N 2 O, Si. O, S 2 O 1) В химические реакции вступают редко 2) Безразличны к кислотам и щелочам 3) Не имеют соответствующих гидроксидов СО (угарный газ): При высокой температуре восстанавливает многие металлы и неметаллы из их оксидов: CO + Cu. O = Cu + CO 2↑ CO + Fe 3 O 4 = Fe + CO 2↑ CO + H 2 O = H 2↑ + CO 2↑ CO + P 2 O 5 = P + + CO 2↑
Несолеобразующие оксиды CO, N 2 O, Si. O, S 2 O 1) В химические реакции вступают редко 2) Безразличны к кислотам и щелочам 3) Не имеют соответствующих гидроксидов СО (угарный газ): При высокой температуре восстанавливает многие металлы и неметаллы из их оксидов: CO + Cu. O = Cu + CO 2↑ CO + Fe 3 O 4 = Fe + CO 2↑ CO + H 2 O = H 2↑ + CO 2↑ CO + P 2 O 5 = P + + CO 2↑
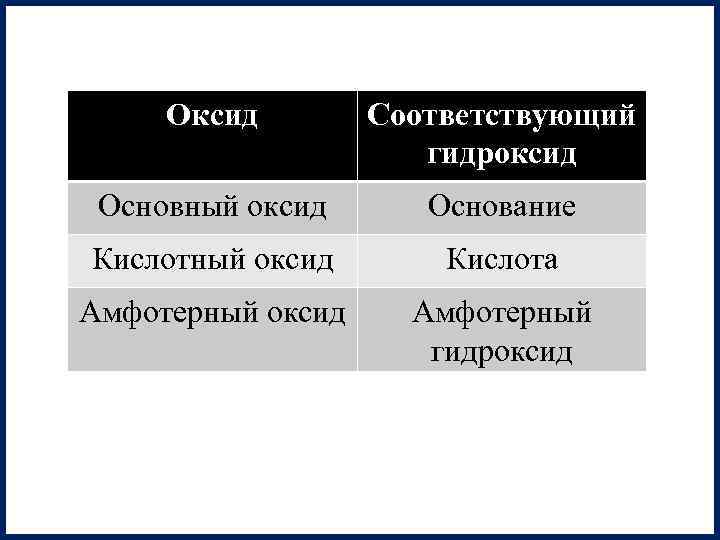 Оксид Соответствующий гидроксид Основный оксид Основание Кислотный оксид Кислота Амфотерный оксид Амфотерный гидроксид
Оксид Соответствующий гидроксид Основный оксид Основание Кислотный оксид Кислота Амфотерный оксид Амфотерный гидроксид
 Алгоритм 1) Определи ст. ок. элемента в оксиде Пример N 2+3 O-23 2) Определи характер оксида и соответствующего Оксид кислотный , ему гидроксида соответствующий гидроксид - кислота 3) Составь формулу гидроксида в форме основания, дописав к элементу необходимое число ОН-групп 4) Если гидроксид – кислота, запиши его формулу в виде кислоты; для этого: а) перепиши формулу в виде Hх. ЭОх б) из полученной формулы вычти максимальное количество групп H 2 O таким образом, чтобы остался хотя бы один Н-атом N+3(OH)3 а) H 3 NO 3 б) H 3 NO 3 - H 2 O => HNO 2 Ответ: оксиду N 2 O 3 соответствует гидроксидкислота HNO 2. Исключения: Оксиду P 2 O 5 соответствуют 3 кислоты – HPO 3, H 4 P 2 O 7, H 3 PO 4. Оксиду Cr. O 3 соответствуют 2 кислоты –H 2 Cr 2 O 7 и H 2 Cr. O 4. У оксидов NO 2 и Cl. O 2 нет соответствующих гидроксидов.
Алгоритм 1) Определи ст. ок. элемента в оксиде Пример N 2+3 O-23 2) Определи характер оксида и соответствующего Оксид кислотный , ему гидроксида соответствующий гидроксид - кислота 3) Составь формулу гидроксида в форме основания, дописав к элементу необходимое число ОН-групп 4) Если гидроксид – кислота, запиши его формулу в виде кислоты; для этого: а) перепиши формулу в виде Hх. ЭОх б) из полученной формулы вычти максимальное количество групп H 2 O таким образом, чтобы остался хотя бы один Н-атом N+3(OH)3 а) H 3 NO 3 б) H 3 NO 3 - H 2 O => HNO 2 Ответ: оксиду N 2 O 3 соответствует гидроксидкислота HNO 2. Исключения: Оксиду P 2 O 5 соответствуют 3 кислоты – HPO 3, H 4 P 2 O 7, H 3 PO 4. Оксиду Cr. O 3 соответствуют 2 кислоты –H 2 Cr 2 O 7 и H 2 Cr. O 4. У оксидов NO 2 и Cl. O 2 нет соответствующих гидроксидов.
 Составь графические формулы гидроксидов, соответствующих оксиду: N 2 O 3, P 2 O 5, NO 2, Be. O, Cr. O 3, CO 2, Co 2 O 3, Cl 2 O 7.
Составь графические формулы гидроксидов, соответствующих оксиду: N 2 O 3, P 2 O 5, NO 2, Be. O, Cr. O 3, CO 2, Co 2 O 3, Cl 2 O 7.
 Основные оксиды Оксиды, которым соответствуют гидроксиды-основания. Твердые ионные кристаллы, высокие температуры плавления и кипения
Основные оксиды Оксиды, которым соответствуют гидроксиды-основания. Твердые ионные кристаллы, высокие температуры плавления и кипения
 Химические свойства основных оксидов: 1 Основный оксид + Вода = Щелочь С водой взаимодействуют только оксиды щелочных и щелочноземельных металлов. Щелочные металлы: Li, Na, K, Rb, Cs, Fr. Щелочноземельные металлы: Ca, Sr, Ba, Ra. K 2 O + H 2 O = Mg. O + H 2 O = K 2 O + H 2 O = KOH Mg. O + H 2 O ≠
Химические свойства основных оксидов: 1 Основный оксид + Вода = Щелочь С водой взаимодействуют только оксиды щелочных и щелочноземельных металлов. Щелочные металлы: Li, Na, K, Rb, Cs, Fr. Щелочноземельные металлы: Ca, Sr, Ba, Ra. K 2 O + H 2 O = Mg. O + H 2 O = K 2 O + H 2 O = KOH Mg. O + H 2 O ≠
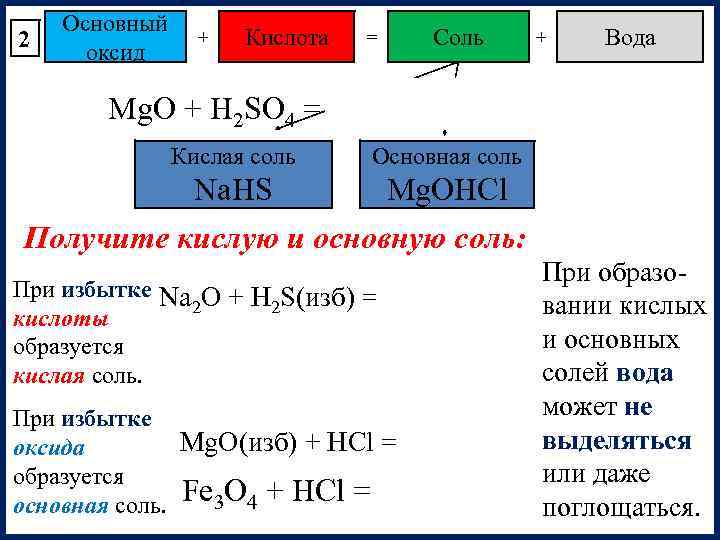 2 Основный оксид + Кислота = Соль + Вода Mg. O + H 2 SO 4 = Mg. SO 4 + H 2 O Кислая соль Основная соль Na. HS Mg. OHCl Получите кислую и основную соль: При образо. При избытке Na O + H S(изб) = Na. HS + H O 2 2 2 вании кислых кислоты и основных образуется солей вода кислая соль. может не При избытке Mg. O(изб) + HCl = Mg. OHCl выделяться оксида или даже образуется основная соль. Fe 3 O 4 + HCl = поглощаться.
2 Основный оксид + Кислота = Соль + Вода Mg. O + H 2 SO 4 = Mg. SO 4 + H 2 O Кислая соль Основная соль Na. HS Mg. OHCl Получите кислую и основную соль: При образо. При избытке Na O + H S(изб) = Na. HS + H O 2 2 2 вании кислых кислоты и основных образуется солей вода кислая соль. может не При избытке Mg. O(изб) + HCl = Mg. OHCl выделяться оксида или даже образуется основная соль. Fe 3 O 4 + HCl = поглощаться.
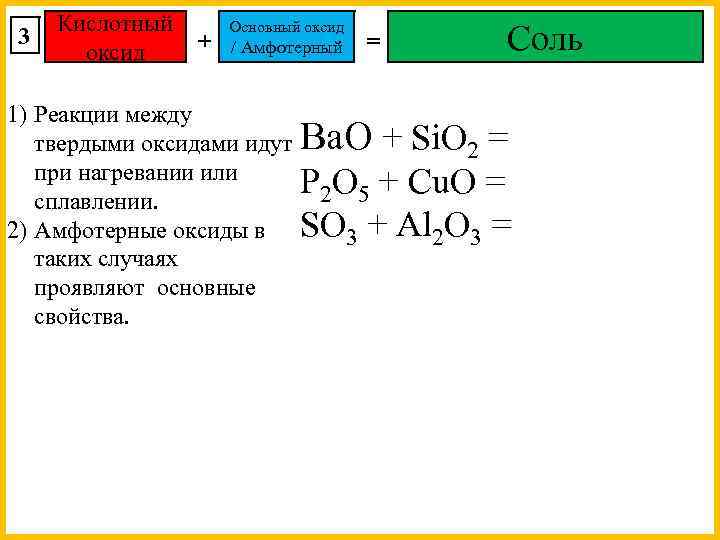
 3 Основный оксид + Кислотный оксид / Амфотерный = Соль 1) Реакции между твердыми оксидами идут Ba. O + Si. O 2 при нагревании или Fe. O + SO 3 = сплавлении. 2) Нерастворимые в воде Fe. O + CO 2 = основные оксиды не Fe. O + CO = взаимодействуют с K 2 O + Zn. O газообразными кислотными оксидами. Mg. O + Al O 2 3 3) Амфотерные оксиды в таких случаях проявляют кислотные свойства.
3 Основный оксид + Кислотный оксид / Амфотерный = Соль 1) Реакции между твердыми оксидами идут Ba. O + Si. O 2 при нагревании или Fe. O + SO 3 = сплавлении. 2) Нерастворимые в воде Fe. O + CO 2 = основные оксиды не Fe. O + CO = взаимодействуют с K 2 O + Zn. O газообразными кислотными оксидами. Mg. O + Al O 2 3 3) Амфотерные оксиды в таких случаях проявляют кислотные свойства.
 4 Основный оксид + Амфотерный гидроксид = Соль + Вода 1) Амфотерные гидроксиды в данном случае будут являться кислотами. 2) Сплавление. Na 2 O + Al(OH)3 K 2 O + Al(OH)3 Na 2 O + Zn(OH)2 K 2 O + Zn(OH)2
4 Основный оксид + Амфотерный гидроксид = Соль + Вода 1) Амфотерные гидроксиды в данном случае будут являться кислотами. 2) Сплавление. Na 2 O + Al(OH)3 K 2 O + Al(OH)3 Na 2 O + Zn(OH)2 K 2 O + Zn(OH)2
 Окислительно-восстановительные реакции основных оксидов: Ag 2 O = Восстановление: 1) При нагревании разлагаются оксиды Hg. O = благородных металлов и ртути. 2) При высокой температуре С и H 2 ( как и СО) Fe 2 O 3 + C = восстанавливают оксиды (частично или Fe. O + C = полностью). При восстановлении оксидов Ca. O + C = щелочных, щелочноземельных металлов и Al выделяется не сам металл, а его карбид или Al 2 O 3 + C = гидрид. Ca. O + H 2 = 3) При высокой температуре более активные Cr 2 O 3 + H 2 = металлы восстанавливают менее активные металлы из их оксидов. В качестве Fe 3 O 4 + Al = восстановителей обычно используют Al Cu. O + Zn = (алюмотермия) или Mg (магнийтермия) WO 3 + Al = Окисление: 1) Под действием кислорода (при нагревании или Fe. O + O = 2 с катализатором) низшие оксиды переходят в Ba. O + O 2 = высшие, а оксиды щелочных и щелочноземельных металлов в пероксиды. Na 2 O + O 2 = 5
Окислительно-восстановительные реакции основных оксидов: Ag 2 O = Восстановление: 1) При нагревании разлагаются оксиды Hg. O = благородных металлов и ртути. 2) При высокой температуре С и H 2 ( как и СО) Fe 2 O 3 + C = восстанавливают оксиды (частично или Fe. O + C = полностью). При восстановлении оксидов Ca. O + C = щелочных, щелочноземельных металлов и Al выделяется не сам металл, а его карбид или Al 2 O 3 + C = гидрид. Ca. O + H 2 = 3) При высокой температуре более активные Cr 2 O 3 + H 2 = металлы восстанавливают менее активные металлы из их оксидов. В качестве Fe 3 O 4 + Al = восстановителей обычно используют Al Cu. O + Zn = (алюмотермия) или Mg (магнийтермия) WO 3 + Al = Окисление: 1) Под действием кислорода (при нагревании или Fe. O + O = 2 с катализатором) низшие оксиды переходят в Ba. O + O 2 = высшие, а оксиды щелочных и щелочноземельных металлов в пероксиды. Na 2 O + O 2 = 5
 Дз • Скан Дерябина с 25 (на компе в каб 301)
Дз • Скан Дерябина с 25 (на компе в каб 301)
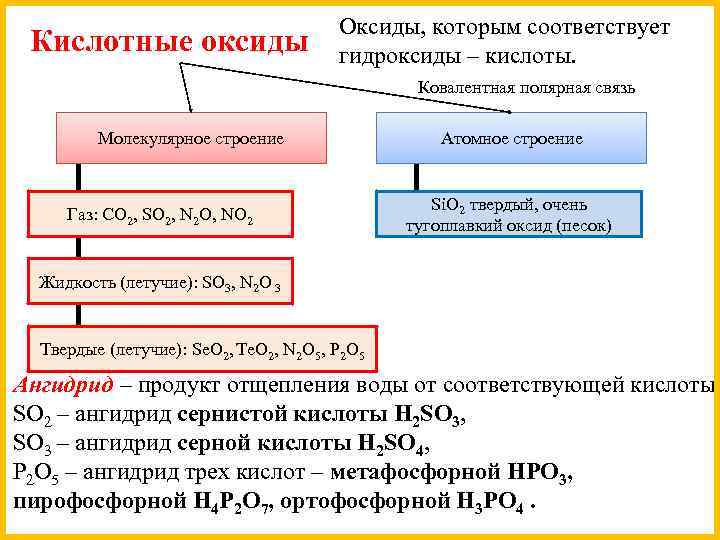 Кислотные оксиды Оксиды, которым соответствует гидроксиды – кислоты. Ковалентная полярная связь Молекулярное строение Газ: CO 2, SO 2, N 2 O, NO 2 Атомное строение Si. O 2 твердый, очень тугоплавкий оксид (песок) Жидкость (летучие): SO 3, N 2 O 3 Твердые (летучие): Se. O 2, Te. O 2, N 2 O 5, P 2 O 5 Ангидрид – продукт отщепления воды от соответствующей кислоты. SO 2 – ангидрид сернистой кислоты H 2 SO 3, SO 3 – ангидрид серной кислоты H 2 SO 4, P 2 O 5 – ангидрид трех кислот – метафосфорной HPO 3, пирофосфорной H 4 P 2 O 7, ортофосфорной H 3 PO 4.
Кислотные оксиды Оксиды, которым соответствует гидроксиды – кислоты. Ковалентная полярная связь Молекулярное строение Газ: CO 2, SO 2, N 2 O, NO 2 Атомное строение Si. O 2 твердый, очень тугоплавкий оксид (песок) Жидкость (летучие): SO 3, N 2 O 3 Твердые (летучие): Se. O 2, Te. O 2, N 2 O 5, P 2 O 5 Ангидрид – продукт отщепления воды от соответствующей кислоты. SO 2 – ангидрид сернистой кислоты H 2 SO 3, SO 3 – ангидрид серной кислоты H 2 SO 4, P 2 O 5 – ангидрид трех кислот – метафосфорной HPO 3, пирофосфорной H 4 P 2 O 7, ортофосфорной H 3 PO 4.
 Химические свойства кислотных оксидов: 1 Кислотный оксид + Вода = Кислота 1) Ст. ок. сохраняется. SO 3 + H 2 O= 2) Реакции Si. O 2 + H 2 O = диспропорционирования: NO 2 + H 2 O = HNO 3 + HNO 2 и Cl. O 2 NO 2 + H 2 O = HNO 3 + NO↑ 3) При растворении в Cl. O 2 + H 2 O = HCl. O 3 + HCl. O 2 воде оксидов P 2 O 5 и Cr. O 3 Cl. O 2 + H 2 O = HCl. O 3 + HCl в зависимости от числа P 2 O 5 + H 2 O = HPO 3 Метафосф присоединенных P 2 O 5 + H 2 O = H 4 P 2 O 7 Пирофосф молекул воды могут P 2 O 5 + H 2 O = H 3 PO 4 Ортофосф образоваться разные Cr. O 3 + H 2 O = H 2 Cr. O 4 Хромовая кислоты. Cr. O 3 + H 2 O = H 2 Cr 2 O 7 Дихромова
Химические свойства кислотных оксидов: 1 Кислотный оксид + Вода = Кислота 1) Ст. ок. сохраняется. SO 3 + H 2 O= 2) Реакции Si. O 2 + H 2 O = диспропорционирования: NO 2 + H 2 O = HNO 3 + HNO 2 и Cl. O 2 NO 2 + H 2 O = HNO 3 + NO↑ 3) При растворении в Cl. O 2 + H 2 O = HCl. O 3 + HCl. O 2 воде оксидов P 2 O 5 и Cr. O 3 Cl. O 2 + H 2 O = HCl. O 3 + HCl в зависимости от числа P 2 O 5 + H 2 O = HPO 3 Метафосф присоединенных P 2 O 5 + H 2 O = H 4 P 2 O 7 Пирофосф молекул воды могут P 2 O 5 + H 2 O = H 3 PO 4 Ортофосф образоваться разные Cr. O 3 + H 2 O = H 2 Cr. O 4 Хромовая кислоты. Cr. O 3 + H 2 O = H 2 Cr 2 O 7 Дихромова
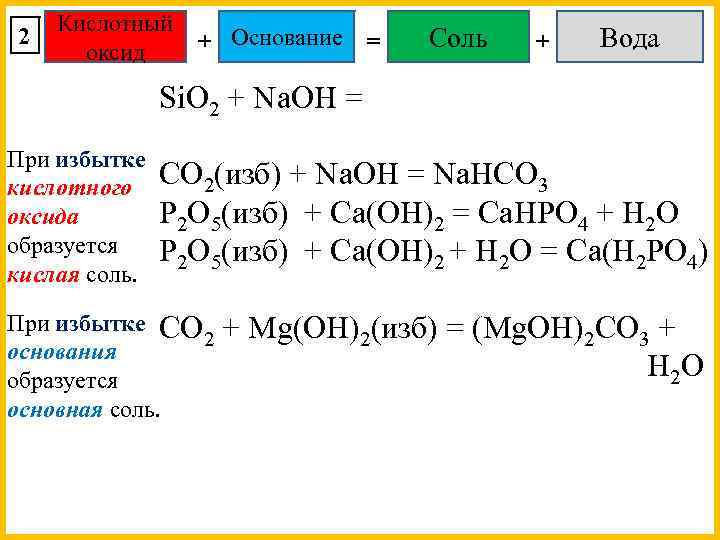 2 Кислотный + Основание оксид = Соль + Вода Si. O 2 + Na. OH = При избытке кислотного оксида образуется кислая соль. CO 2(изб) + Na. OH = Na. HCO 3 P 2 O 5(изб) + Ca(OH)2 = Ca. HPO 4 + H 2 O P 2 O 5(изб) + Ca(OH)2 + H 2 O = Ca(H 2 PO 4) При избытке CO + Mg(OH) (изб) = (Mg. OH) CO + 2 2 2 3 основания H 2 O образуется основная соль.
2 Кислотный + Основание оксид = Соль + Вода Si. O 2 + Na. OH = При избытке кислотного оксида образуется кислая соль. CO 2(изб) + Na. OH = Na. HCO 3 P 2 O 5(изб) + Ca(OH)2 = Ca. HPO 4 + H 2 O P 2 O 5(изб) + Ca(OH)2 + H 2 O = Ca(H 2 PO 4) При избытке CO + Mg(OH) (изб) = (Mg. OH) CO + 2 2 2 3 основания H 2 O образуется основная соль.
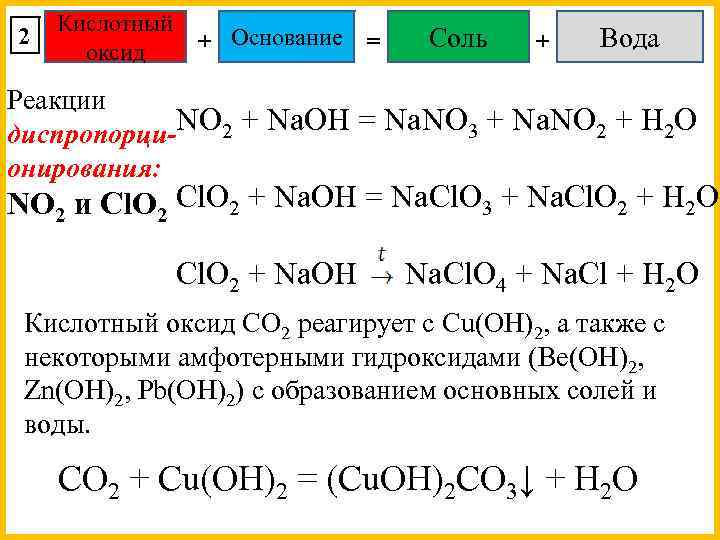 2 Кислотный + Основание оксид = Соль + Вода Реакции диспропорци-NO 2 + Na. OH = Na. NO 3 + Na. NO 2 + H 2 O онирования: NO 2 и Cl. O 2 + Na. OH = Na. Cl. O 3 + Na. Cl. O 2 + H 2 O Cl. O 2 + Na. OH Na. Cl. O 4 + Na. Cl + H 2 O Кислотный оксид CO 2 реагирует с Cu(OH)2, а также с некоторыми амфотерными гидроксидами (Be(OH)2, Zn(OH)2, Pb(OH)2) с образованием основных солей и воды. CO 2 + Cu(OH)2 = (Cu. OH)2 CO 3↓ + H 2 O
2 Кислотный + Основание оксид = Соль + Вода Реакции диспропорци-NO 2 + Na. OH = Na. NO 3 + Na. NO 2 + H 2 O онирования: NO 2 и Cl. O 2 + Na. OH = Na. Cl. O 3 + Na. Cl. O 2 + H 2 O Cl. O 2 + Na. OH Na. Cl. O 4 + Na. Cl + H 2 O Кислотный оксид CO 2 реагирует с Cu(OH)2, а также с некоторыми амфотерными гидроксидами (Be(OH)2, Zn(OH)2, Pb(OH)2) с образованием основных солей и воды. CO 2 + Cu(OH)2 = (Cu. OH)2 CO 3↓ + H 2 O
 3 Кислотный + оксид Основный оксид / Амфотерный = Соль 1) Реакции между + Si. O 2 = твердыми оксидами идут при нагревании или P 2 O 5 + Cu. O = сплавлении. 2) Амфотерные оксиды в SO 3 + Al 2 O 3 = таких случаях проявляют основные свойства. Ba. O
3 Кислотный + оксид Основный оксид / Амфотерный = Соль 1) Реакции между + Si. O 2 = твердыми оксидами идут при нагревании или P 2 O 5 + Cu. O = сплавлении. 2) Амфотерные оксиды в SO 3 + Al 2 O 3 = таких случаях проявляют основные свойства. Ba. O
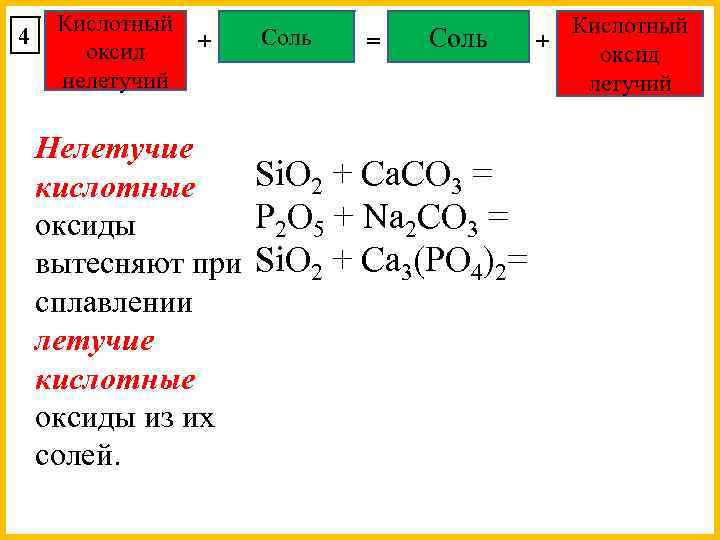 4 Кислотный + оксид нелетучий Соль = Соль Нелетучие Si. O 2 + Сa. CO 3 = кислотные P 2 O 5 + Na 2 CO 3 = оксиды вытесняют при Si. O 2 + Сa 3(PO 4)2= сплавлении летучие кислотные оксиды из их солей. Кислотный + оксид летучий
4 Кислотный + оксид нелетучий Соль = Соль Нелетучие Si. O 2 + Сa. CO 3 = кислотные P 2 O 5 + Na 2 CO 3 = оксиды вытесняют при Si. O 2 + Сa 3(PO 4)2= сплавлении летучие кислотные оксиды из их солей. Кислотный + оксид летучий
 Окислительно-восстановительные реакции кислотных оксидов: СO 2 + C = CO↑ Восстановление: 1) При высокой температуре С и H 2 Si. O 2 + C = Si. O + CO↑ восстанавливают оксиды (частично или SO 3 + C = SO 2 + CO↑ полностью). 2) При восстановлении неметаллов из их SO 2 + C = S + CO 2↑ оксидов часто используют N 2 O + C = N 2 + CO 2↑ магнийтермию. NO + C = N 2 + CO 2↑ NO 2 + C = N 2 + CO 2↑ P 2 O 5 + C = P + CO↑ CO 2 + Mg = C + Mg. O H 2 O + C = H 2 + CO↑ Si. O 2 + Mg = Si + Mg. O N 2 O + Mg = N 2 + Mg. O N 2 O + H 2 = N 2 + H 2 O CO 2 + Ca = Ca. C 2 + Ca. O NO + H 2 = N 2 + H 2 O CO 2 + H 2 = CH 4 + H 2 O 5
Окислительно-восстановительные реакции кислотных оксидов: СO 2 + C = CO↑ Восстановление: 1) При высокой температуре С и H 2 Si. O 2 + C = Si. O + CO↑ восстанавливают оксиды (частично или SO 3 + C = SO 2 + CO↑ полностью). 2) При восстановлении неметаллов из их SO 2 + C = S + CO 2↑ оксидов часто используют N 2 O + C = N 2 + CO 2↑ магнийтермию. NO + C = N 2 + CO 2↑ NO 2 + C = N 2 + CO 2↑ P 2 O 5 + C = P + CO↑ CO 2 + Mg = C + Mg. O H 2 O + C = H 2 + CO↑ Si. O 2 + Mg = Si + Mg. O N 2 O + Mg = N 2 + Mg. O N 2 O + H 2 = N 2 + H 2 O CO 2 + Ca = Ca. C 2 + Ca. O NO + H 2 = N 2 + H 2 O CO 2 + H 2 = CH 4 + H 2 O 5
 5 Окислительно-восстановительные реакции кислотных оксидов: NO + O 3 = NO 2 + O 2 SO + O 3 = SO 3 + O 2 NO + O 3 = N 2 O 5 + O 2 CO + O 2 = CO 2 SO + O 2 = SO 3 P O + O 2 = P 2 O 5 NO + O 2 = NO 2 N 2 O 3 + O 2 = N 2 O 4 Восстановление: 1) При высокой температуре С и H 2 2 восстанавливают оксиды (частично или полностью). 2 2) При восстановлении неметаллов из их оксидов часто используют магнийтермию. Окисление: 1) Под действием кислорода (озона) при 2 нагревании или с катализатором низшие 2 3 оксиды переходят в высшие.
5 Окислительно-восстановительные реакции кислотных оксидов: NO + O 3 = NO 2 + O 2 SO + O 3 = SO 3 + O 2 NO + O 3 = N 2 O 5 + O 2 CO + O 2 = CO 2 SO + O 2 = SO 3 P O + O 2 = P 2 O 5 NO + O 2 = NO 2 N 2 O 3 + O 2 = N 2 O 4 Восстановление: 1) При высокой температуре С и H 2 2 восстанавливают оксиды (частично или полностью). 2 2) При восстановлении неметаллов из их оксидов часто используют магнийтермию. Окисление: 1) Под действием кислорода (озона) при 2 нагревании или с катализатором низшие 2 3 оксиды переходят в высшие.
 Домашнее задание
Домашнее задание
 Составь уравнения реакций, соответствующие схемам:
Составь уравнения реакций, соответствующие схемам:
 Амфотерные оксиды Ст. ок. +3, +4 Be. O Zn. O Pb. O Sn. O Проявляют кислотные и основные свойства.
Амфотерные оксиды Ст. ок. +3, +4 Be. O Zn. O Pb. O Sn. O Проявляют кислотные и основные свойства.
 Химические свойства амфотерных оксидов: 1 Амфотерный + оксид Вода Al 2 O 3 + H 2 O ≠ ≠
Химические свойства амфотерных оксидов: 1 Амфотерный + оксид Вода Al 2 O 3 + H 2 O ≠ ≠
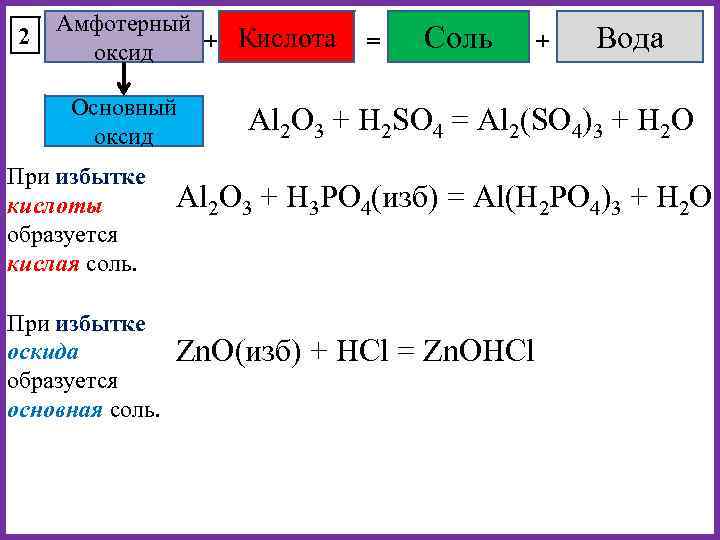 2 Амфотерный + Кислота оксид Основный оксид При избытке кислоты образуется кислая соль. При избытке оскида образуется основная соль. = Соль + Вода Al 2 O 3 + H 2 SO 4 = Al 2(SO 4)3 + H 2 O Al 2 O 3 + H 3 PO 4(изб) = Al(H 2 PO 4)3 + H 2 O Zn. O(изб) + HCl = Zn. OHCl
2 Амфотерный + Кислота оксид Основный оксид При избытке кислоты образуется кислая соль. При избытке оскида образуется основная соль. = Соль + Вода Al 2 O 3 + H 2 SO 4 = Al 2(SO 4)3 + H 2 O Al 2 O 3 + H 3 PO 4(изб) = Al(H 2 PO 4)3 + H 2 O Zn. O(изб) + HCl = Zn. OHCl
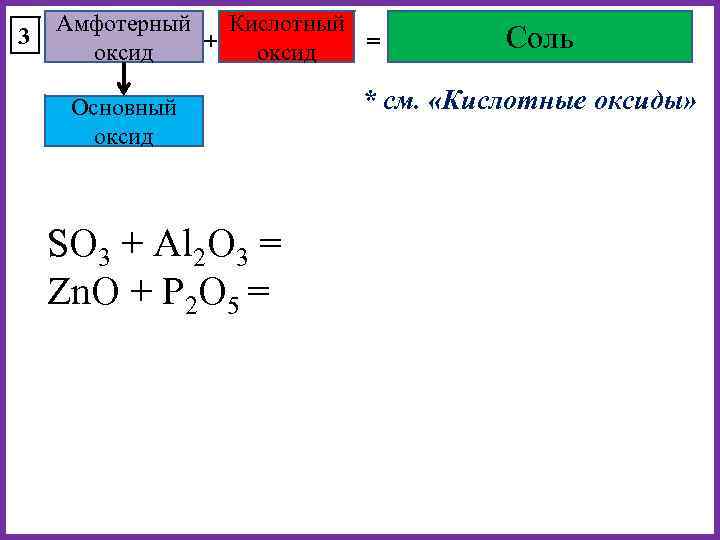 3 Амфотерный Кислотный + = оксид Основный оксид SO 3 + Al 2 O 3 = Zn. O + P 2 O 5 = Соль * см. «Кислотные оксиды»
3 Амфотерный Кислотный + = оксид Основный оксид SO 3 + Al 2 O 3 = Zn. O + P 2 O 5 = Соль * см. «Кислотные оксиды»
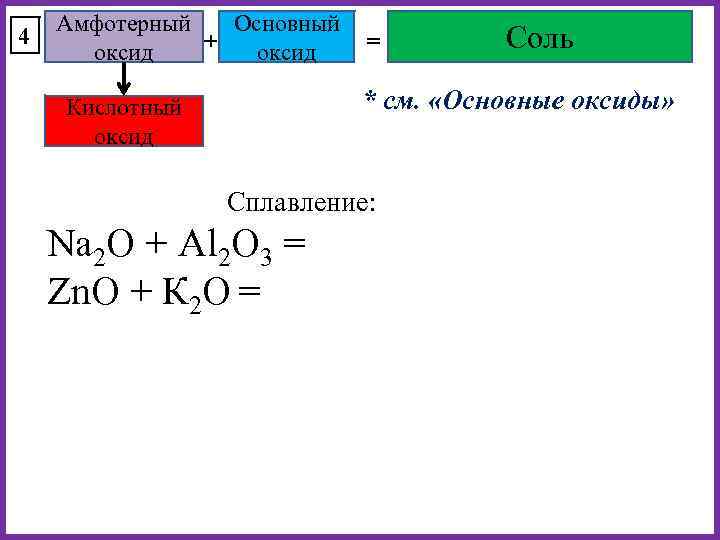 4 Амфотерный Основный + = оксид Соль * см. «Основные оксиды» Кислотный оксид Сплавление: Na 2 O + Al 2 O 3 = Zn. O + К 2 O =
4 Амфотерный Основный + = оксид Соль * см. «Основные оксиды» Кислотный оксид Сплавление: Na 2 O + Al 2 O 3 = Zn. O + К 2 O =
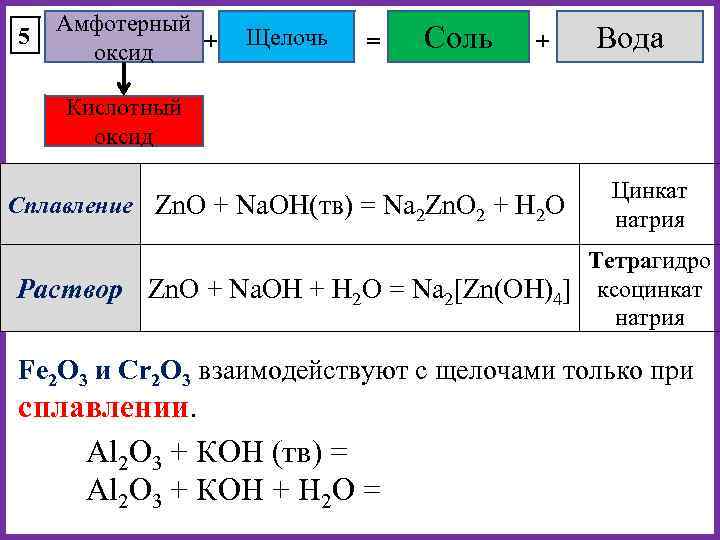 5 Амфотерный + оксид Щелочь = Соль + Вода Кислотный оксид Сплавление Zn. O + Na. OH(тв) = Na 2 Zn. O 2 + H 2 O Раствор Цинкат натрия Тетрагидро Zn. O + Na. OH + H 2 O = Na 2[Zn(OH)4] ксоцинкат натрия Fe 2 O 3 и Cr 2 O 3 взаимодействуют с щелочами только при сплавлении. Al 2 O 3 + КOH (тв) = Al 2 O 3 + КOH + H 2 O =
5 Амфотерный + оксид Щелочь = Соль + Вода Кислотный оксид Сплавление Zn. O + Na. OH(тв) = Na 2 Zn. O 2 + H 2 O Раствор Цинкат натрия Тетрагидро Zn. O + Na. OH + H 2 O = Na 2[Zn(OH)4] ксоцинкат натрия Fe 2 O 3 и Cr 2 O 3 взаимодействуют с щелочами только при сплавлении. Al 2 O 3 + КOH (тв) = Al 2 O 3 + КOH + H 2 O =
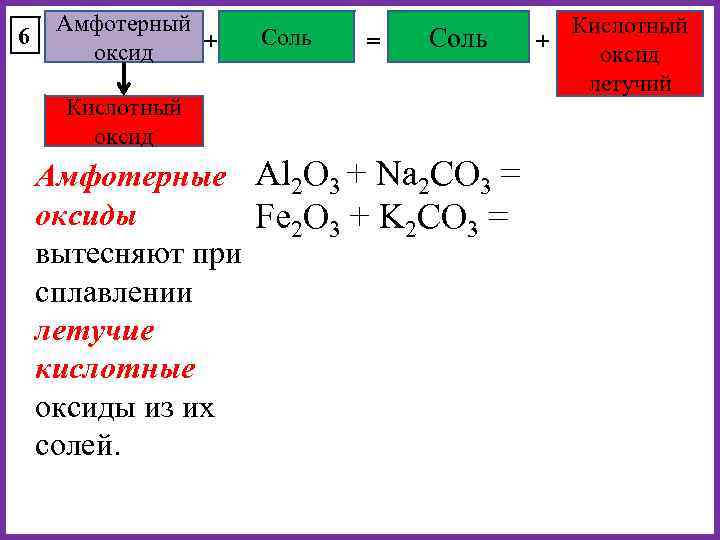 6 Амфотерный + оксид Соль = Соль Кислотный оксид Амфотерные Al 2 O 3 + Na 2 CO 3 = оксиды Fe 2 O 3 + K 2 CO 3 = вытесняют при сплавлении летучие кислотные оксиды из их солей. Кислотный + оксид летучий
6 Амфотерный + оксид Соль = Соль Кислотный оксид Амфотерные Al 2 O 3 + Na 2 CO 3 = оксиды Fe 2 O 3 + K 2 CO 3 = вытесняют при сплавлении летучие кислотные оксиды из их солей. Кислотный + оксид летучий
 Домашнее задание
Домашнее задание


