7. Оксиды и кислоты фосфора.ppt
- Количество слайдов: 19
 Оксиды и кислоты фосфора Свойства и методы получения
Оксиды и кислоты фосфора Свойства и методы получения
 Оксид фосфора (III) – фосфористый ангидрид Истинная формула P 4 O 6; Простейшая формула Р 2 О 3; Белые хлопья или кристаллы с неприятным запахом; Весьма летучий; Неустойчив на свету, вначале желтеет, а затем краснеет; q Хорошо растворяется в органических растворителях − бензоле, сероуглероде q Легко окисляется О 2 воздуха по реакции: Р 2 О 3 + О 2 → Р 2 О 5 q P 2 O 3 обладает всеми свойствами кислотного оксида – взаимодействует с водой с образованием фосфористой или фосфоновой кислоты: Р 2 О 3 + 3 Н 2 О → 2 Н 2 РНО 3 (Н 3 РО 3) q Взаимодействует со щелочами, образуя средние соли: Р 2 О 3 + 4 КОН → 2 К 2 РНО 3 + 2 Н 2 О фосфит калия q q q
Оксид фосфора (III) – фосфористый ангидрид Истинная формула P 4 O 6; Простейшая формула Р 2 О 3; Белые хлопья или кристаллы с неприятным запахом; Весьма летучий; Неустойчив на свету, вначале желтеет, а затем краснеет; q Хорошо растворяется в органических растворителях − бензоле, сероуглероде q Легко окисляется О 2 воздуха по реакции: Р 2 О 3 + О 2 → Р 2 О 5 q P 2 O 3 обладает всеми свойствами кислотного оксида – взаимодействует с водой с образованием фосфористой или фосфоновой кислоты: Р 2 О 3 + 3 Н 2 О → 2 Н 2 РНО 3 (Н 3 РО 3) q Взаимодействует со щелочами, образуя средние соли: Р 2 О 3 + 4 КОН → 2 К 2 РНО 3 + 2 Н 2 О фосфит калия q q q
 Оксид фосфора (V) – фосфорный ангидрид Истинная формула P 4 O 10; q Простейшая формула Р 2 О 5; q Твердый – белая снегообразная масса, состоящая из смеси разных форм P 4 O 10 q Гигроскопичен – очень активно взаимодействует с водой – реакция экзотермическая; q P 2 O 5 обладает всеми свойствами кислотного оксида – при взаимодействии с водой образует различные фосфорные кислоты (в зависимости от условий): P 2 O 5 + 3 H 2 O → 2 H 3 PO 4 (кипячение) ортофосфорная или фосфорная; P 2 O 5 + H 2 O → HPO 3 (0°С) метафосфорная; P 2 O 5 + 2 H 2 O → H 4 P 2 O 7 (20°С) пирофосфорная; q Взаимодействует со щелочами, образуя средние и кислые соли: Р 2 О 5 + 6 КОН → 2 К 3 РО 4 + 3 Н 2 О (ортофосфат или фосфат калия) Р 2 О 5 + 4 КОН → 2 К 2 НРО 4 + 2 Н 2 О (гидроортофосфат или гидрофосфат калия) Р 2 О 5 + 2 КОН + Н 2 О→ 2 КН 2 РО 4 (дигидроортофосфат или дигидрофосфат калия) q
Оксид фосфора (V) – фосфорный ангидрид Истинная формула P 4 O 10; q Простейшая формула Р 2 О 5; q Твердый – белая снегообразная масса, состоящая из смеси разных форм P 4 O 10 q Гигроскопичен – очень активно взаимодействует с водой – реакция экзотермическая; q P 2 O 5 обладает всеми свойствами кислотного оксида – при взаимодействии с водой образует различные фосфорные кислоты (в зависимости от условий): P 2 O 5 + 3 H 2 O → 2 H 3 PO 4 (кипячение) ортофосфорная или фосфорная; P 2 O 5 + H 2 O → HPO 3 (0°С) метафосфорная; P 2 O 5 + 2 H 2 O → H 4 P 2 O 7 (20°С) пирофосфорная; q Взаимодействует со щелочами, образуя средние и кислые соли: Р 2 О 5 + 6 КОН → 2 К 3 РО 4 + 3 Н 2 О (ортофосфат или фосфат калия) Р 2 О 5 + 4 КОН → 2 К 2 НРО 4 + 2 Н 2 О (гидроортофосфат или гидрофосфат калия) Р 2 О 5 + 2 КОН + Н 2 О→ 2 КН 2 РО 4 (дигидроортофосфат или дигидрофосфат калия) q
 Получение оксидов фосфора Оксид фосфора (III) Оксид фосфора (V) 1. Окисление белого фосфора кислородом t°C 1. Окисление белого фосфора кислородом P 4 + 3 O 2 → P 4 O 6 P 4 + 5 O 2 → P 4 O 10 2. Окисление белого фосфора закисью азота 550°C− 625°C P 4 + 6 N 2 O → P 4 O 6 + 6 N 2 3. Окисление белого фосфора углекислым газом 650°C P 4 + 6 СО 2 → P 4 O 6 + 6 СО 4. Сопропорционирование оксида фосфора (V) и белого фосфора: 50°C 2 P 4 + 3 P 4 O 10 → 5 P 4 O 6 t°C 2. Окисление оксида фосфора (III) кислородом t°C P 4 O 6 + 2 O 2 → P 4 O 10
Получение оксидов фосфора Оксид фосфора (III) Оксид фосфора (V) 1. Окисление белого фосфора кислородом t°C 1. Окисление белого фосфора кислородом P 4 + 3 O 2 → P 4 O 6 P 4 + 5 O 2 → P 4 O 10 2. Окисление белого фосфора закисью азота 550°C− 625°C P 4 + 6 N 2 O → P 4 O 6 + 6 N 2 3. Окисление белого фосфора углекислым газом 650°C P 4 + 6 СО 2 → P 4 O 6 + 6 СО 4. Сопропорционирование оксида фосфора (V) и белого фосфора: 50°C 2 P 4 + 3 P 4 O 10 → 5 P 4 O 6 t°C 2. Окисление оксида фосфора (III) кислородом t°C P 4 O 6 + 2 O 2 → P 4 O 10
 Особые свойства оксидов фосфора Оксид фосфора (III) Восстановитель Окисляется кислородом воздуха (быстрее при нагревании): 50°С − 120°С Р+32 O 3 + О 2 → Р+52 O 5 Оксид фосфора (V) Гигроскопичность Извлекает воду из других соединений – реакции дегидратации Р 2 O 5 + 2 HCl. O 4 → Cl 2 O 7 + 2 HPO 3 Р 2 O 5 + 2 HNO 3 → N 2 O 5 + 2 HPO 3
Особые свойства оксидов фосфора Оксид фосфора (III) Восстановитель Окисляется кислородом воздуха (быстрее при нагревании): 50°С − 120°С Р+32 O 3 + О 2 → Р+52 O 5 Оксид фосфора (V) Гигроскопичность Извлекает воду из других соединений – реакции дегидратации Р 2 O 5 + 2 HCl. O 4 → Cl 2 O 7 + 2 HPO 3 Р 2 O 5 + 2 HNO 3 → N 2 O 5 + 2 HPO 3
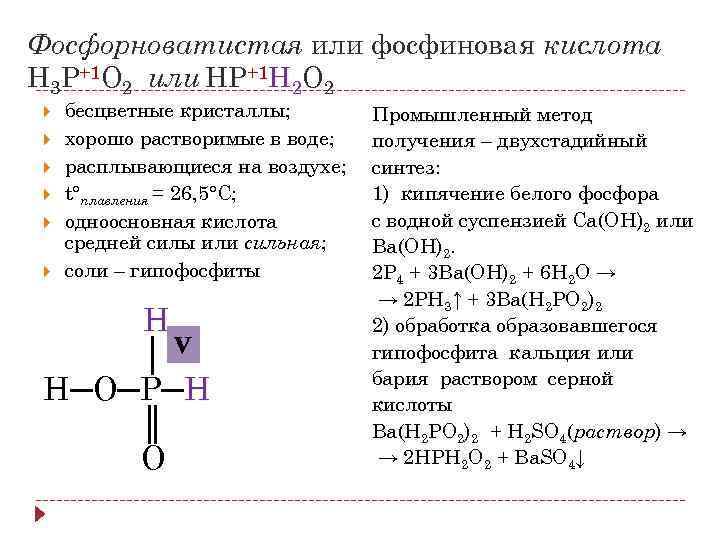 Фосфорноватистая или фосфиновая кислота H 3 P+1 O 2 или HP+1 Н 2 O 2 бесцветные кристаллы; хорошо растворимые в воде; расплывающиеся на воздухе; t°плавления = 26, 5°С; одноосновная кислота средней силы или сильная; соли – гипофосфиты Н │V Н─О─Р─Н ║ О Промышленный метод получения – двухстадийный синтез: 1) кипячение белого фосфора с водной суспензией Ca(OH)2 или Ba(OH)2. 2 P 4 + 3 Ba(OH)2 + 6 H 2 O → → 2 PH 3↑ + 3 Ba(H 2 PO 2)2 2) обработка образовавшегося гипофосфита кальция или бария раствором серной кислоты Ba(H 2 PO 2)2 + H 2 SO 4(раствор) → → 2 НPH 2 O 2 + Ba. SO 4↓
Фосфорноватистая или фосфиновая кислота H 3 P+1 O 2 или HP+1 Н 2 O 2 бесцветные кристаллы; хорошо растворимые в воде; расплывающиеся на воздухе; t°плавления = 26, 5°С; одноосновная кислота средней силы или сильная; соли – гипофосфиты Н │V Н─О─Р─Н ║ О Промышленный метод получения – двухстадийный синтез: 1) кипячение белого фосфора с водной суспензией Ca(OH)2 или Ba(OH)2. 2 P 4 + 3 Ba(OH)2 + 6 H 2 O → → 2 PH 3↑ + 3 Ba(H 2 PO 2)2 2) обработка образовавшегося гипофосфита кальция или бария раствором серной кислоты Ba(H 2 PO 2)2 + H 2 SO 4(раствор) → → 2 НPH 2 O 2 + Ba. SO 4↓
 Особые свойства фосфорноватистой кислоты 1. Фосфорноватистая кислота – восстановитель H 3 P+1 O 2 + 2 H 2 SO 4 концентрированная → H 3 P+5 O 4 + 2 SO 2 + 2 H 2 O S+6 – окислитель H 3 P+1 O 2 + O 2 → H 3 P+5 O 4 O 20 – окислитель H 3 P+1 O 2 + 4 Ag. NO 3 + 2 Н 2 О → 4 Ag + H 3 P+5 O 4 + 4 HNO 3 Ag+1 – окислитель H 3 P+1 O 2 + 2 Cu. SO 4 + 2 Н 2 О → H 3 P+5 O 4 + 2 Cu + 2 H 2 SO 4 Cu+2 – окислитель 2. Фосфорноватистая кислота диспропорционирует 50°С – 140°С 3 H 3 P+1 O 2 → P– 3 H 3 + 2 H 3 P+3 O 3 160°С – 170°С 2 H 3 P+1 O 2 → P– 3 H 3 + H 3 P+5 O 4
Особые свойства фосфорноватистой кислоты 1. Фосфорноватистая кислота – восстановитель H 3 P+1 O 2 + 2 H 2 SO 4 концентрированная → H 3 P+5 O 4 + 2 SO 2 + 2 H 2 O S+6 – окислитель H 3 P+1 O 2 + O 2 → H 3 P+5 O 4 O 20 – окислитель H 3 P+1 O 2 + 4 Ag. NO 3 + 2 Н 2 О → 4 Ag + H 3 P+5 O 4 + 4 HNO 3 Ag+1 – окислитель H 3 P+1 O 2 + 2 Cu. SO 4 + 2 Н 2 О → H 3 P+5 O 4 + 2 Cu + 2 H 2 SO 4 Cu+2 – окислитель 2. Фосфорноватистая кислота диспропорционирует 50°С – 140°С 3 H 3 P+1 O 2 → P– 3 H 3 + 2 H 3 P+3 O 3 160°С – 170°С 2 H 3 P+1 O 2 → P– 3 H 3 + H 3 P+5 O 4
 Фосфористая или фосфоновая кислота H 3 P+3 O 3 или H 2 P+3 НO 3 бесцветное кристаллическое сильно гигроскопичное вещество; t°плавления = 74°С; хорошо растворяется в воде; двухосновная кислота средней силы, ближе к слабым; соли – фосфиты О─Н │V Н─О─Р─Н ║ О Методы получения: 1) взаимодействие трихлорида фосфора с водой PCl 3 + 3 H 2 O → H 2 PНO 3 + 3 HCl↑; 2) взаимодействие с водой P 2 O 3 + 3 H 2 O → 2 H 2 PНO 3
Фосфористая или фосфоновая кислота H 3 P+3 O 3 или H 2 P+3 НO 3 бесцветное кристаллическое сильно гигроскопичное вещество; t°плавления = 74°С; хорошо растворяется в воде; двухосновная кислота средней силы, ближе к слабым; соли – фосфиты О─Н │V Н─О─Р─Н ║ О Методы получения: 1) взаимодействие трихлорида фосфора с водой PCl 3 + 3 H 2 O → H 2 PНO 3 + 3 HCl↑; 2) взаимодействие с водой P 2 O 3 + 3 H 2 O → 2 H 2 PНO 3
 Особые свойства фосфористой кислоты 1. Фосфористая кислота – восстановитель H 3 P+3 O 3 + H 2 SO 4 концентрированная → H 3 P+5 O 4 + SO 2 + H 2 O S+6 – окислитель 2 H 3 P+3 O 3 + O 2 → 2 H 3 P+5 O 4 O 20 – окислитель H 3 P+3 O 3 + 2 Ag. NO 3 + Н 2 О → 2 Ag + H 3 P+5 O 4 + 2 HNO 3 Ag+1 – окислитель H 3 P+3 O 3 + Cu. SO 4 + Н 2 О → H 3 P+5 O 4 + Cu + H 2 SO 4 Cu+2 – окислитель 2. Фосфористая кислота диспропорционирует 160°С – 170°С 4 H 3 P+3 O 3 → P– 3 H 3 + 3 H 3 P+5 O 4
Особые свойства фосфористой кислоты 1. Фосфористая кислота – восстановитель H 3 P+3 O 3 + H 2 SO 4 концентрированная → H 3 P+5 O 4 + SO 2 + H 2 O S+6 – окислитель 2 H 3 P+3 O 3 + O 2 → 2 H 3 P+5 O 4 O 20 – окислитель H 3 P+3 O 3 + 2 Ag. NO 3 + Н 2 О → 2 Ag + H 3 P+5 O 4 + 2 HNO 3 Ag+1 – окислитель H 3 P+3 O 3 + Cu. SO 4 + Н 2 О → H 3 P+5 O 4 + Cu + H 2 SO 4 Cu+2 – окислитель 2. Фосфористая кислота диспропорционирует 160°С – 170°С 4 H 3 P+3 O 3 → P– 3 H 3 + 3 H 3 P+5 O 4
 Общие свойства фосфорноватистой и фосфористой кислот Фосфорноватистая кислота Фосфористая кислота 1. Отношение к щелочам Na. ОН + H 3 PO 2 → Na. PН 2 O 2 + H 2 О 2 Na. ОН + H 3 PO 3 → Na 2 PНO 3 + 2 H 2 О гипофосфит натрия – средняя соль 2. Отношение к активным металлам 2 Na + 2 H 3 PO 2 → 2 Na. PН 2 O 2 + H 2 фосфит натрия – средняя соль 2. Отношение к активным металлам 2 Na + H 3 PO 3 → Na 2 PНO 3 + H 2
Общие свойства фосфорноватистой и фосфористой кислот Фосфорноватистая кислота Фосфористая кислота 1. Отношение к щелочам Na. ОН + H 3 PO 2 → Na. PН 2 O 2 + H 2 О 2 Na. ОН + H 3 PO 3 → Na 2 PНO 3 + 2 H 2 О гипофосфит натрия – средняя соль 2. Отношение к активным металлам 2 Na + 2 H 3 PO 2 → 2 Na. PН 2 O 2 + H 2 фосфит натрия – средняя соль 2. Отношение к активным металлам 2 Na + H 3 PO 3 → Na 2 PНO 3 + H 2
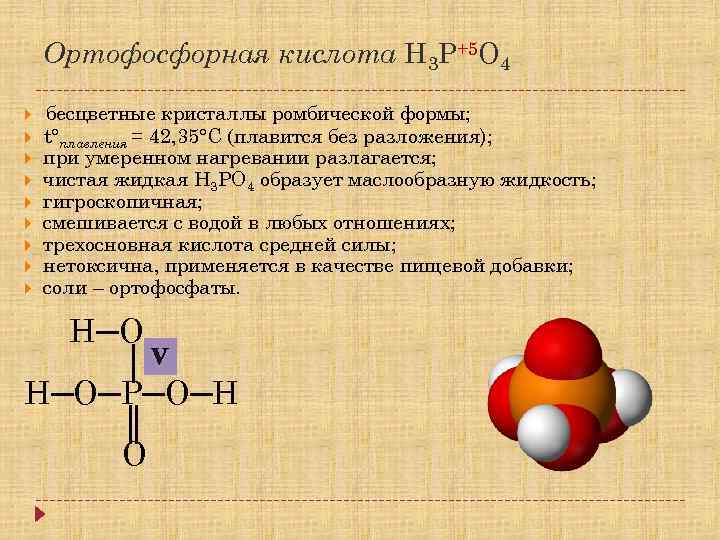 Ортофосфорная кислота H 3 P+5 O 4 бесцветные кристаллы ромбической формы; t°плавления = 42, 35°C (плавится без разложения); при умеренном нагревании разлагается; чистая жидкая Н 3 РО 4 образует маслообразную жидкость; гигроскопичная; смешивается с водой в любых отношениях; трехосновная кислота средней силы; нетоксична, применяется в качестве пищевой добавки; соли – ортофосфаты. Н─О │V Н─О─Р─О─Н ║ О
Ортофосфорная кислота H 3 P+5 O 4 бесцветные кристаллы ромбической формы; t°плавления = 42, 35°C (плавится без разложения); при умеренном нагревании разлагается; чистая жидкая Н 3 РО 4 образует маслообразную жидкость; гигроскопичная; смешивается с водой в любых отношениях; трехосновная кислота средней силы; нетоксична, применяется в качестве пищевой добавки; соли – ортофосфаты. Н─О │V Н─О─Р─О─Н ║ О
 Ортофосфорная кислота H 3 P+5 O 4 Промышленные методы получения: 1) обработка ортофосфата кальция раствором серной кислоты Ca 3(PO 4)2 + 3 H 2 SO 4 → 3 Ca. SO 4↓+ 2 H 3 PO 4 2) Взаимодействие фосфорного ангидрида с водой при кипячении P 2 O 5 + 3 H 2 O → 2 H 3 PO 4 3) Взаимодействие белого фосфора с водяным паром при t°=700 о. C в присутствии катализатора – мелкораздробленной меди 700 о. C, Cu порошок P 4 + 16 H 2 O пар → 4 H 3 PO 4 +10 H 2↑ Лабораторные методы получения: 1) Окисление фосфора 30%-ной азотной кислотой 3 P + 5 HNO 3 + 2 H 2 O→ 3 H 3 PO 4 + 5 NO. 2) Окисление фосфина PH 3 + 2 O 2 → H 3 PO 4
Ортофосфорная кислота H 3 P+5 O 4 Промышленные методы получения: 1) обработка ортофосфата кальция раствором серной кислоты Ca 3(PO 4)2 + 3 H 2 SO 4 → 3 Ca. SO 4↓+ 2 H 3 PO 4 2) Взаимодействие фосфорного ангидрида с водой при кипячении P 2 O 5 + 3 H 2 O → 2 H 3 PO 4 3) Взаимодействие белого фосфора с водяным паром при t°=700 о. C в присутствии катализатора – мелкораздробленной меди 700 о. C, Cu порошок P 4 + 16 H 2 O пар → 4 H 3 PO 4 +10 H 2↑ Лабораторные методы получения: 1) Окисление фосфора 30%-ной азотной кислотой 3 P + 5 HNO 3 + 2 H 2 O→ 3 H 3 PO 4 + 5 NO. 2) Окисление фосфина PH 3 + 2 O 2 → H 3 PO 4
 Химические свойства Н 3 РО 4 Ортофосфорная кислота в водных растворах намного слабее серной и азотной кислот; Это трехосновная кислота средней силы; Электролитическая диссоциация кислоты, как и других многоосновных кислот, осуществляется ступенчато: Н 3 РО 4 ⇄ Н 1+ + Н 2 РО 4 − (I ступень), K 1 = 7, 5∙ 10– 3 Н 2 РО 4 − ⇄ Н 1+ + НРО 42− (II ступень), K 2 = 6, 3∙ 10– 8 НРО 42− ⇄ Н 1+ + РО 43− (III ступень), K 3 = 1, 3∙ 10– 12 Н 3 РО 4 ⇄ 3 Н 1+ + РО 43− (суммарное уравнение)
Химические свойства Н 3 РО 4 Ортофосфорная кислота в водных растворах намного слабее серной и азотной кислот; Это трехосновная кислота средней силы; Электролитическая диссоциация кислоты, как и других многоосновных кислот, осуществляется ступенчато: Н 3 РО 4 ⇄ Н 1+ + Н 2 РО 4 − (I ступень), K 1 = 7, 5∙ 10– 3 Н 2 РО 4 − ⇄ Н 1+ + НРО 42− (II ступень), K 2 = 6, 3∙ 10– 8 НРО 42− ⇄ Н 1+ + РО 43− (III ступень), K 3 = 1, 3∙ 10– 12 Н 3 РО 4 ⇄ 3 Н 1+ + РО 43− (суммарное уравнение)
 Химические свойства Н 3 РО 4 1. Нейтрализация фосфорной кислоты щелочами − образование солей: дигидрофосфатов, фосфатов: Н 3 РО 4 + Na. OH→ Na. H 2 PO 4 + H 2 O (дигидрофосфат натрия); H 3 PO 4 + 2 Na. OH→ Na 2 HPO 4 + 2 H 2 O (гидрофосфат натрия); H 3 PO 4 + 3 Na. OH → Na 3 PO 4 + 3 H 2 O (ортофосфат натрия); 2. Качественная реакция на ортофосфорную кислоту ─ взаимодействие с нитратом серебра Н 3 РО 4 + 3 Ag. NO 3→ Ag 3 PO 4↓ + 3 HNO 3 (ортофосфат серебра – желтый осадок); 3. Термолиз ортофосфорной кислоты: а) при упаривании образуется пирофосфорная кислота: 150°C 2 Н 3 РО 4 → Н 4 Р 2 О 7 + Н 2 О; б) при прокаливании в вакууме – метафосфорная кислота: 300°C, вакуум Н 3 РО 4 → НРО 3 + Н 2 О 4. Взаимодействие с активными металлами: 2 Н 3 РО 4 + 2 Na→ 2 Na. H 2 PO 4 + H 2↑
Химические свойства Н 3 РО 4 1. Нейтрализация фосфорной кислоты щелочами − образование солей: дигидрофосфатов, фосфатов: Н 3 РО 4 + Na. OH→ Na. H 2 PO 4 + H 2 O (дигидрофосфат натрия); H 3 PO 4 + 2 Na. OH→ Na 2 HPO 4 + 2 H 2 O (гидрофосфат натрия); H 3 PO 4 + 3 Na. OH → Na 3 PO 4 + 3 H 2 O (ортофосфат натрия); 2. Качественная реакция на ортофосфорную кислоту ─ взаимодействие с нитратом серебра Н 3 РО 4 + 3 Ag. NO 3→ Ag 3 PO 4↓ + 3 HNO 3 (ортофосфат серебра – желтый осадок); 3. Термолиз ортофосфорной кислоты: а) при упаривании образуется пирофосфорная кислота: 150°C 2 Н 3 РО 4 → Н 4 Р 2 О 7 + Н 2 О; б) при прокаливании в вакууме – метафосфорная кислота: 300°C, вакуум Н 3 РО 4 → НРО 3 + Н 2 О 4. Взаимодействие с активными металлами: 2 Н 3 РО 4 + 2 Na→ 2 Na. H 2 PO 4 + H 2↑
 Метафосфорная кислота НР+5 О 3 белая, стекловидная, гигроскопичная; сублимируется при сильном нагревании; хорошо растворяется в холодной воде; одноосновная кислота слабая; очень ядовита соли – метафосфаты; V Н─О─Р═О ║ О Методы получения: 1) взаимодействие фосфорного ангидрида с водой t°= 0 о. С P 2 O 5 + H 2 O → 2 HPO 3 2) взаимодействие фосфорного ангидрида с безводными кислородсодержащими кислотами – метод получения оксидов неметаллов из кислот и метафосфорной кислоты P 2 O 5 + 2 HCl. O 4 → 2 HPO 3 + Cl 2 O 7, P 2 O 5 + 2 HNO 3 → 2 HPO 3 + N 2 O 5.
Метафосфорная кислота НР+5 О 3 белая, стекловидная, гигроскопичная; сублимируется при сильном нагревании; хорошо растворяется в холодной воде; одноосновная кислота слабая; очень ядовита соли – метафосфаты; V Н─О─Р═О ║ О Методы получения: 1) взаимодействие фосфорного ангидрида с водой t°= 0 о. С P 2 O 5 + H 2 O → 2 HPO 3 2) взаимодействие фосфорного ангидрида с безводными кислородсодержащими кислотами – метод получения оксидов неметаллов из кислот и метафосфорной кислоты P 2 O 5 + 2 HCl. O 4 → 2 HPO 3 + Cl 2 O 7, P 2 O 5 + 2 HNO 3 → 2 HPO 3 + N 2 O 5.
 Свойства метафосфорной кислоты HP+5 O 3 При кипячении водных растворов переходит в ортофосфорную кислоту: кипячение HPO 3 + Н 2 О → Н 3 РО 4 Реагирует с щелочами с образованием солей: HPO 3 + КОН → КPO 3 + 42 О
Свойства метафосфорной кислоты HP+5 O 3 При кипячении водных растворов переходит в ортофосфорную кислоту: кипячение HPO 3 + Н 2 О → Н 3 РО 4 Реагирует с щелочами с образованием солей: HPO 3 + КОН → КPO 3 + 42 О
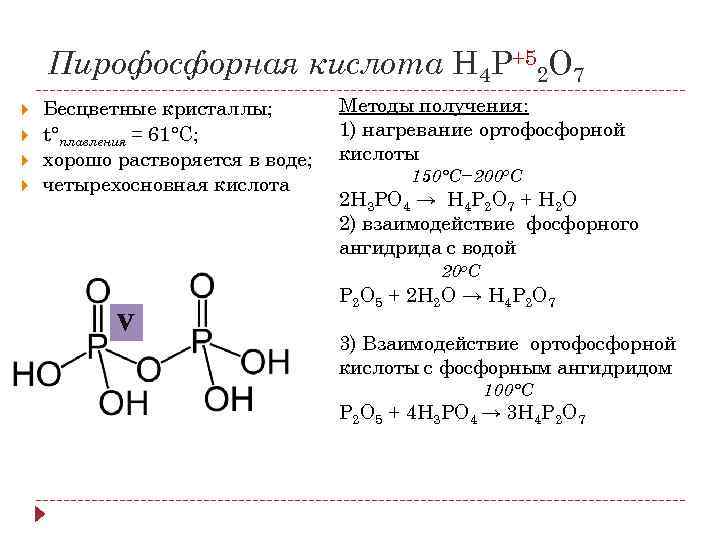 Пирофосфорная кислота H 4 P+52 O 7 Бесцветные кристаллы; t°плавления = 61°С; хорошо растворяется в воде; четырехосновная кислота Методы получения: 1) нагревание ортофосфорной кислоты 150°С− 200 о. С 2 H 3 PO 4 → H 4 P 2 O 7 + H 2 O 2) взаимодействие фосфорного ангидрида с водой 20 о. С P 2 O 5 + 2 H 2 O → H 4 P 2 O 7 V 3) Взаимодействие ортофосфорной кислоты с фосфорным ангидридом 100°С P 2 O 5 + 4 H 3 PO 4 → 3 H 4 P 2 O 7
Пирофосфорная кислота H 4 P+52 O 7 Бесцветные кристаллы; t°плавления = 61°С; хорошо растворяется в воде; четырехосновная кислота Методы получения: 1) нагревание ортофосфорной кислоты 150°С− 200 о. С 2 H 3 PO 4 → H 4 P 2 O 7 + H 2 O 2) взаимодействие фосфорного ангидрида с водой 20 о. С P 2 O 5 + 2 H 2 O → H 4 P 2 O 7 V 3) Взаимодействие ортофосфорной кислоты с фосфорным ангидридом 100°С P 2 O 5 + 4 H 3 PO 4 → 3 H 4 P 2 O 7
 Свойства пирофосфорной кислоты H 4 P+52 O 7 При нагревании в вакууме разлагается: 300°C, вакуум H 4 P 2 O 7 → 2 HPO 3 + Н 2 О При кипячении водных растворов переходит в ортофосфорную кислоту: кипячение H 4 P 2 O 7 + Н 2 О → 2 H 3 PO 4 Реагирует с щелочами с образованием нормальных или кислых солей: H 4 P 2 O 7 + 4 КОН концентрированный → К 4 P 2 O 7 + 4 Н 2 О H 4 P 2 O 7 + 2 КОН разбавленный → К 2 H 2 P 2 O 7 + 2 Н 2 О Вступает в обменные реакции: H 4 P 2 O 7 + 4 Ag. NO 3 → Ag 4 P 2 O 7↓ + 4 HNO 3
Свойства пирофосфорной кислоты H 4 P+52 O 7 При нагревании в вакууме разлагается: 300°C, вакуум H 4 P 2 O 7 → 2 HPO 3 + Н 2 О При кипячении водных растворов переходит в ортофосфорную кислоту: кипячение H 4 P 2 O 7 + Н 2 О → 2 H 3 PO 4 Реагирует с щелочами с образованием нормальных или кислых солей: H 4 P 2 O 7 + 4 КОН концентрированный → К 4 P 2 O 7 + 4 Н 2 О H 4 P 2 O 7 + 2 КОН разбавленный → К 2 H 2 P 2 O 7 + 2 Н 2 О Вступает в обменные реакции: H 4 P 2 O 7 + 4 Ag. NO 3 → Ag 4 P 2 O 7↓ + 4 HNO 3
 Свойства солей ортофосфорной кислоты Ø дигидрофосфаты хорошо растворимы в воде; почти все гидрофосфаты и фосфаты мало растворимы; Ø нерастворимые и малорастворимые гидрофосфаты и фосфаты растворяются в избытке кислоты с образованием дигидрофосфатов: Са 3(PO 4)2 + Н 3 РО 4 → 3 Са. НРО 4 + Н 3 РО 4 → Са(H 2 PO 4)2 Са 3(PO 4)2 + 4 Н 3 РО 4 → 3 Са(H 2 PO 4)2 Ø при прокаливании кислых солей образуются метафосфаты и пирофосфаты: Na. H 2 PO 4 → Na. PO 3 + Н 2 О 2 Na 2 HPO 4 → Na 4 P 2 O 7 + Н 2 О; Ø ортофосфаты устойчивы к нагреванию и плавятся без разложения Ø
Свойства солей ортофосфорной кислоты Ø дигидрофосфаты хорошо растворимы в воде; почти все гидрофосфаты и фосфаты мало растворимы; Ø нерастворимые и малорастворимые гидрофосфаты и фосфаты растворяются в избытке кислоты с образованием дигидрофосфатов: Са 3(PO 4)2 + Н 3 РО 4 → 3 Са. НРО 4 + Н 3 РО 4 → Са(H 2 PO 4)2 Са 3(PO 4)2 + 4 Н 3 РО 4 → 3 Са(H 2 PO 4)2 Ø при прокаливании кислых солей образуются метафосфаты и пирофосфаты: Na. H 2 PO 4 → Na. PO 3 + Н 2 О 2 Na 2 HPO 4 → Na 4 P 2 O 7 + Н 2 О; Ø ортофосфаты устойчивы к нагреванию и плавятся без разложения Ø


