оксиды азота.ppt
- Количество слайдов: 25

Оксиды азота Общая характеристика Индивидуальные характеристики оксидов

Общая характеристика w Азот образует ряд соединений в положительной степени окисления w Все оксиды могут быть получены из азотной кислоты и ее солей w Некоторые оксиды могут быть получены прямым взаимодействием азота с кислородом w По строению молекул и проявляемым свойствам могут быть разделены на группы
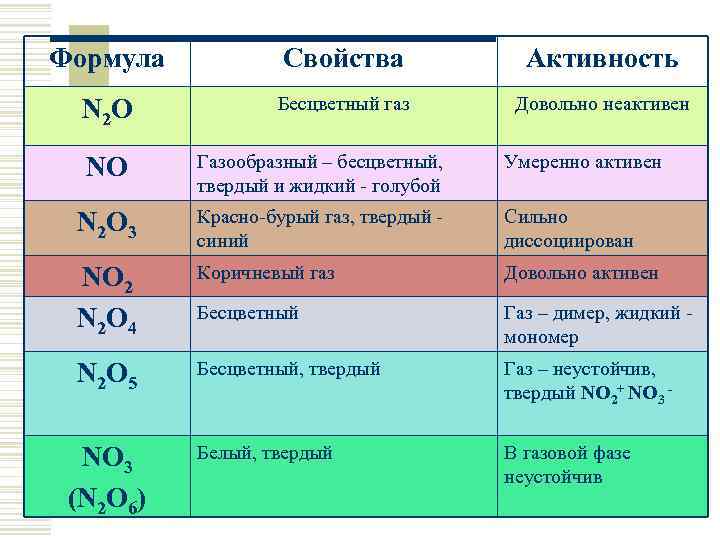
Формула Свойства Активность N 2 O Бесцветный газ Довольно неактивен NO Газообразный – бесцветный, твердый и жидкий - голубой Умеренно активен N 2 O 3 Красно-бурый газ, твердый синий Сильно диссоциирован NO 2 N 2 O 4 Коричневый газ Довольно активен Бесцветный Газ – димер, жидкий мономер N 2 O 5 Бесцветный, твердый Газ – неустойчив, твердый NO 2+ NO 3 - Белый, твердый В газовой фазе неустойчив NO 3 (N 2 O 6)

Группы оксидов w Несолеобразующие - N 2 O , NO w Кислотные - N 2 O 3 , N 2 O 5 w Склонные к димеризации – NO 2 w Димерные - N 2 O 4 , N 2 O 6

Несолеобразующие оксиды Оксид азота (I) Оксид азота(II)

Молекула N 2 O w Молекула линейная w N- =N+ = О 0 N 0 = N+ Оодин из крайних атомов заряжен отрицательно, другой – нейтрален, средний атом азота всегда имеет положительный заряд

w Получение : NH 4 NO 3 = N 2 O + 2 H 2 O (степени окисления? ) w N 2 O – газ, без цвета, легко сгущается при понижении температуры в бесцветную жидкость, хорошо растворим в воде (1: 1, 3 при 00 С), w «Веселящий газ» , в больших количествах возбуждающе действует на нервную систему w Применяется при легких операциях, приводит к потере болевой чувствительности

Химические свойства N 2 O w С водой при растворении не взаимодействует w При комнатной температуре инертен к галогенам, щелочным металлам, озону w При нагревании разлагается на азот и кислород, поддерживает горение, сера, фосфор сгорают: 2 N 2 O = 2 N 2 + O 2 S + 2 N 2 O = SO 2 + 2 N 2

Оксид азота (II) w Единственный из оксидов можно получить реакций соединения простых веществ при температуре 1200 -30000 С w В природе – при грозовых разрядах w При понижении температуры разлагается на азот и кислород w При резком падении температуры происходит «закалка» равновесия эндотермической реакции

Физические свойства NO w Бесцветный газ, плохо растворим в воде, сжижается с трудом, tпл. =-163, 70 С, tкип. =-151, 80 С, в жидком и твердом состоянии – голубой Кратность связи 2. 5. В твердом состоянии состоит из слабосвязанных димеров: N O O N

Химические свойства NO w С трудом отдает кислород w Реагирует лишь с очень активными веществами окислителями или восстановителями: 2 NO + Cl 2 = 2 NOCl SO 2 + NO = N 2 O + SO 3 w С водой не взаимодействует

Получение NO w Из азотной кислоты: 3 Cu + 8 HNO 3 = Cu(NO 3)2 + 2 NO + 4 H 2 O w С участием нитратов: 2 КNO 2 + КNO 3 +Cr 2 O 3 = 2 K 2 Cr. O 4 + 4 NO w Каталитическим окислением аммиака: 4 NH 3 + 5 О 2 = 4 NO + 6 Н 2 О

Кислотные оксиды Оксид азота (III) Оксид азота(V)

Оксид азота (III) w Существует в чистом виде только в твердом состоянии w N 2 O 3 – жидкость, интенсивно синего цвета, tкип. 40 С, в значительной степени дисоциирована: N 2 O 3 = NO+ NO 2 N 2 O 3 –в твердом состоянии, имеет слабую синеватую окраску, tпл. = -1000 С

Химические свойства N 2 O 3 w Формально соответствует азотистой кислоте: N 2 O 3 + Н 2 О =2 НNO 2 w При растворении в щелочах образует нитриты: N 2 O 3 + 2 КОН = 2 КNO 2 + Н 2 О w Может реагировать с серной кислотой: N 2 O 3 + 3 Н 2 SO 4 =3 НSO 4 - + Н 3 О+ + 2 NO+ - ион нитрозония, очень сильный окислитель; реакция интересна только теоретически

Получение N 2 O 3 w Из азотной кислоты: 2 НNO 3 + As 2 О 3 = 2 НAs. О 3 + NO 2 w При пропускании через жидкий воздух электрического разряда: N 2 + O 2 = 2 NO 4 NO + O 2 =2 N 2 O 3 – голубой порошок

Оксид азота N 2 O 5 w N 2 O 5 – бесцветные кристаллы, неустойчив, взрывоопасен, возгоняется при 330 С w Образован ионами NO 2+ и NO 3 O O N O w Получается при дегидрировании азотной кислоты: 2 НNO 3 + Р 2 О 5 = 2 НРО 3 + N 2 O 5 w Является ангидридом азотной кислоты: N 2 O 5 +Н 2 О = 2 НNO 3

Склонные к димеризации Оксид азота (IV) и его свойства

Оксид азота NO 2 w NO 2 – газ, коричневого цвета, активен, легко выделяется из раствора азотной кислоты: Cu + HNO 3 = Cu (NO 3)2 + 2 NO 2 + 2 H 2 O, а также при прокаливании нитратов: NO 2 2 Pb(NO 3)2 = 2 Pb. O + 4 NO 2 + O 2 w При растворении взаимодействует с водой: 2 NO 2 + H 2 O = HNO 3 + HNO 2 3 NO 2 + H 2 O = 2 HNO 3 + NO, и растворами щелочей: 2 NO 2 + КОH = КNO 3 + КNO 2 + H 2 O (степени окисления азота? )

Димерные оксиды Оксид азота N 2 O 4 Оксид азота N 2 O 6

Оксид азота N 2 O 4 w Димер NO 2, причина – неспаренные электроны молекулы NO 2 w Оксиды находятся в равновесии: 2 NO 2 N 2 O 4 w Равновесие смещается в зависимости от температуры: ниже – 120 С – только N 2 O 4; при -11, 20 С – 0, 01% NO 2 – светло-желтая жидкость при 21, 150 С – 0, 1% NO 2 - красно-бурая жидкость при 1000 С – 90% NO 2; при 1400 С – 100% NO 2, - газ черного цвета

Оксид азота N 2 O 6 w Пероксид азота - NO 3 ! w Имеет спектр поглощения w Получается при взаимодействии N 2 O 4 или N 2 O 5 с жидким озоном: N 2 O 5 + О 3 = 2 NO 3 + О 2 w Формула доказывается взаимодействием с водой: 2 NO 3 + Н 2 О = НNO 3 + НNO 2 + О 2 Появляется лишний кислород! w Атом азота пятивалентен, существование структуры NO 3 невероятно

w Вероятен димер состава N 2 O 6 w Две частицы NO 3 соединяются друг с другом через пероксидный мостик, образуя димерную структуру (структура? ) w В данной структуре валентность и степень окисления атомов азота совпадают w Термически неустойчив, возможность химических реакций проследить нет возможности w Вероятно, активность обусловлена появлением других оксидов при распаде молекулы: N 2 O 6 = 2 NO 2 + О 2

Таким образом… w Оксиды азота газообразны (? ) w Чем больше степень окисления, тем легче они становятся жидкостями w Оксиды азота проявляют разнообразные свойства: с увеличением степени окисления окислительная способность оксидов возрастает, восстановительная – уменьшается w Некоторые оксиды являются ангидридами кислот (? )

Спасибо за внимание!
оксиды азота.ppt