вода лекция 10.pptx
- Количество слайдов: 19
 Оксид водорода – Вода является одним из самых распространённых в природе веществ. В природе вода встречается как в свободном, так и в связанном состояниях. В свободном состоянии она находится в реках , озёрах , океанах, в грунтовых водах , входит в состав растительных и животных организмов. В связанном состоянии она содержится во многих минералах и горных породах ( гидросиликаты , гипс , различные глины , опал и др. ). Промышленное значение воды огромно. Практически нет ни одного производственного процесса, в котором не использовали бы воду. Вода – важная составная часть технологических процессов , в том числе – в строительном производстве, например, для затворения цемента, глины, извести и других вяжущих веществ, ежегодно используются сотни миллионов тонн воды. Твердение вяжущих также протекает в результате химического взаимодействия их с водой.
Оксид водорода – Вода является одним из самых распространённых в природе веществ. В природе вода встречается как в свободном, так и в связанном состояниях. В свободном состоянии она находится в реках , озёрах , океанах, в грунтовых водах , входит в состав растительных и животных организмов. В связанном состоянии она содержится во многих минералах и горных породах ( гидросиликаты , гипс , различные глины , опал и др. ). Промышленное значение воды огромно. Практически нет ни одного производственного процесса, в котором не использовали бы воду. Вода – важная составная часть технологических процессов , в том числе – в строительном производстве, например, для затворения цемента, глины, извести и других вяжущих веществ, ежегодно используются сотни миллионов тонн воды. Твердение вяжущих также протекает в результате химического взаимодействия их с водой.
 Наряду с этим , природные воды, воздействуя на различные сооружения, вызывают их коррозию. Разрушению подвергаются как металлические, так и неметаллические ( например , бетон , каменные материалы ) конструкции. Причем , интенсивность этих процессов зависит от состава природных вод. Поэтому при разработке мер борьбы против коррозии необходимо учитывать состав соответствующих вод. Чистой воды в природе нет – она всегда содержит примеси.
Наряду с этим , природные воды, воздействуя на различные сооружения, вызывают их коррозию. Разрушению подвергаются как металлические, так и неметаллические ( например , бетон , каменные материалы ) конструкции. Причем , интенсивность этих процессов зависит от состава природных вод. Поэтому при разработке мер борьбы против коррозии необходимо учитывать состав соответствующих вод. Чистой воды в природе нет – она всегда содержит примеси.
 Физические свойства воды Чистая вода представляет собой бесцветную, летучую, прозрачную жидкость. Её наибольшая плотность при 0 °C. Плотность льда меньше плотности жидкой воды, поэтому лёд всплывает на поверхность. Вода замерзает при 0 °С , кипит при 100 °С ( давление 101, 325 Па ). Вода – хороший растворитель. Плотность воды при переходе её из твёрдого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает. При нагревании воды от 0 до 4°С плотность её также увеличивается. При 4°С вода имеет максимальную плотность , и лишь при дальнейшем нагревании её плотность уменьшается. По массе в состав воды входит 88, 81% кислорода и 11, 19% водорода. Физические свойства воды аномальны, вода является единственным веществом на Земле, существующем в жидком, твёрдом и газообразном состоянии.
Физические свойства воды Чистая вода представляет собой бесцветную, летучую, прозрачную жидкость. Её наибольшая плотность при 0 °C. Плотность льда меньше плотности жидкой воды, поэтому лёд всплывает на поверхность. Вода замерзает при 0 °С , кипит при 100 °С ( давление 101, 325 Па ). Вода – хороший растворитель. Плотность воды при переходе её из твёрдого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает. При нагревании воды от 0 до 4°С плотность её также увеличивается. При 4°С вода имеет максимальную плотность , и лишь при дальнейшем нагревании её плотность уменьшается. По массе в состав воды входит 88, 81% кислорода и 11, 19% водорода. Физические свойства воды аномальны, вода является единственным веществом на Земле, существующем в жидком, твёрдом и газообразном состоянии.
 Физические свойства H 2 O Температура кипения (°С) 100 Температура кристаллизации (°С) 0 Плотность при 20 °С, ( г/см 3 ) 0, 9982 Молекулярная масса 18 Максимальная плотность при 4°С , ( г/см 3) 1 Вода обладает рядом уникальных физических свойств , наличие которых объясняется высокой полярностью молекул воды и объединением молекул воды в ассоциаты за счёт образования водородных связей. Любое из свойств воды уникально! Структура воды наиболее важна, чем химические свойства.
Физические свойства H 2 O Температура кипения (°С) 100 Температура кристаллизации (°С) 0 Плотность при 20 °С, ( г/см 3 ) 0, 9982 Молекулярная масса 18 Максимальная плотность при 4°С , ( г/см 3) 1 Вода обладает рядом уникальных физических свойств , наличие которых объясняется высокой полярностью молекул воды и объединением молекул воды в ассоциаты за счёт образования водородных связей. Любое из свойств воды уникально! Структура воды наиболее важна, чем химические свойства.
 Строение молекулы воды. В молекуле воды ядра атомов водорода и кислорода образуют равнобедренный треугольник: в основании треугольника находятся два протона водорода, а в вершине – ядро атома кислорода. Длина связи H – O равна 0, 09584 нм , а расстояние между атомами водорода равно 0, 145 нм.
Строение молекулы воды. В молекуле воды ядра атомов водорода и кислорода образуют равнобедренный треугольник: в основании треугольника находятся два протона водорода, а в вершине – ядро атома кислорода. Длина связи H – O равна 0, 09584 нм , а расстояние между атомами водорода равно 0, 145 нм.
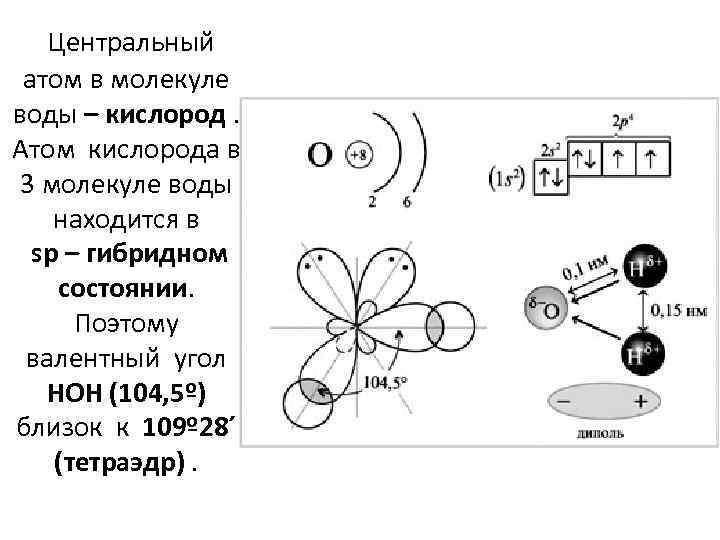 Центральный атом в молекуле воды – кислород. Атом кислорода в 3 молекуле воды находится в sp – гибридном состоянии. Поэтому валентный угол HOH (104, 5º) близок к 109º 28´ (тетраэдр).
Центральный атом в молекуле воды – кислород. Атом кислорода в 3 молекуле воды находится в sp – гибридном состоянии. Поэтому валентный угол HOH (104, 5º) близок к 109º 28´ (тетраэдр).
 Электроны , образующие связи H – O , смещены к атому кислорода, в результате атомы водорода приобретают эффективные положительные заряды. Неподеленные электронные пары (НЭП) создают два отрицательных полюса. Связь водород – кислород ( H – O ) – ковалентная полярная. Молекулы воды полярны (диполь) по двум причинам: 1. Каждая из связей H – O полярна и на том её конце , где находится ядро водорода , имеется избыток положительного заряда, а на «кислородном» конце – избыток отрицательного. 2. Две неподеленные электронные пары создают дополнительную плотность отрицательного заряда на атоме кислорода. В жидком состоянии молекулы воды ассоциированы. Причиной ассоциации молекул воды является их высокая полярность, а так же водородные связи между молекулами воды.
Электроны , образующие связи H – O , смещены к атому кислорода, в результате атомы водорода приобретают эффективные положительные заряды. Неподеленные электронные пары (НЭП) создают два отрицательных полюса. Связь водород – кислород ( H – O ) – ковалентная полярная. Молекулы воды полярны (диполь) по двум причинам: 1. Каждая из связей H – O полярна и на том её конце , где находится ядро водорода , имеется избыток положительного заряда, а на «кислородном» конце – избыток отрицательного. 2. Две неподеленные электронные пары создают дополнительную плотность отрицательного заряда на атоме кислорода. В жидком состоянии молекулы воды ассоциированы. Причиной ассоциации молекул воды является их высокая полярность, а так же водородные связи между молекулами воды.
 Водородная связь – является особым видом химической связи, это, в основном, межмолекулярная связь. Водородной химической связью называется такая связь , которая образуется за счёт атома водорода одной молекулы с сильноэлектроотрицательным атомом другой молекулы, например, таким атомом может быть фтор, кислород и азот. Более слабые межмолекулярные связи образуются между молекулами H 2 S, HCl, HBr.
Водородная связь – является особым видом химической связи, это, в основном, межмолекулярная связь. Водородной химической связью называется такая связь , которая образуется за счёт атома водорода одной молекулы с сильноэлектроотрицательным атомом другой молекулы, например, таким атомом может быть фтор, кислород и азот. Более слабые межмолекулярные связи образуются между молекулами H 2 S, HCl, HBr.
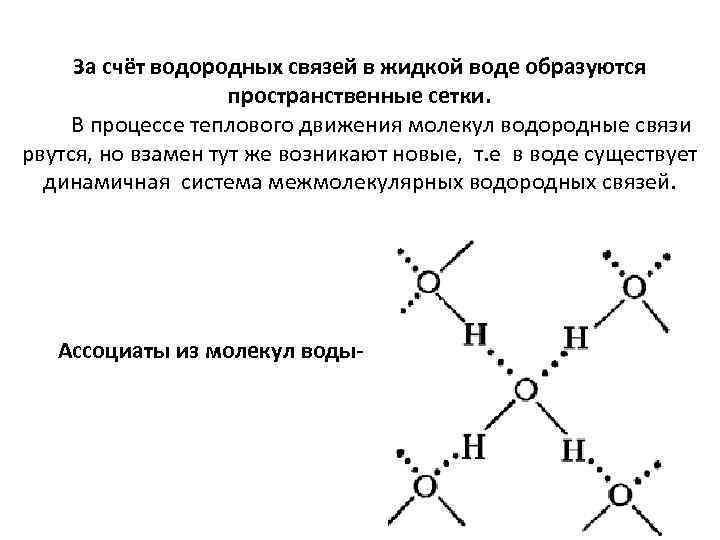 За счёт водородных связей в жидкой воде образуются пространственные сетки. В процессе теплового движения молекул водородные связи рвутся, но взамен тут же возникают новые, т. е в воде существует динамичная система межмолекулярных водородных связей. Ассоциаты из молекул воды-
За счёт водородных связей в жидкой воде образуются пространственные сетки. В процессе теплового движения молекул водородные связи рвутся, но взамен тут же возникают новые, т. е в воде существует динамичная система межмолекулярных водородных связей. Ассоциаты из молекул воды-
 Структура и свойства льда Наиболее распространённым минералом земной коры можно считать лёд (снег) , покрывающий значительную часть её поверхности в виде ледников, занимающих около 11% площади всей суши , или в виде вечной мерзлоты – 14%. Его большая роль в формировании климата нашей планеты и жизнедеятельности человека объясняет необходимость знания строения данного минерала и его кристаллохимических особенностей. В структуре льда каждый атом кислорода окружён четырьмя такими же атомами , отстоящими от него на 0, 275 нм. Благодаря этому структура льда представляет собой ажурный каркас из почти идеальных тетраэдров с углами между водородными связями, равными 109°.
Структура и свойства льда Наиболее распространённым минералом земной коры можно считать лёд (снег) , покрывающий значительную часть её поверхности в виде ледников, занимающих около 11% площади всей суши , или в виде вечной мерзлоты – 14%. Его большая роль в формировании климата нашей планеты и жизнедеятельности человека объясняет необходимость знания строения данного минерала и его кристаллохимических особенностей. В структуре льда каждый атом кислорода окружён четырьмя такими же атомами , отстоящими от него на 0, 275 нм. Благодаря этому структура льда представляет собой ажурный каркас из почти идеальных тетраэдров с углами между водородными связями, равными 109°.
 В кристалле льда между молекулами остаются пустоты. Объём этих пустот больше , чем размер отдельной молекулы Н 2 О. Поэтому лёд имеет 2 меньшую плотность , чем жидкая вода и плавает на поверхности воды. Большинство же других веществ при замерзании увеличивают свою плотность. Т. о. сравнительно слабые по энергии водородные связи играют определенную роль в свойствах уникального природного вещества, каким является вода.
В кристалле льда между молекулами остаются пустоты. Объём этих пустот больше , чем размер отдельной молекулы Н 2 О. Поэтому лёд имеет 2 меньшую плотность , чем жидкая вода и плавает на поверхности воды. Большинство же других веществ при замерзании увеличивают свою плотность. Т. о. сравнительно слабые по энергии водородные связи играют определенную роль в свойствах уникального природного вещества, каким является вода.
 Аномалии физических свойств воды Аномалии воды – отклонения воды по физическим свойствам от других минералов.
Аномалии физических свойств воды Аномалии воды – отклонения воды по физическим свойствам от других минералов.
 Основные аномалии физических свойств воды: 1. Как растворитель растворяет многие вещества в больших количествах, чем другие жидкости (используется в технике как основной растворитель); 2. Уменьшение объема (вместо расширения) при плавлении; 3. Увеличение объема при сильном охлаждении (в водопроводной системе при замерзании могут разорваться металлические водопроводные трубы, батареи); 4. Летучесть воды наименьшая, тогда как у соединений водорода с элементами подгруппы кислорода она возрастает при переходе от тяжелых к легким элементам; 5. У воды аномально высокие теплота плавления и удельная теплоемкость; при плавлении льда теплоемкость увеличивается более чем вдвое;
Основные аномалии физических свойств воды: 1. Как растворитель растворяет многие вещества в больших количествах, чем другие жидкости (используется в технике как основной растворитель); 2. Уменьшение объема (вместо расширения) при плавлении; 3. Увеличение объема при сильном охлаждении (в водопроводной системе при замерзании могут разорваться металлические водопроводные трубы, батареи); 4. Летучесть воды наименьшая, тогда как у соединений водорода с элементами подгруппы кислорода она возрастает при переходе от тяжелых к легким элементам; 5. У воды аномально высокие теплота плавления и удельная теплоемкость; при плавлении льда теплоемкость увеличивается более чем вдвое;
 Основные аномалии физических свойств воды: 6. Теплоемкость воды с повышением температуры до 27°C умень- шается, а затем вновь начинает возрастать; 7. Вязкость воды (при t 0 – 30°С) уменьшается с повышением давления; 8. Наиболее высокая из всех жидкостей диэлектричекская проницаемость (оказывает существенное влияние на диссоциацию электролитов); 9. Плотность воды наибольшая при +3, 98°С, дальнейшее охлаждение, приводящее к переходу ее в лед, сопровождается уменьшением плотности (лед плавает на поверхности воды - обеспечивает жизнь живым организмам зимой в водоёмах).
Основные аномалии физических свойств воды: 6. Теплоемкость воды с повышением температуры до 27°C умень- шается, а затем вновь начинает возрастать; 7. Вязкость воды (при t 0 – 30°С) уменьшается с повышением давления; 8. Наиболее высокая из всех жидкостей диэлектричекская проницаемость (оказывает существенное влияние на диссоциацию электролитов); 9. Плотность воды наибольшая при +3, 98°С, дальнейшее охлаждение, приводящее к переходу ее в лед, сопровождается уменьшением плотности (лед плавает на поверхности воды - обеспечивает жизнь живым организмам зимой в водоёмах).
 Химические свойства воды 1. Молекулы воды имеют большую устойчивость к нагреванию. Однако при температурах выше 1000 °C водяной пар начинает разлагаться на водород и кислород 2 H 2 O =2 H 2↑ + O 2 ↑ 2. Вода – реакционноспособное вещество. При обычных условиях с водой взаимодействуют активные металлы, например 2 Na + 2 H 2 O = 2 Na. OH + H 2 ↑ Ca + 2 H 2 O = Ca(OH)2 + H 2 ↑ 2 Al + 6 H 2 O = 2 Al (OH )3 + 3 H 2 ↑ Менее активные только при высоких температурах, например 3 Fe+4 H 2 O(пар)=Fe 3 O 4+4 H 2 ↑ (до 570°С) 2 Cr+3 H 2 O(пар)=Cr 2 O 3+3 H 2 ↑(600 -700°С)
Химические свойства воды 1. Молекулы воды имеют большую устойчивость к нагреванию. Однако при температурах выше 1000 °C водяной пар начинает разлагаться на водород и кислород 2 H 2 O =2 H 2↑ + O 2 ↑ 2. Вода – реакционноспособное вещество. При обычных условиях с водой взаимодействуют активные металлы, например 2 Na + 2 H 2 O = 2 Na. OH + H 2 ↑ Ca + 2 H 2 O = Ca(OH)2 + H 2 ↑ 2 Al + 6 H 2 O = 2 Al (OH )3 + 3 H 2 ↑ Менее активные только при высоких температурах, например 3 Fe+4 H 2 O(пар)=Fe 3 O 4+4 H 2 ↑ (до 570°С) 2 Cr+3 H 2 O(пар)=Cr 2 O 3+3 H 2 ↑(600 -700°С)
 Химические свойства воды 3. В прямое взаимодействие с водой вступают оксиды сильно основного или сильно кислотного характера, например Na 2 O + H 2 O = 2 Na. OH Ca. O + H 2 O = Ca(OH)2 SO 3 + H 2 O = H 2 SO 4 CO 2+H 2 O=H 2 CO 3 2 NO 2+H 2 O=HNO 3+HNO 2 CL 2 O+H 2 O=2 HCLO CL 2 O 7+H 2 O=2 HCLO 4 CL 2 O 6+H 2 O=HCLO 3+HCLO 4
Химические свойства воды 3. В прямое взаимодействие с водой вступают оксиды сильно основного или сильно кислотного характера, например Na 2 O + H 2 O = 2 Na. OH Ca. O + H 2 O = Ca(OH)2 SO 3 + H 2 O = H 2 SO 4 CO 2+H 2 O=H 2 CO 3 2 NO 2+H 2 O=HNO 3+HNO 2 CL 2 O+H 2 O=2 HCLO CL 2 O 7+H 2 O=2 HCLO 4 CL 2 O 6+H 2 O=HCLO 3+HCLO 4
 Химические свойства воды 4. При взаимодействии воды с солями происходит реакция гидратации и гидролиза: Na 2 CO 3 + 10 H 2 O = Na 2 CO 3 • 10 H 2 O Cu. SO 4 + 5 H 2 O =Cu. SO 4 • 5 H 2 O 2 Cu. SO 4 + 2 H 2 O = (Cu. OH)2 SO 4 + H 2 SO 4 Na 2 CO 3 + H 2 O = Na. HCO 3 + Na. OH (NH 4)2 SO 4 + H 2 O= NH 4 OH + NH 4 HSO 4 Al 2 S 3 + 6 H 2 O = 3 H 2 S + 2 Al(OH)3 ↓ Na 3 N + 3 H 2 O = NH 3 ↑ + 3 Na. OH
Химические свойства воды 4. При взаимодействии воды с солями происходит реакция гидратации и гидролиза: Na 2 CO 3 + 10 H 2 O = Na 2 CO 3 • 10 H 2 O Cu. SO 4 + 5 H 2 O =Cu. SO 4 • 5 H 2 O 2 Cu. SO 4 + 2 H 2 O = (Cu. OH)2 SO 4 + H 2 SO 4 Na 2 CO 3 + H 2 O = Na. HCO 3 + Na. OH (NH 4)2 SO 4 + H 2 O= NH 4 OH + NH 4 HSO 4 Al 2 S 3 + 6 H 2 O = 3 H 2 S + 2 Al(OH)3 ↓ Na 3 N + 3 H 2 O = NH 3 ↑ + 3 Na. OH
 Химические свойства воды 5. Вода может вступать в реакции с отдельными неметаллами. С галогенами реакция протекает в нормальных условиях, при взаимодействии с другими неметаллами требуется нагревание: 2 P+8 H 2 O=(температура)=2 H 3 PO 4+5 H 2 ↑ C+H 20=(температура)=CO↑ +H 2↑ 2 F 2 + H 2 O = 2 HF + OF 2↑ Cl 2 + H 2 O = HCl + HCl. O Br 2 + H 2 O = HBr + HBr. O
Химические свойства воды 5. Вода может вступать в реакции с отдельными неметаллами. С галогенами реакция протекает в нормальных условиях, при взаимодействии с другими неметаллами требуется нагревание: 2 P+8 H 2 O=(температура)=2 H 3 PO 4+5 H 2 ↑ C+H 20=(температура)=CO↑ +H 2↑ 2 F 2 + H 2 O = 2 HF + OF 2↑ Cl 2 + H 2 O = HCl + HCl. O Br 2 + H 2 O = HBr + HBr. O
 Химические свойства воды 6. Вода образует соединения – гидраты ( в твёрдом состоянии – кристаллогидраты ): n. H 2 O + H 2 SO 4 = H 2 SO 4 • Nh 2 o 5 H 2 O + Cu. SO 4 =Cu. SO 4 • 5 H 2 O
Химические свойства воды 6. Вода образует соединения – гидраты ( в твёрдом состоянии – кристаллогидраты ): n. H 2 O + H 2 SO 4 = H 2 SO 4 • Nh 2 o 5 H 2 O + Cu. SO 4 =Cu. SO 4 • 5 H 2 O


