Лекция 10 синтез-газ.pptx
- Количество слайдов: 33
 Оксид углерода и синтез-газ, синтезы на их основе. Способы производства СО и синтез-газа. Получение СО и синтез-газа из углеводородов. Производство Н 2. Получение концентрированного СО Лекция 10 Лектор: доцент каф. НХТ, к. т. н. Давыдова О. В.
Оксид углерода и синтез-газ, синтезы на их основе. Способы производства СО и синтез-газа. Получение СО и синтез-газа из углеводородов. Производство Н 2. Получение концентрированного СО Лекция 10 Лектор: доцент каф. НХТ, к. т. н. Давыдова О. В.
 Свойства СО В органическом синтезе применяются как чистый СО, так и его смеси с водородом (синтез-газ) в объемном отношении от 1: 1 до 2 -2, 3: 1. СО – бесцветный трудно сжижаемый газ. tконд= -192ºС, tкр= -130ºС, Ркр= 35 атм. Технология в пределах концентраций С воздухом образует взрывоопасные смеси 12. 5÷ 74 % об. СО, 4. 0÷ 75 % Н. Все производства, связанные с СО и СГ имеют производства эпоксидных высокую пожаро- и взрывоопасность. смол СО – очень токсичен, ПДК 20 мг/м. 2 3 Для защиты от CO применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO 2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух.
Свойства СО В органическом синтезе применяются как чистый СО, так и его смеси с водородом (синтез-газ) в объемном отношении от 1: 1 до 2 -2, 3: 1. СО – бесцветный трудно сжижаемый газ. tконд= -192ºС, tкр= -130ºС, Ркр= 35 атм. Технология в пределах концентраций С воздухом образует взрывоопасные смеси 12. 5÷ 74 % об. СО, 4. 0÷ 75 % Н. Все производства, связанные с СО и СГ имеют производства эпоксидных высокую пожаро- и взрывоопасность. смол СО – очень токсичен, ПДК 20 мг/м. 2 3 Для защиты от CO применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO 2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух.
 Свойства СО Обычный способ защиты — использование изолирующего дыхательного аппарата. Обычные противогазы не поглощают СО, поэтому используют изолирующие противогазы или специальные противогазы, содержащие окислы марганца. СО плохо сорбируется и жидкими поглотителями, плохо растворим в воде и органических жидкостях, но образует комплексы с некоторыми солями. Практическое значение получила абсорбция СО водноаммиачными растворами солей одновалентной меди, которые поглощают его при низкой температуре и десорбируют при нагревании. При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах (так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Свойства СО Обычный способ защиты — использование изолирующего дыхательного аппарата. Обычные противогазы не поглощают СО, поэтому используют изолирующие противогазы или специальные противогазы, содержащие окислы марганца. СО плохо сорбируется и жидкими поглотителями, плохо растворим в воде и органических жидкостях, но образует комплексы с некоторыми солями. Практическое значение получила абсорбция СО водноаммиачными растворами солей одновалентной меди, которые поглощают его при низкой температуре и десорбируют при нагревании. При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах (так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
 Свойства СО Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть. смол Признаки отравления: головная боль и головокружение; отмечается шум в ушах, одышка, сердцебиение, мерцание перед глазами, покраснение лица, общая слабость, тошнота, иногда рвота; в тяжёлых случаях судороги, потеря сознания, кома. Токсическое действие монооксида углерода основано на том, что он связывается с гемоглобином крови прочнее и в 200— 300 раз быстрее, чем кислород (при этом образуется карбоксигемоглобин), таким образом, блокируя процессы транспортировки кислорода и клеточного дыхания. Концентрация в воздухе более 0, 1 % приводит к смерти в течение одного часа.
Свойства СО Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть. смол Признаки отравления: головная боль и головокружение; отмечается шум в ушах, одышка, сердцебиение, мерцание перед глазами, покраснение лица, общая слабость, тошнота, иногда рвота; в тяжёлых случаях судороги, потеря сознания, кома. Токсическое действие монооксида углерода основано на том, что он связывается с гемоглобином крови прочнее и в 200— 300 раз быстрее, чем кислород (при этом образуется карбоксигемоглобин), таким образом, блокируя процессы транспортировки кислорода и клеточного дыхания. Концентрация в воздухе более 0, 1 % приводит к смерти в течение одного часа.
 Синтез-газ Водород — второй компонент синтез-газа — наиболее трудно сжижаемый газ (т. конд. при атмосферном давлении — 252, 8 °С). Образует с воздухом взрывоопасные смеси в пределах 4, 0— 75 % (об. ) Н 2. Наряду с высокой взрывоопаспостыо оксида углерода это предъявляет повышенные требования к технике безопасности производстве синтезгаза, а также в цехах, где он служит сырьем для органического синтеза. смол Для производства синтез-газа вначале использовали уголь. Затем преобладающее значение получила конверсия углеводородов, которую осуществляют в двух вариантах: каталитическом и высокотемпературном. Сырьем для нее может служить метан или природный газ, а также жидкие фракции нефти.
Синтез-газ Водород — второй компонент синтез-газа — наиболее трудно сжижаемый газ (т. конд. при атмосферном давлении — 252, 8 °С). Образует с воздухом взрывоопасные смеси в пределах 4, 0— 75 % (об. ) Н 2. Наряду с высокой взрывоопаспостыо оксида углерода это предъявляет повышенные требования к технике безопасности производстве синтезгаза, а также в цехах, где он служит сырьем для органического синтеза. смол Для производства синтез-газа вначале использовали уголь. Затем преобладающее значение получила конверсия углеводородов, которую осуществляют в двух вариантах: каталитическом и высокотемпературном. Сырьем для нее может служить метан или природный газ, а также жидкие фракции нефти.
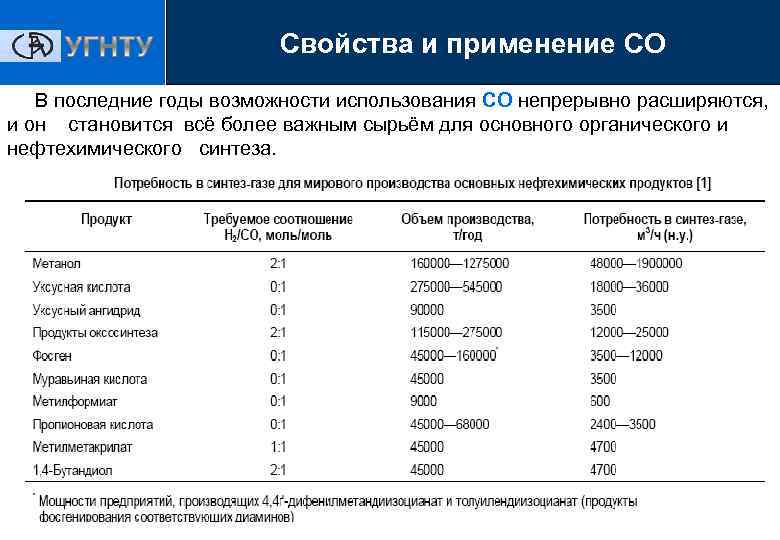 Свойства и применение СО В последние годы возможности использования СО непрерывно расширяются, и он становится всё более важным сырьём для основного органического и нефтехимического синтеза. Технология производства эпоксидных смол
Свойства и применение СО В последние годы возможности использования СО непрерывно расширяются, и он становится всё более важным сырьём для основного органического и нефтехимического синтеза. Технология производства эпоксидных смол
 Синтезы на основе СО – довольно реакционноспособное соединение и способен вступать во многие реакции, часть из которых получила промышленное применение. Синтез муравьиной кислоты: Na. OH + CO → HCOONa → (+H 2 SO 4, −Na 2 SO 4) HCOOH Технология производства эпоксидных CO + Cl COCl смол Гидрирование СО в зависимости от катализатора приводит к СH или Хлорирование с получением фосгена: 2 СH 3 OH: + H 2 CO 2 4 СН 4 CH 3 OH
Синтезы на основе СО – довольно реакционноспособное соединение и способен вступать во многие реакции, часть из которых получила промышленное применение. Синтез муравьиной кислоты: Na. OH + CO → HCOONa → (+H 2 SO 4, −Na 2 SO 4) HCOOH Технология производства эпоксидных CO + Cl COCl смол Гидрирование СО в зависимости от катализатора приводит к СH или Хлорирование с получением фосгена: 2 СH 3 OH: + H 2 CO 2 4 СН 4 CH 3 OH
 Синтезы на основе СО Синтез Фишера-Тропша. Из СО и Н 2 на кобальтовом или железном катализаторе получают парафиновые углеводороды: Co n. CO + (2 n+1) Н 2 Cn. H 2 n+2 + n. H 2 O Fe 2 n CO + (n+1) H 2 Cn. H 2 n+2 + n. CO 2 На этой реакции основан метод производства жидкого моторного топлива из угля, сначала утративший своё прежнее значение, а в последнее время вновь ставшим актуальным. Оксосинтез Со CH 2═CH 2 + СО + H 2 СН 3 -СН 2 СНО
Синтезы на основе СО Синтез Фишера-Тропша. Из СО и Н 2 на кобальтовом или железном катализаторе получают парафиновые углеводороды: Co n. CO + (2 n+1) Н 2 Cn. H 2 n+2 + n. H 2 O Fe 2 n CO + (n+1) H 2 Cn. H 2 n+2 + n. CO 2 На этой реакции основан метод производства жидкого моторного топлива из угля, сначала утративший своё прежнее значение, а в последнее время вновь ставшим актуальным. Оксосинтез Со CH 2═CH 2 + СО + H 2 СН 3 -СН 2 СНО
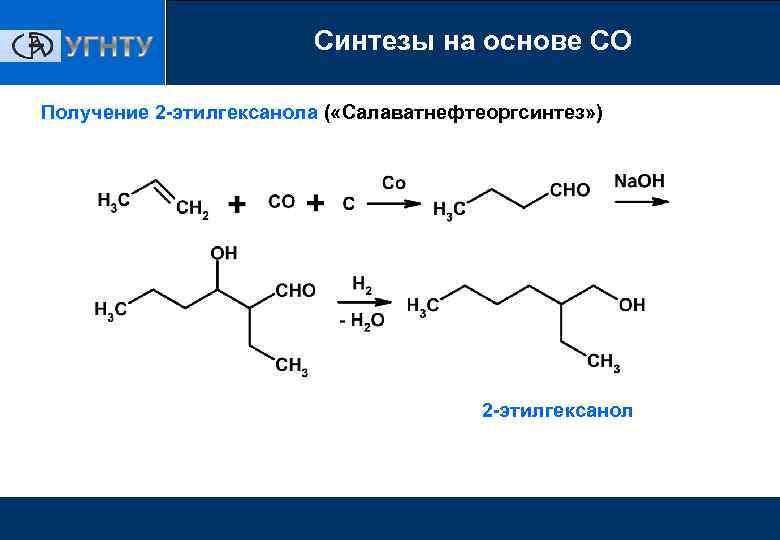 Синтезы на основе СО Получение 2 -этилгексанола ( «Салаватнефтеоргсинтез» ) 2 -этилгексанол
Синтезы на основе СО Получение 2 -этилгексанола ( «Салаватнефтеоргсинтез» ) 2 -этилгексанол
 Получение СО из высокоуглеродистых материалов Первые промышленные методы получения газов, содержащих СО, основывались кокса применении твёрдого Главным на другого топлива. или назначением этих процессов была выработка газообразного топлива (генераторный газ) путем газификации угля, но частично их использовали для производства СО и Н 2. Получение ЭС При получении генераторного газа протекают следующие основные реакции: С + О 2 СО 2 С + СО 2 2 СО На практике генераторный газ получают сжиганием каменного угля при 1200÷ 1400ºС. Другая возможность получения СО из высокоуглеродистых материалов состоит во взаимодействии углерода с водяным паром, при котором образуется водяной газ: С + Н 2 О СО + Н 2
Получение СО из высокоуглеродистых материалов Первые промышленные методы получения газов, содержащих СО, основывались кокса применении твёрдого Главным на другого топлива. или назначением этих процессов была выработка газообразного топлива (генераторный газ) путем газификации угля, но частично их использовали для производства СО и Н 2. Получение ЭС При получении генераторного газа протекают следующие основные реакции: С + О 2 СО 2 С + СО 2 2 СО На практике генераторный газ получают сжиганием каменного угля при 1200÷ 1400ºС. Другая возможность получения СО из высокоуглеродистых материалов состоит во взаимодействии углерода с водяным паром, при котором образуется водяной газ: С + Н 2 О СО + Н 2
 Получение синтез газа из угля Эндотермичность реакции предопределяет смещение равновесия вправо при высокой температуре. На практике поддерживают температуру ≈1000ºС, причем подачу пара чередуют с подачей воздуха, при которой кокс разогревается до нужной температуры. Первоначально газификацию угля проводили при давлении, близком к атмосферному, что не обеспечивало высокой производительности. Позже перешли к газификации при давлении 2 -3 МПа. Получение ЭС В газогенераторах новых поколений наиболее обещающими являются две конструкции. В первой работают со сплошным слоем кускового угля, перемещающегося сверху вниз по мере выгорания его нижних слоев. Уголь и газ движутся противотоком. , Газ в нижней части вначале подогревается раскаленными остатками газификации, выше, ввиду более быстрой реакции с кислородом, располагается зона горения и еще выше — зоны газификации, коксования и подсушки угля.
Получение синтез газа из угля Эндотермичность реакции предопределяет смещение равновесия вправо при высокой температуре. На практике поддерживают температуру ≈1000ºС, причем подачу пара чередуют с подачей воздуха, при которой кокс разогревается до нужной температуры. Первоначально газификацию угля проводили при давлении, близком к атмосферному, что не обеспечивало высокой производительности. Позже перешли к газификации при давлении 2 -3 МПа. Получение ЭС В газогенераторах новых поколений наиболее обещающими являются две конструкции. В первой работают со сплошным слоем кускового угля, перемещающегося сверху вниз по мере выгорания его нижних слоев. Уголь и газ движутся противотоком. , Газ в нижней части вначале подогревается раскаленными остатками газификации, выше, ввиду более быстрой реакции с кислородом, располагается зона горения и еще выше — зоны газификации, коксования и подсушки угля.
 Получение синтез газа из угля Во второй системе применяют мелкоизмельченный уголь, находящийся в токе газов в псевдоожиженном состоянии. Для создания противотока газа и угля газогенератор разделен на несколько секций, в которых происходят соответствующие стадии. Все генераторы футерованы огнеупорным Получение ЭС кирпичом и имеют водяную рубашку. Синтез-газ выходит из генераторов при 700— 800°С, проходит системы утилизации тепла, очистки от смол, сернистых соединений и СО 2; после этого его направляют потребителю. . Недостатками газификации угля являются большие капитальные вложения на стадиях измельчения и транспортирования угля и сложная система очистки газа.
Получение синтез газа из угля Во второй системе применяют мелкоизмельченный уголь, находящийся в токе газов в псевдоожиженном состоянии. Для создания противотока газа и угля газогенератор разделен на несколько секций, в которых происходят соответствующие стадии. Все генераторы футерованы огнеупорным Получение ЭС кирпичом и имеют водяную рубашку. Синтез-газ выходит из генераторов при 700— 800°С, проходит системы утилизации тепла, очистки от смол, сернистых соединений и СО 2; после этого его направляют потребителю. . Недостатками газификации угля являются большие капитальные вложения на стадиях измельчения и транспортирования угля и сложная система очистки газа.
 Получение СО и синтез-газа из углеводородов В настоящее время производство синтез-газа преимущественно осуществляют конверсией углеводородов, которая имеет два варианта: каталитический и высокотемпературный. Сырьем служит метан или природный газ, а также жидкие углеводороды. Получение ЭС Взаимодействие углеводородов с Н 2 О и СО 2 в отсутствие катализаторов протекает очень медленно: при 1000ºС требуется 2 ч, чтобы достигнуть конверсии СH 4 70÷ 80%. Поэтому применяют катализатор – восстановленный Ni на Al 2 O 3, промотированный окисями Mg и Cr. Такой катализатор активен при 500÷ 600ºС, но на практике поддерживают температуру 750÷ 850ºС и даже 900÷ 940ºС.
Получение СО и синтез-газа из углеводородов В настоящее время производство синтез-газа преимущественно осуществляют конверсией углеводородов, которая имеет два варианта: каталитический и высокотемпературный. Сырьем служит метан или природный газ, а также жидкие углеводороды. Получение ЭС Взаимодействие углеводородов с Н 2 О и СО 2 в отсутствие катализаторов протекает очень медленно: при 1000ºС требуется 2 ч, чтобы достигнуть конверсии СH 4 70÷ 80%. Поэтому применяют катализатор – восстановленный Ni на Al 2 O 3, промотированный окисями Mg и Cr. Такой катализатор активен при 500÷ 600ºС, но на практике поддерживают температуру 750÷ 850ºС и даже 900÷ 940ºС.
 Получение СО и синтез-газа из углеводородов Существуют три основных метода конверсии углеводородов: q конверсия водяным паром, двуокисью углерода или их смесью на никелевом катализаторе при 750÷ 800ºС; q окислительная конверсия смесью водяного пара с О 2 на никелевом Получение ЭС катализаторе при 900÷ 950ºС; q Высокотемпературная конверсия - неполное углеводородов без катализатора при 1200÷ 1250ºС; окисление
Получение СО и синтез-газа из углеводородов Существуют три основных метода конверсии углеводородов: q конверсия водяным паром, двуокисью углерода или их смесью на никелевом катализаторе при 750÷ 800ºС; q окислительная конверсия смесью водяного пара с О 2 на никелевом Получение ЭС катализаторе при 900÷ 950ºС; q Высокотемпературная конверсия - неполное углеводородов без катализатора при 1200÷ 1250ºС; окисление
 Каталитическая конверсия углеводородов Каталитическая конверсия метана водяным паром или СО 2 СH 4 + Н 2 О СО + 3 Н 2 - 49, 3 ккал/моль СH 4 + СО 2 2 СО + 2 Н 2 - 59, 2 ккал/моль. Обе реакции сильно эндотермичны. На практике процесс ведут при 750÷ 850ºС и избытке водяного пара или Получение ЭС СО 2. Кроме конверсии метана протекает также экзотермическая реакция конверсии СО: СО + Н 2 О СО 2 + Н 2 Ее равновесие смещается влево при повышении температуры, причем избыток водяного пара вызывает повышенное образование СО 2. Конверсия оксида углерода протекает быстро, и состав конвертированного газа определяется ее равновесием.
Каталитическая конверсия углеводородов Каталитическая конверсия метана водяным паром или СО 2 СH 4 + Н 2 О СО + 3 Н 2 - 49, 3 ккал/моль СH 4 + СО 2 2 СО + 2 Н 2 - 59, 2 ккал/моль. Обе реакции сильно эндотермичны. На практике процесс ведут при 750÷ 850ºС и избытке водяного пара или Получение ЭС СО 2. Кроме конверсии метана протекает также экзотермическая реакция конверсии СО: СО + Н 2 О СО 2 + Н 2 Ее равновесие смещается влево при повышении температуры, причем избыток водяного пара вызывает повышенное образование СО 2. Конверсия оксида углерода протекает быстро, и состав конвертированного газа определяется ее равновесием.
 Каталитическая конверсия углеводородов При конверсии метана водяным паром получается газ с большим отношением Н 2 : СО (как минимум 3: 1), в то время как для органического синтеза требуется синтез-газ с отношением Н 2 : СО от 1 : 1 до (2, 0 -2, 3): 1. Этого отношения можно добиться, во-первых, подвергая конверсии жидкие углеводороды и, во-вторых, добавляя при конверсии к водяному пару диоксид углерода, который также конвертирует углеводороды. Получение ЭС Ввиду высокой эндотермичности конверсию углеводородов проводят в трубчатых печах. Исходное сырье подают в трубы, заполненные гетерогенным катализатором и обогреваемые топочным газом, причем температура осуществляется главным образом за счет излучения (радиантные печи). Недостатки этой системы — большая потребность в жаростойких трубах и малое полезное использование объема печи, в которой катализатор занимает очень небольшую часть.
Каталитическая конверсия углеводородов При конверсии метана водяным паром получается газ с большим отношением Н 2 : СО (как минимум 3: 1), в то время как для органического синтеза требуется синтез-газ с отношением Н 2 : СО от 1 : 1 до (2, 0 -2, 3): 1. Этого отношения можно добиться, во-первых, подвергая конверсии жидкие углеводороды и, во-вторых, добавляя при конверсии к водяному пару диоксид углерода, который также конвертирует углеводороды. Получение ЭС Ввиду высокой эндотермичности конверсию углеводородов проводят в трубчатых печах. Исходное сырье подают в трубы, заполненные гетерогенным катализатором и обогреваемые топочным газом, причем температура осуществляется главным образом за счет излучения (радиантные печи). Недостатки этой системы — большая потребность в жаростойких трубах и малое полезное использование объема печи, в которой катализатор занимает очень небольшую часть.
 Каталитическая конверсия углеводородов По этим причинам была разработана другая система, в которой эндотермические реакции конверсии совмещены с экзотермическим процессом сгорания части углеводорода при подаче в конвертор кислорода, благодаря чему суммарный процесс становится немного экзотермическим. Расчеты показывают, что для этой цели на конверсию надо подавать Получение ЭС смесь СН 4 и О 2 в отношении 1, 0 : 0, 55, находящуюся вне пределов взрываемости, которые тем более не достигаются из-за разбавления смеси водяным паром. Объемное отношение Н 2 О к СН 4 в этом случае можно брать более низким, чем в отсутствии кислорода, а именно от 1 : 1 до (2, 5 -4 -3, 0): 1 в зависимости от применяемого давления. Этот процесс окислительной, или автотермической конверсии получил большое распространение. Он не требует подвода тепла извне и осуществляется в шахтных печах со сплошным слоем катализатора.
Каталитическая конверсия углеводородов По этим причинам была разработана другая система, в которой эндотермические реакции конверсии совмещены с экзотермическим процессом сгорания части углеводорода при подаче в конвертор кислорода, благодаря чему суммарный процесс становится немного экзотермическим. Расчеты показывают, что для этой цели на конверсию надо подавать Получение ЭС смесь СН 4 и О 2 в отношении 1, 0 : 0, 55, находящуюся вне пределов взрываемости, которые тем более не достигаются из-за разбавления смеси водяным паром. Объемное отношение Н 2 О к СН 4 в этом случае можно брать более низким, чем в отсутствии кислорода, а именно от 1 : 1 до (2, 5 -4 -3, 0): 1 в зависимости от применяемого давления. Этот процесс окислительной, или автотермической конверсии получил большое распространение. Он не требует подвода тепла извне и осуществляется в шахтных печах со сплошным слоем катализатора.
 Каталитическая конверсия углеводородов Корпус конвертора футерован огнеупорным кирпичом и имеет охлаждающую водяную рубашку, в которой генерируется пар. В верхней части конвертора имеется смеситель, куда подают смеси СН 4 + Н 2 О и О 2 + Н 2 О. Смеситель должен обеспечить гомогенизацию смеси в условиях, исключающих взрыв или воспламенение. Сгорание СН 4 протекает примерно в Получение ЭС 10 раз быстрее конверсии, поэтому в верхних слоях катализатора температура быстро повышается до максимума (1100— 1200°С) и затем падает (до 800— 900°С) на выходе из печи. По сравнению с конверсией в трубчатых печах при этом методе устраняется потребность в жаростойких трубах, конструкция реактора становится очень простой и большая часть его объема полезно используется для размещения катализатора. При окислительной конверсии в получаемом газе несколько возрастает количество СО.
Каталитическая конверсия углеводородов Корпус конвертора футерован огнеупорным кирпичом и имеет охлаждающую водяную рубашку, в которой генерируется пар. В верхней части конвертора имеется смеситель, куда подают смеси СН 4 + Н 2 О и О 2 + Н 2 О. Смеситель должен обеспечить гомогенизацию смеси в условиях, исключающих взрыв или воспламенение. Сгорание СН 4 протекает примерно в Получение ЭС 10 раз быстрее конверсии, поэтому в верхних слоях катализатора температура быстро повышается до максимума (1100— 1200°С) и затем падает (до 800— 900°С) на выходе из печи. По сравнению с конверсией в трубчатых печах при этом методе устраняется потребность в жаростойких трубах, конструкция реактора становится очень простой и большая часть его объема полезно используется для размещения катализатора. При окислительной конверсии в получаемом газе несколько возрастает количество СО.
 Технология каталитической конверсии углеводородов Процесс состоит из нескольких стадий: подготовки сырья, конверсии, утилизации тепла, очистки газа от СО 2. Подготовка сырья. Никелевый катализатор чувствителен к отравлению органическими соединениями серы, поэтому при необходимости сырье подвергают каталитическому гидрообессериванию с последующим удалением образовавшегося сероводорода. Получение ЭС Стадия подготовки сырья включает также компримирование (сжатие компрессором) газа (если это необходимо), смешение его с водяным паром и предварительное нагревание смеси. Конверсия. В течение долгого времени установки каталитической конверсии работали при давлении, близком к атмосферному, и такие установки сохранились до сих пор. В последнее время переходят на работу при высоком давлении, а именно 2— 3 МПа. Несмотря на нежелательное смещение равновесия это дает ряд важных преимуществ.
Технология каталитической конверсии углеводородов Процесс состоит из нескольких стадий: подготовки сырья, конверсии, утилизации тепла, очистки газа от СО 2. Подготовка сырья. Никелевый катализатор чувствителен к отравлению органическими соединениями серы, поэтому при необходимости сырье подвергают каталитическому гидрообессериванию с последующим удалением образовавшегося сероводорода. Получение ЭС Стадия подготовки сырья включает также компримирование (сжатие компрессором) газа (если это необходимо), смешение его с водяным паром и предварительное нагревание смеси. Конверсия. В течение долгого времени установки каталитической конверсии работали при давлении, близком к атмосферному, и такие установки сохранились до сих пор. В последнее время переходят на работу при высоком давлении, а именно 2— 3 МПа. Несмотря на нежелательное смещение равновесия это дает ряд важных преимуществ.
 Технология каталитической конверсии углеводородов Во-первых, из-за повышения скорости реакции под давлением процесс значительно интенсифицируется, уменьшаются габариты аппаратов и трубопроводов, появляются условия для создания агрегатов большой единичной мощности. Во-вторых, снижаются энергетические затраты и лучше утилизируется тепло горячих Получение ЭС в том, что синтез из СО и Н 2 газов. Дело обычно проводят под давлением, и, так как объем конвертированного газа больше, чем объем исходных веществ, то экономически выгоднее компримировать природный газ, в то время как кислород обычно уже находится под давлением. Системы утилизации тепла также становятся более компактными и эффективными, причем, возможно использование тепла, выделяющегося при конденсации избыточного водяного пара из конвертированного газа, генерирование пара высокого давления и его использование для привода турбокомпрессоров при сжатии газа.
Технология каталитической конверсии углеводородов Во-первых, из-за повышения скорости реакции под давлением процесс значительно интенсифицируется, уменьшаются габариты аппаратов и трубопроводов, появляются условия для создания агрегатов большой единичной мощности. Во-вторых, снижаются энергетические затраты и лучше утилизируется тепло горячих Получение ЭС в том, что синтез из СО и Н 2 газов. Дело обычно проводят под давлением, и, так как объем конвертированного газа больше, чем объем исходных веществ, то экономически выгоднее компримировать природный газ, в то время как кислород обычно уже находится под давлением. Системы утилизации тепла также становятся более компактными и эффективными, причем, возможно использование тепла, выделяющегося при конденсации избыточного водяного пара из конвертированного газа, генерирование пара высокого давления и его использование для привода турбокомпрессоров при сжатии газа.
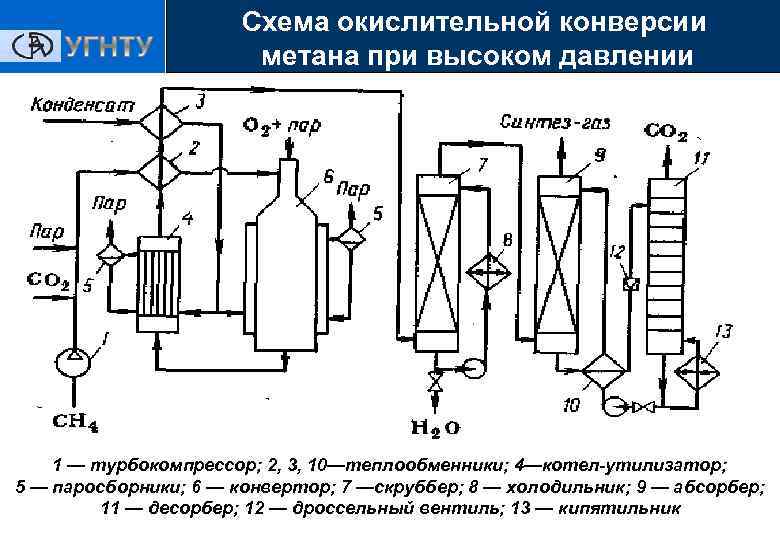 Схема окислительной конверсии метана при высоком давлении Получение ЭС 1 — турбокомпрессор; 2, 3, 10—теплообменники; 4—котел-утилизатор; 5 — паросборники; 6 — конвертор; 7 —скруббер; 8 — холодильник; 9 — абсорбер; 11 — десорбер; 12 — дроссельный вентиль; 13 — кипятильник
Схема окислительной конверсии метана при высоком давлении Получение ЭС 1 — турбокомпрессор; 2, 3, 10—теплообменники; 4—котел-утилизатор; 5 — паросборники; 6 — конвертор; 7 —скруббер; 8 — холодильник; 9 — абсорбер; 11 — десорбер; 12 — дроссельный вентиль; 13 — кипятильник
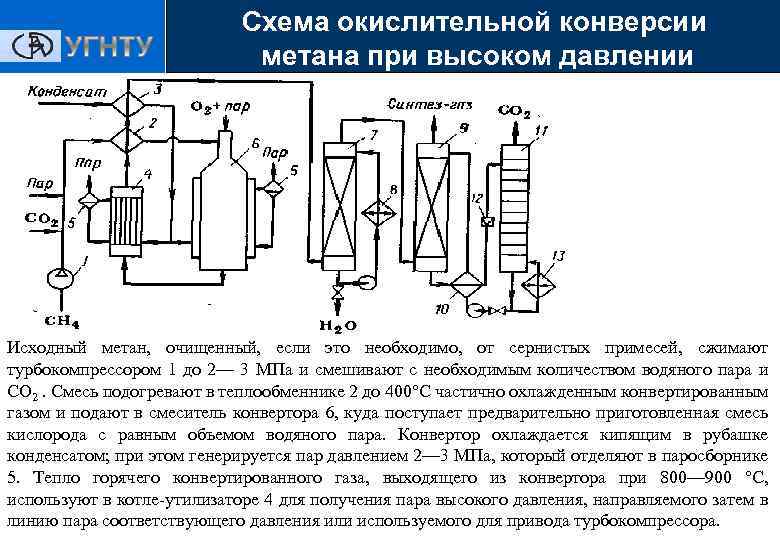 Схема окислительной конверсии метана при высоком давлении Получение ЭС Исходный метан, очищенный, если это необходимо, от сернистых примесей, сжимают турбокомпрессором 1 до 2— 3 МПа и смешивают с необходимым количеством водяного пара и СО 2. Смесь подогревают в теплообменнике 2 до 400°С частично охлажденным конвертированным газом и подают в смеситель конвертора 6, куда поступает предварительно приготовленная смесь кислорода с равным объемом водяного пара. Конвертор охлаждается кипящим в рубашке конденсатом; при этом генерируется пар давлением 2— 3 МПа, который отделяют в паросборнике 5. Тепло горячего конвертированного газа, выходящего из конвертора при 800— 900 °С, используют в котле-утилизаторе 4 для получения пара высокого давления, направляемого затем в линию пара соответствующего давления или используемого для привода турбокомпрессора.
Схема окислительной конверсии метана при высоком давлении Получение ЭС Исходный метан, очищенный, если это необходимо, от сернистых примесей, сжимают турбокомпрессором 1 до 2— 3 МПа и смешивают с необходимым количеством водяного пара и СО 2. Смесь подогревают в теплообменнике 2 до 400°С частично охлажденным конвертированным газом и подают в смеситель конвертора 6, куда поступает предварительно приготовленная смесь кислорода с равным объемом водяного пара. Конвертор охлаждается кипящим в рубашке конденсатом; при этом генерируется пар давлением 2— 3 МПа, который отделяют в паросборнике 5. Тепло горячего конвертированного газа, выходящего из конвертора при 800— 900 °С, используют в котле-утилизаторе 4 для получения пара высокого давления, направляемого затем в линию пара соответствующего давления или используемого для привода турбокомпрессора.
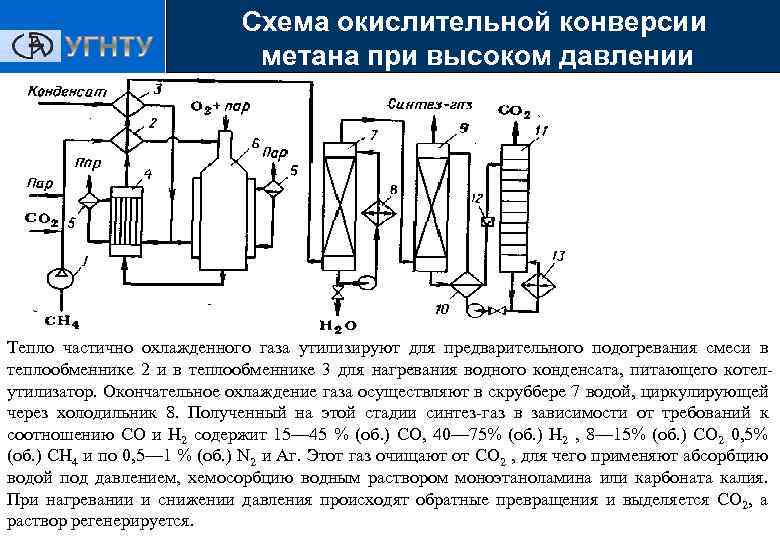 Схема окислительной конверсии метана при высоком давлении Получение ЭС Тепло частично охлажденного газа утилизируют для предварительного подогревания смеси в теплообменнике 2 и в теплообменнике 3 для нагревания водного конденсата, питающего котелутилизатор. Окончательное охлаждение газа осуществляют в скруббере 7 водой, циркулирующей через холодильник 8. Полученный на этой стадии синтез-газ в зависимости от требований к соотношению СО и Н 2 содержит 15— 45 % (об. ) СО, 40— 75% (об. ) Н 2 , 8— 15% (об. ) СО 2 0, 5% (об. ) СН 4 и по 0, 5— 1 % (об. ) N 2 и Аг. Этот газ очищают от СО 2 , для чего применяют абсорбцию водой под давлением, хемосорбцию водным раствором моноэтаноламина или карбоната калия. При нагревании и снижении давления происходят обратные превращения и выделяется СО 2, а раствор регенерируется.
Схема окислительной конверсии метана при высоком давлении Получение ЭС Тепло частично охлажденного газа утилизируют для предварительного подогревания смеси в теплообменнике 2 и в теплообменнике 3 для нагревания водного конденсата, питающего котелутилизатор. Окончательное охлаждение газа осуществляют в скруббере 7 водой, циркулирующей через холодильник 8. Полученный на этой стадии синтез-газ в зависимости от требований к соотношению СО и Н 2 содержит 15— 45 % (об. ) СО, 40— 75% (об. ) Н 2 , 8— 15% (об. ) СО 2 0, 5% (об. ) СН 4 и по 0, 5— 1 % (об. ) N 2 и Аг. Этот газ очищают от СО 2 , для чего применяют абсорбцию водой под давлением, хемосорбцию водным раствором моноэтаноламина или карбоната калия. При нагревании и снижении давления происходят обратные превращения и выделяется СО 2, а раствор регенерируется.
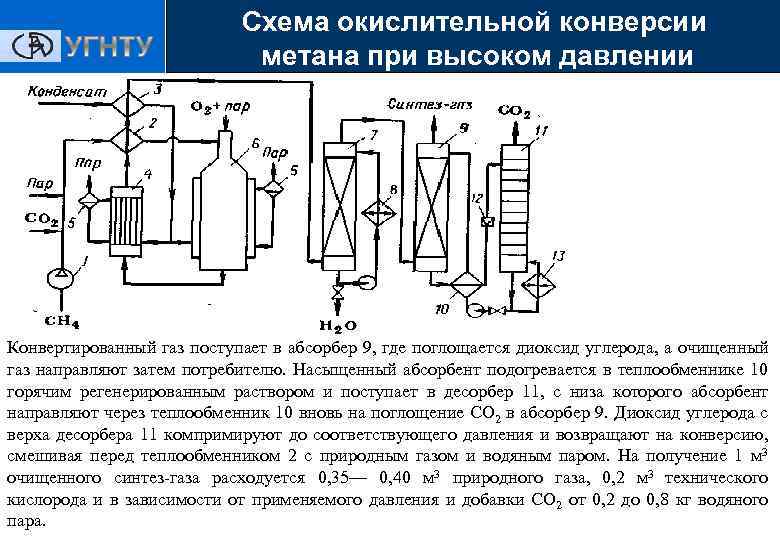 Схема окислительной конверсии метана при высоком давлении Получение ЭС Конвертированный газ поступает в абсорбер 9, где поглощается диоксид углерода, а очищенный газ направляют затем потребителю. Насыщенный абсорбент подогревается в теплообменнике 10 горячим регенерированным раствором и поступает в десорбер 11, с низа которого абсорбент направляют через теплообменник 10 вновь на поглощение СО 2 в абсорбер 9. Диоксид углерода с верха десорбера 11 компримируют до соответствующего давления и возвращают на конверсию, смешивая перед теплообменником 2 с природным газом и водяным паром. На получение 1 м 3 очищенного синтез-газа расходуется 0, 35— 0, 40 м 3 природного газа, 0, 2 м 3 технического кислорода и в зависимости от применяемого давления и добавки СO 2 от 0, 2 до 0, 8 кг водяного пара.
Схема окислительной конверсии метана при высоком давлении Получение ЭС Конвертированный газ поступает в абсорбер 9, где поглощается диоксид углерода, а очищенный газ направляют затем потребителю. Насыщенный абсорбент подогревается в теплообменнике 10 горячим регенерированным раствором и поступает в десорбер 11, с низа которого абсорбент направляют через теплообменник 10 вновь на поглощение СО 2 в абсорбер 9. Диоксид углерода с верха десорбера 11 компримируют до соответствующего давления и возвращают на конверсию, смешивая перед теплообменником 2 с природным газом и водяным паром. На получение 1 м 3 очищенного синтез-газа расходуется 0, 35— 0, 40 м 3 природного газа, 0, 2 м 3 технического кислорода и в зависимости от применяемого давления и добавки СO 2 от 0, 2 до 0, 8 кг водяного пара.
 Высокотемпературная конверсия углеводородов Отличается высокой температурой (1350 -1450°С), давлением от 2 -3 до 1014 МПа и отсутствием катализаторов. Процесс состоит в неполном окислении метана или жидких фракций нефти, причем главной первичной реакцией в случае СH 4 является окисление его в смесь СО, Н 2 О и Н 2: Получение ЭС Реакция экзотермична и необратима. В небольшом количестве образуются также СО 2 и углеводороды С 2 и С 3, в том числе ацетилен. В заключительной стадии процесса водяной пар конвертирует оставшиеся углеводороды до СО и Н 2, причем устанавливается равновесие между оксидами углерода, которое при высокой температуре сильно смещено в пользу СО.
Высокотемпературная конверсия углеводородов Отличается высокой температурой (1350 -1450°С), давлением от 2 -3 до 1014 МПа и отсутствием катализаторов. Процесс состоит в неполном окислении метана или жидких фракций нефти, причем главной первичной реакцией в случае СH 4 является окисление его в смесь СО, Н 2 О и Н 2: Получение ЭС Реакция экзотермична и необратима. В небольшом количестве образуются также СО 2 и углеводороды С 2 и С 3, в том числе ацетилен. В заключительной стадии процесса водяной пар конвертирует оставшиеся углеводороды до СО и Н 2, причем устанавливается равновесие между оксидами углерода, которое при высокой температуре сильно смещено в пользу СО.
 Высокотемпературная конверсия углеводородов Суммарное уравнение высокотемпературной конверсии метана: СH 4 + 0, 5 О 2 СО + 2 Н 2 +8, 5 ккал/моль Соотношение Н 2 и СО в зависимости от исходного сырья может меняться от 2: 1 до 1: 1. Кроме того, в газе находятся 2 -3% (об. ) СО 2, 0, 3 -0, 5% (об. ) СH 4 , и до 1% (об. ) N 2 и Аr. Получение ЭС Конвертор для этого процесса — пустотелый аппарат, рассчитанный на высокое давление. Конвертор имеет внутреннюю изоляцию и водяную рубашку, предохраняющую корпус от действия высоких температур, а также смеситель углеводорода и кислорода, обеспечивающий быструю гомогенизацию смеси во взрывобезопасных условиях. Достоинствами процесса являются его высокая интенсивность, простота конструкции конвертора, отсутствие катализатора и нетребовательность к качеству исходного сырья. Это обусловливает все более широкое распространение высокотемпературной конверсии особенно для жидких углеводородов, вплоть до мазута и сырой нефти.
Высокотемпературная конверсия углеводородов Суммарное уравнение высокотемпературной конверсии метана: СH 4 + 0, 5 О 2 СО + 2 Н 2 +8, 5 ккал/моль Соотношение Н 2 и СО в зависимости от исходного сырья может меняться от 2: 1 до 1: 1. Кроме того, в газе находятся 2 -3% (об. ) СО 2, 0, 3 -0, 5% (об. ) СH 4 , и до 1% (об. ) N 2 и Аr. Получение ЭС Конвертор для этого процесса — пустотелый аппарат, рассчитанный на высокое давление. Конвертор имеет внутреннюю изоляцию и водяную рубашку, предохраняющую корпус от действия высоких температур, а также смеситель углеводорода и кислорода, обеспечивающий быструю гомогенизацию смеси во взрывобезопасных условиях. Достоинствами процесса являются его высокая интенсивность, простота конструкции конвертора, отсутствие катализатора и нетребовательность к качеству исходного сырья. Это обусловливает все более широкое распространение высокотемпературной конверсии особенно для жидких углеводородов, вплоть до мазута и сырой нефти.
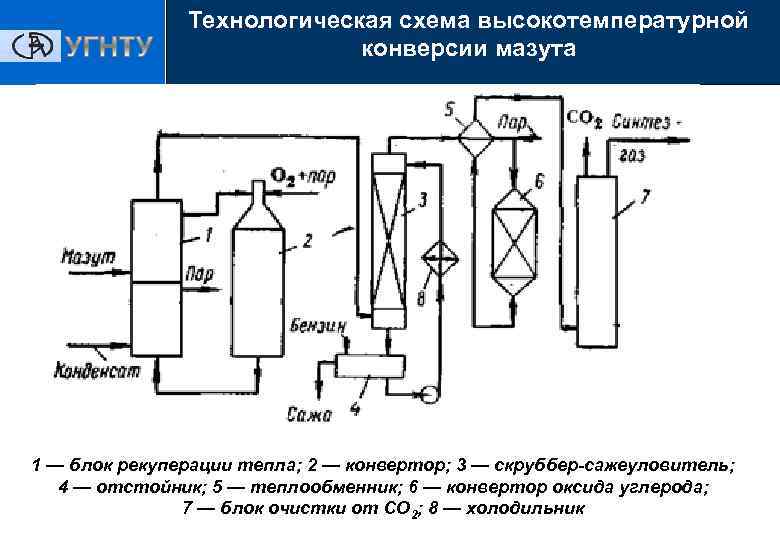 Технологическая схема высокотемпературной конверсии мазута Получение ЭС 1 — блок рекуперации тепла; 2 — конвертор; 3 — скруббер-сажеуловитель; 4 — отстойник; 5 — теплообменник; 6 — конвертор оксида углерода; 7 — блок очистки от СО 2; 8 — холодильник
Технологическая схема высокотемпературной конверсии мазута Получение ЭС 1 — блок рекуперации тепла; 2 — конвертор; 3 — скруббер-сажеуловитель; 4 — отстойник; 5 — теплообменник; 6 — конвертор оксида углерода; 7 — блок очистки от СО 2; 8 — холодильник
 Получение водорода Водород – важное сырьё для органического синтеза (гидрирование), широко применяется для получения NH 3 и современных процессах переработки нефти и газа. Вместо старых методов его производства электролизом воды в настоящее время используют другие методы. Водород в больших количествах образуется при риформинге нефтепродуктов и пиролизе природного газа до олефинов и ацетилена, содержится в коксовом газе, в метаново-водородных фракциях газов крекинга, пиролиза нефтепродуктов и т. д. Получение ЭС Кроме того, водород вырабатывают из метана, дополняя процесс конверсией СО до СО 2 и Н 2. СО + Н 2 О СО 2 + Н 2 Двухступенчатая конверсия водяным паром применяется и для метанововодородных фракционных газов крекинга и пиролиза, для коксового газа и т. д. Конверсия СО водяным паром протекает с достаточной полнотой только при температуре ниже 500ºС. Технологически её нельзя объединить с конверсией метана, для которой требуется более высокая температура, поэтому процесс разделён на две стадии.
Получение водорода Водород – важное сырьё для органического синтеза (гидрирование), широко применяется для получения NH 3 и современных процессах переработки нефти и газа. Вместо старых методов его производства электролизом воды в настоящее время используют другие методы. Водород в больших количествах образуется при риформинге нефтепродуктов и пиролизе природного газа до олефинов и ацетилена, содержится в коксовом газе, в метаново-водородных фракциях газов крекинга, пиролиза нефтепродуктов и т. д. Получение ЭС Кроме того, водород вырабатывают из метана, дополняя процесс конверсией СО до СО 2 и Н 2. СО + Н 2 О СО 2 + Н 2 Двухступенчатая конверсия водяным паром применяется и для метанововодородных фракционных газов крекинга и пиролиза, для коксового газа и т. д. Конверсия СО водяным паром протекает с достаточной полнотой только при температуре ниже 500ºС. Технологически её нельзя объединить с конверсией метана, для которой требуется более высокая температура, поэтому процесс разделён на две стадии.
 Получение водорода Переработку синтез-газа с целью получения водорода осуществляют на гетерогенных катализаторах (окислы Fe, Cr, Mg) при 400 -500ºС. Применяя избыток водяного пара, можно получить высокую степень превращения СО: концентрация ее снижается с 22 -30% об. в СГ до 2 -4% в газах после конверсии. Количество СО 2 повышается с 8 -9% до 20% об. Получение ЭС После очистки от СО 2 и СО (которая является ядом для гидрирующих катализаторов) остаётся технический 97 -98%-ный водород. Он содержит небольшие примеси N 2 и CH 4 и вполне пригоден для любых процессов переработки.
Получение водорода Переработку синтез-газа с целью получения водорода осуществляют на гетерогенных катализаторах (окислы Fe, Cr, Mg) при 400 -500ºС. Применяя избыток водяного пара, можно получить высокую степень превращения СО: концентрация ее снижается с 22 -30% об. в СГ до 2 -4% в газах после конверсии. Количество СО 2 повышается с 8 -9% до 20% об. Получение ЭС После очистки от СО 2 и СО (которая является ядом для гидрирующих катализаторов) остаётся технический 97 -98%-ный водород. Он содержит небольшие примеси N 2 и CH 4 и вполне пригоден для любых процессов переработки.
 Получение водорода Из биомассы Водород из биомассы получается термохимическим, или биохимическим способом. При термохимическом методе биомассу нагревают без доступа кислорода до температуры 500°- 800° (для отходов древесины), что намного ниже температуры процесса газификации угля. В результате процесса выделяется H 2, CO и CH 4. Получение ЭС Себестоимость процесса $5 -$7 за килограмм водорода. В будущем возможно снижение до $1, 0 -$3, 0. В биохимическом процессе водород вырабатывают различные бактерии, например, Rodobacter speriodes Разнообразие способов получения водорода является одним из главных преимуществ водородной энергетики, так как повышает энергетическую безопасность и снижает зависимость от отдельных видов сырья.
Получение водорода Из биомассы Водород из биомассы получается термохимическим, или биохимическим способом. При термохимическом методе биомассу нагревают без доступа кислорода до температуры 500°- 800° (для отходов древесины), что намного ниже температуры процесса газификации угля. В результате процесса выделяется H 2, CO и CH 4. Получение ЭС Себестоимость процесса $5 -$7 за килограмм водорода. В будущем возможно снижение до $1, 0 -$3, 0. В биохимическом процессе водород вырабатывают различные бактерии, например, Rodobacter speriodes Разнообразие способов получения водорода является одним из главных преимуществ водородной энергетики, так как повышает энергетическую безопасность и снижает зависимость от отдельных видов сырья.
 Получение концентрированного СО Кроме синтез-газа, для некоторых процессов органического синтеза требуется концентрированный СО, не содержащий Н 2: производство фосгена, карбоновых кислот, карбонилов металлов. Т. к. СГ состоит из СО (-192ºС) и Н 2 (-259ºС), то возможно низкотемпературное их разделение, т. е. простая конденсация СО при глубоком охлаждении даёт концентрированную СО и технический Н 2. Однако большие энергетические затраты делают этот метод экономически Получение ЭС нерентабельным. Второй метод – газификация кокса двуокисью углерода: С + СО 2 2 СО Этот процесс сходен с получением водяного газа, но вместо пара в газогенератор подают СО 2. Ввиду высокой эндотермичности реакции кокс быстро остывает.
Получение концентрированного СО Кроме синтез-газа, для некоторых процессов органического синтеза требуется концентрированный СО, не содержащий Н 2: производство фосгена, карбоновых кислот, карбонилов металлов. Т. к. СГ состоит из СО (-192ºС) и Н 2 (-259ºС), то возможно низкотемпературное их разделение, т. е. простая конденсация СО при глубоком охлаждении даёт концентрированную СО и технический Н 2. Однако большие энергетические затраты делают этот метод экономически Получение ЭС нерентабельным. Второй метод – газификация кокса двуокисью углерода: С + СО 2 2 СО Этот процесс сходен с получением водяного газа, но вместо пара в газогенератор подают СО 2. Ввиду высокой эндотермичности реакции кокс быстро остывает.
 Получение концентрированной СО Для этого процесса нужна температура 1000 -1100ºС. Поэтому делают чередование периодов разогрева кокса и его газификации. Сначала в газогенератор подают воздух для сгорания части кокса. При этом основная его масса разогревается до 1200ºС. Затем подают СО 2. Получаемая СО содержит СО 2, N 2 и небольшие количества других примесей. Получение ЭС После очистки от СО 2 остаётся 95 -98 %-ный СО. В последнее время для производства концентрированной СО всё больше используют метод её извлечения из газов двухступенчатой конверсией метана до водорода. При этом одновременно осуществляется очистка Н 2 от нежелательной примеси СО. Учитывая большие масштабы производства водорода, такой источник концентрированной СО – наиболее перспективен.
Получение концентрированной СО Для этого процесса нужна температура 1000 -1100ºС. Поэтому делают чередование периодов разогрева кокса и его газификации. Сначала в газогенератор подают воздух для сгорания части кокса. При этом основная его масса разогревается до 1200ºС. Затем подают СО 2. Получаемая СО содержит СО 2, N 2 и небольшие количества других примесей. Получение ЭС После очистки от СО 2 остаётся 95 -98 %-ный СО. В последнее время для производства концентрированной СО всё больше используют метод её извлечения из газов двухступенчатой конверсией метана до водорода. При этом одновременно осуществляется очистка Н 2 от нежелательной примеси СО. Учитывая большие масштабы производства водорода, такой источник концентрированной СО – наиболее перспективен.
 Получение концентрированной СО При производстве водорода из синтез-газа после очистки от СО 2 газ Н 2 содержит 2 -4% об. СО. СО извлекают водными растворами аммиачных комплексов солей одновалентной меди. Под давлением при обычной температуре комплексы поглощают СО в количестве 1 моль на 1 г-атом меди. Получение ЭС Cu+(NH 3)4 + CO Cu+(NH 3)3 CO + NH 3 При снижении давления до атмосферного из раствора выделяется газ, содержащий СО – 80%, остальное - СО 2, NH 3, N 2, CH 4, Н 2. При нагревании раствора до 80ºС получается дополнительное количество газа, который после абсорбции из него NH 3 представляет собой почти 100% СО.
Получение концентрированной СО При производстве водорода из синтез-газа после очистки от СО 2 газ Н 2 содержит 2 -4% об. СО. СО извлекают водными растворами аммиачных комплексов солей одновалентной меди. Под давлением при обычной температуре комплексы поглощают СО в количестве 1 моль на 1 г-атом меди. Получение ЭС Cu+(NH 3)4 + CO Cu+(NH 3)3 CO + NH 3 При снижении давления до атмосферного из раствора выделяется газ, содержащий СО – 80%, остальное - СО 2, NH 3, N 2, CH 4, Н 2. При нагревании раствора до 80ºС получается дополнительное количество газа, который после абсорбции из него NH 3 представляет собой почти 100% СО.


