47788b94e4ed2927db70d86bf716e428.ppt
- Количество слайдов: 39

ОКС с STэлевация, STдепрессия и норма Магистрант: Иброхимова Д. Т

Острый коронарный синдром • Определение понятия (Что это? ) • Причины • Механизмы возникновения и развития (Патогенез) • Клиническая картина (симптомы и синдромы) • Диагностика • Лечение

Определение понятия • В настоящее время доказано, что атеросклероз – это заболевание с фазами стабильного течения и обострений. Периодом обострения хронической ишемической болезни сердца называют острый коронарный синдром. Этот термин объединяет такие клинические состояния, как инфаркт миокарда (ИМ), нестабильная стенокардия (НС) и внезапная сердечная смерть. • На сегодняшний день в зависимости от выявленных ЭКГ нарушений выделяют 2 вида ОКС: с подъемом сегмента ST на кардиограмме (острый инфаркт миокарда с подъемом сегмента ST) и без подъемом сегмента ST на кардиограмме (острый инфаркт миокарда без подъема сегмента ST, нестабильная стенокардия). Разделение на вышеперечисленные виды имеет принципиальное значение для выбора тактики лечения пациента.

Причины и патогенез заболевания Появление термина ОКС связано с тем, что хотя ИМ и НС имеют разные клинические проявления, однако у них одинаковый патофизиологический механизм: разрыв или эрозия атеросклеротической бляшки с разной степенью тромбоза, вазоконстрикции и дистальной эмболизации коронарных сосудов. По современным представлениям, основными факторами, которые приводят к дестабилизации атеросклеротической бляшки, являются системное и местное воспаление. В свою очередь, агенты, способствующие развитию воспаления, весьма разнообразны: инфекции, оксидантный стресс, гемодинамические нарушения (гипертензивный криз), системные иммунные реакции и т. д. Наполненное липидами ядро бляшки, которое раскрывается после ее разрыва, высокотромбогенно. Это приводит к запуску каскада реакций: адгезии тромбоцитов на поврежденной поверхности, активации тромбоцитов и свертывающей системы крови, секреции серотонина и тромбоксана А 2 , агрегации тромбоцитов. .

• . В редких • случаях, ACS, возможно, неатеросклеротической этиологии, таких как артрит, • травм, рассечение, тромбоэмболии, врожденные аномалии, • злоупотребления кокаином, или осложнения катетеризации сердца. ключевых патофизиологических концепций, таких как уязвимая бляшка, ишемической • тромбоз, уязвимых пациентов, эндотелиальной дисфункции, ускоренное • атеротромбоза, вторичные механизмы NSTEACS,

Развитию острого тромбоза в пораженном атеросклеротическим процессом венечном сосуде может способствовать не только разрыв бляшки, но и повышенная свертываемость крови, которая чаще отмечается у курильщиков, у женщин, пользующихся оральными контрацептивами, у молодых пациентов, перенесших ИМ. Торможение естественной активации плазминогена индуцирует гиперкоагуляцию и может привести к развитию обширного ИМ даже при ангиографически малоизмененных артериях. Активация плазминогена подвержена циркадным ритмам со спадом в ранние утренние часы, когда вероятность ИМ, внезапной смерти и инсульта наибольшая. Если тромб не полностью перекрывает просвет сосуда, развивается клиническая картина НС. В том случае, когда тромб в венечном сосуде вызывает полную его окклюзию, возникает ИМ, особенно при отсутствии развитого коллатерального кровообращения, что чаще имеет место у молодых пациентов. Это может произойти и при гемодинамически незначимом коронарном стенозе

На основании изменений на ЭКГ различают две основные формы ОКС: с подъемом и без подъема сегмента ST. У пациентов с элевацией сегмента ST, как правило, имеется трансмуральная ишемия миокарда, обусловленная полной окклюзией коронарной артерии тромбом, развивается обширный некроз. У пациентов с депрессией сегмента ST возникает ишемия, которая может сформировать или не сформировать некроз, поскольку коронарный кровоток частично сохранен. Инфаркт у этих пациентов развивается без появления на ЭКГ зубца Q (ИМ без зубца Q). В случае быстрой нормализации ЭКГ и отсутствия повышения уровня маркеров некроза миокарда ставится диагноз НС. Выделение двух форм ОКС связано также с различным прогнозом и лечебной тактикой у этих групп пациентов.

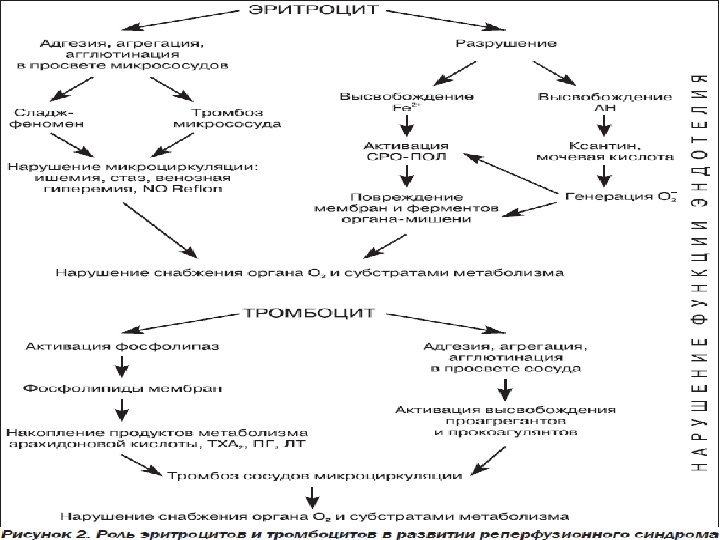
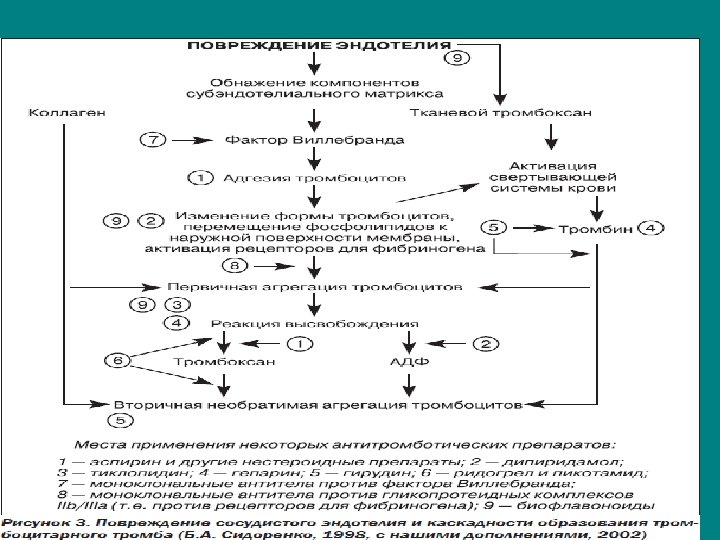
Патогенез. • Предположение о тромбозе коронарной артерии как причины острой коронарной недостаточности (ОКН) высказал английский терапевт W. Heberden (1772), и это предположение в течение многих десятилетий позволяло для лечения различных форм коронарной недостаточности с успехом применять прямые и непрямые антикоагулянты. Однако ведущей в тромбообразовании является патология тромбоцитарнососудистого гемостаза. Этому в значительной мере способствуют атеросклеротическое повреждение сосудистой стенки коронарных артерии, снижение скорости кровотока, турбулентный характер движения крови. • Эти факторы приводят к повышению адгезивно-агрегационных свойств тромбоцитов, стимулируют высвобождение из них биологически активных веществ, потенцирующих клеточную агрегацию и свертывание белков крови. К наиболее активным биологическим субстратам, высвобождающимся из тромбоцитов, следует отнести гистамин, серотонин, βтромбоглобулин и тромбоксан А, обладающий выраженным вазоконстрикторным действием и вызывающий электрическую нестабильность миокардиальной клетки, Са 2+.
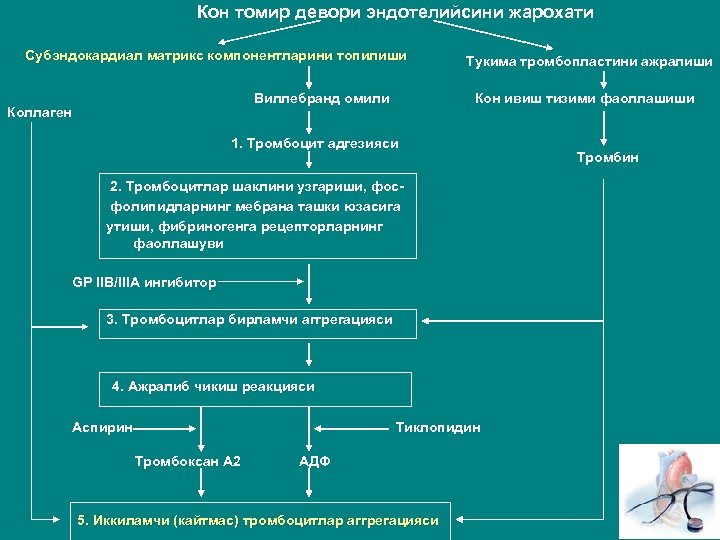
Кон томир девори эндотелийсини жарохати Субэндокардиал матрикс компонентларини топилиши Виллебранд омили Коллаген Тукима тромбопластини ажралиши Кон ивиш тизими фаоллашиши 1. Тромбоцит адгезияси 2. Тромбоцитлар шаклини узгариши, фосфолипидларнинг мебрана ташки юзасига утиши, фибриногенга рецепторларнинг фаоллашуви GP IIB/IIIA ингибитор 3. Тромбоцитлар бирламчи аггрегацияси 4. Ажралиб чикиш реакцияси Аспирин Тиклопидин Тромбоксан А 2 АДФ 5. Иккиламчи (кайтмас) тромбоцитлар аггрегацияси Тромбин
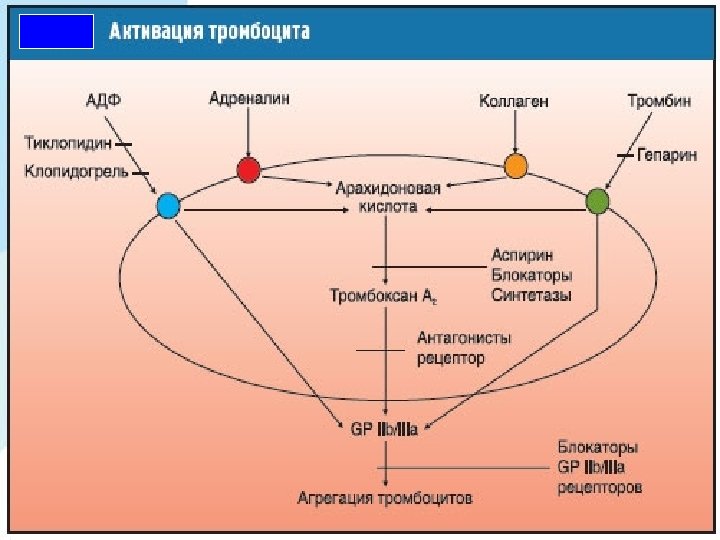

Усугублению и (или) возникновению указанных процессов способствует и повреждение эндотелия сосудистой стенки избыточным выбросом катехоламинов в результате стрессовых ситуаций или активации симпатоадреналовой системы. Этому же способствуют повреждение и слущивание эпителия коронарных сосудов, увеличение площади контакта тромбоцитов с коллагеном. Коллаген так же, как и тромбин, является индуктором реакции высвобождения. Продукты реакции высвобождения прямо или опосредованно повреждают сосудистую стенку с последующим образованием тромбоцитарных тромбов. При малых концентрациях этих веществ такие тромбы легко растворимы и обычно разрушаются током крови. При нарастании их концентрации агрегация тромбоцитов приобретает необратимый характер и приводит к полной окклюзии сосуда тромбоцитарными тромбами. В последующем агрегация форменных элементов крови и высвобождение ими биологически активных веществ, обладающих прокоагулянтным действием, активируют сывороточные факторы коагуляции и на фоне истощения противосвертывающей системы крови приводят к образованию красных тромбов, суживающих либо закрывающих просвет сосуда.

Указанные процессы сопровождаются значительным снижением синтеза простациклина, который продуцируется эндотелиальными клетками сосудистого русла. В противоположность тромбоксану, который обладает выраженным вазоспастическим действием и вызывает электрическую нестабильность миокарда, простациклин, с одной стороны, обладает вазолитическим действием, а с другой — препятствует адгезии и агрегации тромбоцитов, блокирует или значительно подавляет реакцию высвобождения, уменьшает коагуляционную активность плазменных белков, предотвращая тем самым образование как тромбоцитарных, так и красных тромбов. Таким образом, при ОКС происходят нарушения в системе сосудисто тромбоцитарного гемостаза и, в частности, простациклин-тромбоксановой системы в сторону тромбоксанового метаболизма арахидоновой кислоты.

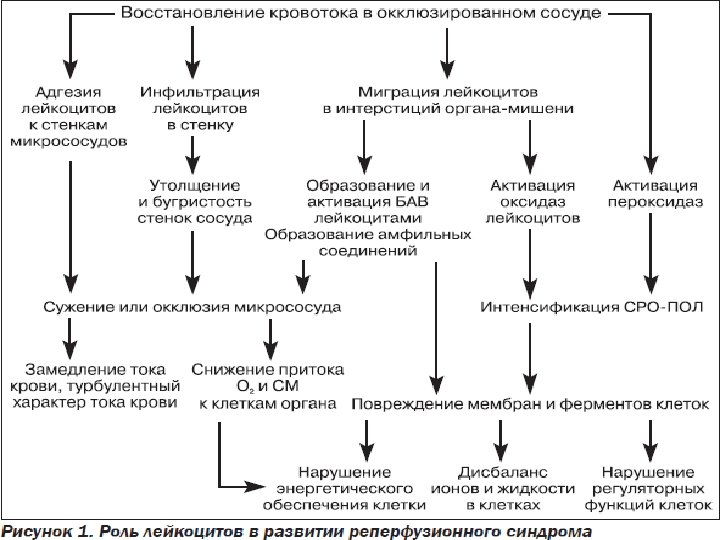
• Под действием тех же активаторов (катехоламины, АДФ. коллаген, тромбин, Са 2+) происходит и изменение фосфолипидов мембран лейкоцитов, в частности арахидоновая кислота (АК) под действием липооксигеназы превращается в лейкотриены (ЛТ) и 5 -ГЭТЕ (эйкозаноиды). Наибольшее содержание этих продуктов в коронарном русле и миокарде определяется через 24 -36 часов после развития ОКН (особенно при очаговых поражениях). Это связано с аккумуляцией ПМЯЛ в ишемизированных тканях миокарда. Следует отметить, что основными источниками лейкотриенов являются клетки крови, особенно нейтрофилы и макрофаги, тучные клетки, в меньшей степени ЛТ могут продуцироваться эндотелием сосудистого русла, тканью сердца, легких, тромбоцитами.

Указанные продукты липооксигеназного пути метаболизма АК вызывают интенсивное сужение коронарных артерий, ослабляют сократительную способность миокарда, приводят к электрической нестабильности миокардиальной клетки, гипотонии. Кроме этого, аккумуляция ПМЯЛ в миокарде при ОКН приводит и (или) усугубляет ишемию миокарда вследствие закупорки мелких сосудов, в том числе коллатералей, лейкоцитарными пробками. Необходимо отметить, что избыточное содержание Са 2+ в миокардиоцитах способствует активации липооксигеназы, что может служить дополнительным источником ЛТ, и эйкозаноидов в миокардиальной ткани, активирует агрегацию лейкоцитов. Все продукты липооксигенозной реакции обладают чрезвычайно высокими биологическими и вазоактивными свойствами. Помимо локального и генерализованного вазоконстрикторного эффекта, они практически немедленно увеличивают проницаемость микрососудов, что еще более увеличивает стаз. Отмечено увеличение их содержания не только в период ишемии, но и особенно во время реперфузии. Они же играют значительную роль и в гипоксическом отеке мозга.

• Связь между циклооксигеназным и липооксигеназным путями метаболизма АК имеет прямой и обратный характер. Следует отметить, что вазоконстрикторный эффект лейкотриенов опосредовано повышает синтез тромбоксанов и других простагландинов. • Указанные процессы касаются продуктов метаболизма арахидоновой кислоты. Сама же АК, вернее ее избыток в миокардиальной ткани, также участвует в поражении миокарда. Иначе говоря, она обладает кардиотоксическим действием, которое наиболее выражено как в условиях ишемии, так и в период реперфузии и проявляется электрической нестабильностью миокарда, снижением его сократительной способности. • Главной причиной, ведущей к накоплению АК и усилению ее метаболизма, является накопление в микрососудах органа при ишемии тромбоцитов, чрезвычайно богатых циклооксигеназой, тромбоксансинтетазой, липооксигеназой. Возникшие агрегация и адгезия клеток активируют эти ферменты. Важным фактором усиления этих неокисленных путей метаболизма АК является образование активных форм О 2 и продуктов ПОЛ.

• Усиление СРО (перекисного) липидов. Протекающее в норме СРО — необходимое звено таких жизненно важных процессов, как транспорт электронов в цепи дыхательных ферментов, синтез простагландинов и лейкотриенов, пролиферация и дифференциация клеток, их рецепции, фагоцитоз, метаболизм катехоламинов и самое основное — регуляция липидного слоя биомембран клеток, что связано с их нормальным функционированием. • Интенсивность СРО регулируется соотношением факторов, активирующих (прооксиданты) и подавляющих этот процесс (антиоксиданты — АО). Соотношение интенсивности СРО и активности антиоксидантных систем ответственно за модификацию состава и структур липидной фазы мембран, их липопротеидных комплексов, а также мембраносвязанных ферментов. В соответствии с изменением интенсивности СРО меняется и характер ответа клеток на различные воздействия. Недостаток поступления АО с пищей, стрессовые ситуации, гиподинамия, возрастные изменения (старение) и ряд других факторов приводят к вспышке СРО, которая сопровождается образованием активных форм кислорода: гидроксильного радикала, супероксиданионрадикала, перекиси водорода, синглетного кислорода и т. д. При повышении концентрации этих форм по сравнению с нормальным содержанием они оказывают разрушающее действие на биомембраны клеток, т. е. ведут к их гибели, изменяют структуры ДНК, РНК, белок,

• инактивируют сульфгидрильные группы тиоловых ферментов. Эти активные соединения вызывают повреждения эндотелия сосудистой стенки, агрегацию тромбоцитов, прилипание лейкоцитов к стенке коронарных артерий, могут быть одной из причин вазоконстрикторной реакции мелких артерий, способствуют и стимулируют тромбообразование. • Источниками увеличения СРО являются: катехоламины, накапливающиеся в миокарде на ранних стадиях ишемии; митохондрии, из которых при повреждении усиливается утечка гидроксильного радикала; значительный вклад в продукцию радикалов в очаге ишемии вносят нейгрофильные лейкоциты, инфильтрирующие пограничную зону и участвующие в фагоцитозе. Инфильтрация ишемизированного миокарда наблюдается уже через 8 -12 часов после начала ОКН. Кроме того, активизированные лейкоциты, мигрировавшие в очаг ишемии, освобождают ряд продуктов, оказывающих цитотоксическое действие. Происходит лейкоцитарная деструкция ишемизированных клеток, которая во многом опосредована активными формами О 2. Это, несомненно, утяжеляет повреждение миокарда в зоне ишемии.

• Постишемический реперфузионный синдром. Феномен реперфузии при ОКН обусловлен рядом факторов: медикаментозным восстановлением кровотока, притоком крови по коллатералям коронарных артерий, ретроградным кровотоком по венулам, возобновлением кровотока вследствие хирургического вмешательства. Однако благоприятное по сути восстановление венечного кровотока в начальный его период сопровождается повреждением мембранного аппарата и ферментов кардиомиоцитов. Основной причиной повреждения миокарда в этот период является активация СРО. Причем степень реперфузионного повреждения продуктами СРО прямо пропорциональна длительности ишемии. • В основе патологических проявлений этого синдрома лежит избыточность притока О 2 в зону ишемии, т. е. постишемическая гипероксия миокарда. Вследствие этого происходит быстрая лавинообразная интенсификация СРО, вследствие чего происходит гибель клеток, находящихся в аноксии и гипоксии, т. е. углубление ишемического процесса, избыточное накопление в пограничной зоне и зоне

• ишемии Са 2+, прооксидантов, увеличивается содержание свободных жирных кислот, лизофосфатидов, повреждающих клеточные структуры миокарда. Все это ведет к ригидности миофибрилл, их набуханию, отеку, вплоть до разрыва клеточной оболочки, снижается эластичность миокарда во время ишемии. Эти явления могут привести к феномену «невосстановленного кровотока» вследствие отека эндотелиальных клеток и закрытия темсамым просвета артериол, капилляров, а также вследствие контрактуры миокарда вокруг окклюзированных сосудов. В клинике реперфузионный синдром проявляется в виде распространения зоны повреждения или некроза на ЭКГ, поздними нарушениями ритма, возобновлением приступов стенокардии, расстройством сократительной способности, активацией процессов гемокоагуляции. Таким образом, указанные звенья патогенеза играют ведущую роль в возникновении c 2 l и течении ОКН и отягощают течение болезни. •

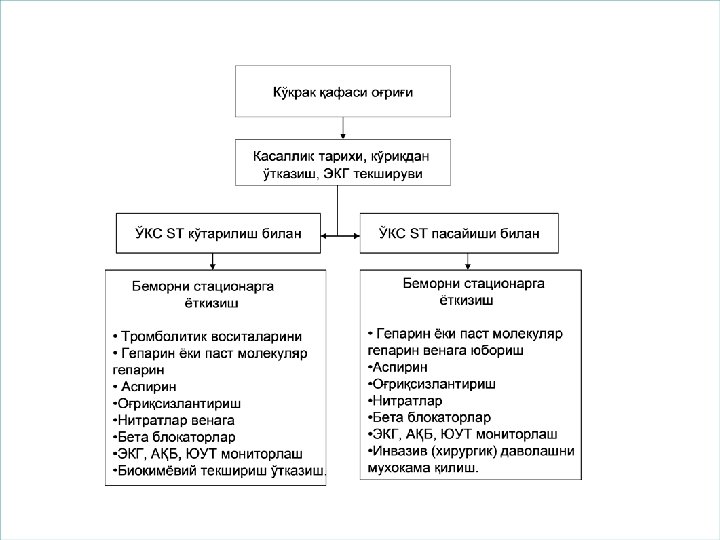
Клиническая картина заболевания и тактика Формы ОКС. • Острый коронарный синдром с подъемом сегмента ST или остро возникшей блокадой левой ножки пучка Гиса. • Стойкие подъемы сегмента ST свидетельствуют об острой полной окклюзии коронарной артерии, возможно, в проксимальном отделе. Поскольку риску повреждения подвергается большая площадь миокарда левого желудочка, прогноз у этих пациентов наиболее тяжелый. Целью лечения в данной ситуации является быстрое восстановление проходимости сосуда. Для этого используют тромболитические препараты (при отсутствии противопоказаний) или чрескожную ангиопластику.

Острый коронарный синдром без подъема сегмента ST. • При этом варианте изменения на ЭКГ характеризуются стойкой или преходящей депрессией сегмента ST, инверсией, сглаженностью или псевдонормализацией зубца Т. В некоторых случаях ЭКГ в первые часы бывает нормальной, и тактика ведения таких больных заключается в устранении болевого синдрома и ишемии миокарда с использованием аспирина, гепарина, β-блокаторов, нитратов. Тромболитическая терапия неэффективна и может даже ухудшить прогноз у пациентов. • Диагноз ОКС на догоспитальном этапе базируется на клинических проявлениях (ангинозный статус) и ЭКГдиагностике.

Ангинозный статус. • ОКС с подъемом сегмента ST. • Диагностика проводится на основании наличия ангинозной боли в грудной клетке в течение 20 минут и более, которая не купируется нитроглицерином и иррадиирует в шею, нижнюю челюсть, левую руку. У лиц пожилого возраста в клинической картине может преобладать не болевой синдром, а слабость, одышка, потеря сознания, артериальная гипотензия, нарушения ритма сердца, явления острой сердечной недостаточности.

• ОКС без подъема сегмента ST. Клиническими проявлениями ангинозного приступа у пациентов с этим вариантом ОКС могут быть стенокардия покоя продолжительностью более 20 минут, впервые возникшая стенокардия напряжения ІІІ функционального класса, прогрессирующая стенокардия (учащение приступов, увеличение их длительности, снижение толерантности к физической нагрузке). Острый коронарный синдром может иметь атипичное клиническое течение. Атипичные проявления: боль в эпигастрии с тошнотой и рвотой, колющая боль в грудной клетке, болевой синдром с признаками, характерными для поражения плевры, нарастание одышки. В этих случаях правильной диагностике способствуют указания о наличии в анамнезе ИБС и изменения на ЭКГ.

Диагностика заболевания -Анамнез: ангинозный боль. -ЭКГ. -Биомаркер: Тропонин. (Т, I) - Фермент: КФК-МВ, ЛДГ-1, ЛДГ-2

ЭКГ – основной метод оценки больных с ОКС, на основании которого строится прогноз и выбирается лечебная тактика. ОКС с подъемом сегмента ST. • Элевация сегмента ST ≥ 0, 2 м. В в отведениях V 1 -V 3 или ≥ 0, 1 м. В в других отведениях. • Наличие любого зубца Q в отведениях V 1 -V 3 или зубца Q ≥ 0, 03 с в отведениях I, av. L, av. F, V 4 -V 6. • Остро возникшая блокада левой ножки пучка Гиса.

ОКС без подъема сегмента ST. • ЭКГ-признаки этого варианта ОКС – депрессия сегмента ST и изменения зубца Т. Вероятность этого синдрома наиболее велика при сочетании клинической картины с депрессией сегмента ST, превышающей 1 мм в двух смежных отведениях с преобладающим зубцом R или более. Нормальная ЭКГ у больных с симптомами, характерными для ОКС, не исключают его наличия. При этом необходимо исключить другие возможные причины жалоб пациента.

• УКС ЭКГ буйича куйидагича трансформацияланади. • S-T кутарилиши ёки янги. ГТЧОТ: S-T депрессия ёки Т тиш инверсияси: Норма. Бунда: УИМ нинг Q тишли тури - УИМ нинг Q тишсиз тури - ривожланиш хавфи юкорилигини курсатади. -Номуким стенокардия. -УМИ ривожланиш хавфи юкорилигини курсатади. -Стабил стенокардия –Номуким стенокардия
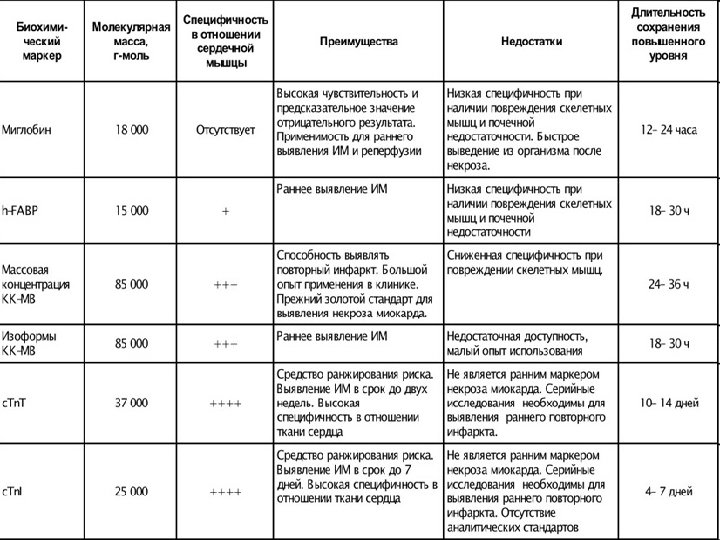

• Таблица 1. 1. Свойства биомаркеров некроза миокарда • Примечание. Время первого повышения составляет 1– 3 ч для миоглобина, 3– 4 часа для массовой концентрации КФК-МВ, 3– 4 часа для с. Тn. T и 4– 6 ч для c. Тn. TI. h-FABP — heart fatty acid-binding protein (сердечный белок, связывающий жирные кислоты) Адаптировано из: Christenson R. H. and Azzazy H. M. E. Biomarkers of necrosis: past, present and future // Morrow D. A. , ed. Cardiovascular Biomarkers: Pathophysiology and Clinical Management. — N. Y. : Humana Press, 2006.
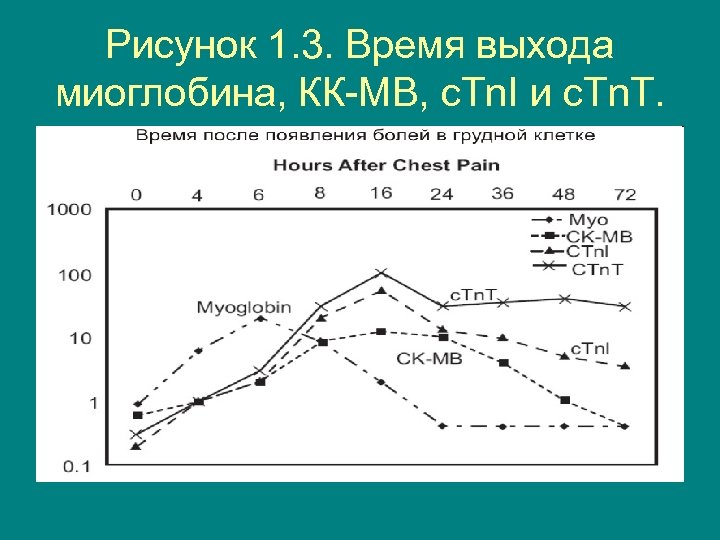
Рисунок 1. 3. Время выхода миоглобина, КК-МВ, с. Tn. I и с. Tn. T.

Лечение заболевания • Модифицированная классификация Американской коллегии кардиологов/Американской кардиологической ассоциации
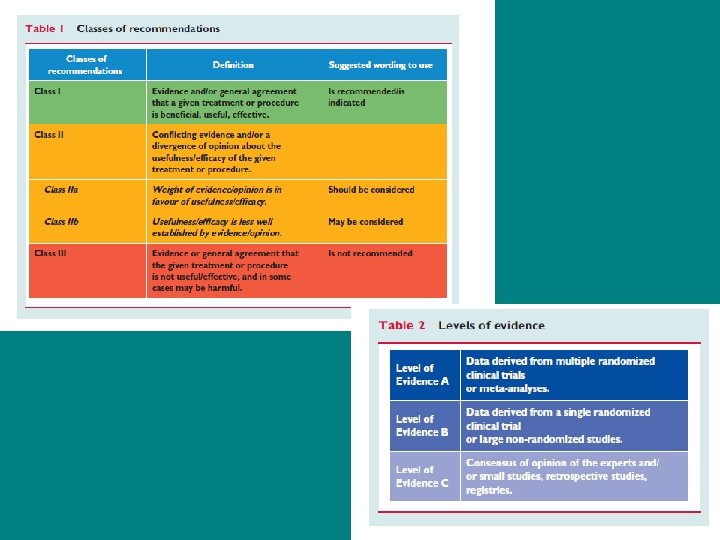

Сводка по показаниям • I. Состояния, для которых имеются свидетельства или согласие по вопросу о том, что данная лабораторная или терапевтическая процедура полезна и эффективна. • II. Состояния, для которых имеются противоречивые сведения или разные мнения по вопросу о том, что данная лабораторная или терапевтическая процедура полезна и эффективна: • a. Сведения/мнения склоняются в пользу полезности/эффективности. • b. Полезность/эффективность недостаточно обоснована. • III. Состояния, для которых имеются свидетельства или согласие по вопросу о том, что данная лабораторная или терапевтическая процедура бесполезна и неэффективна, а в некоторых случаях и вредна

Степень обоснованности • А. Данные получены в многочисленных рандомизированных или должным образом спланированных клинических испытаниях на большом числе больных. • B. Данные получены в небольшом числе рандомизированных или надлежащим образом спланированных клинических испытаниях на небольшом числе больных. • C. Рекомендация основана главным образом на мнении экспертов.

47788b94e4ed2927db70d86bf716e428.ppt