Лекция по органике_3.ppt
- Количество слайдов: 51
 Окончание предыдущей лекции
Окончание предыдущей лекции
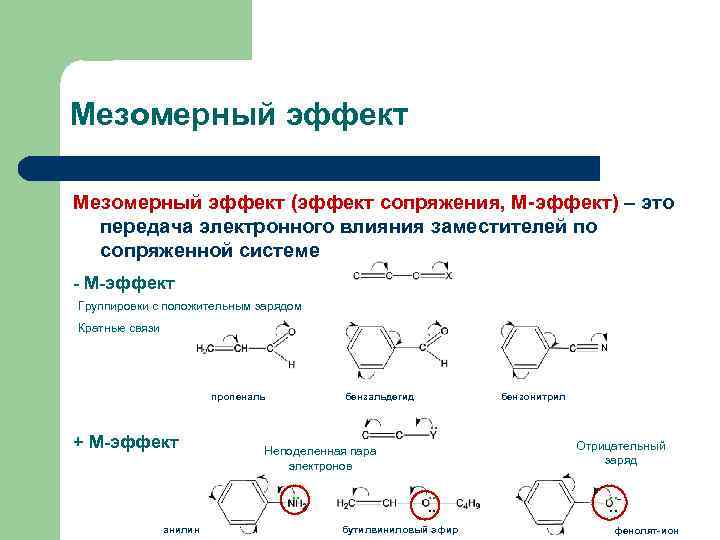 Мезомерный эффект (эффект сопряжения, М-эффект) – это передача электронного влияния заместителей по сопряженной системе - М-эффект Группировки с положительным зарядом Кратные связи N пропеналь + М-эффект бензальдегид . . Отрицательный заряд Неподеленная пара электронов . . анилин бензонитрил . . бутилвиниловый эфир . . фенолят-ион
Мезомерный эффект (эффект сопряжения, М-эффект) – это передача электронного влияния заместителей по сопряженной системе - М-эффект Группировки с положительным зарядом Кратные связи N пропеналь + М-эффект бензальдегид . . Отрицательный заряд Неподеленная пара электронов . . анилин бензонитрил . . бутилвиниловый эфир . . фенолят-ион
 +М-эффект ОН-группы в молекуле фенола
+М-эффект ОН-группы в молекуле фенола
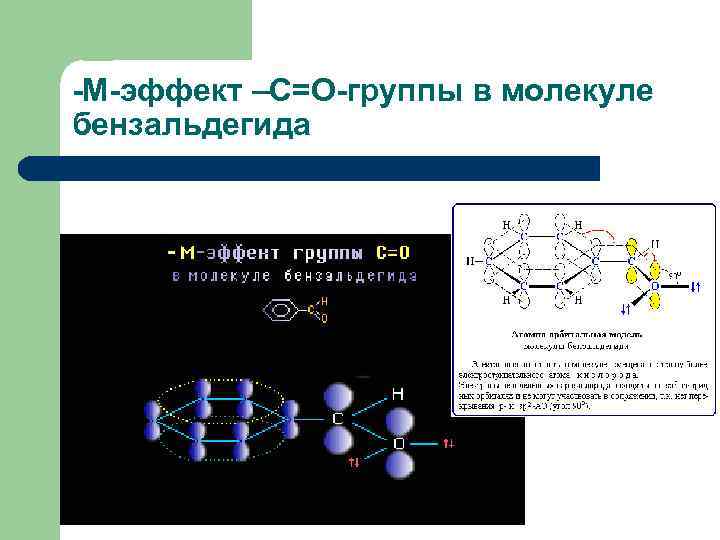 -М-эффект –С=О-группы в молекуле бензальдегида
-М-эффект –С=О-группы в молекуле бензальдегида
 Закономерности проявления мезомерного эффекта Величина -М-эффекта растет с увеличением заряда заместителя + - -HC=NR < -HC=NR 2 -M растет - -O < -SH -M растет + -N≡N > -SO 3 H ~ -NO 2 > -CN > C=O -M убывает -М-эффект тем сильнее, чем имеющихся в заместителе атомов -C≡C-R < -C≡N -M растет больше электроотрицательность -CH=CHR < -CH=NR < -C=O -M растет
Закономерности проявления мезомерного эффекта Величина -М-эффекта растет с увеличением заряда заместителя + - -HC=NR < -HC=NR 2 -M растет - -O < -SH -M растет + -N≡N > -SO 3 H ~ -NO 2 > -CN > C=O -M убывает -М-эффект тем сильнее, чем имеющихся в заместителе атомов -C≡C-R < -C≡N -M растет больше электроотрицательность -CH=CHR < -CH=NR < -C=O -M растет
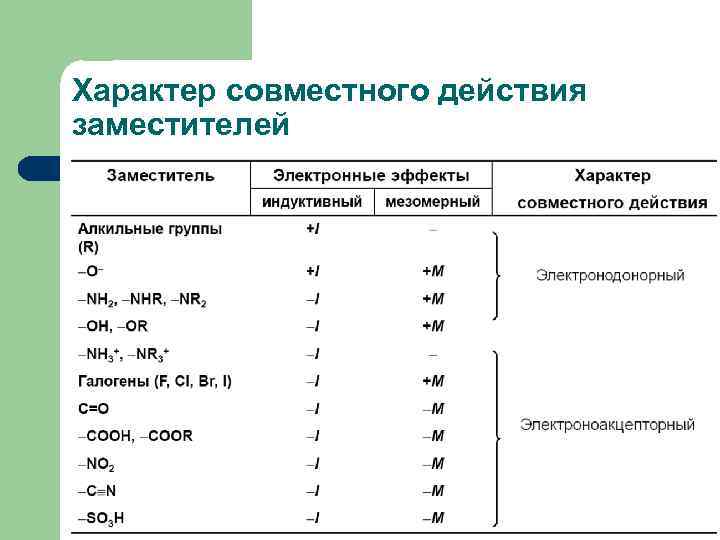 Характер совместного действия заместителей
Характер совместного действия заместителей
 Резонанс
Резонанс
 Теория резонанса: определения Теория (метод) резонанса – способ описания сопряженных πсистем, демонстрирующий подвижность π-электронов под действием заместителей, обладающих мезомерным эффектом* π-Система – цепочка атомов, каждый их которых имеет р-орбиталь, либо неподеленную пару электронов. Такие системы называются сопряженными * Мезомерный эффект – передача электронного влияния заместителей по сопряженной системе
Теория резонанса: определения Теория (метод) резонанса – способ описания сопряженных πсистем, демонстрирующий подвижность π-электронов под действием заместителей, обладающих мезомерным эффектом* π-Система – цепочка атомов, каждый их которых имеет р-орбиталь, либо неподеленную пару электронов. Такие системы называются сопряженными * Мезомерный эффект – передача электронного влияния заместителей по сопряженной системе
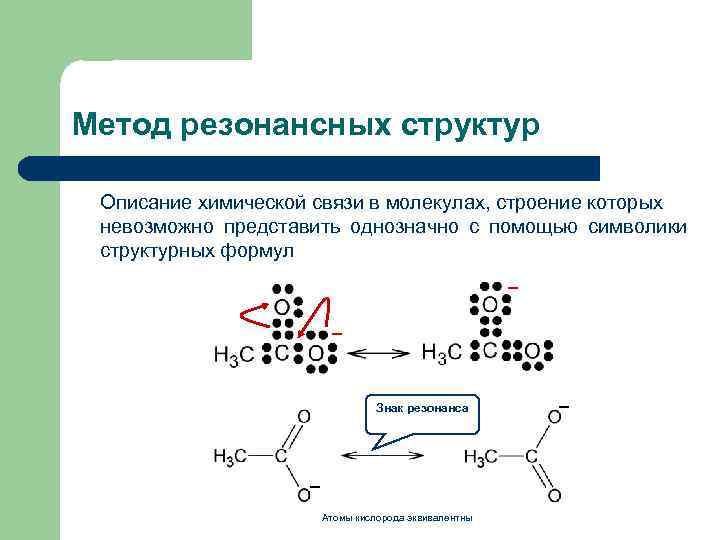 Метод резонансных структур Описание химической связи в молекулах, строение которых невозможно представить однозначно с помощью символики структурных формул _ _ Знак резонанса _ Атомы кислорода эквивалентны _
Метод резонансных структур Описание химической связи в молекулах, строение которых невозможно представить однозначно с помощью символики структурных формул _ _ Знак резонанса _ Атомы кислорода эквивалентны _
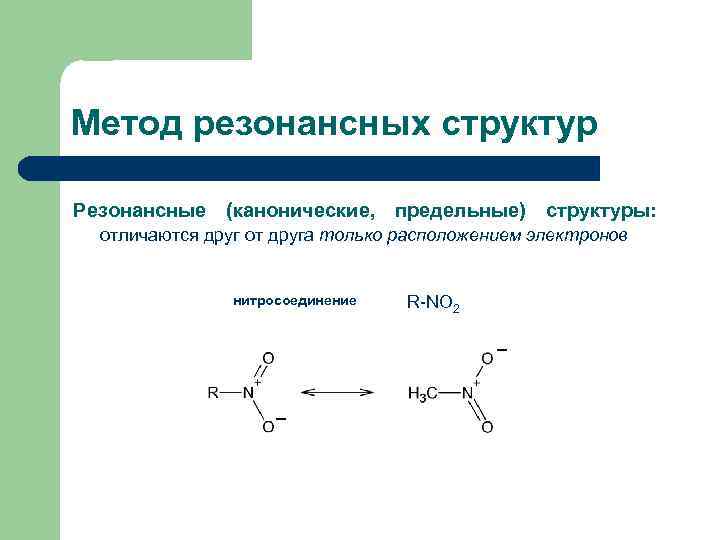 Метод резонансных структур Резонансные (канонические, предельные) структуры: отличаются друг от друга только расположением электронов нитросоединение R-NO 2 _ _
Метод резонансных структур Резонансные (канонические, предельные) структуры: отличаются друг от друга только расположением электронов нитросоединение R-NO 2 _ _
 Положения метода резонанса 1) Резонансные структуры не должны отличаться расположением атомов. 2) Каждая резонансная структура не должна изменять валентность атомов. 3) Все резонансные структуры должны иметь одинаковое число неспаренных электронов.
Положения метода резонанса 1) Резонансные структуры не должны отличаться расположением атомов. 2) Каждая резонансная структура не должна изменять валентность атомов. 3) Все резонансные структуры должны иметь одинаковое число неспаренных электронов.
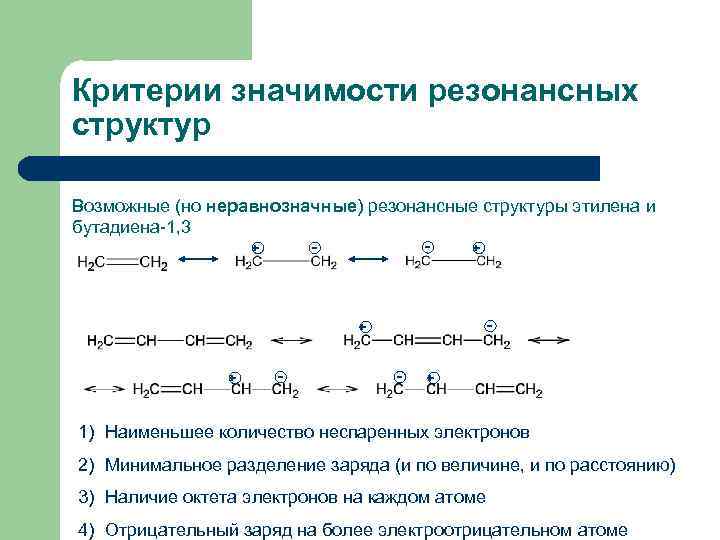 Критерии значимости резонансных структур Возможные (но неравнозначные) резонансные структуры этилена и бутадиена-1, 3 + + - - + 1) Наименьшее количество неспаренных электронов 2) Минимальное разделение заряда (и по величине, и по расстоянию) 3) Наличие октета электронов на каждом атоме 4) Отрицательный заряд на более электроотрицательном атоме
Критерии значимости резонансных структур Возможные (но неравнозначные) резонансные структуры этилена и бутадиена-1, 3 + + - - + 1) Наименьшее количество неспаренных электронов 2) Минимальное разделение заряда (и по величине, и по расстоянию) 3) Наличие октета электронов на каждом атоме 4) Отрицательный заряд на более электроотрицательном атоме
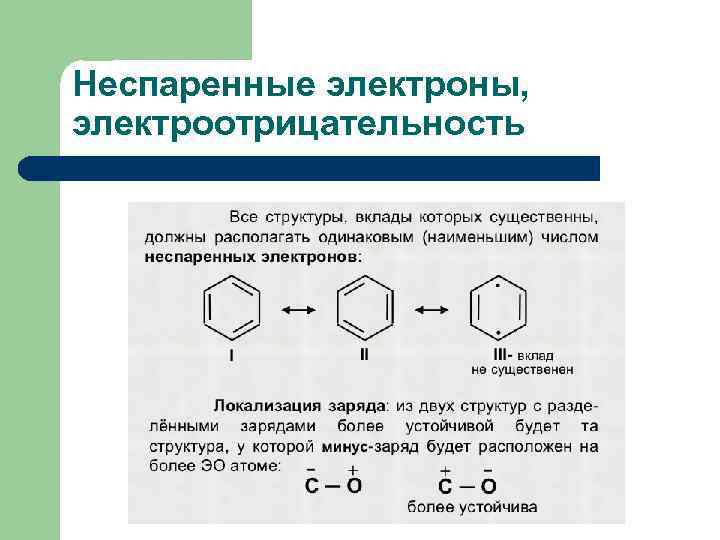 Неспаренные электроны, электроотрицательность
Неспаренные электроны, электроотрицательность
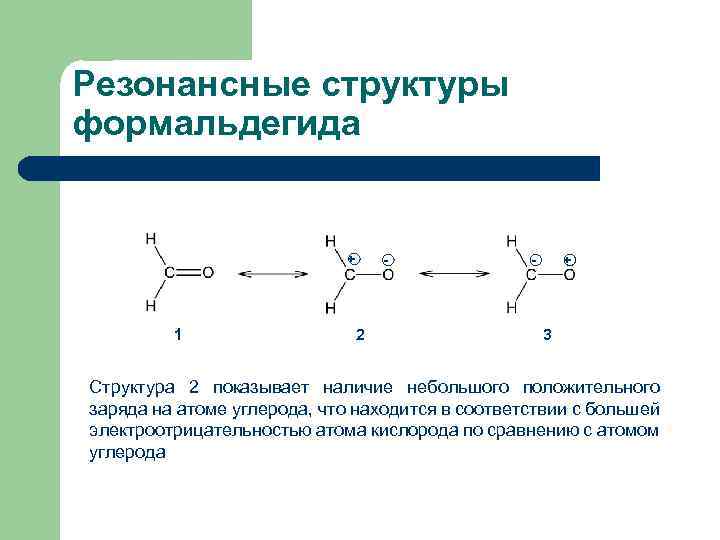 Резонансные структуры формальдегида + 1 - 2 - + 3 Структура 2 показывает наличие небольшого положительного заряда на атоме углерода, что находится в соответствии с большей электроотрицательностью атома кислорода по сравнению с атомом углерода
Резонансные структуры формальдегида + 1 - 2 - + 3 Структура 2 показывает наличие небольшого положительного заряда на атоме углерода, что находится в соответствии с большей электроотрицательностью атома кислорода по сравнению с атомом углерода
 Химическая связь в органических соединениях Лекция 3
Химическая связь в органических соединениях Лекция 3
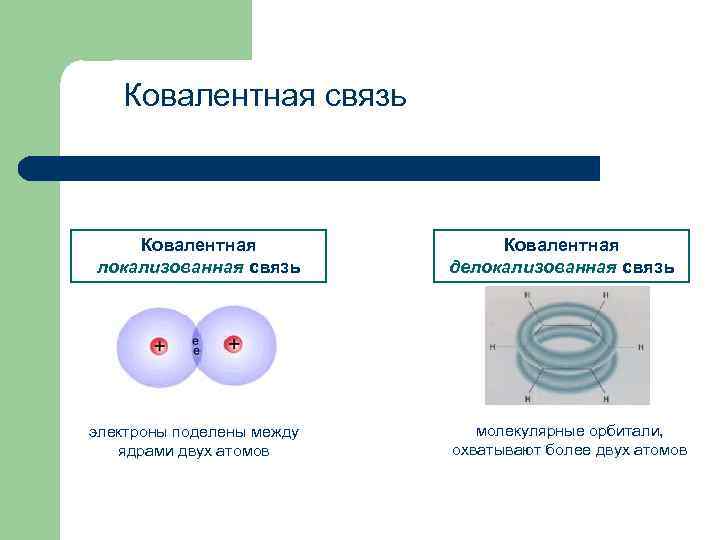 Ковалентная связь Ковалентная локализованная связь электроны поделены между ядрами двух атомов Ковалентная делокализованная связь молекулярные орбитали, охватывают более двух атомов
Ковалентная связь Ковалентная локализованная связь электроны поделены между ядрами двух атомов Ковалентная делокализованная связь молекулярные орбитали, охватывают более двух атомов
 Основные понятия Делокализованная связь – это ковалентная связь, молекулярные орбитали которой охватывают более двух атомов Характерны для соединений, содержащих открытые или замкнутые системы сопряжения Бутадиен-1, 3
Основные понятия Делокализованная связь – это ковалентная связь, молекулярные орбитали которой охватывают более двух атомов Характерны для соединений, содержащих открытые или замкнутые системы сопряжения Бутадиен-1, 3
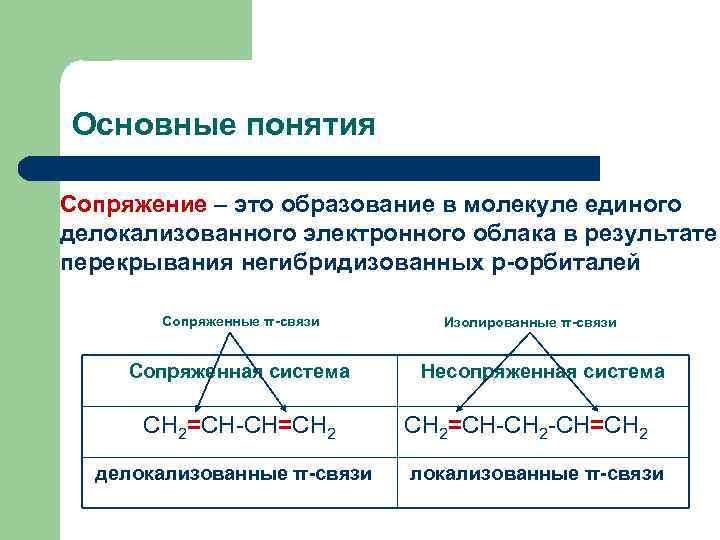 Основные понятия Сопряжение – это образование в молекуле единого делокализованного электронного облака в результате перекрывания негибридизованных р-орбиталей Сопряженные π-связи Сопряженная система CH 2=CH-CH=CH 2 делокализованные π-связи Изолированные π-связи Несопряженная система CH 2=CH-СН 2 -CH=CH 2 локализованные π-связи
Основные понятия Сопряжение – это образование в молекуле единого делокализованного электронного облака в результате перекрывания негибридизованных р-орбиталей Сопряженные π-связи Сопряженная система CH 2=CH-CH=CH 2 делокализованные π-связи Изолированные π-связи Несопряженная система CH 2=CH-СН 2 -CH=CH 2 локализованные π-связи
 π, π-сопряженные системы Делокализованные МО принадлежат двум или более π-связям
π, π-сопряженные системы Делокализованные МО принадлежат двум или более π-связям
 Условия π, π-сопряжения 1) Кратные связи должны быть разделены одной (и только одной) простой связью 2) Максимальное сопряжение достигается, когда обе кратные связи лежат в одной плоскости 3) Если по пространственным соображениям две кратные связи не могут лежать в одной плоскости, то сопряжение между ними уменьшается с увеличением угла между плоскостями этих связей Кумулированные π-связи 4) >С=С=С< аллены >С=С=О кетены Сопряжение невозможно
Условия π, π-сопряжения 1) Кратные связи должны быть разделены одной (и только одной) простой связью 2) Максимальное сопряжение достигается, когда обе кратные связи лежат в одной плоскости 3) Если по пространственным соображениям две кратные связи не могут лежать в одной плоскости, то сопряжение между ними уменьшается с увеличением угла между плоскостями этих связей Кумулированные π-связи 4) >С=С=С< аллены >С=С=О кетены Сопряжение невозможно
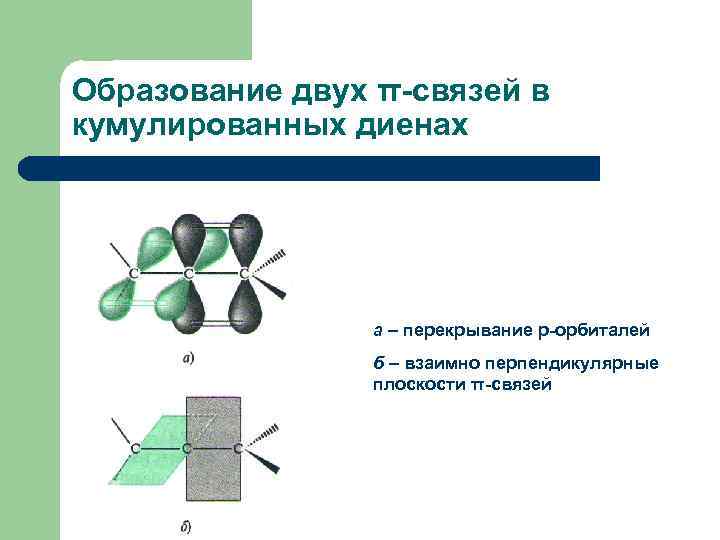 Образование двух π-связей в кумулированных диенах а – перекрывание р-орбиталей б – взаимно перпендикулярные плоскости π-связей
Образование двух π-связей в кумулированных диенах а – перекрывание р-орбиталей б – взаимно перпендикулярные плоскости π-связей
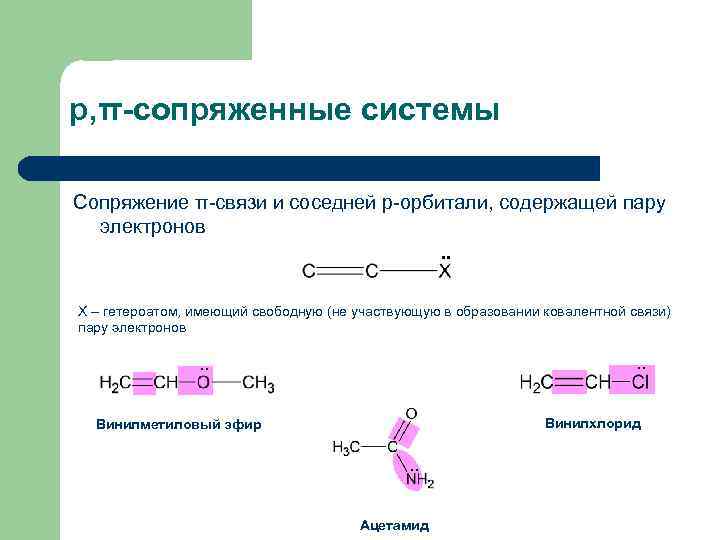 р, π-сопряженные системы Сопряжение π-связи и соседней р-орбитали, содержащей пару электронов. . Х – гетероатом, имеющий свободную (не участвующую в образовании ковалентной связи) пару электронов . . Винилхлорид Винилметиловый эфир . . Ацетамид
р, π-сопряженные системы Сопряжение π-связи и соседней р-орбитали, содержащей пару электронов. . Х – гетероатом, имеющий свободную (не участвующую в образовании ковалентной связи) пару электронов . . Винилхлорид Винилметиловый эфир . . Ацетамид
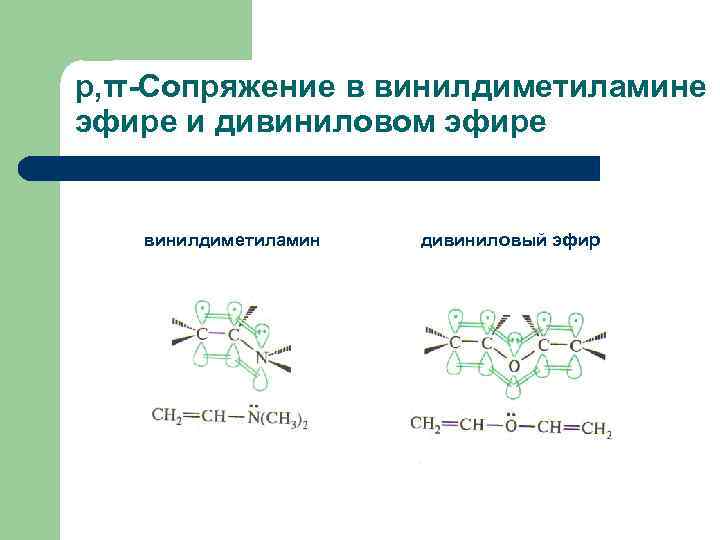 p, π-Сопряжение в винилдиметиламине эфире и дивиниловом эфире винилдиметиламин дивиниловый эфир
p, π-Сопряжение в винилдиметиламине эфире и дивиниловом эфире винилдиметиламин дивиниловый эфир
 Условия р, π-сопряжения 1) Атом, несущий свободную электронную пару должен быть отделен от кратной связи одной простой связью 2) Наибольшей величины сопряжение достигает, если р-АО перпендикулярна плоскости двойной связи 3) Сопряжение невозможно, если р-АО лежит в плоскости двойной связи 4) Участие атома С в р, π-сопряжении с кратной связью возможно только в том случае, если он превратится в радикал, катион или анион
Условия р, π-сопряжения 1) Атом, несущий свободную электронную пару должен быть отделен от кратной связи одной простой связью 2) Наибольшей величины сопряжение достигает, если р-АО перпендикулярна плоскости двойной связи 3) Сопряжение невозможно, если р-АО лежит в плоскости двойной связи 4) Участие атома С в р, π-сопряжении с кратной связью возможно только в том случае, если он превратится в радикал, катион или анион
 р, π-Сопряженные системы Система сопряжeния может быть открытой или замкнутой и содержать атом (C, N, O, S, Cl и т. д. ) с неподеленной электронной парой (формулы I, II), с неспаренным электроном (III) или с вакантной р-АО (IV):
р, π-Сопряженные системы Система сопряжeния может быть открытой или замкнутой и содержать атом (C, N, O, S, Cl и т. д. ) с неподеленной электронной парой (формулы I, II), с неспаренным электроном (III) или с вакантной р-АО (IV):
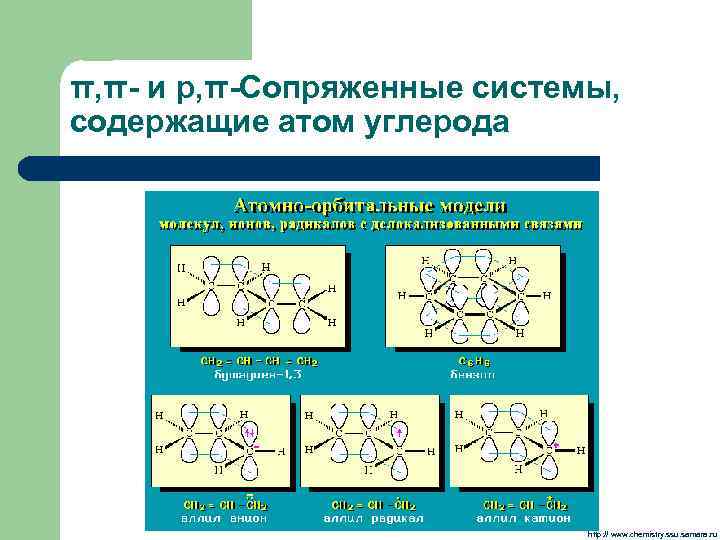 π, π- и р, π-Сопряженные системы, содержащие атом углерода http: // www. chemistry. ssu. samara. ru
π, π- и р, π-Сопряженные системы, содержащие атом углерода http: // www. chemistry. ssu. samara. ru
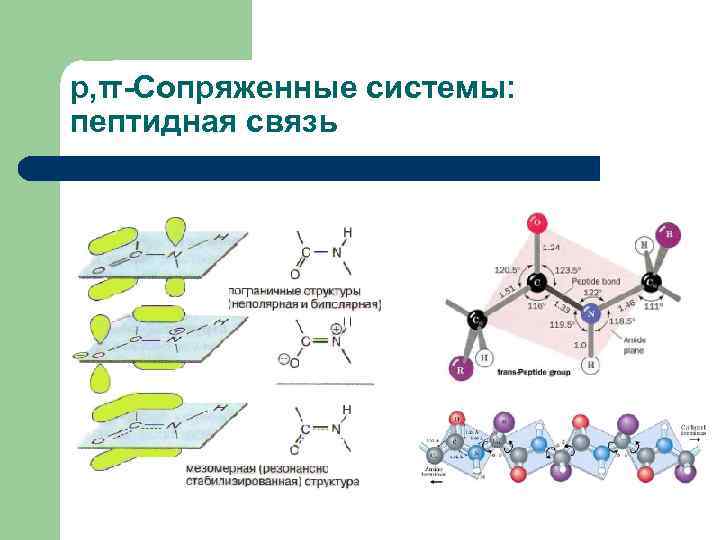 р, π-Сопряженные системы: пептидная связь
р, π-Сопряженные системы: пептидная связь
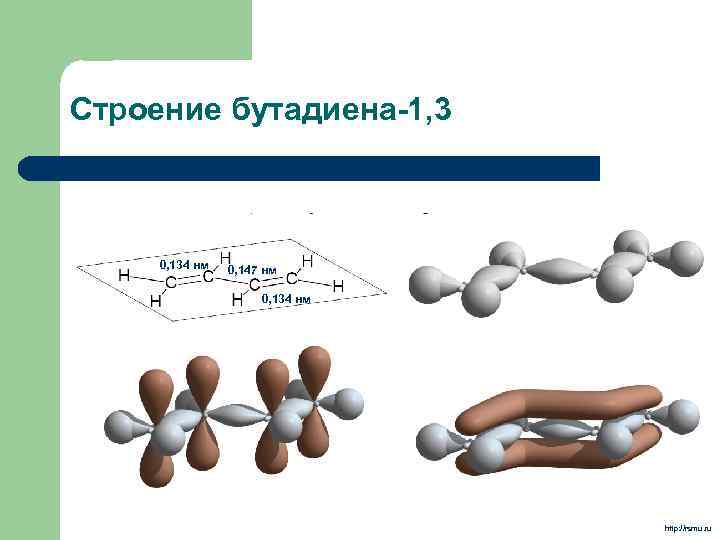 Строение бутадиена-1, 3 0, 134 нм 0, 147 нм 0, 134 нм http: //rsmu. ru
Строение бутадиена-1, 3 0, 134 нм 0, 147 нм 0, 134 нм http: //rsmu. ru
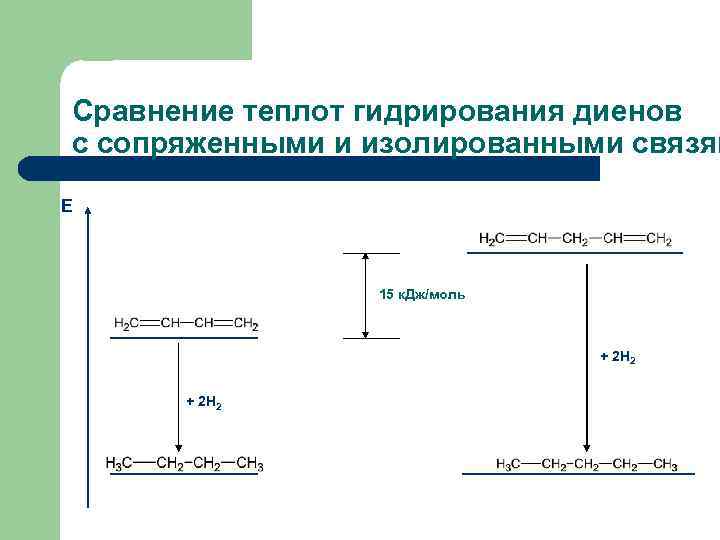 Сравнение теплот гидрирования диенов с сопряженными и изолированными связям Е 15 к. Дж/моль + 2 Н 2
Сравнение теплот гидрирования диенов с сопряженными и изолированными связям Е 15 к. Дж/моль + 2 Н 2
 Методы описания делокализованной химической связи 1) Метод молекулярных орбиталей Хюккеля Э. Хюккель (1930) 2) Метод резонансных структур (метод резонанса, РС) К. Ингольд (1922), Л. Полинг (1928)
Методы описания делокализованной химической связи 1) Метод молекулярных орбиталей Хюккеля Э. Хюккель (1930) 2) Метод резонансных структур (метод резонанса, РС) К. Ингольд (1922), Л. Полинг (1928)
 σ- и π-электроны в делокализованных связях 1) Пренебрегают взаимодействием σ- и π-электронов. Такое приближение основано на различии в симметрии орбиталей (ортогональные орбитали). σ -связи молекулы относят к ее остову. 2) π-электроны описывают с помощью МО, состоящих исключительно из АО ртипа. Т. е. считают, что атомы углерода в сопряженной системе находятся в состоянии идеальной sp 2 -гибридизации. Систему сопряженных π-связей рассматривают независимо от σ-скелета и считают, что именно π-система играет главную роль в проявлении химических свойств сопряженных соединений
σ- и π-электроны в делокализованных связях 1) Пренебрегают взаимодействием σ- и π-электронов. Такое приближение основано на различии в симметрии орбиталей (ортогональные орбитали). σ -связи молекулы относят к ее остову. 2) π-электроны описывают с помощью МО, состоящих исключительно из АО ртипа. Т. е. считают, что атомы углерода в сопряженной системе находятся в состоянии идеальной sp 2 -гибридизации. Систему сопряженных π-связей рассматривают независимо от σ-скелета и считают, что именно π-система играет главную роль в проявлении химических свойств сопряженных соединений
 Применение метода резонанса к описанию сопряженной системы бутадиена-1, 3 _ (I) (II) _ (III) Вклад структур II и III в резонансный гибрид меньше, чем структуры I , из-за уменьшения в них числа ковалентных связей и разделения зарядов Резонансный гибрид – комбинация ряда структур (с локализованными связями), называемых резонансными или каноническими
Применение метода резонанса к описанию сопряженной системы бутадиена-1, 3 _ (I) (II) _ (III) Вклад структур II и III в резонансный гибрид меньше, чем структуры I , из-за уменьшения в них числа ковалентных связей и разделения зарядов Резонансный гибрид – комбинация ряда структур (с локализованными связями), называемых резонансными или каноническими
 Выводы 1) Перекрывание р-АО (сопряжение, делокализация π-электронов) энергетически выгодно и осуществляется всегда, когда для этого есть необходимые условия. 2) Сопряженные соединения стабильнее, чем соединения с изолированными кратными связями. 3) Чем больше цепь сопряжения, тем стабильнее соединение. 4) Выигрыш энергии, получаемый в результате сопряжения, называют энергией сопряжения (энергией делокализации).
Выводы 1) Перекрывание р-АО (сопряжение, делокализация π-электронов) энергетически выгодно и осуществляется всегда, когда для этого есть необходимые условия. 2) Сопряженные соединения стабильнее, чем соединения с изолированными кратными связями. 3) Чем больше цепь сопряжения, тем стабильнее соединение. 4) Выигрыш энергии, получаемый в результате сопряжения, называют энергией сопряжения (энергией делокализации).
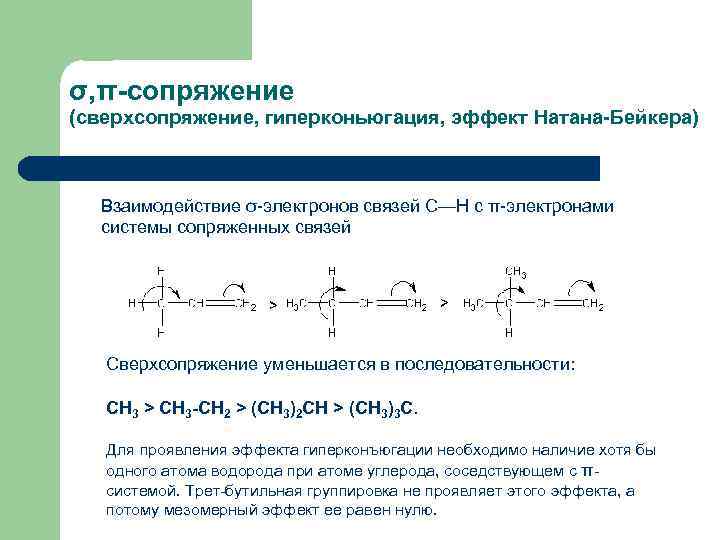 σ, π-сопряжение (сверхсопряжение, гиперконьюгация, эффект Натана-Бейкера) Взаимодействие σ-электронов связей С—Н с π-электронами системы сопряженных связей Сверхсопряжение уменьшается в последовательности: СН 3 > CH 3 -CH 2 > (CH 3)2 CH > (CH 3)3 C. Для проявления эффекта гиперконъюгации необходимо наличие хотя бы одного атома водорода при атоме углерода, соседствующем с πсистемой. Трет-бутильная группировка не проявляет этого эффекта, а потому мезомерный эффект ее равен нулю.
σ, π-сопряжение (сверхсопряжение, гиперконьюгация, эффект Натана-Бейкера) Взаимодействие σ-электронов связей С—Н с π-электронами системы сопряженных связей Сверхсопряжение уменьшается в последовательности: СН 3 > CH 3 -CH 2 > (CH 3)2 CH > (CH 3)3 C. Для проявления эффекта гиперконъюгации необходимо наличие хотя бы одного атома водорода при атоме углерода, соседствующем с πсистемой. Трет-бутильная группировка не проявляет этого эффекта, а потому мезомерный эффект ее равен нулю.
 Ароматичность: особый вид сопряжения Химические свойства ароматических соединений • • Высокая стабильность Преимущественно вступают в реакции замещения Циклическая сопряженная система молекулы Условия возникновения 1) 2) 3) Система должна быть циклической (карбоциклы, гетероциклы) Система должна быть плоской Все атомы цикла должны находиться в состоянии sp 2 гибридизации
Ароматичность: особый вид сопряжения Химические свойства ароматических соединений • • Высокая стабильность Преимущественно вступают в реакции замещения Циклическая сопряженная система молекулы Условия возникновения 1) 2) 3) Система должна быть циклической (карбоциклы, гетероциклы) Система должна быть плоской Все атомы цикла должны находиться в состоянии sp 2 гибридизации
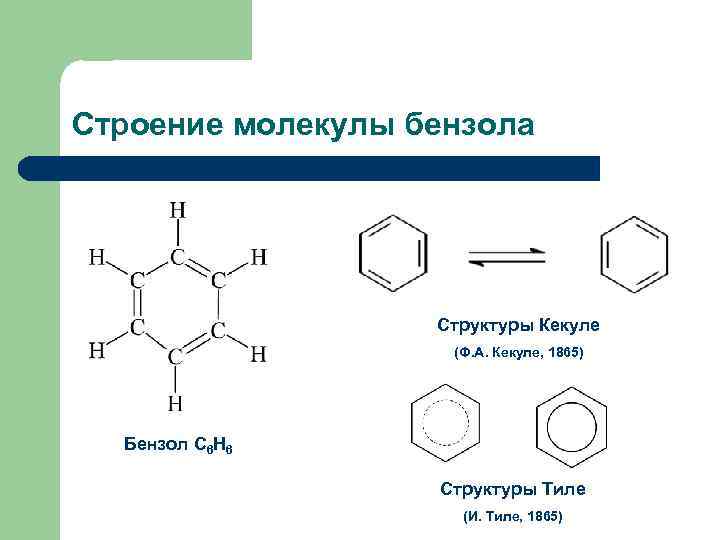 Строение молекулы бензола Структуры Кекуле (Ф. А. Кекуле, 1865) Бензол С 6 Н 6 Структуры Тиле (И. Тиле, 1865)
Строение молекулы бензола Структуры Кекуле (Ф. А. Кекуле, 1865) Бензол С 6 Н 6 Структуры Тиле (И. Тиле, 1865)
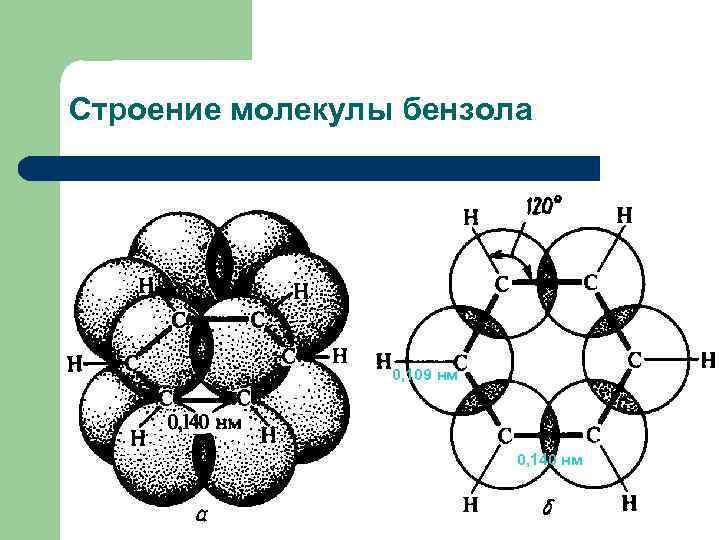 Строение молекулы бензола 0, 109 нм 0, 140 нм
Строение молекулы бензола 0, 109 нм 0, 140 нм
 Строение молекулы бензола Бензол – плоский правильный шестиугольник с валентными углами 120°, все связи С-С равноценны (0, 140 нм) и все атомы углерода sp 2 -гибридизованы; все связи С-С и С-Н лежат в одной плоскости
Строение молекулы бензола Бензол – плоский правильный шестиугольник с валентными углами 120°, все связи С-С равноценны (0, 140 нм) и все атомы углерода sp 2 -гибридизованы; все связи С-С и С-Н лежат в одной плоскости
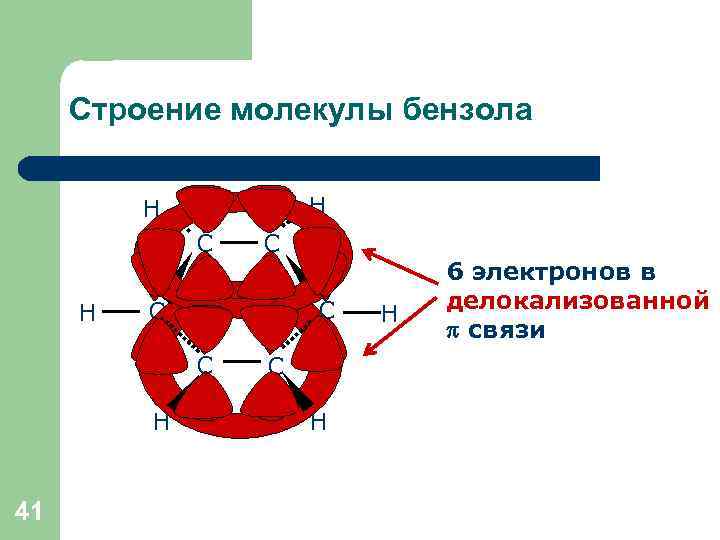 Строение молекулы бензола H H C C C H 41 C C H H 6 электронов в делокализованной связи
Строение молекулы бензола H H C C C H 41 C C H H 6 электронов в делокализованной связи
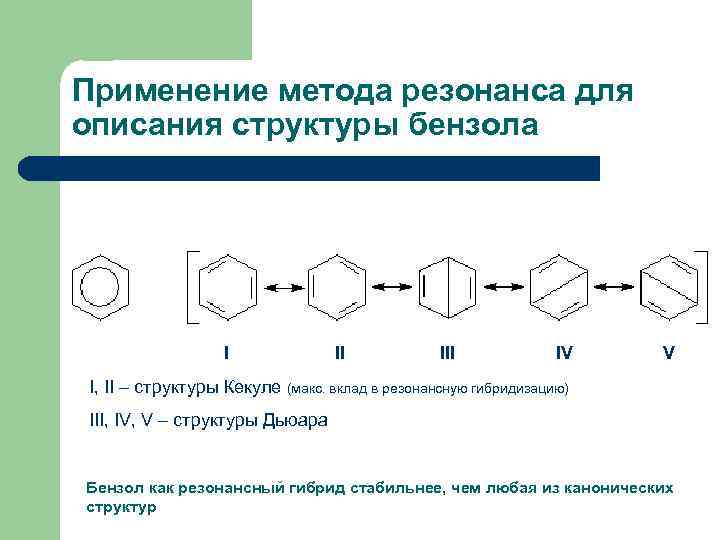 Применение метода резонанса для описания структуры бензола I II IV V I, II – структуры Кекуле (макс. вклад в резонансную гибридизацию) III, IV, V – структуры Дьюара Бензол как резонансный гибрид стабильнее, чем любая из канонических структур
Применение метода резонанса для описания структуры бензола I II IV V I, II – структуры Кекуле (макс. вклад в резонансную гибридизацию) III, IV, V – структуры Дьюара Бензол как резонансный гибрид стабильнее, чем любая из канонических структур
 Правило Хюккеля ПЛОСКИЕ, МОНОЦИКЛИЧЕСКИЕ, СОПРЯЖЕННЫЕ углеводороды будут ароматическими, если цикл содержит (4 n+2) π – электронов
Правило Хюккеля ПЛОСКИЕ, МОНОЦИКЛИЧЕСКИЕ, СОПРЯЖЕННЫЕ углеводороды будут ароматическими, если цикл содержит (4 n+2) π – электронов
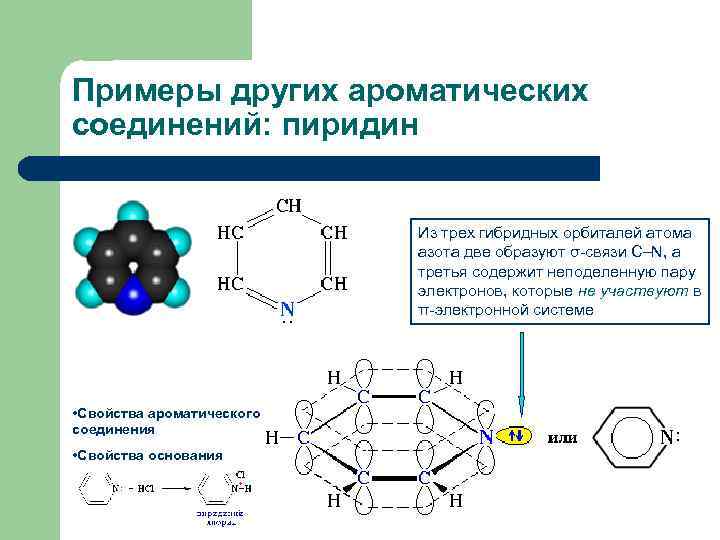 Примеры других ароматических соединений: пиридин Из трех гибридных орбиталей атома азота две образуют σ-связи С–N, а третья содержит неподеленную пару электронов, которые не участвуют в π-электронной системе • Свойства ароматического соединения • Свойства основания
Примеры других ароматических соединений: пиридин Из трех гибридных орбиталей атома азота две образуют σ-связи С–N, а третья содержит неподеленную пару электронов, которые не участвуют в π-электронной системе • Свойства ароматического соединения • Свойства основания
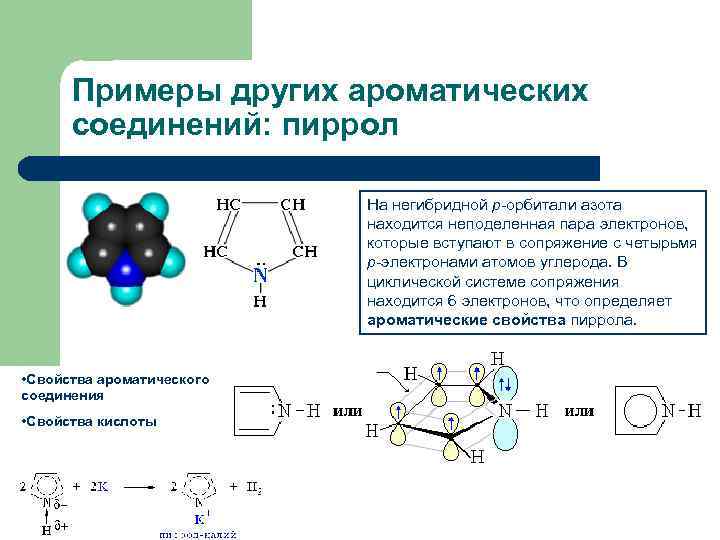 Примеры других ароматических соединений: пиррол На негибридной р-орбитали азота находится неподеленная пара электронов, которые вступают в сопряжение с четырьмя р-электронами атомов углерода. В циклической системе сопряжения находится 6 электронов, что определяет ароматические свойства пиррола. • Свойства ароматического соединения • Свойства кислоты
Примеры других ароматических соединений: пиррол На негибридной р-орбитали азота находится неподеленная пара электронов, которые вступают в сопряжение с четырьмя р-электронами атомов углерода. В циклической системе сопряжения находится 6 электронов, что определяет ароматические свойства пиррола. • Свойства ароматического соединения • Свойства кислоты
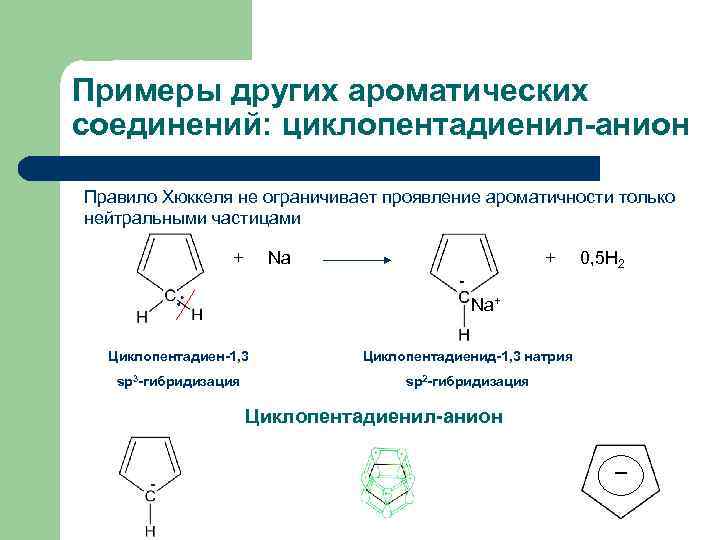 Примеры других ароматических соединений: циклопентадиенил-анион Правило Хюккеля не ограничивает проявление ароматичности только нейтральными частицами + Na + - : Na+ Циклопентадиен-1, 3 Циклопентадиенид-1, 3 натрия sp 3 -гибридизация sp 2 -гибридизация Циклопентадиенил-анион - 0, 5 H 2
Примеры других ароматических соединений: циклопентадиенил-анион Правило Хюккеля не ограничивает проявление ароматичности только нейтральными частицами + Na + - : Na+ Циклопентадиен-1, 3 Циклопентадиенид-1, 3 натрия sp 3 -гибридизация sp 2 -гибридизация Циклопентадиенил-анион - 0, 5 H 2
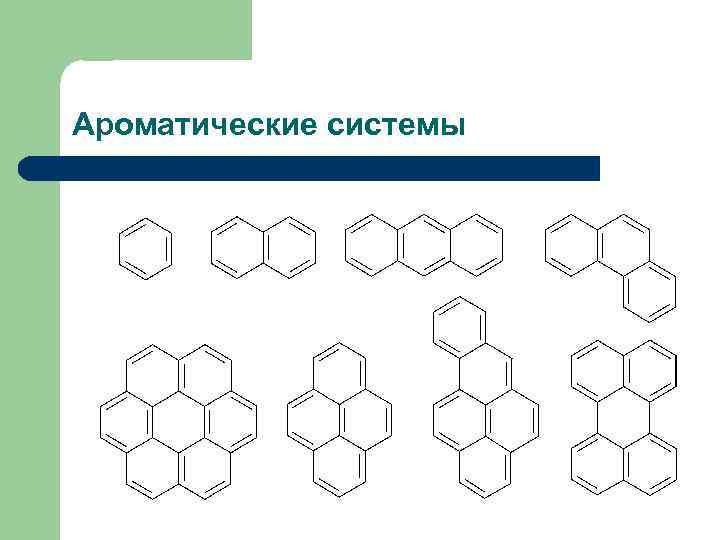 Ароматические системы
Ароматические системы
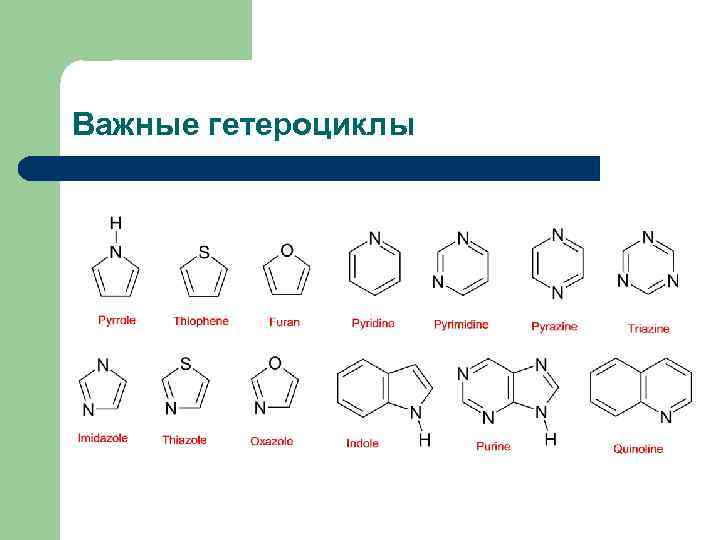 Важные гетероциклы
Важные гетероциклы
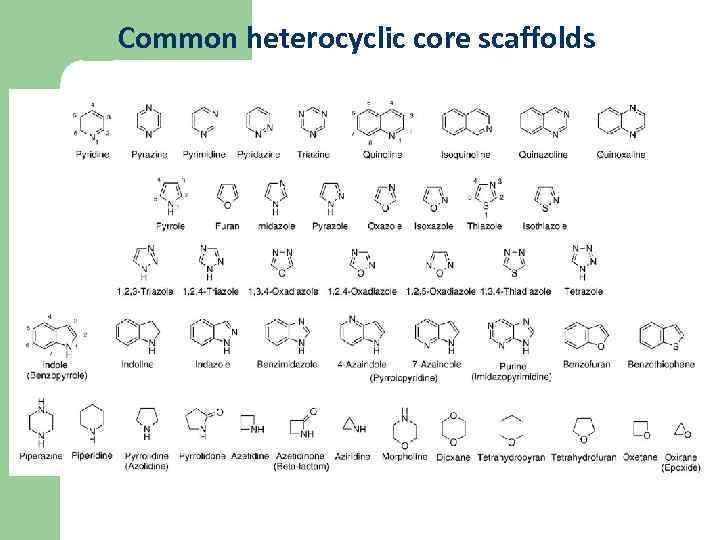 Common heterocyclic core scaffolds
Common heterocyclic core scaffolds
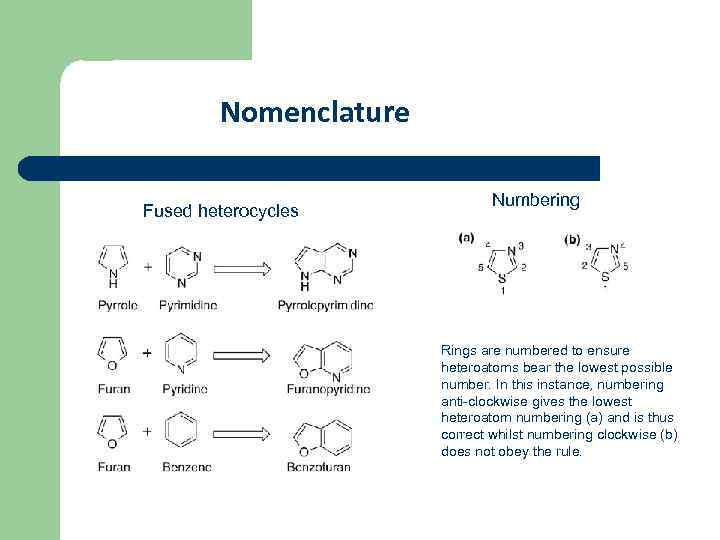 Nomenclature Fused heterocycles Numbering Rings are numbered to ensure heteroatoms bear the lowest possible number. In this instance, numbering anti-clockwise gives the lowest heteroatom numbering (a) and is thus correct whilst numbering clockwise (b) does not obey the rule.
Nomenclature Fused heterocycles Numbering Rings are numbered to ensure heteroatoms bear the lowest possible number. In this instance, numbering anti-clockwise gives the lowest heteroatom numbering (a) and is thus correct whilst numbering clockwise (b) does not obey the rule.
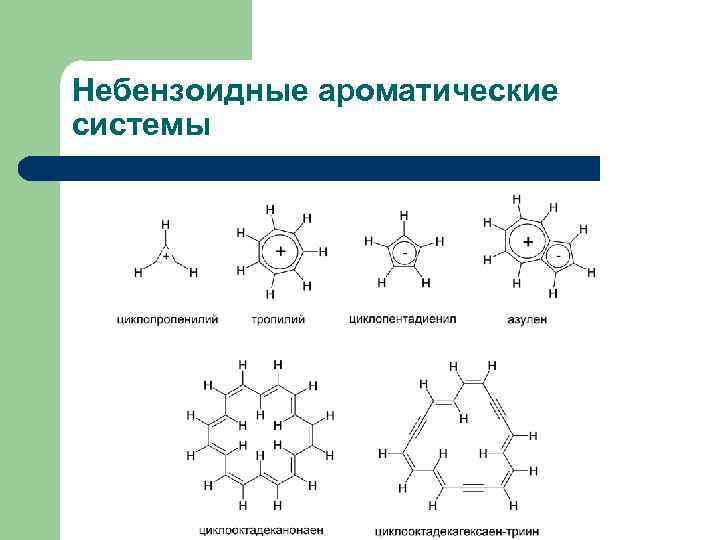 Небензоидные ароматические системы
Небензоидные ароматические системы
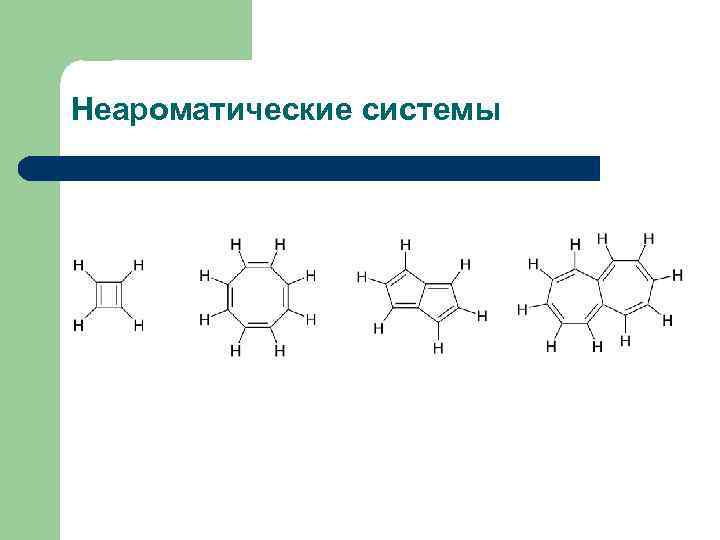 Неароматические системы
Неароматические системы
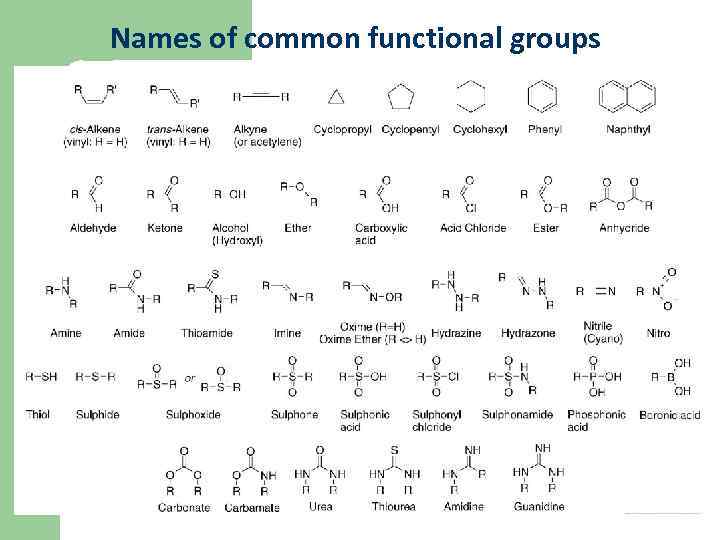 Names of common functional groups
Names of common functional groups


