Лекция 9-2012(ОВР1).ppt
- Количество слайдов: 15
 Окислительновосстановительные реакции в анализе 1. Применение ред-окс процессов в анализе. 2. Стандартные редокс-потенциалы. 3. Реальные (формальные)редокс-потенциалы. 4. Факторы, влияющие на величину потенциала: а) р. Н раствора б) комплексообразование в) концентрация 5. Константа ред-окс реакции.
Окислительновосстановительные реакции в анализе 1. Применение ред-окс процессов в анализе. 2. Стандартные редокс-потенциалы. 3. Реальные (формальные)редокс-потенциалы. 4. Факторы, влияющие на величину потенциала: а) р. Н раствора б) комплексообразование в) концентрация 5. Константа ред-окс реакции.
 Применение окислительновосстановительных реакций (ОВР) в анализе На проведении ОВР основаны: • разложение анализируемых материалов (растворение сплавов в азотной кислоте и т. п. ); • предварительное окисление или восстановление определяемого вещества; • маскирование мешающих компонентов путем их перевода в другую степень окисления; • некоторые реакции обнаружения в качественном анализе; • редоксметрические методы (перманганатометрия, иодометрия, хроматометрия и др. ); • многие электрохимические методы анализа (вольтамперометрия, кулонометрия, электрогравиметрия, разделение смесей путем электролиза при контролируемом потенциале).
Применение окислительновосстановительных реакций (ОВР) в анализе На проведении ОВР основаны: • разложение анализируемых материалов (растворение сплавов в азотной кислоте и т. п. ); • предварительное окисление или восстановление определяемого вещества; • маскирование мешающих компонентов путем их перевода в другую степень окисления; • некоторые реакции обнаружения в качественном анализе; • редоксметрические методы (перманганатометрия, иодометрия, хроматометрия и др. ); • многие электрохимические методы анализа (вольтамперометрия, кулонометрия, электрогравиметрия, разделение смесей путем электролиза при контролируемом потенциале).
 Полуреакции и их ред-окс потенциалы Окислительно-восстановительные реакции – это реакции переноса электронов Любая ОВР может быть представлена в общем виде: n e- Ox 1 + Red 2 Red 1 + Ox 2 В ОВР одновременно протекают две полуреакции Ох1 + n 1 e Red 1 Ох2 + n 2 e Red 2 Важно знать, в какую сторону смещено равновесие
Полуреакции и их ред-окс потенциалы Окислительно-восстановительные реакции – это реакции переноса электронов Любая ОВР может быть представлена в общем виде: n e- Ox 1 + Red 2 Red 1 + Ox 2 В ОВР одновременно протекают две полуреакции Ох1 + n 1 e Red 1 Ох2 + n 2 e Red 2 Важно знать, в какую сторону смещено равновесие
 Количественной характеристикой сродства электронов к окисленной форме любой ред-окс системы является ее окислительновосстановительный потенциал (редокс-потенциал, Е) 1. Редокс-потенциал– важнейшая теоретическая характеристика химического процесса 2. Редокс-потенциал характеризует определенный процесс, систему из окисленной и восстановленной форм 3. Редокс-потенциал измеряют относительно системы 2 Н + +2 е- = Н 2 потенциал которой принимают равным нулю, Е (Н+/н 2) = 0, 0 в 4. Редокс-потенциал, измеренный в стандартных условиях, называется стандартным, Е 0
Количественной характеристикой сродства электронов к окисленной форме любой ред-окс системы является ее окислительновосстановительный потенциал (редокс-потенциал, Е) 1. Редокс-потенциал– важнейшая теоретическая характеристика химического процесса 2. Редокс-потенциал характеризует определенный процесс, систему из окисленной и восстановленной форм 3. Редокс-потенциал измеряют относительно системы 2 Н + +2 е- = Н 2 потенциал которой принимают равным нулю, Е (Н+/н 2) = 0, 0 в 4. Редокс-потенциал, измеренный в стандартных условиях, называется стандартным, Е 0
 Измерение ред-окс потенциалов __ 0 Fe+3 + e. Cu+2 + 2 e- Pt H 2 1 M H+ Zn Cu Pt Fe+2 Cu 0 Zn+2 + 2 e- Zn 0 1 M Fe+2 1 M М +3 1 Fe Zn Сu+2 Стандартные условия: Температура – 250 С Ионная сила раствора = 0 Активности Ох и Red форм = 1 м E 0 = 0, 77 B E 0 = 0, 52 B E 0 = - 0, 76 B
Измерение ред-окс потенциалов __ 0 Fe+3 + e. Cu+2 + 2 e- Pt H 2 1 M H+ Zn Cu Pt Fe+2 Cu 0 Zn+2 + 2 e- Zn 0 1 M Fe+2 1 M М +3 1 Fe Zn Сu+2 Стандартные условия: Температура – 250 С Ионная сила раствора = 0 Активности Ох и Red форм = 1 м E 0 = 0, 77 B E 0 = 0, 52 B E 0 = - 0, 76 B
 5. Система с более высоким потенциалом может окислять любую систему с более низким потенциалом. При этом окисленная форма из системы с большим потенциалом реагирует с восстановленной формой из системы с меньшим потенциалом Ох 1 + n 1 e Red 1 Е 0 1 Ох 2 + n 2 e Red 2 Е 0 2 Пример Е 01 > Е 02 2 e- 2 Fe+2 + I 2 = 2 Fe+3 + 2 I- Fe +3 + e- = Fe+2 E 0 = 0, 77 B I 2 + 2 e- = 2 I- E 0 = 0, 55 B
5. Система с более высоким потенциалом может окислять любую систему с более низким потенциалом. При этом окисленная форма из системы с большим потенциалом реагирует с восстановленной формой из системы с меньшим потенциалом Ох 1 + n 1 e Red 1 Е 0 1 Ох 2 + n 2 e Red 2 Е 0 2 Пример Е 01 > Е 02 2 e- 2 Fe+2 + I 2 = 2 Fe+3 + 2 I- Fe +3 + e- = Fe+2 E 0 = 0, 77 B I 2 + 2 e- = 2 I- E 0 = 0, 55 B
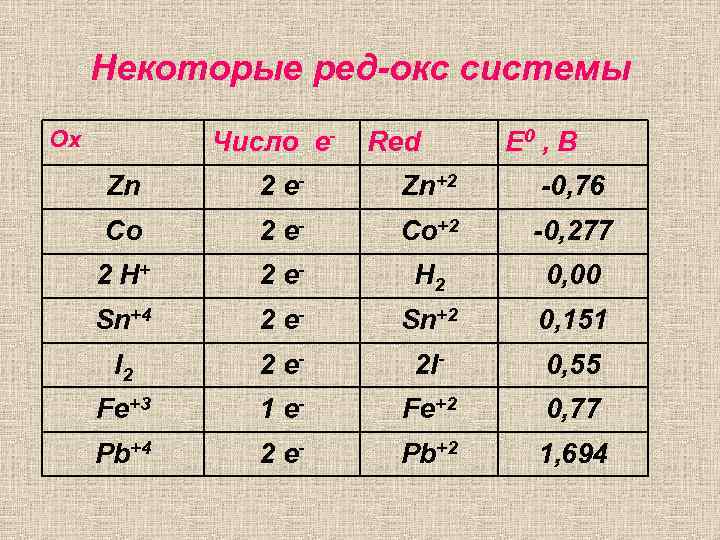 Некоторые ред-окс системы Ox Число е- Red Е 0 , В Zn 2 e- Zn+2 -0, 76 Co 2 e- Co+2 -0, 277 2 H+ 2 e- H 2 0, 00 Sn+4 2 e- Sn+2 0, 151 I 2 2 e- 2 I- 0, 55 Fe+3 1 e- Fe+2 0, 77 Pb+4 2 e- Pb+2 1, 694
Некоторые ред-окс системы Ox Число е- Red Е 0 , В Zn 2 e- Zn+2 -0, 76 Co 2 e- Co+2 -0, 277 2 H+ 2 e- H 2 0, 00 Sn+4 2 e- Sn+2 0, 151 I 2 2 e- 2 I- 0, 55 Fe+3 1 e- Fe+2 0, 77 Pb+4 2 e- Pb+2 1, 694
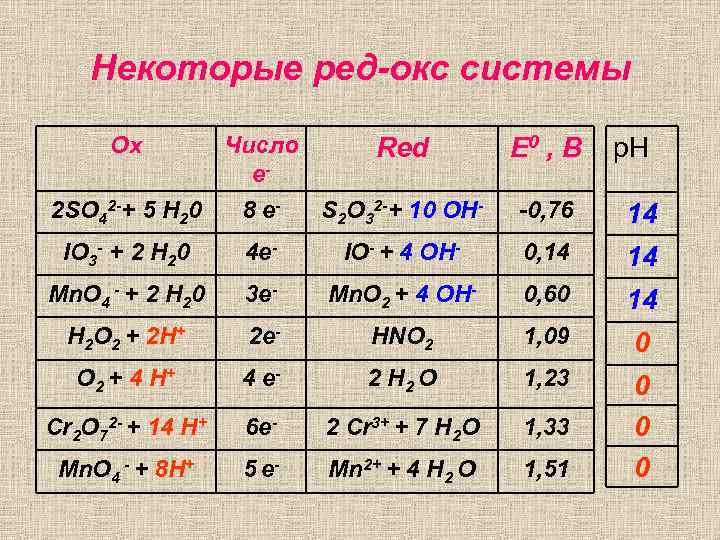 Некоторые ред-окс системы Ox Число е- Red Е 0 , В 2 SO 42 -+ 5 H 20 8 e- S 2 O 32 -+ 10 OH- -0, 76 14 IO 3 - + 2 H 20 4 e- IO- + 4 OH- 0, 14 14 Mn. O 4 - + 2 H 20 3 e- Mn. O 2 + 4 OH- 0, 60 14 H 2 O 2 + 2 H+ 2 e- HNO 2 1, 09 0 O 2 + 4 H + 4 e- 2 H 2 O 1, 23 Cr 2 O 72 - + 14 H+ 6 e- 2 Cr 3+ + 7 H 2 O 1, 33 Mn. O 4 - + 8 H+ 5 e- Mn 2+ + 4 H 2 O 1, 51 0 0 0 p. H
Некоторые ред-окс системы Ox Число е- Red Е 0 , В 2 SO 42 -+ 5 H 20 8 e- S 2 O 32 -+ 10 OH- -0, 76 14 IO 3 - + 2 H 20 4 e- IO- + 4 OH- 0, 14 14 Mn. O 4 - + 2 H 20 3 e- Mn. O 2 + 4 OH- 0, 60 14 H 2 O 2 + 2 H+ 2 e- HNO 2 1, 09 0 O 2 + 4 H + 4 e- 2 H 2 O 1, 23 Cr 2 O 72 - + 14 H+ 6 e- 2 Cr 3+ + 7 H 2 O 1, 33 Mn. O 4 - + 8 H+ 5 e- Mn 2+ + 4 H 2 O 1, 51 0 0 0 p. H
 Уравнение Нернста R – универсальная газовая постоянная Т - температура n- число электронов F – число Фарадея (1) [Red], [Ox] – равновесные концентрации всех частиц, участвующих в ОВР
Уравнение Нернста R – универсальная газовая постоянная Т - температура n- число электронов F – число Фарадея (1) [Red], [Ox] – равновесные концентрации всех частиц, участвующих в ОВР
 В условиях, отличных от стандартных, окислительно-восстановительные свойства веществ характеризуют с помощью формальных потенциалов (Е 0/) Формальный (кажущийся, реальный) потенциал – потенциал, измеренный в условиях, отличных от стандартных (при любом значении р. Н, в присутствии посторонних веществ и т. п. ), при этом концентрации окисленной и восстановленной форм равны 1 моль/л
В условиях, отличных от стандартных, окислительно-восстановительные свойства веществ характеризуют с помощью формальных потенциалов (Е 0/) Формальный (кажущийся, реальный) потенциал – потенциал, измеренный в условиях, отличных от стандартных (при любом значении р. Н, в присутствии посторонних веществ и т. п. ), при этом концентрации окисленной и восстановленной форм равны 1 моль/л
 Факторы, влияющие на потенциал Влияние р. Н раствора ( на примере окислителей) Ox + m H++ n e- = Red + m/2 H 2 O =0 (2)
Факторы, влияющие на потенциал Влияние р. Н раствора ( на примере окислителей) Ox + m H++ n e- = Red + m/2 H 2 O =0 (2)
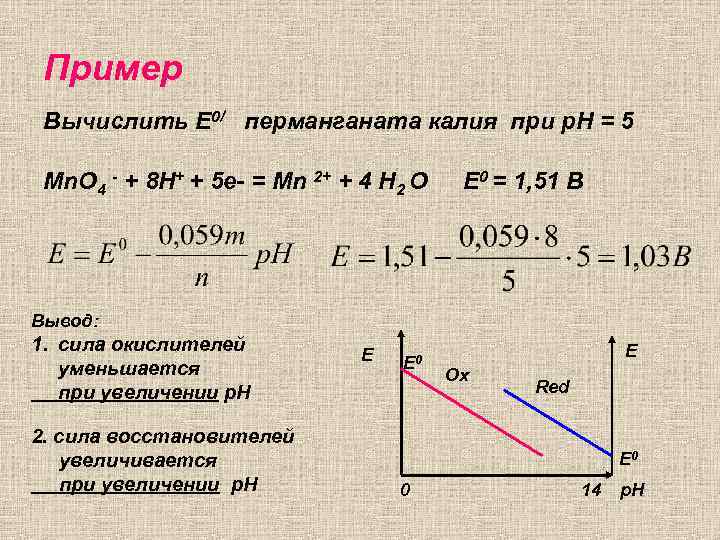 Пример Вычислить E 0/ перманганата калия при p. H = 5 Mn. O 4 - + 8 H+ + 5 e- = Mn 2+ + 4 H 2 O Е 0 = 1, 51 В Вывод: 1. сила окислителей уменьшается при увеличении р. Н 2. сила восстановителей увеличивается при увеличении р. Н Е Е 0 Е Ох Red Е 0 0 14 p. H
Пример Вычислить E 0/ перманганата калия при p. H = 5 Mn. O 4 - + 8 H+ + 5 e- = Mn 2+ + 4 H 2 O Е 0 = 1, 51 В Вывод: 1. сила окислителей уменьшается при увеличении р. Н 2. сила восстановителей увеличивается при увеличении р. Н Е Е 0 Е Ох Red Е 0 0 14 p. H
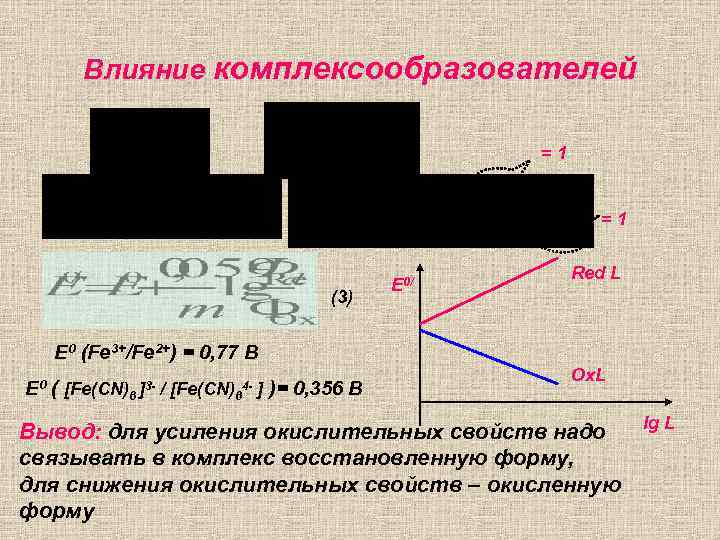 Влияние комплексообразователей =1 =1 (3) E 0/ Red L E 0 (Fe 3+/Fe 2+) = 0, 77 B E 0 ( [Fe(CN)6 ]3 - / [Fe(CN)64 - ] )= 0, 356 B Ox. L Вывод: для усиления окислительных свойств надо связывать в комплекс восстановленную форму, для снижения окислительных свойств – окисленную форму lg L
Влияние комплексообразователей =1 =1 (3) E 0/ Red L E 0 (Fe 3+/Fe 2+) = 0, 77 B E 0 ( [Fe(CN)6 ]3 - / [Fe(CN)64 - ] )= 0, 356 B Ox. L Вывод: для усиления окислительных свойств надо связывать в комплекс восстановленную форму, для снижения окислительных свойств – окисленную форму lg L
![Влияние концентрации Увеличение концентрации [Ох] увеличивает, а увеличение концентрации [Red] снижает потенциал системы Пример Влияние концентрации Увеличение концентрации [Ох] увеличивает, а увеличение концентрации [Red] снижает потенциал системы Пример](https://present5.com/presentation/8401469_132692746/image-14.jpg) Влияние концентрации Увеличение концентрации [Ох] увеличивает, а увеличение концентрации [Red] снижает потенциал системы Пример Вычислить потенциал платинового электрода, опущенного в раствор, в котором С (Fe 3+) = 0, 1 моль/л, а С (Fe 2+) =0, 5 моль/л E 0 (Fe 3+/Fe 2+) = 0, 77 B
Влияние концентрации Увеличение концентрации [Ох] увеличивает, а увеличение концентрации [Red] снижает потенциал системы Пример Вычислить потенциал платинового электрода, опущенного в раствор, в котором С (Fe 3+) = 0, 1 моль/л, а С (Fe 2+) =0, 5 моль/л E 0 (Fe 3+/Fe 2+) = 0, 77 B
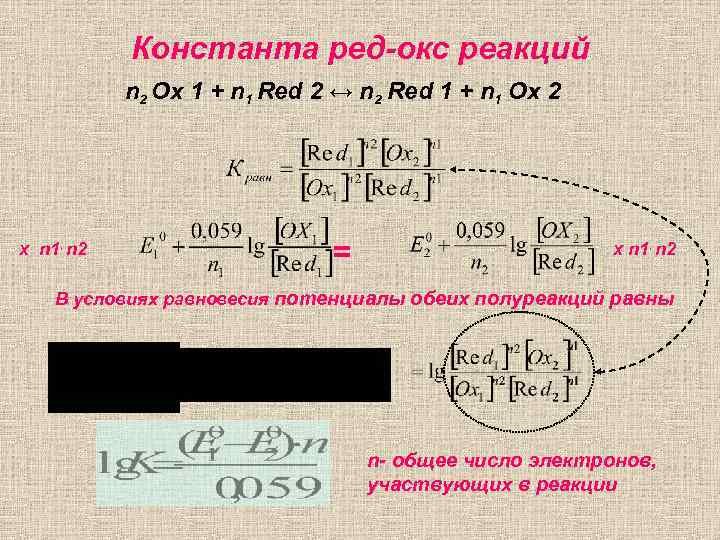 Константа ред-окс реакций n 2 Ox 1 + n 1 Red 2 ↔ n 2 Red 1 + n 1 Ox 2 Х n 1. n 2 = Х n 1. n 2 В условиях равновесия потенциалы обеих полуреакций равны n- общее число электронов, участвующих в реакции
Константа ред-окс реакций n 2 Ox 1 + n 1 Red 2 ↔ n 2 Red 1 + n 1 Ox 2 Х n 1. n 2 = Х n 1. n 2 В условиях равновесия потенциалы обеих полуреакций равны n- общее число электронов, участвующих в реакции


