Lektsia_N11_Okislitelno-vosstanovitelnye_reak.ppt
- Количество слайдов: 26

Окислительновосстановительные реакции Профессор Рыбальченко В. С.
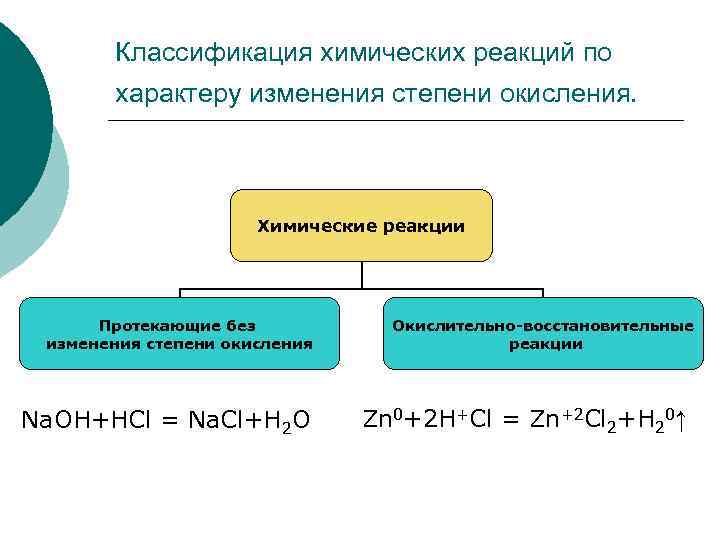
Классификация химических реакций по характеру изменения степени окисления. Химические реакции Протекающие без изменения степени окисления Na. OH+HCl = Na. Cl+H 2 O Окислительно-восстановительные реакции Zn 0+2 H+Cl = Zn+2 Cl 2+H 20↑

Окислительновосстановительные реакции это реакции, протекающие с изменением степени окисления атомов, входящих в состав молекул реагирующих веществ. Cтепень окисления -это условный заряд атома в молекуле, возникающий исходя из предположения, что электроны не смещены, а полностью отданы атому более электроотрицательного элемента.

Правила для нахождения степени окисления. ¡ Степень окисления атомов элементов в молекулах простых веществ равна нулю. Например: Н 20, О 20, Mg 0, Cu 0 H-H Н: Н

Правила для нахождения степени окисления. ¡ Степень окисления атомов водорода в соединениях обычно равна +1. Например: H+1 Cl, H 2+1 S исключения: в гидридах cтепень окисления атомов водорода равна – 1. Например: : Ca. H 2 -1, Na. H-1

Правила для нахождения степени окисления (продолжение). ¡ Степень окисления атомов кислорода в соединениях обычно равна – 2. Например: Н 2 О-2, Са. О-2 исключения: степень окисления кислорода во фториде кислорода ( OF 2 ) равна +2. F ← O+2 → F в пероксидах (Н 2 О 2, Na 2 O 2) степень окисления кислорода равна – 1. Н-О-О-Н H+1→О-1 – О-1 ← Н+1

Правила для нахождения степени окисления (продолжение). ¡ Степень окисления металлов в соединениях обычно положительна. Например: Сu+2 SO 4 ¡ Степень окисления неметаллов может быть и отрицательной, и положительной. Например: HCl ¡ -1, HCl. O ( H+1→O-2←Cl+1) Сумма cтепеней окисления всех атомов в молекуле равна 0.

ОПРЕДЕЛИТЬ СТЕПЕНИ ОКИСЛЕНИЯ ВСЕХ АТОМОВ В ЧАСТИЦАХ: KMn. O 4 K+1 Mn O-24 (+1 + X – 8) = 0 X=7 K+1 Mn+7 O-24 (SO 3)2 - → H 2 SO 3 ( +1∙ 2 + X + -2∙ 3) = 0 x = +4 H 2+1 S+4 O 3 -2

Процессы окисления и восстановления p Окисление – это процесс отдачи электронов атомом, молекулой или ионом, при этом степень окисления повышается, а вещество является восстановителем. Na 0 – 1 e- → Na+1 (процесс окисления) p восстановление – это процесс присоединения электронов, при этом степень окисления понижается, а вещество является окислителем. Cl 0 + 1 e- → Cl-1 (процесс восстановления)

Окислители и восстановители. Окислитель - вещество, которое принимает электроны. При этом оно восстанавливается (степень окисления элемента понижается). ¡ Восстановитель – вещество, которое отдает электроны. При этом оно окисляется (степень окисления элемента понижается). ¡

Типичные окислители и восстановители. ¡ ОКИСЛИТЕЛИ: - простые вещества: галогены (F 2, CI 2, Br 2, J 2), халькогены (О 2, О 3, S) сложные вещества: HNO 3, H 2 SO 4, K 2 Mn. O 4, K 2 Cr 2 O 7, K 2 Cr. O 4, Mn. O 2, Pb. O 2, KCIO 3 - -

Типичные окислители и восстановители. ¡ - ВОССТАНОВИТЕЛИ: простые вещества: металлы (Na, Mg, Zn, Al, Fe) неметаллы - (Н 2, С, S) сложные вещества: H 2 S и сульфиды (Na 2 S), сульфиты (Na 2 SO 3), галогеноводороды (HCI, HBr, HJ).
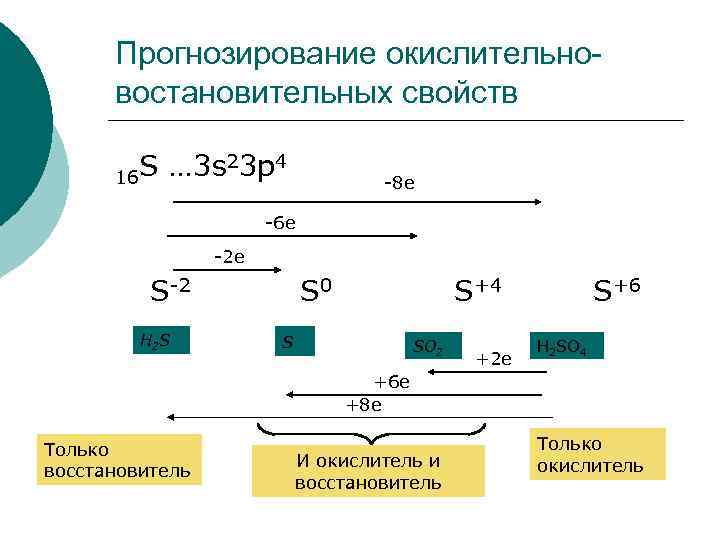
Прогнозирование окислительновостановительных свойств S … 3 s 23 p 4 16 -8 e -6 e -2 e S-2 H 2 S S 0 S+4 S SO 2 +2 e S+6 H 2 SO 4 +6 e +8 e Только восстановитель И окислитель и восстановитель Только окислитель

Составление уравнений ОВР Существуют два метода составления уравнений окислительновосстановительных реакций: ¡ ¡ метод электронного баланса; метод полуреакций (электронно-ионный метод).

Составление уравнений ОВР методом электронного баланса. q Записывают схему реакции (реагенты и продукты реакции): P + HNO 3 → H 3 PO 4 + NO q Определяют степени окисления у элементов, изменяющих ее: 0 +5 +5 -2 P + HNO 3 → H 3 PO 4 + NO

Составление уравнений ОВР Составляют схему электронного баланса, указывают процессы окисления и восстановления (окислитель и восстановитель) q P 0 - 5 e → P+5 окисление, восстановитель N+5 +3 e → N+2 восстановление, окислитель

Составление уравнений ОВР q Oпределяют коэффициенты при восстановителе и окислителе и переносят их в схему реакции. 3 P 0 - 5 e → P+5 5 N+5 + 3 e → N+2 восстановление, окисление, восстановитель окислитель 3 P + 5 HNO 3 → 3 H 3 PO 4 + 5 NO

Составление уравнений ОВР q Далее находят коэффициенты для формул всех остальных веществ. q Если водород и кислород не меняет своих степеней окисления, то их количество подсчитывают в последнюю очередь и добавляют нужное количество молекул воды в левую или правую часть уравнения. 3 P + 5 HNO 3 + 2 H 20 = 3 H 3 PO 4 + 5 NO

КЛАССИФИКАЦИЯ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ ¡ межмолекулярного окисления – восстановления ¡ внутримолекулярного окисления – восстановления ¡ самоокисления – самовосстановления (диспропорционирования)

Реакции межмолекулярного окисления – восстановления ¡ Окислитель и восстановитель входят в состав различных молекул. Например: 0 +2 +4 С + 2 Cu. O = CO 2 + 2 Сu 0 Восстановитель Окислитель

Реакции внутримолекулярного окисления – восстановления ¡ Окислитель и восстановитель входят в состав одной молекулы (и представлены разными элементами, либо одним элементом, но с разными степенями окисления) +5 -2 -1 0 2 KCIO 3 = KCI + 3 O 2 Окислитель Восстановитель -3 +3 0 t NH 4 NO 2 = N 2 + 2 H 2 O

Опыт: термическое разложение бихромата аммония -3 +6 (NH 4)2 Cr 2 O 7 → t +3 0 Cr 203 + N 2 + 4 H 2 O 6 2 N-3 - 6 e → N 2 o 6 2 Сr+6 +6 e → 2 Cr+3 восстановление, ок-ль окисление, восстановитель


Реакции самоокисления – самовосстановления (диспропорционирования). ¡ при протекании этих реакций происходит и повышение и понижение степени окисления одного и того же элемента. Например: CI 20 + H 2 O = HCI-1 + HCI+1 O Cl 0 +1 e → Cl- восстановление, окислитель Cl 0 - 1 e → Cl+ окисление, восстановитель
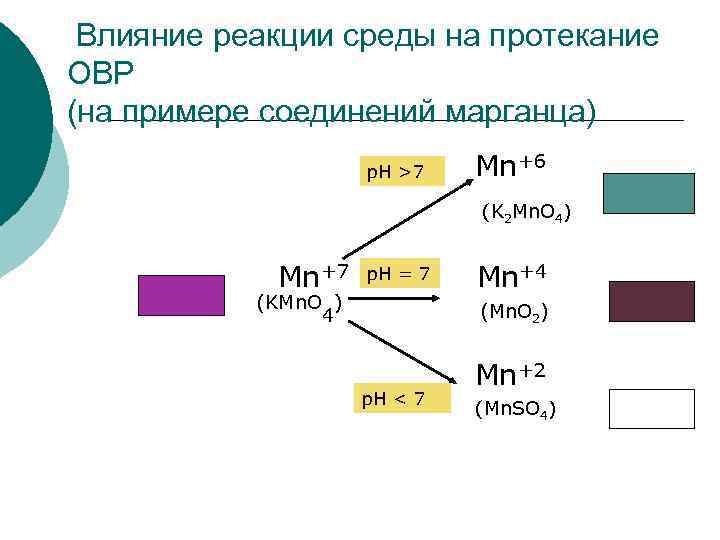
Влияние реакции среды на протекание ОВР (на примере соединений марганца) p. H >7 Mn+6 (K 2 Mn. O 4) Mn+7 p. H = 7 (KMn. O ) 4 Mn+4 (Mn. O 2) p. H < 7 Mn+2 (Mn. SO 4)

Опыт. Влияние реакции среды на протекание ОВР ¡ КMn. O 4 + Na 2 SO 3 + KOH → K 2 Mn. O 4 + Na 2 SO 4 + H 2 O зеленый ¡ КMn. O 4 + Na 2 SO 3 + H 2 O → Mn. O 2 + Na 2 SO 4 + KOH бурый ¡ КMn. O 4 + Na 2 SO 3 + H 2 SO 4 → Mn. SO 4 + Na 2 SO 4 + H 2 O бесцветный
Lektsia_N11_Okislitelno-vosstanovitelnye_reak.ppt