Лекция 3 - ОВР.ppt
- Количество слайдов: 22
 ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР) 1
ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР) 1

 Степень окисления простых веществ равна нулю: Н 20, Cl 20, S 0, Са 0 Ион водорода H в соединениях чаще +Cl, H +S всего +1: H 2 но в соединениях с металлами – (гидридах) – 1: Ca. H 2 3
Степень окисления простых веществ равна нулю: Н 20, Cl 20, S 0, Са 0 Ион водорода H в соединениях чаще +Cl, H +S всего +1: H 2 но в соединениях с металлами – (гидридах) – 1: Ca. H 2 3
 Кислород О– 2 чаще всего – 2 (кроме H 2 O 2, здесь кислород – 1) Постоянную степень окисления имеют: • атомы щелочных металлов в соединениях +1 (1 группа). • атомы щелочноземельных металлов в соединениях +2 (2 группа в таблице Менделеева).
Кислород О– 2 чаще всего – 2 (кроме H 2 O 2, здесь кислород – 1) Постоянную степень окисления имеют: • атомы щелочных металлов в соединениях +1 (1 группа). • атомы щелочноземельных металлов в соединениях +2 (2 группа в таблице Менделеева).
 +1 N+ХO K +1+Х + (– 2)3 = 0 Х = +5 +ХO (N – ) +Х + (– 2)3 = – 1 Х = +5
+1 N+ХO K +1+Х + (– 2)3 = 0 Х = +5 +ХO (N – ) +Х + (– 2)3 = – 1 Х = +5
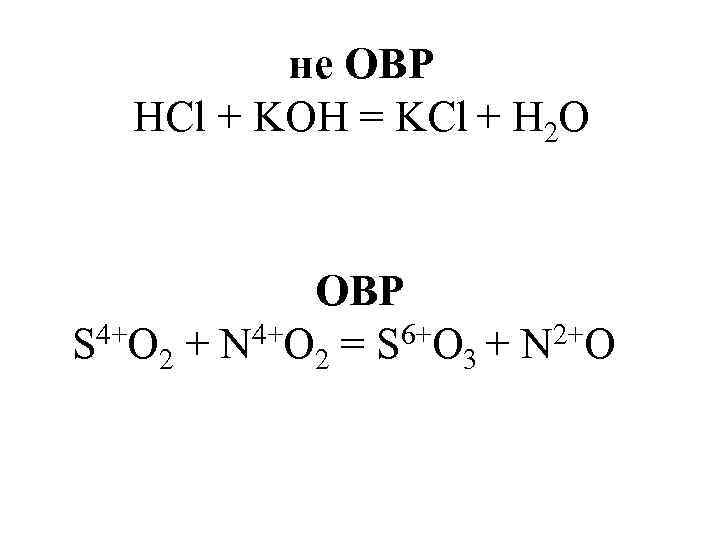 не ОВР HCl + KOH = KCl + H 2 O ОВР S 4+O 2 + N 4+O 2 = S 6+O 3 + N 2+O
не ОВР HCl + KOH = KCl + H 2 O ОВР S 4+O 2 + N 4+O 2 = S 6+O 3 + N 2+O
 Окисление – процесс отдачи электронов реагирующей частицей (молекула, атом, ион), при которой степень окисления элемента повышается. Ca 0 – 2 e → Ca+2 Восстановление – процесс принятия электронов реагирующей частицей, при которой степень окисления элемента понижается. Al+3 + 3 e → Al 0 7
Окисление – процесс отдачи электронов реагирующей частицей (молекула, атом, ион), при которой степень окисления элемента повышается. Ca 0 – 2 e → Ca+2 Восстановление – процесс принятия электронов реагирующей частицей, при которой степень окисления элемента понижается. Al+3 + 3 e → Al 0 7
 Процесс окисления: Восстановитель N 0 – 3 e → N+3 Процесс восстановления: Окислитель N 0 + 3 e → N 3– Восстановители: H, Me, элементы в низшей степени окисления (Na 2 S 2–). Окислители: элементы в высшей степени окисления (KMn 7+O 4).
Процесс окисления: Восстановитель N 0 – 3 e → N+3 Процесс восстановления: Окислитель N 0 + 3 e → N 3– Восстановители: H, Me, элементы в низшей степени окисления (Na 2 S 2–). Окислители: элементы в высшей степени окисления (KMn 7+O 4).
 Типы ОВР 1. Межмолекулярная ОВР Mn 4+O 2+4 HBr 1– = Mn 2+Br 20+2 H 2 O ок-ль в-ль 2 Сa 0 + O 20 = 2 Ca 2+O 2– Окислитель и восстановитель входят в состав разных молекул. 9
Типы ОВР 1. Межмолекулярная ОВР Mn 4+O 2+4 HBr 1– = Mn 2+Br 20+2 H 2 O ок-ль в-ль 2 Сa 0 + O 20 = 2 Ca 2+O 2– Окислитель и восстановитель входят в состав разных молекул. 9
 2. Внутримолекулярная ОВР 2 KCl 5+O ок-ль = 2 KCl 1– + 3 O в-ль Окислитель и восстановитель – разные элементы, но входят в состав одной молекулы. 10
2. Внутримолекулярная ОВР 2 KCl 5+O ок-ль = 2 KCl 1– + 3 O в-ль Окислитель и восстановитель – разные элементы, но входят в состав одной молекулы. 10
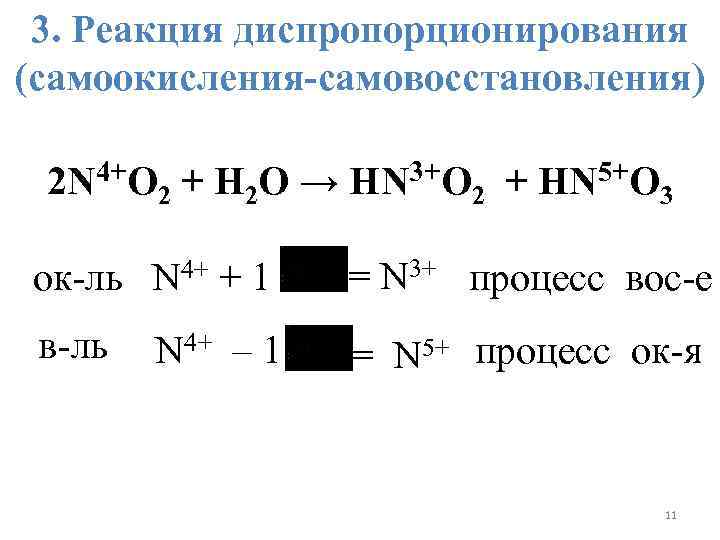 3. Реакция диспропорционирования (самоокисления-самовосстановления) 2 N 4+O 2 + H 2 O → HN 3+O 2 + HN 5+O 3 ок-ль N 4+ + 1 = N 3+ процесс вос-е в-ль = N 5+ процесс ок-я N 4+ – 1 11
3. Реакция диспропорционирования (самоокисления-самовосстановления) 2 N 4+O 2 + H 2 O → HN 3+O 2 + HN 5+O 3 ок-ль N 4+ + 1 = N 3+ процесс вос-е в-ль = N 5+ процесс ок-я N 4+ – 1 11
 Метод электронного баланса Fe. SO 4 + KCl. O 3 + H 2 SO 4 = = Fe 2(SO 4)3 + KCl + 3 H 2 O 1. Определяем элементы, меняющие степень окисления. Fe 2+SO 4 + KCl 5+O 3 + H 2 SO 4 = 3+(SO ) + KCl– + 3 H O = Fe 2 4 3 2
Метод электронного баланса Fe. SO 4 + KCl. O 3 + H 2 SO 4 = = Fe 2(SO 4)3 + KCl + 3 H 2 O 1. Определяем элементы, меняющие степень окисления. Fe 2+SO 4 + KCl 5+O 3 + H 2 SO 4 = 3+(SO ) + KCl– + 3 H O = Fe 2 4 3 2
 2. Составляем электронный баланс. в-ль Fe 2+ – 1 e = Fe 3+ 6 Cl 5+ ок-е – + 6 e = Cl 1 вос-е ок-ль 3. Из уравнения электронного баланса ставим коэффициенты. 6 Fe 2+SO 4 + KCl 5+O 3 + 3 H 2 SO 4 = 3+(SO ) + KCl– + 3 H O = 3 Fe 2 4 3 2 4. Уравниваем в порядке: Ме, не. Ме, Н 2, проверка по О. 39 O = 39 O
2. Составляем электронный баланс. в-ль Fe 2+ – 1 e = Fe 3+ 6 Cl 5+ ок-е – + 6 e = Cl 1 вос-е ок-ль 3. Из уравнения электронного баланса ставим коэффициенты. 6 Fe 2+SO 4 + KCl 5+O 3 + 3 H 2 SO 4 = 3+(SO ) + KCl– + 3 H O = 3 Fe 2 4 3 2 4. Уравниваем в порядке: Ме, не. Ме, Н 2, проверка по О. 39 O = 39 O
 Влияние среды на ОВР Перманганат калия KMn. O 4 1. Среда кислая 2 KMn 7+O 4 + 5 KN 3+O 2 + 3 H 2 SO 4 = = 2 Mn 2+SO 4 + 5 KN 5+O 3 + K 2 SO 4 + 3 H 2 O ок-ль в-ль Mn 7+ + 5 e = Mn 2+ 2 N 3+ – 2 e = 5+ N 30 O = 30 O 5 вос-е ок-е
Влияние среды на ОВР Перманганат калия KMn. O 4 1. Среда кислая 2 KMn 7+O 4 + 5 KN 3+O 2 + 3 H 2 SO 4 = = 2 Mn 2+SO 4 + 5 KN 5+O 3 + K 2 SO 4 + 3 H 2 O ок-ль в-ль Mn 7+ + 5 e = Mn 2+ 2 N 3+ – 2 e = 5+ N 30 O = 30 O 5 вос-е ок-е
 2. Среда нейтральная 2 KMn 7+O 4 + 3 KN 3+O 2 + H 2 O = = 2 Mn 4+O 2 + 3 KN 5+O 3 + 2 KOH ок-ль в-ль Mn 7+ + 3 e = Mn 4+ 2 N 3+ – 2 e = N 5+ 15 O = 15 O 3 вос-е ок-е
2. Среда нейтральная 2 KMn 7+O 4 + 3 KN 3+O 2 + H 2 O = = 2 Mn 4+O 2 + 3 KN 5+O 3 + 2 KOH ок-ль в-ль Mn 7+ + 3 e = Mn 4+ 2 N 3+ – 2 e = N 5+ 15 O = 15 O 3 вос-е ок-е
 3. Среда щелочная 2 KMn 7+O 4 + KN 3+O 2 + 2 KOH = = 2 K 2 Mn 6+O 4 + KN 5+O 3 + H 2 O ок-ль в-ль Mn 7+ + 1 e = Mn 6+ 2 N 3+ – 2 e = N 5+ 12 O = 12 O 1 вос-е ок-е
3. Среда щелочная 2 KMn 7+O 4 + KN 3+O 2 + 2 KOH = = 2 K 2 Mn 6+O 4 + KN 5+O 3 + H 2 O ок-ль в-ль Mn 7+ + 1 e = Mn 6+ 2 N 3+ – 2 e = N 5+ 12 O = 12 O 1 вос-е ок-е
 – перманганат-ион Mn. O 4 восстанавливается: кис. ион, бесцветный р-р нейтрал. оксид, бурый осадок щел. манганат-ион, зеленый р-р 17
– перманганат-ион Mn. O 4 восстанавливается: кис. ион, бесцветный р-р нейтрал. оксид, бурый осадок щел. манганат-ион, зеленый р-р 17
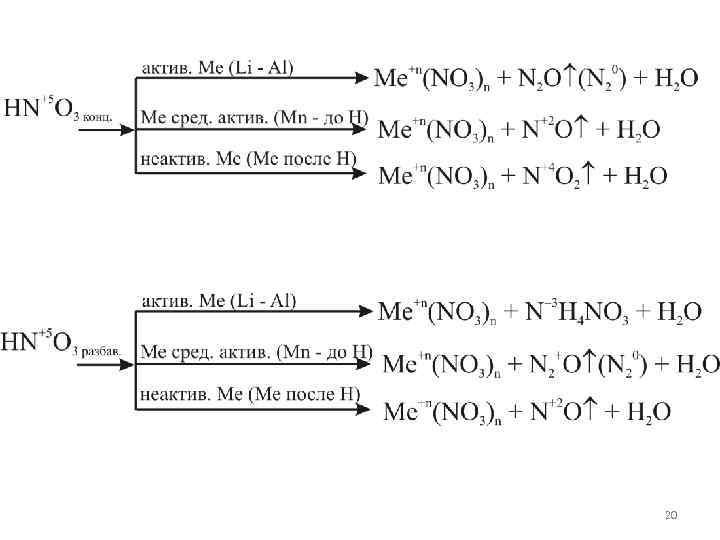
 Влияние концентрации кислоты на ОВР Азотная кислота HNO 3 1. Концентрированная азотная к-та Pb 0 + 4 HN 5+O 3(конц) = = Pb 2+(NO 3)2 + 2 N 4+O 2 + 2 H 2 O ок-ль N 5+ + 1 e = N 4+ 2 вос-е в-ль Pb 0 – 2 e = Pb 2+ 1 ок-е 12 O = 12 O 18
Влияние концентрации кислоты на ОВР Азотная кислота HNO 3 1. Концентрированная азотная к-та Pb 0 + 4 HN 5+O 3(конц) = = Pb 2+(NO 3)2 + 2 N 4+O 2 + 2 H 2 O ок-ль N 5+ + 1 e = N 4+ 2 вос-е в-ль Pb 0 – 2 e = Pb 2+ 1 ок-е 12 O = 12 O 18
 2. Разбавленная азотная к-та 3 Pb 0 + 8 HN 5+O 3(разб) = = 3 Pb 2+(NO 3)2 + 2 N 2+O + 4 H 2 O ок-ль N 5+ + 3 e = N 2+ в-ль Pb 0 – 2 e = 2+ Pb 2 вос-е 3 ок-е 24 O = 24 O 19
2. Разбавленная азотная к-та 3 Pb 0 + 8 HN 5+O 3(разб) = = 3 Pb 2+(NO 3)2 + 2 N 2+O + 4 H 2 O ок-ль N 5+ + 3 e = N 2+ в-ль Pb 0 – 2 e = 2+ Pb 2 вос-е 3 ок-е 24 O = 24 O 19
 20
20
 Серная кислота H 2 SO 4 Разбавленная серная кислота Mg + H 2 SO 4 Mg. SO 4 + H 2 21
Серная кислота H 2 SO 4 Разбавленная серная кислота Mg + H 2 SO 4 Mg. SO 4 + H 2 21
 Концентрированная серная кислота 22
Концентрированная серная кислота 22


