ОБЩАЯ 6 овр.pptx
- Количество слайдов: 13
 ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Лекция 5
ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Лекция 5
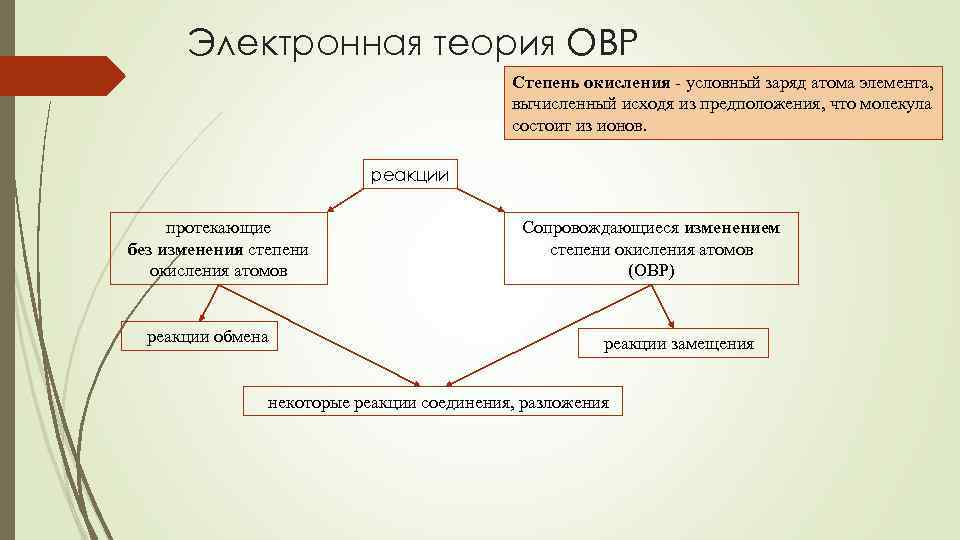 Электронная теория ОВР Степень окисления - условный заряд атома элемента, вычисленный исходя из предположения, что молекула состоит из ионов. реакции протекающие без изменения степени окисления атомов реакции обмена Сопровождающиеся изменением степени окисления атомов (ОВР) реакции замещения некоторые реакции соединения, разложения
Электронная теория ОВР Степень окисления - условный заряд атома элемента, вычисленный исходя из предположения, что молекула состоит из ионов. реакции протекающие без изменения степени окисления атомов реакции обмена Сопровождающиеся изменением степени окисления атомов (ОВР) реакции замещения некоторые реакции соединения, разложения
 Окисление – процесс отдачи электронов атомом, молекулой или ионом, ст. окисления при этом повышается. Ca – 2 e- = Ca+2 H 02 – 2 e- = 2 H+ Восстановление – процесс присоединения электронов атомом, молекулой, ионом. Ст. окисления при этом понижается. Fe+3 + e- = Fe 2+ Cl 02 + 2 e- = 2 Cl- - Окислители молекулы или ионы, присоединяющие электроны те простые вещества, элементы которых обладают высокой электроотрицательностью, т. е. неметаллы: F 2, O 2, Cl 2, Br 2, S и т. д. ионы металлов и водорода: Ag +, Au 3+, Cu 2+, H+, Fe 3+, и т. д. сложные вещества, которые содержат атомы неметаллов, имеющие высокие степени окисления K 2 Cr+62 O 7, KMn+7 O 4, HN+5 O 3, H 2 S+6 O 4, HCl+7 O 4, K 2 Cr+6 O 4 Восстановители - простые вещества, образованные элементами с низкой электроотрицательностью, т. е. все металлы и некоторые неметаллы (H 2, B, C). Наиболее активный восстановитель – франций. - сложные вещества, которые содержат атомы с низкими степенями окисления: Fe+2 Cl 2, Cr 2+3(SO 4)3, KCl-1, H 2 S-2, N-3 H 3, H 2 S+4 O 3 Вещества, обладающие окислительно-восстановительной двойственностью - содержащие элементы в промежуточных степенях окисления, - могут выполнять как функции окислителей, так и восстановителей, - Например: N -3 H 3 - всегда восстановитель N 2 -2 H 4, N-1 H 2 OH, N 20, N 2+1 O, N+2 O, N 2+3 O 3, N+4 O 2 – обладают окислительно – восстановительной двойственностью N 2+5 O 5 - всегда окислитель Азот в степени окисления -3 – может быть только восстановителем, т. е. может только повышать степень окисления. Азот в степени окисления +5 всегда окислитель, повысить степень окисления не может, может только понизить.
Окисление – процесс отдачи электронов атомом, молекулой или ионом, ст. окисления при этом повышается. Ca – 2 e- = Ca+2 H 02 – 2 e- = 2 H+ Восстановление – процесс присоединения электронов атомом, молекулой, ионом. Ст. окисления при этом понижается. Fe+3 + e- = Fe 2+ Cl 02 + 2 e- = 2 Cl- - Окислители молекулы или ионы, присоединяющие электроны те простые вещества, элементы которых обладают высокой электроотрицательностью, т. е. неметаллы: F 2, O 2, Cl 2, Br 2, S и т. д. ионы металлов и водорода: Ag +, Au 3+, Cu 2+, H+, Fe 3+, и т. д. сложные вещества, которые содержат атомы неметаллов, имеющие высокие степени окисления K 2 Cr+62 O 7, KMn+7 O 4, HN+5 O 3, H 2 S+6 O 4, HCl+7 O 4, K 2 Cr+6 O 4 Восстановители - простые вещества, образованные элементами с низкой электроотрицательностью, т. е. все металлы и некоторые неметаллы (H 2, B, C). Наиболее активный восстановитель – франций. - сложные вещества, которые содержат атомы с низкими степенями окисления: Fe+2 Cl 2, Cr 2+3(SO 4)3, KCl-1, H 2 S-2, N-3 H 3, H 2 S+4 O 3 Вещества, обладающие окислительно-восстановительной двойственностью - содержащие элементы в промежуточных степенях окисления, - могут выполнять как функции окислителей, так и восстановителей, - Например: N -3 H 3 - всегда восстановитель N 2 -2 H 4, N-1 H 2 OH, N 20, N 2+1 O, N+2 O, N 2+3 O 3, N+4 O 2 – обладают окислительно – восстановительной двойственностью N 2+5 O 5 - всегда окислитель Азот в степени окисления -3 – может быть только восстановителем, т. е. может только повышать степень окисления. Азот в степени окисления +5 всегда окислитель, повысить степень окисления не может, может только понизить.
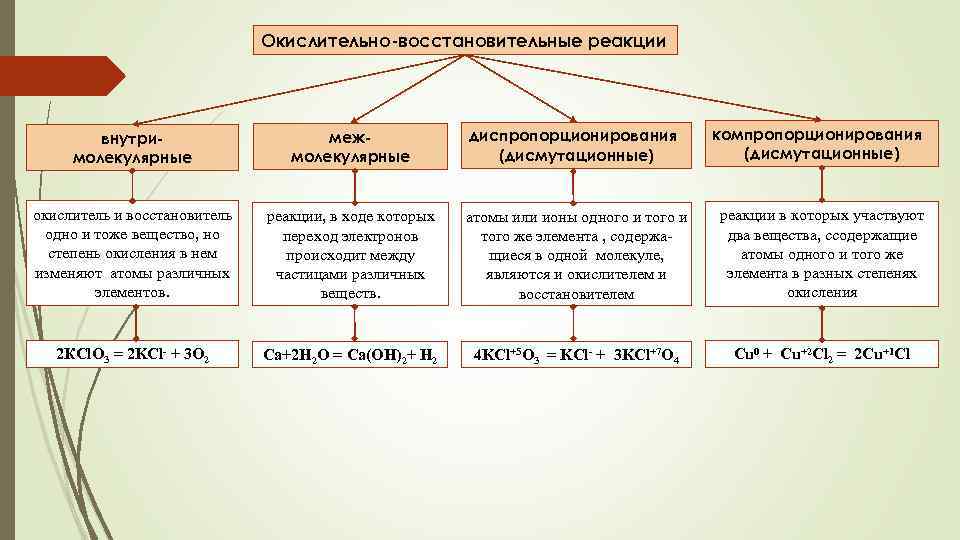 Окислительно-восстановительные реакции диспропорционирования (дисмутационные) компропорционирования (дисмутационные) внутримолекулярные межмолекулярные окислитель и восстановитель одно и тоже вещество, но степень окисления в нем изменяют атомы различных элементов. реакции, в ходе которых переход электронов происходит между частицами различных веществ. атомы или ионы одного и того же элемента , содержащиеся в одной молекуле, являются и окислителем и восстановителем реакции в которых участвуют два вещества, cсодержащие атомы одного и того же элемента в разных степенях окисления 2 КCl. O 3 = 2 KCl- + 3 O 2 Ca+2 H 2 O = Ca(OH)2+ H 2 4 KCl+5 O 3 = KCl- + 3 KCl+7 O 4 Cu 0 + Cu+2 Cl 2 = 2 Cu+1 Cl
Окислительно-восстановительные реакции диспропорционирования (дисмутационные) компропорционирования (дисмутационные) внутримолекулярные межмолекулярные окислитель и восстановитель одно и тоже вещество, но степень окисления в нем изменяют атомы различных элементов. реакции, в ходе которых переход электронов происходит между частицами различных веществ. атомы или ионы одного и того же элемента , содержащиеся в одной молекуле, являются и окислителем и восстановителем реакции в которых участвуют два вещества, cсодержащие атомы одного и того же элемента в разных степенях окисления 2 КCl. O 3 = 2 KCl- + 3 O 2 Ca+2 H 2 O = Ca(OH)2+ H 2 4 KCl+5 O 3 = KCl- + 3 KCl+7 O 4 Cu 0 + Cu+2 Cl 2 = 2 Cu+1 Cl
 Влияние среды раствора на протекание ОВР Mn. O-4 + 8 H+ + 5 e = Mn+2 + 4 H 2 O Mn. O-4 + 2 H 2 O + 3 e = Mn. О 2 + 4 OHMn. O-4+ 1 e = Mn. О 42 - Эквивалент окислителя и эквивалент восстановителя – это часть моля, которая отвечает соответственно одному присоединенному или отданному каждой молекулой электрону в данной реакции. МЭ KMn. O 4 = М5 = 1585 = 31, 6 гмоль-экв МЭ KMn. O 4 = M3 = 1583 = 52, 7 гмоль-экв МЭ KMn. O 4 = M1 = 158, 0 гмоль
Влияние среды раствора на протекание ОВР Mn. O-4 + 8 H+ + 5 e = Mn+2 + 4 H 2 O Mn. O-4 + 2 H 2 O + 3 e = Mn. О 2 + 4 OHMn. O-4+ 1 e = Mn. О 42 - Эквивалент окислителя и эквивалент восстановителя – это часть моля, которая отвечает соответственно одному присоединенному или отданному каждой молекулой электрону в данной реакции. МЭ KMn. O 4 = М5 = 1585 = 31, 6 гмоль-экв МЭ KMn. O 4 = M3 = 1583 = 52, 7 гмоль-экв МЭ KMn. O 4 = M1 = 158, 0 гмоль
 Электродный потенциал. Уравнение Нернста EMe = E 0 Me + (R ∙T/n ·F) / ln а. Men+, а в случае разбавленных растворов полностью диссоциирующих солей данного металла ЕMe = E 0 Me + (R∙T/n · F) / ln[Men+], где E 0 Me- стандартный электродный потенциал R- универсальная газовая постоянная. R=8, 314 Джмоль· К F- постоянная Фарадея F=96487 Кл n - заряд иона металла T=298, 15 К а. Men+ , [ Men+] – активность или концентрация ионов металла (мольл) В. Г. Нернст (1888) EMe = E 0 Me + 0, 0592/n ·lg [Men+]
Электродный потенциал. Уравнение Нернста EMe = E 0 Me + (R ∙T/n ·F) / ln а. Men+, а в случае разбавленных растворов полностью диссоциирующих солей данного металла ЕMe = E 0 Me + (R∙T/n · F) / ln[Men+], где E 0 Me- стандартный электродный потенциал R- универсальная газовая постоянная. R=8, 314 Джмоль· К F- постоянная Фарадея F=96487 Кл n - заряд иона металла T=298, 15 К а. Men+ , [ Men+] – активность или концентрация ионов металла (мольл) В. Г. Нернст (1888) EMe = E 0 Me + 0, 0592/n ·lg [Men+]
 Потенциалы, измеренные при температуре равной 25 0 С, Р=101, 325 к. Па и концентрации ионов 1 моль/л относительно СВЭ называются стандартными электродными потенциалами Е 0 или окислительно – восстановительным или редокс – потенциалами Система с большим электродным потенциалом всегда является окислителем по отношению к системе с меньшим потенциалом 1) чем меньше электродный потенциал металла Е 0, тем легче он окисляется и труднее восстанавливается из своих ионов. 2) металлы, имеющие отрицательные значения электродных потенциалов , стоящие левее водорода, способны его вытеснять из разбавленных растворов кислот. 3) каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокий электродный потенциал. Электродный потенциал, возникающий на границе фаз называется стандартным водородным потенциалом Е 02 Н+/H 2, а его значение принято равным нулю.
Потенциалы, измеренные при температуре равной 25 0 С, Р=101, 325 к. Па и концентрации ионов 1 моль/л относительно СВЭ называются стандартными электродными потенциалами Е 0 или окислительно – восстановительным или редокс – потенциалами Система с большим электродным потенциалом всегда является окислителем по отношению к системе с меньшим потенциалом 1) чем меньше электродный потенциал металла Е 0, тем легче он окисляется и труднее восстанавливается из своих ионов. 2) металлы, имеющие отрицательные значения электродных потенциалов , стоящие левее водорода, способны его вытеснять из разбавленных растворов кислот. 3) каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокий электродный потенциал. Электродный потенциал, возникающий на границе фаз называется стандартным водородным потенциалом Е 02 Н+/H 2, а его значение принято равным нулю.
 Понятие о гальваническом элементе Гальванический элемент – это устройство, в котором на основе ОВР получают электрический ток. Zn-2 e= Zn+2 (анодный процесс) Cu 2++2 е=Cu 0 (катодный процесс) медно-цинковый или элемент Даниэля-Якоби. Zn+ Cu 2+= Zn+2+ Cu 0 Zn+Cu. SO 4 = Zn. SO 4+Cu Цинковый электрод – источник электронов –отрицательный, медный электрод – положительный. Процесс окисления (отдача электронов) на аноде (отрицательный полюс), Процесс восстановления (присоединения) электронов – на катоде (положительный полюс) Причина возникновения электрического тока – разность электродных потенциалов (э. д. с. ) ΔЕ = Ек - Еа > 0 Ек > Еа т. е. катод – электрод с более высоким электродным потенциалом. т. к. ЭДС должно быть > 0, поэтому надо из потенциала электрода имеющего большую алгебраическую величину, вычитать электрод - алгебраическая величина которого меньше.
Понятие о гальваническом элементе Гальванический элемент – это устройство, в котором на основе ОВР получают электрический ток. Zn-2 e= Zn+2 (анодный процесс) Cu 2++2 е=Cu 0 (катодный процесс) медно-цинковый или элемент Даниэля-Якоби. Zn+ Cu 2+= Zn+2+ Cu 0 Zn+Cu. SO 4 = Zn. SO 4+Cu Цинковый электрод – источник электронов –отрицательный, медный электрод – положительный. Процесс окисления (отдача электронов) на аноде (отрицательный полюс), Процесс восстановления (присоединения) электронов – на катоде (положительный полюс) Причина возникновения электрического тока – разность электродных потенциалов (э. д. с. ) ΔЕ = Ек - Еа > 0 Ек > Еа т. е. катод – электрод с более высоким электродным потенциалом. т. к. ЭДС должно быть > 0, поэтому надо из потенциала электрода имеющего большую алгебраическую величину, вычитать электрод - алгебраическая величина которого меньше.
 5 KI + KIO 3 + 3 H 2 SO 4 = 3 I 2+3 K 2 SO 4+3 H 2 O 1) восстановительная полупара, включающую ион (атом) восстановитель, I- - e = I 0 2) окислительная полупара, включающая ион (атом) – окислитель, IO 3 - + 6 H+ + 5 e = I 0 + 3 H 2 O Окислительная форма полупары, имеющая более высокое значение Е 0, может принимать электроны от восстановительной формы с меньшим значением Е 0. Чем выше значение потенциала Е 0, тем выше у данной полупары окислительная способность ее окислительной формы. Разность между стандартными окислительными потенциалами окислительной и восстановительной полупар называют электродвижущей силой реакции (ЭДС). ЭДС = Е 0 Ox – E 0 Red • если ЭДС > 0 , то такая реакция осуществима; • если ЭДС <0, то возможной будет обратная реакция, для которой ЭДС будет иметь то же самое абсолютное значение, но с обратным знаком.
5 KI + KIO 3 + 3 H 2 SO 4 = 3 I 2+3 K 2 SO 4+3 H 2 O 1) восстановительная полупара, включающую ион (атом) восстановитель, I- - e = I 0 2) окислительная полупара, включающая ион (атом) – окислитель, IO 3 - + 6 H+ + 5 e = I 0 + 3 H 2 O Окислительная форма полупары, имеющая более высокое значение Е 0, может принимать электроны от восстановительной формы с меньшим значением Е 0. Чем выше значение потенциала Е 0, тем выше у данной полупары окислительная способность ее окислительной формы. Разность между стандартными окислительными потенциалами окислительной и восстановительной полупар называют электродвижущей силой реакции (ЭДС). ЭДС = Е 0 Ox – E 0 Red • если ЭДС > 0 , то такая реакция осуществима; • если ЭДС <0, то возможной будет обратная реакция, для которой ЭДС будет иметь то же самое абсолютное значение, но с обратным знаком.
 Пример Можно ли окислить Br- до элементарного брома, используя элементарный хлор, т. е. осуществить реакцию 2 Br -+ Cl 02 = Br 02 + 2 Cl- Е 0 Br 2/2 Br- = 1, 0652 В ≈ 1, 07 В Е 0 Cl 2/2 Cl - = 1, 3595 В ≈ 1, 36 В ЭДС = ∆ Е = Е 0 окисл. – Е 0 воост. = 1, 3695 – 1, 0652 = 0, 29 В > 0, Значит, реакция осуществима.
Пример Можно ли окислить Br- до элементарного брома, используя элементарный хлор, т. е. осуществить реакцию 2 Br -+ Cl 02 = Br 02 + 2 Cl- Е 0 Br 2/2 Br- = 1, 0652 В ≈ 1, 07 В Е 0 Cl 2/2 Cl - = 1, 3595 В ≈ 1, 36 В ЭДС = ∆ Е = Е 0 окисл. – Е 0 воост. = 1, 3695 – 1, 0652 = 0, 29 В > 0, Значит, реакция осуществима.
 Возможность и направление протекания ОВР 1. По величине ЭДС 2. По энергии Гиббса ЭДС > 0 ∆G 0 < 0 Для ОВР при Т = 298 ΔG 0= - n ·F · ΔE 0 При условиях, отличающихся от стандартных: Ox + ne ↔ Red электродный потенциал определяется уравнением Нернста: Eoх/Red = E 00 х/Red - (RT/n· F) · ln(CRed/СOx) Eox/Red и E 0 ox/Red - электродный и стандартный потенциалы системы. N - число электронов, участвующих в процессе. CRed и Cox - молярные концентрации восстановленной и окисленной форм. Eox/Red = E 0 ox/Red – (0, 059/n) · lg CRed/СOx или
Возможность и направление протекания ОВР 1. По величине ЭДС 2. По энергии Гиббса ЭДС > 0 ∆G 0 < 0 Для ОВР при Т = 298 ΔG 0= - n ·F · ΔE 0 При условиях, отличающихся от стандартных: Ox + ne ↔ Red электродный потенциал определяется уравнением Нернста: Eoх/Red = E 00 х/Red - (RT/n· F) · ln(CRed/СOx) Eox/Red и E 0 ox/Red - электродный и стандартный потенциалы системы. N - число электронов, участвующих в процессе. CRed и Cox - молярные концентрации восстановленной и окисленной форм. Eox/Red = E 0 ox/Red – (0, 059/n) · lg CRed/СOx или
 Пример Выбрать галогенид калия в качестве восстановителя для Fe. Cl 3 2 KГ- + 2 Fe 3+Cl 3(P) = Г 02 + 2 KCl(P) + 2 Fe 2+Cl 2(P) (Г = F-, Cl-, Br-, I- ) По таблице: E 0 Fe 3+/Fe+2 = +0, 77 B E 0 F 2/2 F- = + 2, 86 B E 0 Cl 2/2 Cl- = + 1, 36 B E 0 Br 2/2 Br- = +1, 07 B E 0 I 2/2 I- = +0, 54 B < 0. 77 B Вычислим э. д. с. с участием гологенидов для KI ΔЕ 0298 = Е 0 окисл. – Е 0 восст. = 0, 77 – 0, 54 = 0, 23 В > 0. Только иодид калия будет восстанавливать Fe. Cl 3, т. к. Δ Е 0298 > 0.
Пример Выбрать галогенид калия в качестве восстановителя для Fe. Cl 3 2 KГ- + 2 Fe 3+Cl 3(P) = Г 02 + 2 KCl(P) + 2 Fe 2+Cl 2(P) (Г = F-, Cl-, Br-, I- ) По таблице: E 0 Fe 3+/Fe+2 = +0, 77 B E 0 F 2/2 F- = + 2, 86 B E 0 Cl 2/2 Cl- = + 1, 36 B E 0 Br 2/2 Br- = +1, 07 B E 0 I 2/2 I- = +0, 54 B < 0. 77 B Вычислим э. д. с. с участием гологенидов для KI ΔЕ 0298 = Е 0 окисл. – Е 0 восст. = 0, 77 – 0, 54 = 0, 23 В > 0. Только иодид калия будет восстанавливать Fe. Cl 3, т. к. Δ Е 0298 > 0.
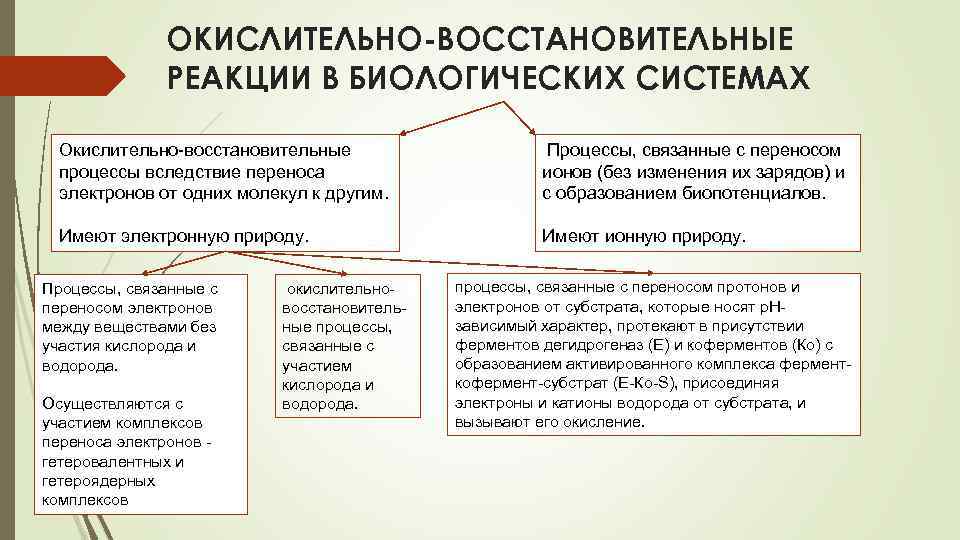 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ В БИОЛОГИЧЕСКИХ СИСТЕМАХ Окислительно-восстановительные процессы вследствие переноса электронов от одних молекул к другим. Процессы, связанные с переносом ионов (без изменения их зарядов) и с образованием биопотенциалов. Имеют электронную природу. Имеют ионную природу. Процессы, связанные с переносом электронов между веществами без участия кислорода и водорода. Осуществляются с участием комплексов переноса электронов - гетеровалентных и гетероядерных комплексов окислительновосстановительные процессы, связанные с участием кислорода и водорода. процессы, связанные с переносом протонов и электронов от субстрата, которые носят p. Hзависимый характер, протекают в присутствии ферментов дегидрогеназ (E) и коферментов (Ко) с образованием активированного комплекса ферменткофермент-субстрат (Е-Ко-S), присоединяя электроны и катионы водорода от субстрата, и вызывают его окисление.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ В БИОЛОГИЧЕСКИХ СИСТЕМАХ Окислительно-восстановительные процессы вследствие переноса электронов от одних молекул к другим. Процессы, связанные с переносом ионов (без изменения их зарядов) и с образованием биопотенциалов. Имеют электронную природу. Имеют ионную природу. Процессы, связанные с переносом электронов между веществами без участия кислорода и водорода. Осуществляются с участием комплексов переноса электронов - гетеровалентных и гетероядерных комплексов окислительновосстановительные процессы, связанные с участием кислорода и водорода. процессы, связанные с переносом протонов и электронов от субстрата, которые носят p. Hзависимый характер, протекают в присутствии ферментов дегидрогеназ (E) и коферментов (Ко) с образованием активированного комплекса ферменткофермент-субстрат (Е-Ко-S), присоединяя электроны и катионы водорода от субстрата, и вызывают его окисление.


