Окислительно-восстановительные процессы.ppt
- Количество слайдов: 21
 Окислительновосстановительные процессы Часть № 1 ОВР
Окислительновосстановительные процессы Часть № 1 ОВР
 Степень окисления - это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна. Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
Степень окисления - это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна. Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
 Например: N 2 H 4 (гидразин) степень окисления азота : -2; валентность азота : III Для вычисления степени окисления элемента следует учитывать следующие положения:
Например: N 2 H 4 (гидразин) степень окисления азота : -2; валентность азота : III Для вычисления степени окисления элемента следует учитывать следующие положения:
 1. Степени окисления атомов в простых веществах равны нулю. 2. Сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе - равна заряду иона. 3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) [кроме гидридов Na. H (-1)], кислорода (-2) [кроме F 2 O(+2) и пероксидов (-1)]. 4. Положительная степень окисления элемента не может превышать величину, равную номеру группы периодической системы.
1. Степени окисления атомов в простых веществах равны нулю. 2. Сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе - равна заряду иона. 3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) [кроме гидридов Na. H (-1)], кислорода (-2) [кроме F 2 O(+2) и пероксидов (-1)]. 4. Положительная степень окисления элемента не может превышать величину, равную номеру группы периодической системы.
 Пример: V 2+5 O 5 -2; Na 2+1 B 4+3 O 7 -2; K+1 Cl+7 O 4 -2; N-3 H 3+1; K 2+1 H+1 P+5 O 4 -2; Na 2+1 Cr 2+6 O 7 -2 Существует два типа химических реакций: A Реакции, в которых не изменяется степень окисления элементов: SO 2 + Na 2 O = Na 2 SO 3
Пример: V 2+5 O 5 -2; Na 2+1 B 4+3 O 7 -2; K+1 Cl+7 O 4 -2; N-3 H 3+1; K 2+1 H+1 P+5 O 4 -2; Na 2+1 Cr 2+6 O 7 -2 Существует два типа химических реакций: A Реакции, в которых не изменяется степень окисления элементов: SO 2 + Na 2 O = Na 2 SO 3
 B Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений: Mn+4 O 2 + 4 HCl-1 = Mn+2 Cl 2 + Cl 20 + 2 H 2 O Такие реакции называются окислительно - восстановительными.
B Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений: Mn+4 O 2 + 4 HCl-1 = Mn+2 Cl 2 + Cl 20 + 2 H 2 O Такие реакции называются окислительно - восстановительными.
 Окисление, восстановление В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов - окисление. При окислении степень окисления повышается: H 20 - 2ē =2 H+ ; S-2 - 2ē =S 0
Окисление, восстановление В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов - окисление. При окислении степень окисления повышается: H 20 - 2ē =2 H+ ; S-2 - 2ē =S 0
 Процесс присоединения электронов – восстановление. При восстановлении степень окисления понижается. Mn+4 + 2ē = Mn+2 ; S 0 + 2ē = S-2 Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны - восстановителями.
Процесс присоединения электронов – восстановление. При восстановлении степень окисления понижается. Mn+4 + 2ē = Mn+2 ; S 0 + 2ē = S-2 Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны - восстановителями.
 Важнейшие восстановители и окислители Восстановители: Ме, Н 2, С. Окись углерода (II) (CO). Сероводород (H 2 S); оксид серы (IV) (SO 2); сернистая кислота H 2 SO 3 и ее соли. Галогеноводородные кислоты и их соли. Катионы металлов в низших степенях окисления: Sn. Cl 2, Fe. Cl 2, Mn. SO 4, Cr 2(SO 4)3. Азотистая кислота HNO 2; аммиак NH 3; гидразин N 2 H 4; оксид азота(II) (NO). Катод при электролизе.
Важнейшие восстановители и окислители Восстановители: Ме, Н 2, С. Окись углерода (II) (CO). Сероводород (H 2 S); оксид серы (IV) (SO 2); сернистая кислота H 2 SO 3 и ее соли. Галогеноводородные кислоты и их соли. Катионы металлов в низших степенях окисления: Sn. Cl 2, Fe. Cl 2, Mn. SO 4, Cr 2(SO 4)3. Азотистая кислота HNO 2; аммиак NH 3; гидразин N 2 H 4; оксид азота(II) (NO). Катод при электролизе.
 Окислители: Галогены. Перманганат калия(KMn. O 4); манганат калия (K 2 Mn. O 4); оксид марганца (IV) (Mn. O 2). Дихромат калия (K 2 Cr 2 O 7); хромат калия (K 2 Cr. O 4). Азотная кислота (HNO 3). Серная кислота (H 2 SO 4), конц. Оксид меди(II) (Cu. O); оксид свинца(IV) (Pb. O 2); оксид серебра (Ag 2 O); пероксид водорода (H 2 O 2). Хлорид железа(III) (Fe. Cl 3). Бертоллетова соль (KCl. O 3). Анод при электролизе.
Окислители: Галогены. Перманганат калия(KMn. O 4); манганат калия (K 2 Mn. O 4); оксид марганца (IV) (Mn. O 2). Дихромат калия (K 2 Cr 2 O 7); хромат калия (K 2 Cr. O 4). Азотная кислота (HNO 3). Серная кислота (H 2 SO 4), конц. Оксид меди(II) (Cu. O); оксид свинца(IV) (Pb. O 2); оксид серебра (Ag 2 O); пероксид водорода (H 2 O 2). Хлорид железа(III) (Fe. Cl 3). Бертоллетова соль (KCl. O 3). Анод при электролизе.
 Классификация окислительновосстановительных реакций 1. Межмолекулярные ОВР S 0 + O 20 = S+4 O 2 -2 S - восстановитель; O 2 - окислитель Cu+2 O + C+2 O = Cu 0 + C+4 O 2 CO - восстановитель; Cu. O - окислитель
Классификация окислительновосстановительных реакций 1. Межмолекулярные ОВР S 0 + O 20 = S+4 O 2 -2 S - восстановитель; O 2 - окислитель Cu+2 O + C+2 O = Cu 0 + C+4 O 2 CO - восстановитель; Cu. O - окислитель
 2. Внутримолекулярные ОВР Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Чаще протекают, при термическом разложении веществ, содержащих окислитель и восстановитель. 2 KCl+5 O 3 -2 =2 KCl-1 + 3 O 20 Cl+5 - окислитель; О-2 - восстановитель N-3 H 4 N+5 O 3 = N 2+1 O + 2 H 2 O N+5 - окислитель; N-3 - восстановитель
2. Внутримолекулярные ОВР Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Чаще протекают, при термическом разложении веществ, содержащих окислитель и восстановитель. 2 KCl+5 O 3 -2 =2 KCl-1 + 3 O 20 Cl+5 - окислитель; О-2 - восстановитель N-3 H 4 N+5 O 3 = N 2+1 O + 2 H 2 O N+5 - окислитель; N-3 - восстановитель
 3. Диспропорционирование - окислительно-восстановительная реакция, в которой один элемент одновременно повышает и понижает степень окисления. Cl 20 + 2 KOH =KCl+1 O + KCl-1 + H 2 O 3 K 2 Mn+6 O 4 + 2 H 2 O = = 2 KMn+7 O 4 + Mn+4 O 2 + 4 KOH
3. Диспропорционирование - окислительно-восстановительная реакция, в которой один элемент одновременно повышает и понижает степень окисления. Cl 20 + 2 KOH =KCl+1 O + KCl-1 + H 2 O 3 K 2 Mn+6 O 4 + 2 H 2 O = = 2 KMn+7 O 4 + Mn+4 O 2 + 4 KOH
 Составление уравнений ОВР A. Электронный баланс - метод нахождения коэффициентов в уравнениях окислительновосстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Составление уравнений ОВР A. Электронный баланс - метод нахождения коэффициентов в уравнениях окислительновосстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
 1. Записывают схему реакции. 2. Проставляют степени окисления над знаками элементов, которые меняются. KMn+7 O 4 + HCl-1= KCl + Mn+2 Cl 2+Cl 20+ H 2 O 3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем. Mn+7 + 5ē =Mn+2 2 Cl-1 - 2ē = Cl 20
1. Записывают схему реакции. 2. Проставляют степени окисления над знаками элементов, которые меняются. KMn+7 O 4 + HCl-1= KCl + Mn+2 Cl 2+Cl 20+ H 2 O 3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем. Mn+7 + 5ē =Mn+2 2 Cl-1 - 2ē = Cl 20
 4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления. Mn+7 + 5ē = Mn+2 2 2 Cl-1 - 2ē = Cl 20 5 –––––––––––– 2 Mn+7 + 10 Cl-1 = 2 Mn+2 + 5 Cl 20 5. Подбирают коэффициенты для всех остальных участников реакции. 2 KMn+7 O 4+16 HCl-1=2 KCl+2 Mn+2 Cl 2+5 Cl 20 + 8 H 2 O
4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления. Mn+7 + 5ē = Mn+2 2 2 Cl-1 - 2ē = Cl 20 5 –––––––––––– 2 Mn+7 + 10 Cl-1 = 2 Mn+2 + 5 Cl 20 5. Подбирают коэффициенты для всех остальных участников реакции. 2 KMn+7 O 4+16 HCl-1=2 KCl+2 Mn+2 Cl 2+5 Cl 20 + 8 H 2 O
 B Электронно-ионный баланс (метод полуреакций) метод нахождения коэффициентов, в котором рассматривается обмен электронами между ионами в растворе с учетом характера среды: 2 Cl 1 - – 2ē = Cl 20 5 5 Mn. O 41 - + 8 H++ 5ē =Mn 2+ + 4 H 2 O 2 ––––––––––––––––––– 10 Cl- + 2 Mn. O 41 - + 16 H+ = 5 Cl 20 + 2 Mn 2+ + 8 H 2 O (для уравнивания ионной полуреакции используют H+, OH- или воду)
B Электронно-ионный баланс (метод полуреакций) метод нахождения коэффициентов, в котором рассматривается обмен электронами между ионами в растворе с учетом характера среды: 2 Cl 1 - – 2ē = Cl 20 5 5 Mn. O 41 - + 8 H++ 5ē =Mn 2+ + 4 H 2 O 2 ––––––––––––––––––– 10 Cl- + 2 Mn. O 41 - + 16 H+ = 5 Cl 20 + 2 Mn 2+ + 8 H 2 O (для уравнивания ионной полуреакции используют H+, OH- или воду)
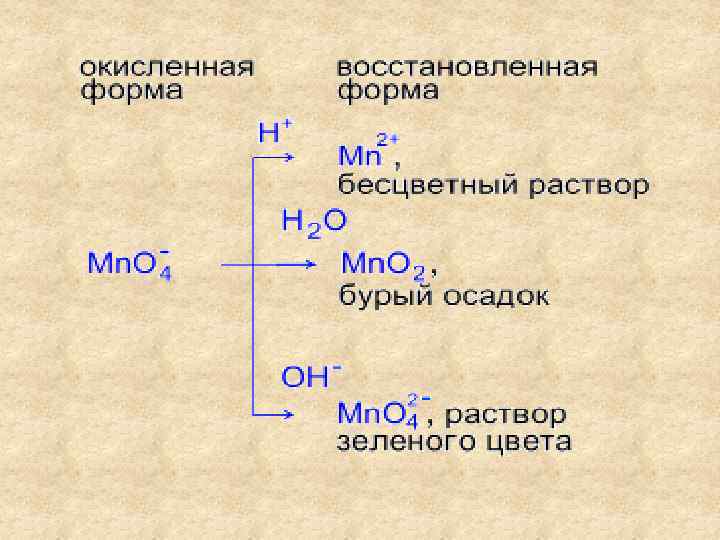
 Реакции в кислой среде 5 K 2 S+4 O 3+2 KMn+7 O 4+3 H 2 SO 4= =6 K 2 S+6 O 4+2 Mn+2 SO 4+3 H 2 O метод полуреакций: Mn. O 4 - + 8 H+ + 5ē = Mn 2+ + 4 H 2 O 2 SO 32 - + H 2 O – 2ē = SO 42 - + 2 H+ 5 ––––––––––––– 2 Mn. O 4 -+16 H++ 5 SO 32 - +5 H 2 O= = 2 Mn 2++8 H 2 O+5 SO 42 - + 10 H+ или 2 Mn. O 4 - + 6 H+ + 5 SO 32 - = =2 Mn 2+ + 3 H 2 O + 5 SO 42 Фиолетовый раствор KMn. O 4 обесцвечивается при добавлении раствора K 2 SO 3.
Реакции в кислой среде 5 K 2 S+4 O 3+2 KMn+7 O 4+3 H 2 SO 4= =6 K 2 S+6 O 4+2 Mn+2 SO 4+3 H 2 O метод полуреакций: Mn. O 4 - + 8 H+ + 5ē = Mn 2+ + 4 H 2 O 2 SO 32 - + H 2 O – 2ē = SO 42 - + 2 H+ 5 ––––––––––––– 2 Mn. O 4 -+16 H++ 5 SO 32 - +5 H 2 O= = 2 Mn 2++8 H 2 O+5 SO 42 - + 10 H+ или 2 Mn. O 4 - + 6 H+ + 5 SO 32 - = =2 Mn 2+ + 3 H 2 O + 5 SO 42 Фиолетовый раствор KMn. O 4 обесцвечивается при добавлении раствора K 2 SO 3.
 Реакции в нейтральной среде 3 K 2 S+4 O 3+ 2 KMn+7 O 4 + H 2 O = 3 K 2 S+6 O 4 +2 Mn+4 O 2+ 2 KOH метод полуреакций: Mn. O 41 - + 2 H 2 O + 3ē = Mn. O 2 + 4 OH- 2 SO 32 - + 2 OH- - 2ē = SO 42 - + H 2 O 3 ––––––––––––––––––– 2 Mn. O 4 -+4 H 2 O+3 SO 32 -+6 OH- =2 Mn. O 2+8 OH-+3 SO 42 -+3 H 2 O 2 Mn. O 4 - + H 2 O + 3 SO 32 - = 2 Mn. O 2 + 2 OH- + 3 SO 42 Фиолетовый раствор KMn. O 4 после окончания реакции обесцвечивается и наблюдается выпадение бурого осадка.
Реакции в нейтральной среде 3 K 2 S+4 O 3+ 2 KMn+7 O 4 + H 2 O = 3 K 2 S+6 O 4 +2 Mn+4 O 2+ 2 KOH метод полуреакций: Mn. O 41 - + 2 H 2 O + 3ē = Mn. O 2 + 4 OH- 2 SO 32 - + 2 OH- - 2ē = SO 42 - + H 2 O 3 ––––––––––––––––––– 2 Mn. O 4 -+4 H 2 O+3 SO 32 -+6 OH- =2 Mn. O 2+8 OH-+3 SO 42 -+3 H 2 O 2 Mn. O 4 - + H 2 O + 3 SO 32 - = 2 Mn. O 2 + 2 OH- + 3 SO 42 Фиолетовый раствор KMn. O 4 после окончания реакции обесцвечивается и наблюдается выпадение бурого осадка.
 Реакции в щелочной среде K 2 S+4 O 3 + 2 KMn+7 O 4 + 2 KOH = =K 2 S+6 O 4 +2 K 2 Mn+6 O 4 + H 2 O метод полуреакций: SO 32 - + 2 OH- - 2ē = SO 42 - + H 2 O 1 Mn. O 41 - + ē = Mn. O 42 - 2 ––––––––––––––––––– SO 32 - + 2 OH- + 2 Mn. O 4 - = SO 42 - + H 2 O + 2 Mn. O 42 Фиолетовый раствор KMn. O 4 превращается в зеленоватый раствор K 2 Mn. O 4
Реакции в щелочной среде K 2 S+4 O 3 + 2 KMn+7 O 4 + 2 KOH = =K 2 S+6 O 4 +2 K 2 Mn+6 O 4 + H 2 O метод полуреакций: SO 32 - + 2 OH- - 2ē = SO 42 - + H 2 O 1 Mn. O 41 - + ē = Mn. O 42 - 2 ––––––––––––––––––– SO 32 - + 2 OH- + 2 Mn. O 4 - = SO 42 - + H 2 O + 2 Mn. O 42 Фиолетовый раствор KMn. O 4 превращается в зеленоватый раствор K 2 Mn. O 4