ДИХРОМАТОМЕТРИЯ Microsoft Office PowerPoint.pptx
- Количество слайдов: 16
 Окислительновосстановительное титрование. Дихроматометрия Презентацию подготовила студентка 2 курса специальности «химия» Хомутецкая Александра
Окислительновосстановительное титрование. Дихроматометрия Презентацию подготовила студентка 2 курса специальности «химия» Хомутецкая Александра
 Основная полуреакция методов хроматометрии является процесс восстановления дихромата калия в кислой среде: Сr 2 О 7(2 -) + 6 е + 14(Н+) = 2 Сr(3+) + 7 Н 20; E 0(Cr 2 O 2 -/2 Cr 3 -)=1, 33 В. молярная масса эквивалента дихромата калия равна 1/6 молярной массы М(1/6 К 2 Cr 2 О 7) = М(К 2 Cr 2 О 7)/6 = =294, 185/6 =49, 031 г/моль.
Основная полуреакция методов хроматометрии является процесс восстановления дихромата калия в кислой среде: Сr 2 О 7(2 -) + 6 е + 14(Н+) = 2 Сr(3+) + 7 Н 20; E 0(Cr 2 O 2 -/2 Cr 3 -)=1, 33 В. молярная масса эквивалента дихромата калия равна 1/6 молярной массы М(1/6 К 2 Cr 2 О 7) = М(К 2 Cr 2 О 7)/6 = =294, 185/6 =49, 031 г/моль.
 Характеристика титранта 1) Первичный стандарт (раствор, концентрация которого точна известна, готовится по точной навеске) 2) Легко приготовить достаточно чистым; 3) Устойчив при хранении на воздухе 4) Сохраняет неизменный титр длительное, неопределенно долгое время 5) Может быть использован в день приготовления
Характеристика титранта 1) Первичный стандарт (раствор, концентрация которого точна известна, готовится по точной навеске) 2) Легко приготовить достаточно чистым; 3) Устойчив при хранении на воздухе 4) Сохраняет неизменный титр длительное, неопределенно долгое время 5) Может быть использован в день приготовления
 Применение дихроматометрии. Прямое титрование Прямым дихроматометрическим титрованием можно определять ряд восстановителей: железо(II) 6 Fe(2+) + Cr 2 О 7(2⁻) +14(H+)= 6(Fe 3+)+2 Cr(3+)+7 H 2 О Сульфиты: Cr 2 O 7(2 -)+ 3 SO 3(2 -)+ 8(H+) = 2 Cr(3+) + 3 SO 4(2 -)+ +4 H 2 O Иодиды: 6 I(-) +Cr 2 O 7(2 -) +14 H(+) = 3 I 2 + 2 Cr(3+) + 7 H 2 O и т. д.
Применение дихроматометрии. Прямое титрование Прямым дихроматометрическим титрованием можно определять ряд восстановителей: железо(II) 6 Fe(2+) + Cr 2 О 7(2⁻) +14(H+)= 6(Fe 3+)+2 Cr(3+)+7 H 2 О Сульфиты: Cr 2 O 7(2 -)+ 3 SO 3(2 -)+ 8(H+) = 2 Cr(3+) + 3 SO 4(2 -)+ +4 H 2 O Иодиды: 6 I(-) +Cr 2 O 7(2 -) +14 H(+) = 3 I 2 + 2 Cr(3+) + 7 H 2 O и т. д.
 Обратное титрование. Методом обратного титрования определяют некоторые окислители. Так можно определять нитраты: NO(3 -)+ 3 Fe(2+) + 4(H+) = 3 Fe(3+) + NO + 2 H 2 O А В 1 Избыток железа(II) оттитровывают раствором дихромата калия: 6 Fe(2+) + Cr 2 О 7(2 -)+ 14 Н(+) = 6 Fe(3+)+ 2 Cr(3+) +7 H 2 O В 1 В 2
Обратное титрование. Методом обратного титрования определяют некоторые окислители. Так можно определять нитраты: NO(3 -)+ 3 Fe(2+) + 4(H+) = 3 Fe(3+) + NO + 2 H 2 O А В 1 Избыток железа(II) оттитровывают раствором дихромата калия: 6 Fe(2+) + Cr 2 О 7(2 -)+ 14 Н(+) = 6 Fe(3+)+ 2 Cr(3+) +7 H 2 O В 1 В 2
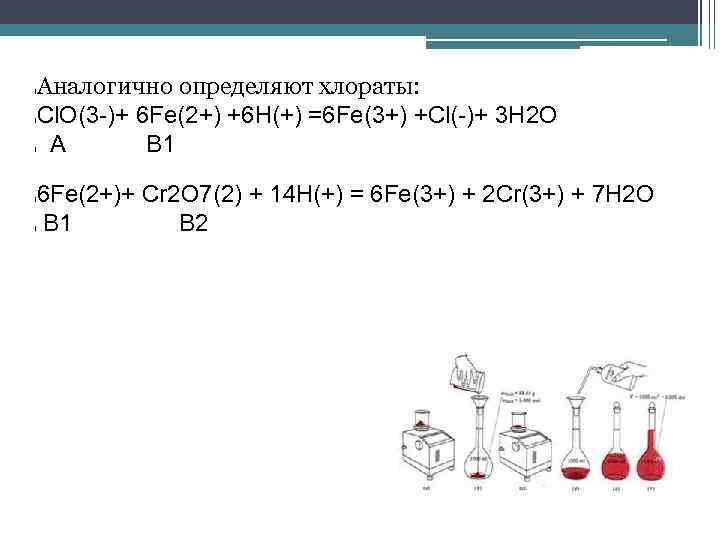 l l l Аналогично определяют хлораты: Сl. O(3 -)+ 6 Fe(2+) +6 Н(+) =6 Fe(3+) +Сl(-)+ 3 Н 2 O А В 1 6 Fe(2+)+ Cr 2 О 7(2) + 14 H(+) = 6 Fe(3+) + 2 Cr(3+) + 7 H 2 O В 1 В 2
l l l Аналогично определяют хлораты: Сl. O(3 -)+ 6 Fe(2+) +6 Н(+) =6 Fe(3+) +Сl(-)+ 3 Н 2 O А В 1 6 Fe(2+)+ Cr 2 О 7(2) + 14 H(+) = 6 Fe(3+) + 2 Cr(3+) + 7 H 2 O В 1 В 2
 органических веществ. Определение окисля 2 Cr 2 O 7(2 -) + 16 H(+) +3 C=4 Cr(3+)+ 3 CO 2+ 8 H 2 Для достижения полноты окисления вводится катализатор Ag 2 SO 4 или Hg 2 SO 4. Кроме каталитического действия, эти соединения связывают хлорид-ионы, имеющиеся в воде, в малорастворимые соединения: хлориды серебра и ртути (|), что предотвращает побочную реакцию окисления хлорид-иона.
органических веществ. Определение окисля 2 Cr 2 O 7(2 -) + 16 H(+) +3 C=4 Cr(3+)+ 3 CO 2+ 8 H 2 Для достижения полноты окисления вводится катализатор Ag 2 SO 4 или Hg 2 SO 4. Кроме каталитического действия, эти соединения связывают хлорид-ионы, имеющиеся в воде, в малорастворимые соединения: хлориды серебра и ртути (|), что предотвращает побочную реакцию окисления хлорид-иона.
 Определение гидрохинона OH)2+ Cr 2 O 7(2 -)+ 8 H(+) = 3 C 6 H 4 O 2+2 Cr(3+ Гидрохинон титруют стандартным раствором дихромата калия в присутствии дифениламина.
Определение гидрохинона OH)2+ Cr 2 O 7(2 -)+ 8 H(+) = 3 C 6 H 4 O 2+2 Cr(3+ Гидрохинон титруют стандартным раствором дихромата калия в присутствии дифениламина.
 Определение изопропилового спирта основано на реакции окисления изопропилового спирта до ацетона дихроматом калия в кислой среде: 3 С 3 H 8 O +Cr 2 O 7(2 -)+ 8 H(+)= 3 C 3 H 6 O+2 Cr(3+) +7 H 2 O l l Реакция окисления изопропилового спирта протекает медленно, используют метод обратного титрования: l l Cr 2 O 7(2 -)+6 I(-)+14 H(+)=2 Cr(3+)+3 I 2+7 H 2 O I 2+2 S 2 O 3(2 -)=2 I(-)+S 4 O 6(2 -)
Определение изопропилового спирта основано на реакции окисления изопропилового спирта до ацетона дихроматом калия в кислой среде: 3 С 3 H 8 O +Cr 2 O 7(2 -)+ 8 H(+)= 3 C 3 H 6 O+2 Cr(3+) +7 H 2 O l l Реакция окисления изопропилового спирта протекает медленно, используют метод обратного титрования: l l Cr 2 O 7(2 -)+6 I(-)+14 H(+)=2 Cr(3+)+3 I 2+7 H 2 O I 2+2 S 2 O 3(2 -)=2 I(-)+S 4 O 6(2 -)
 Определение глицерина основано на окислении глицерина дихроматом калия в кислой среде: 3 C 3 H 5(OH)3+ 7 Cr 2 O 7(2 -)+ 56 H(+)=9 CO 2+ 14 Cr(3+)+ К анализируемого раствору глицерина добавляют избыток стандартного раствора K 2 Cr 2 O 7. Избыток K 2 Cr 2 O 7 оттитровывают иодометрическим Cr 2 O 7(2 -)+ 6 I(-)+ 14 H(+)=2 Cr(3+)+ 3 I 2+ 7 H 2 O I 2+ S 2 O 3(2 -)= 2 I(-)+ S 4 O 6(2 -)
Определение глицерина основано на окислении глицерина дихроматом калия в кислой среде: 3 C 3 H 5(OH)3+ 7 Cr 2 O 7(2 -)+ 56 H(+)=9 CO 2+ 14 Cr(3+)+ К анализируемого раствору глицерина добавляют избыток стандартного раствора K 2 Cr 2 O 7. Избыток K 2 Cr 2 O 7 оттитровывают иодометрическим Cr 2 O 7(2 -)+ 6 I(-)+ 14 H(+)=2 Cr(3+)+ 3 I 2+ 7 H 2 O I 2+ S 2 O 3(2 -)= 2 I(-)+ S 4 O 6(2 -)
 Определение этиленгликоля основано на реакции окисления этиленгликоля дихроматом калия: CH 2 OH +5 K 2 Cr 2 O 7+ 20 H 2 SO 4= 5 K 2 SO 4+ 5 Cr 2(SO 4)3+ 29 H 2 Избыток K 2 Cr 2 O 7 определяют иодометрически: Cr 2 O 7(2 -)+ 6 I(-)+ 14 H(+)=2 Cr(3+)+ 3 I 2+ 7 H 2 O I 2+ 2 S 2 O 3(2 -)= 2 I(-)+ S 4 O 6(2 -)
Определение этиленгликоля основано на реакции окисления этиленгликоля дихроматом калия: CH 2 OH +5 K 2 Cr 2 O 7+ 20 H 2 SO 4= 5 K 2 SO 4+ 5 Cr 2(SO 4)3+ 29 H 2 Избыток K 2 Cr 2 O 7 определяют иодометрически: Cr 2 O 7(2 -)+ 6 I(-)+ 14 H(+)=2 Cr(3+)+ 3 I 2+ 7 H 2 O I 2+ 2 S 2 O 3(2 -)= 2 I(-)+ S 4 O 6(2 -)
 Индикатор
Индикатор
 Расчёты Содержание железа (II) определяют по формуле: m(Fe 2+)=N*Vср*Vк*Э(Fe)/(1000*Vп) где: N - нормальность раствора дихромата калия; средний объем дихромата калия, пошедший на титрование, мл; Эж - восстановительный эквивалент железа, равный 55, 85; Vк, Vп - объем соответственно мерной колбы и мерной пипетки, мл - -
Расчёты Содержание железа (II) определяют по формуле: m(Fe 2+)=N*Vср*Vк*Э(Fe)/(1000*Vп) где: N - нормальность раствора дихромата калия; средний объем дихромата калия, пошедший на титрование, мл; Эж - восстановительный эквивалент железа, равный 55, 85; Vк, Vп - объем соответственно мерной колбы и мерной пипетки, мл - -
 Общая оценка метода Преимущества дихроматометрии: -стандартный раствор титранта готовится по точной навеске; - не требует последующей стандартизации; титрант стабилен даже при длительном хранении; -титрование можно проводить в кислой среде. l l
Общая оценка метода Преимущества дихроматометрии: -стандартный раствор титранта готовится по точной навеске; - не требует последующей стандартизации; титрант стабилен даже при длительном хранении; -титрование можно проводить в кислой среде. l l
 Недостатки хроматометрии: - несколько меньший по сравнению с перманганат-ионом cтандартный OВ потенциал редокс-пары; - более ограниченная возможность определения восстановителей; - необходимость использования редокс-индикаторов.
Недостатки хроматометрии: - несколько меньший по сравнению с перманганат-ионом cтандартный OВ потенциал редокс-пары; - более ограниченная возможность определения восстановителей; - необходимость использования редокс-индикаторов.
 Спасибо за внимание!
Спасибо за внимание!


