Ок.фос. и СРО 2008.ppt
- Количество слайдов: 88
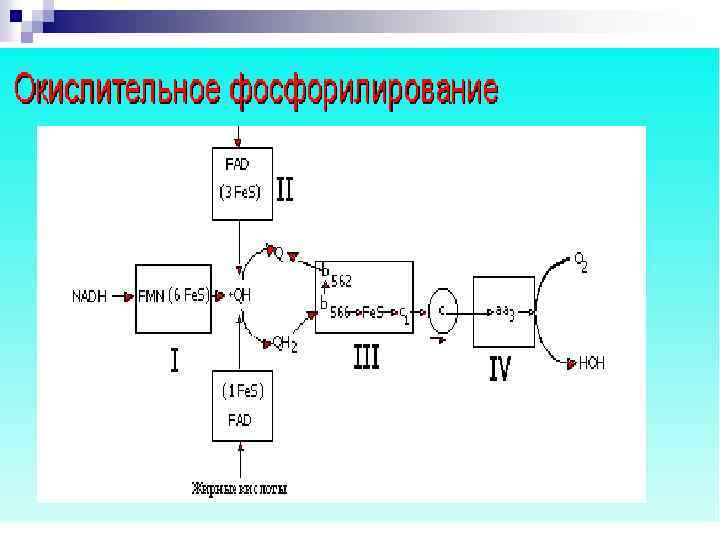
 Окислительное фосфорилирование
Окислительное фосфорилирование
 Окислительное фосфорилированиесинтез АТФ из АДФ и Фн за счёт энергии, выделяющейся при тканевом дыхании. Ø Идею о наличии сопряжения высказал в 1931 году Энгельгардт. Ø Для образования одной макроэргической связи АТФ, затраты на которую составляют не менее 7, 3 ккал, требуется перепад редокс-потенциалов между участками цепи 0, 2 вольта на пару перенесённых электронов.
Окислительное фосфорилированиесинтез АТФ из АДФ и Фн за счёт энергии, выделяющейся при тканевом дыхании. Ø Идею о наличии сопряжения высказал в 1931 году Энгельгардт. Ø Для образования одной макроэргической связи АТФ, затраты на которую составляют не менее 7, 3 ккал, требуется перепад редокс-потенциалов между участками цепи 0, 2 вольта на пару перенесённых электронов.
 Места сопряжения В дыхательной цепи есть 3 участка, в которых перенос электрона сопровождается относительно большим изменением стандартной свободной энергии: Ø НАДН-ДГ − Ko. Q, Ø цитохром В - цитохром С 1, Ø цитохромоксидаза. Это пункты фосфорилирования. Уменьшение энергии на каждом из этих участков достаточно для сопряжённого образования АТФ.
Места сопряжения В дыхательной цепи есть 3 участка, в которых перенос электрона сопровождается относительно большим изменением стандартной свободной энергии: Ø НАДН-ДГ − Ko. Q, Ø цитохром В - цитохром С 1, Ø цитохромоксидаза. Это пункты фосфорилирования. Уменьшение энергии на каждом из этих участков достаточно для сопряжённого образования АТФ.
 Р/О – коэффициент фосфорилирования Ø Ø Р/О – число молей неорганического фосфата, переведённых в органическую форму в расчёте на каждый поглощённый атом кислорода. Пары электронов от НАД-зависимых дегидрогеназ проходят все 3 участка фосфорилирования, что даёт 3 молекулы АТФ. Пары электронов, отщепляемые от сукцината, поступают в дыхательную цепь, минуя участок 1, поэтому образуется 2 молекулы АТФ. При окислении аскорбиновой кислоты Р/О =1.
Р/О – коэффициент фосфорилирования Ø Ø Р/О – число молей неорганического фосфата, переведённых в органическую форму в расчёте на каждый поглощённый атом кислорода. Пары электронов от НАД-зависимых дегидрогеназ проходят все 3 участка фосфорилирования, что даёт 3 молекулы АТФ. Пары электронов, отщепляемые от сукцината, поступают в дыхательную цепь, минуя участок 1, поэтому образуется 2 молекулы АТФ. При окислении аскорбиновой кислоты Р/О =1.
 Взрослому здоровому человеку в день требуется 190 кг АТФ В организме человека – 50 г АТФ. Ø Для удовлетворения потребности организма в химической энергии эти 50 г АТФ должны много раз в течение суток расщепиться до АДФ и Фн с последующим ресинтезом. Ø
Взрослому здоровому человеку в день требуется 190 кг АТФ В организме человека – 50 г АТФ. Ø Для удовлетворения потребности организма в химической энергии эти 50 г АТФ должны много раз в течение суток расщепиться до АДФ и Фн с последующим ресинтезом. Ø
 Механизм окислительного фосфорилирования В 1961 году английский биохимик Питер Митчелл сформулировал хемиосмотическую концепцию превращения энергии в живых клетках. В 1975 году он получил Нобелевскую премию.
Механизм окислительного фосфорилирования В 1961 году английский биохимик Питер Митчелл сформулировал хемиосмотическую концепцию превращения энергии в живых клетках. В 1975 году он получил Нобелевскую премию.
 Основные положения хемиосмотической концепции 1) Движущей силой фосфорилирования является протонный градиент. Перенос электрона сопровождается выкачиванием ионов водорода из матрикса через внутреннюю мембрану митохондрии. При транспорте каждой пары электронов в межмембранном пространстве может накапливаться до 6 протонов. Свободная энергия потока электронов используется для перекачивания ионов водорода наружу против градиента концентрации.
Основные положения хемиосмотической концепции 1) Движущей силой фосфорилирования является протонный градиент. Перенос электрона сопровождается выкачиванием ионов водорода из матрикса через внутреннюю мембрану митохондрии. При транспорте каждой пары электронов в межмембранном пространстве может накапливаться до 6 протонов. Свободная энергия потока электронов используется для перекачивания ионов водорода наружу против градиента концентрации.
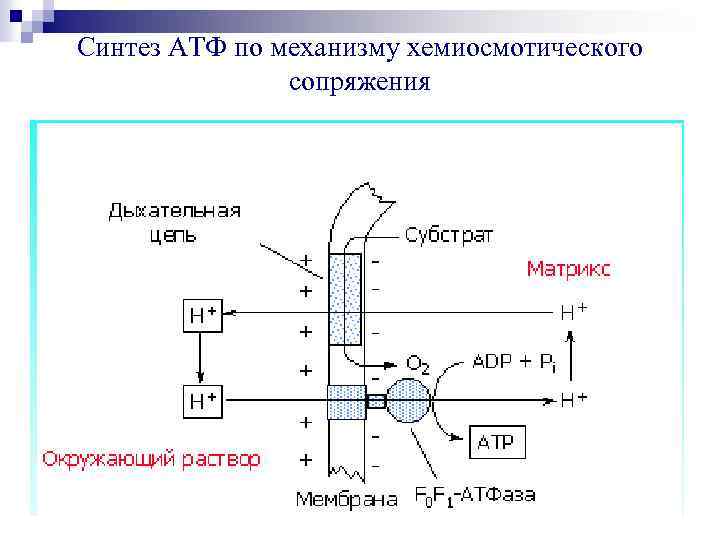 Синтез АТФ по механизму хемиосмотического сопряжения
Синтез АТФ по механизму хемиосмотического сопряжения
 Dm. Н + Перенос электронов создаёт электрохимический + + градиент ионов Н (Dm. Н ), включающий 2 компонента: + Dm. Н = Dy + Dр. Н Dy – мембранный потенциал. Внутренняя сторона мембраны более электроотрицательна, а наружная более электроположительна. Dр. Н – градиент р. Н. Наружная сторона мембраны имеет более кислую реакцию, а матрикс митохондрий –щелочную.
Dm. Н + Перенос электронов создаёт электрохимический + + градиент ионов Н (Dm. Н ), включающий 2 компонента: + Dm. Н = Dy + Dр. Н Dy – мембранный потенциал. Внутренняя сторона мембраны более электроотрицательна, а наружная более электроположительна. Dр. Н – градиент р. Н. Наружная сторона мембраны имеет более кислую реакцию, а матрикс митохондрий –щелочную.
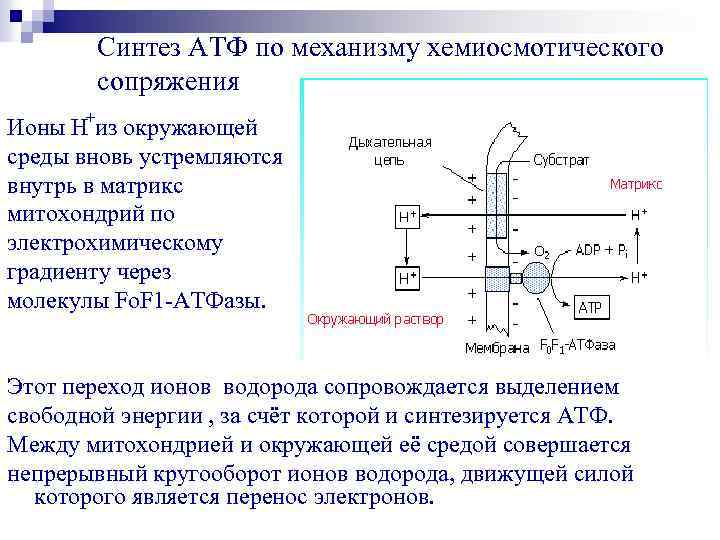 Синтез АТФ по механизму хемиосмотического сопряжения Ионы Н+из окружающей среды вновь устремляются внутрь в матрикс митохондрий по электрохимическому градиенту через молекулы Fo. F 1 -АТФазы. Этот переход ионов водорода сопровождается выделением свободной энергии , за счёт которой и синтезируется АТФ. Между митохондрией и окружающей её средой совершается непрерывный кругооборот ионов водорода, движущей силой которого является перенос электронов.
Синтез АТФ по механизму хемиосмотического сопряжения Ионы Н+из окружающей среды вновь устремляются внутрь в матрикс митохондрий по электрохимическому градиенту через молекулы Fo. F 1 -АТФазы. Этот переход ионов водорода сопровождается выделением свободной энергии , за счёт которой и синтезируется АТФ. Между митохондрией и окружающей её средой совершается непрерывный кругооборот ионов водорода, движущей силой которого является перенос электронов.
 Основные положения хемиосмотической концепции 2) Окислительное фосфорилирование требует целостности внутренней митохондриальной мембраны. При разрыве мембраны нет окислительного фосфорилирования, хотя перенос электронов продолжается.
Основные положения хемиосмотической концепции 2) Окислительное фосфорилирование требует целостности внутренней митохондриальной мембраны. При разрыве мембраны нет окислительного фосфорилирования, хотя перенос электронов продолжается.
 Основные положения хемиосмотической концепции 3) Внутренняя митохондриальная мембрана - + + непроницаема для ионов Н, ОН, К, Сl. Если мембрана при повреждении становится проницаемой, то окислительного фосфорилирования не будет.
Основные положения хемиосмотической концепции 3) Внутренняя митохондриальная мембрана - + + непроницаема для ионов Н, ОН, К, Сl. Если мембрана при повреждении становится проницаемой, то окислительного фосфорилирования не будет.
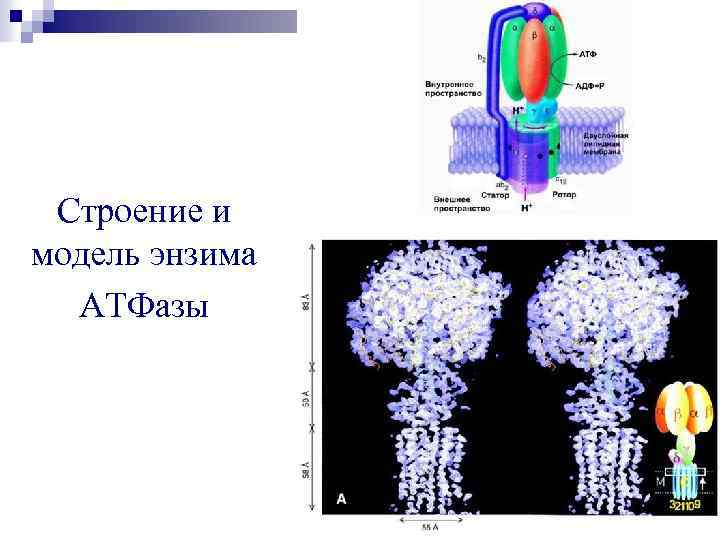 Строение и модель энзима АТФазы
Строение и модель энзима АТФазы
 Ø Ø Тканевое дыхание заряжает митохондриальную мембрану, а окислительное фосфорилирование разряжает её, иначе мембрана лопнет. Энергопреобразующие мембраны сначала + генерируют Dm. Н, а затем реализуют его через Н -АТФ-синтетазу в синтез АТФ.
Ø Ø Тканевое дыхание заряжает митохондриальную мембрану, а окислительное фосфорилирование разряжает её, иначе мембрана лопнет. Энергопреобразующие мембраны сначала + генерируют Dm. Н, а затем реализуют его через Н -АТФ-синтетазу в синтез АТФ.

 АТФ-синтетаза Ø Состоит из двух компонентов Fо и F 1. Ø Ø Ø По форме напоминает гриб, головка которого обращена в сторону матрикса. F 1 - каталитическая часть из 9 субъединиц. Fо встроен во внутреннюю мембрану, осуществляет + перенос Н через канал. Олигомицин – ингибитор фермента. Dm. Н+ приводит в действие АТФ-синтазу, катализирующую реакцию: АДФ + Фн Ё АТФ
АТФ-синтетаза Ø Состоит из двух компонентов Fо и F 1. Ø Ø Ø По форме напоминает гриб, головка которого обращена в сторону матрикса. F 1 - каталитическая часть из 9 субъединиц. Fо встроен во внутреннюю мембрану, осуществляет + перенос Н через канал. Олигомицин – ингибитор фермента. Dm. Н+ приводит в действие АТФ-синтазу, катализирующую реакцию: АДФ + Фн Ё АТФ
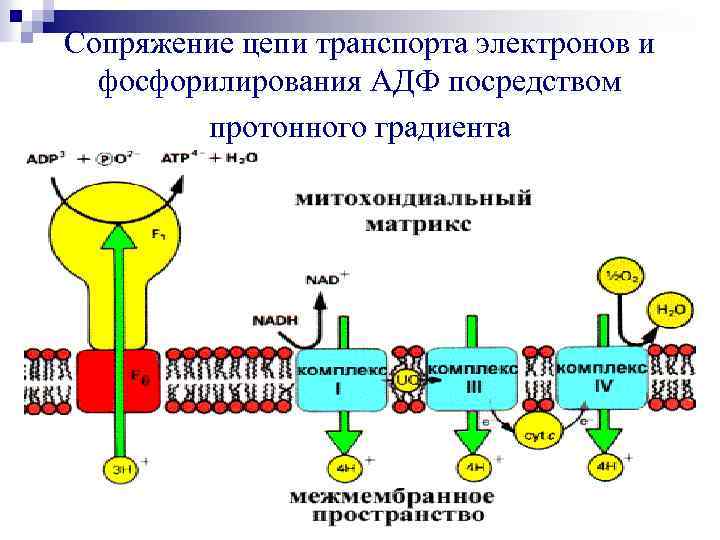 Сопряжение цепи транспорта электронов и фосфорилирования AДФ посредством протонного градиента
Сопряжение цепи транспорта электронов и фосфорилирования AДФ посредством протонного градиента
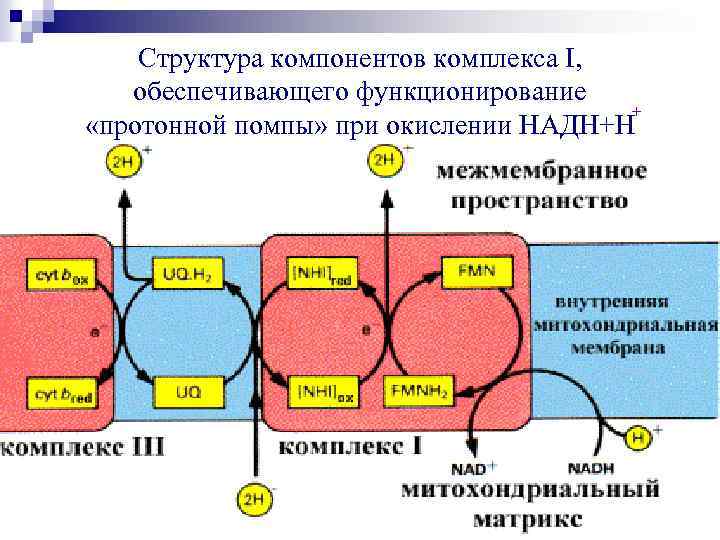 Структура компонентов комплекса I, обеспечивающего функционирование + «протонной помпы» при окислении НАДН+Н
Структура компонентов комплекса I, обеспечивающего функционирование + «протонной помпы» при окислении НАДН+Н
 В 1997 году Бойеру и Уокеру была присуждена Нобелевская премия за выявление молекулярных механизмов действия протонной АТФ-синтазы Ø Ø Реккер и сотрудники показали, что в изолированном виде F 1 действует как АТФ-аза, то есть расщепляет АТФ на АДФ и Фн. + Преобразовать Dm. Н в синтез АТФ может только полный F 1 + Fо комплекс.
В 1997 году Бойеру и Уокеру была присуждена Нобелевская премия за выявление молекулярных механизмов действия протонной АТФ-синтазы Ø Ø Реккер и сотрудники показали, что в изолированном виде F 1 действует как АТФ-аза, то есть расщепляет АТФ на АДФ и Фн. + Преобразовать Dm. Н в синтез АТФ может только полный F 1 + Fо комплекс.
 Ø Ø Ø Энергия находится в области протонных каналов на внутренней поверхности внутренней мембраны. Как только 2 Н проходят из среды в матрикс через + канал, выделяется энергия, которая используется для синтеза АТФ. Вместе с протонами идёт фосфат. АДФ поступает в выросты, а выйти не может, а АТФ легко выходит из митохондрий, а поступать туда не может.
Ø Ø Ø Энергия находится в области протонных каналов на внутренней поверхности внутренней мембраны. Как только 2 Н проходят из среды в матрикс через + канал, выделяется энергия, которая используется для синтеза АТФ. Вместе с протонами идёт фосфат. АДФ поступает в выросты, а выйти не может, а АТФ легко выходит из митохондрий, а поступать туда не может.
 энергетические источники + + Dm Н Dm Na АТФ субстраты
энергетические источники + + Dm Н Dm Na АТФ субстраты
 Образование АТФ путём окислительного фосфорилирования регулируется в соответствии с энергетическими нуждами клетки. Уровни регуляции: 1. дыхательный контроль, 2. разобщители.
Образование АТФ путём окислительного фосфорилирования регулируется в соответствии с энергетическими нуждами клетки. Уровни регуляции: 1. дыхательный контроль, 2. разобщители.
 Дыхательный контроль – изменение скорости дыхания с изменением концентрации АДФ. В норме это отношение велико. Если повышена концентрация АДФ: Ø активируется ЦТК, Ø возрастает скорость переноса электронов и окислительное фосфорилирование, Ø усиливается синтез АТФ. Если снижена концентрация АДФ, то тормозится ЦТК.
Дыхательный контроль – изменение скорости дыхания с изменением концентрации АДФ. В норме это отношение велико. Если повышена концентрация АДФ: Ø активируется ЦТК, Ø возрастает скорость переноса электронов и окислительное фосфорилирование, Ø усиливается синтез АТФ. Если снижена концентрация АДФ, то тормозится ЦТК.
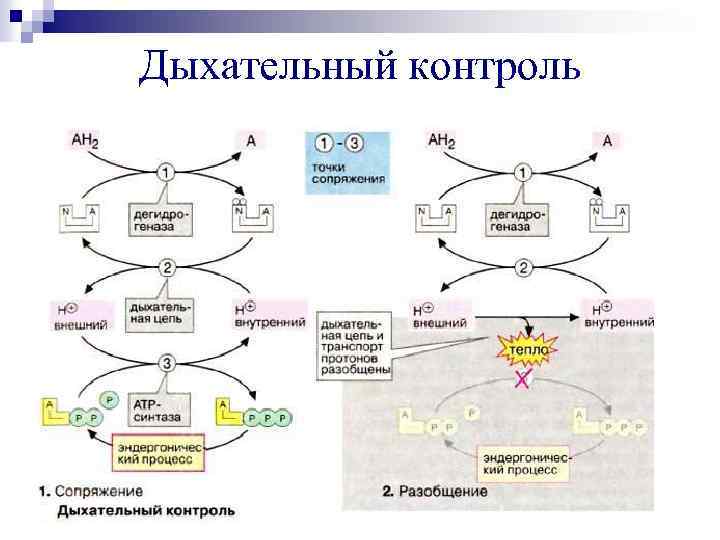 Дыхательный контроль
Дыхательный контроль
 Разобщители Ø Разобщают перенос электронов и синтез АТФ. При Ø этом свободная энергия, выделенная при переносе электрона, переходит в тепло, а не запасается в виде АТФ. Повышают проницаемость внутренней мембраны + + + митохондрий для ионов Н, К, Na.
Разобщители Ø Разобщают перенос электронов и синтез АТФ. При Ø этом свободная энергия, выделенная при переносе электрона, переходит в тепло, а не запасается в виде АТФ. Повышают проницаемость внутренней мембраны + + + митохондрий для ионов Н, К, Na.
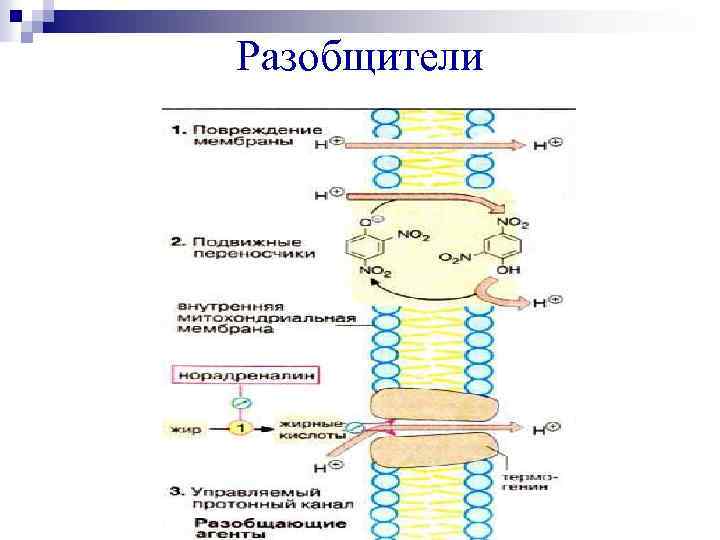 Разобщители
Разобщители
 Различают разобщители 1. естественной природы: прогестерон, тироксин, холод, жирные кислоты. 2. патологические факторы (дифтерийный токсин), 3. искусственные (валиномицин, 2, 4 – динитрофенол, грамицидин). Ионофоры – жирорастворимые вещества, способные связывать ионы и переносить их через мембрану, подавляют окислительное фосфорилирование.
Различают разобщители 1. естественной природы: прогестерон, тироксин, холод, жирные кислоты. 2. патологические факторы (дифтерийный токсин), 3. искусственные (валиномицин, 2, 4 – динитрофенол, грамицидин). Ионофоры – жирорастворимые вещества, способные связывать ионы и переносить их через мембрану, подавляют окислительное фосфорилирование.
 Свободное (нефосфорилирующее) дыхание Ø В митохондриях дыхание не всегда сопровождается с фосфорилированием. Такой путь окисления субстратов в дыхательной цепи назван Ленинджером свободным окислением. Ø Вся энергия окисляемых веществ превращается при этом в теплоту. Теплообразующая функция митохондрий была впервые продемонстрирована В. П. Скулачёвым.
Свободное (нефосфорилирующее) дыхание Ø В митохондриях дыхание не всегда сопровождается с фосфорилированием. Такой путь окисления субстратов в дыхательной цепи назван Ленинджером свободным окислением. Ø Вся энергия окисляемых веществ превращается при этом в теплоту. Теплообразующая функция митохондрий была впервые продемонстрирована В. П. Скулачёвым.
 В организме есть термогенные ткани. Бурый жир. Ø Ø У крольчат 5 -6% от массы тела приходится на бурый жир. Много его у зимоспящих животных. У новорожденных детей на бурый жир приходится 2%. Он расположен в области шеи, спины. Бурый жир содержит много митохондрий, кровеносных сосудов, симпатических нервных волокон. Внутренние мембраны митохондрий бурого жира имеют специальные поры для ионов водорода. В них содержится белок ионофор-термогенин.
В организме есть термогенные ткани. Бурый жир. Ø Ø У крольчат 5 -6% от массы тела приходится на бурый жир. Много его у зимоспящих животных. У новорожденных детей на бурый жир приходится 2%. Он расположен в области шеи, спины. Бурый жир содержит много митохондрий, кровеносных сосудов, симпатических нервных волокон. Внутренние мембраны митохондрий бурого жира имеют специальные поры для ионов водорода. В них содержится белок ионофор-термогенин.
 Субстратное фосфорилирование – образование АТФ за счёт превращения субстрата, имеющего макроэргическую связь. COOH | | CH 2 | | СН 2 + ГДФ + Фн + ГТФ + HS-Ko. A СН 2 | Сукцинил-Ко. А- | C=O синтетаза COOH S-Ko. A Сукцинат Cукцинил-Ко. А
Субстратное фосфорилирование – образование АТФ за счёт превращения субстрата, имеющего макроэргическую связь. COOH | | CH 2 | | СН 2 + ГДФ + Фн + ГТФ + HS-Ko. A СН 2 | Сукцинил-Ко. А- | C=O синтетаза COOH S-Ko. A Сукцинат Cукцинил-Ко. А
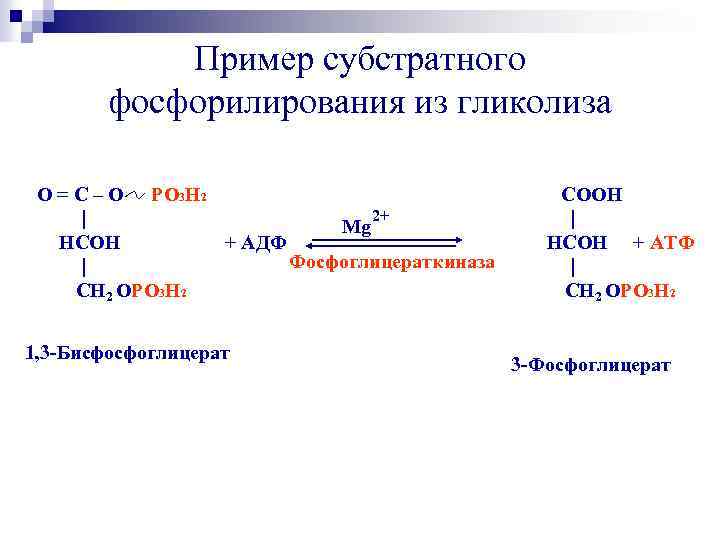 Пример субстратного фосфорилирования из гликолиза O = C – O PO 3 H 2 2+ | Mg HCOH + АДФ Фосфоглицераткиназа | СН 2 OPO 3 H 2 1, 3 -Бисфосфоглицерат COOH | HCOH + АТФ | СН 2 OPO 3 H 2 3 -Фосфоглицерат
Пример субстратного фосфорилирования из гликолиза O = C – O PO 3 H 2 2+ | Mg HCOH + АДФ Фосфоглицераткиназа | СН 2 OPO 3 H 2 1, 3 -Бисфосфоглицерат COOH | HCOH + АТФ | СН 2 OPO 3 H 2 3 -Фосфоглицерат
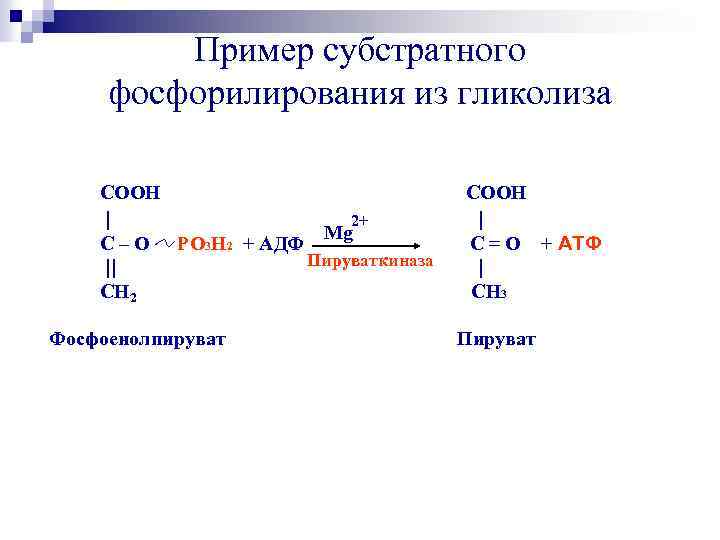 Пример субстратного фосфорилирования из гликолиза COOH | 2+ Mg C – O PO 3 H 2 + АДФ Пируваткиназа || СН 2 Фосфоенолпируват COOH | C = O + АТФ | CH 3 Пируват
Пример субстратного фосфорилирования из гликолиза COOH | 2+ Mg C – O PO 3 H 2 + АДФ Пируваткиназа || СН 2 Фосфоенолпируват COOH | C = O + АТФ | CH 3 Пируват
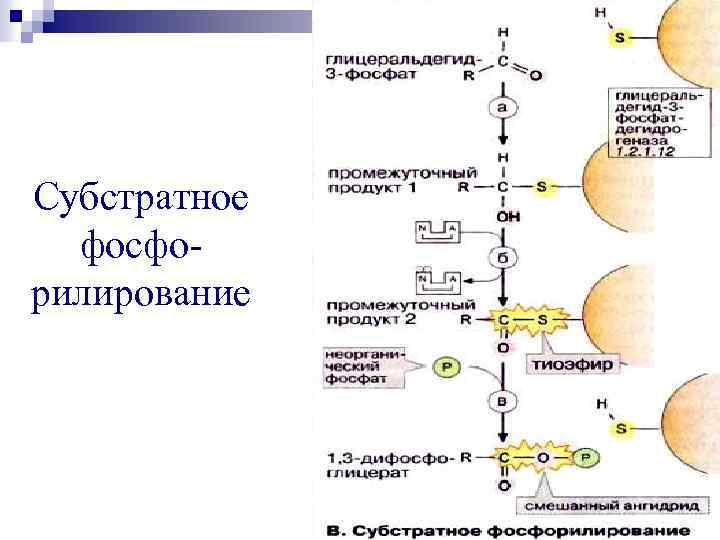 Субстратное фосфорилирование
Субстратное фосфорилирование
 Отличия окислительного и субстратного фосфорилирования Окислительное Субстратное Сопряжено с транспортом электронов в дыхательной цепи За счёт превращения субстрата, имеющего макроэргическую связь Локализация в митохондриях и ядерных мембранах Локализация в митохондриях и в цитоплазме Главный генератор энергии Подсобный механизм. Стаёт ведущим при недостатке кислорода. SH 2 + O 2+АДФ+Фн Ё АТФ + Н 20 + S S~Р+АДФ Ё АТФ + S Аэробный процесс Может протекать в аэробных и анаэробных условиях Зависит от разобщителей Не зависит от разобщителей
Отличия окислительного и субстратного фосфорилирования Окислительное Субстратное Сопряжено с транспортом электронов в дыхательной цепи За счёт превращения субстрата, имеющего макроэргическую связь Локализация в митохондриях и ядерных мембранах Локализация в митохондриях и в цитоплазме Главный генератор энергии Подсобный механизм. Стаёт ведущим при недостатке кислорода. SH 2 + O 2+АДФ+Фн Ё АТФ + Н 20 + S S~Р+АДФ Ё АТФ + S Аэробный процесс Может протекать в аэробных и анаэробных условиях Зависит от разобщителей Не зависит от разобщителей
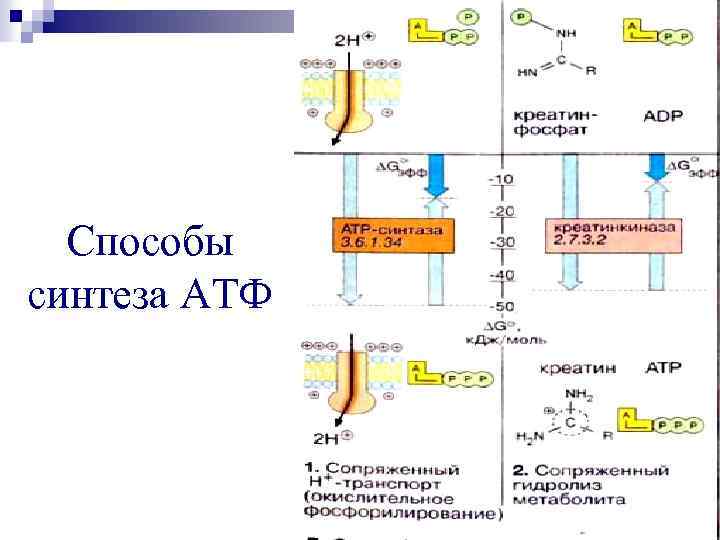 Способы синтеза АТФ
Способы синтеза АТФ
 Использование кислорода в организме Ø Ø До 80 -90% фонда кислорода расходуется на окисление субстратов в митохондриальной дыхательной цепи. Помимо тканевого дыхания кислород расходуется в реакциях микросомального окисления, в реакциях, катализируемых оксигеназами, монооксигеназами, диоксигеназами.
Использование кислорода в организме Ø Ø До 80 -90% фонда кислорода расходуется на окисление субстратов в митохондриальной дыхательной цепи. Помимо тканевого дыхания кислород расходуется в реакциях микросомального окисления, в реакциях, катализируемых оксигеназами, монооксигеназами, диоксигеназами.
 Микросомальное окисление Ø Микросомы – морфологически замкнутые везикулы, в которые Ø Ø превращается эндоплазматический ретикулум при гомогенизации тканей. Функция микросомального окисления: использование кислорода с «пластическими» целями. Микросомальное окисление осуществляется во фракции микросом печени и надпочечников, но может встречаться и в любой другой ткани.
Микросомальное окисление Ø Микросомы – морфологически замкнутые везикулы, в которые Ø Ø превращается эндоплазматический ретикулум при гомогенизации тканей. Функция микросомального окисления: использование кислорода с «пластическими» целями. Микросомальное окисление осуществляется во фракции микросом печени и надпочечников, но может встречаться и в любой другой ткани.
 Монооксигеназная система состоит из трёх компонентов: Ø флавопротеина, Ø железосерного белка, Ø цитохрома Р 450. Монооксигеназы присоединяют к субстрату один из двух атомов кислорода. + НАДФН+Н - поставщик атомов водорода для восстановления второго атома кислорода до воды. + Электрон НАДФН+Н переносится на флавопротеин, затем на белок, содержащий негемовое железо, затем на цитохром Р 450. В цепи микросомального окисления образуются свободные радикалы. 2+ Fe от Р 450 - радикалообразующий центр.
Монооксигеназная система состоит из трёх компонентов: Ø флавопротеина, Ø железосерного белка, Ø цитохрома Р 450. Монооксигеназы присоединяют к субстрату один из двух атомов кислорода. + НАДФН+Н - поставщик атомов водорода для восстановления второго атома кислорода до воды. + Электрон НАДФН+Н переносится на флавопротеин, затем на белок, содержащий негемовое железо, затем на цитохром Р 450. В цепи микросомального окисления образуются свободные радикалы. 2+ Fe от Р 450 - радикалообразующий центр.
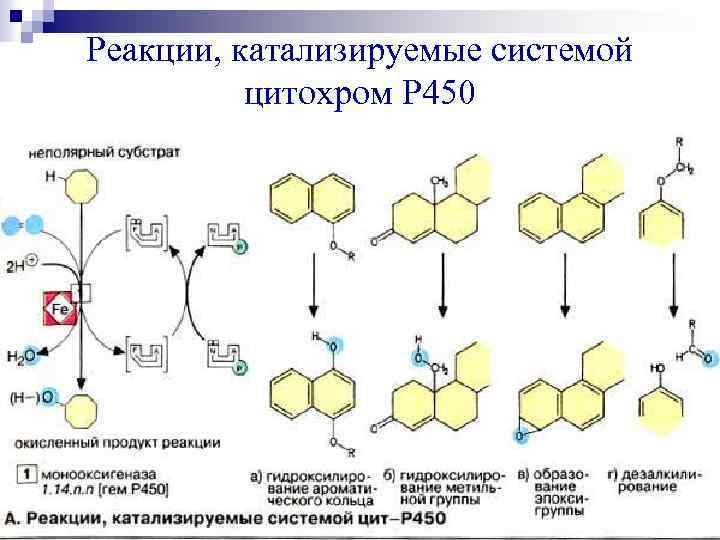 Реакции, катализируемые системой цитохром Р 450
Реакции, катализируемые системой цитохром Р 450

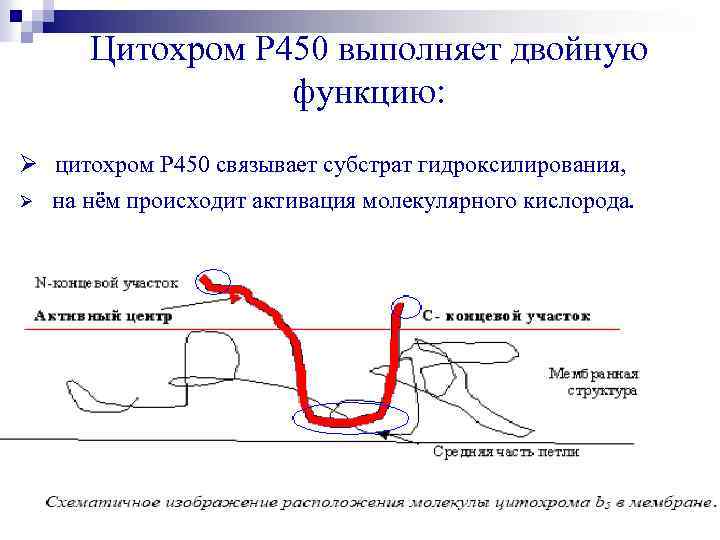 Цитохром Р 450 выполняет двойную функцию: Ø цитохром Р 450 связывает субстрат гидроксилирования, Ø на нём происходит активация молекулярного кислорода.
Цитохром Р 450 выполняет двойную функцию: Ø цитохром Р 450 связывает субстрат гидроксилирования, Ø на нём происходит активация молекулярного кислорода.
 Цепь микросом печени - универсальная биологическая система, окисляющая Ø Ø неполярные соединения любого происхождения: эндогенные субстраты – стероидные гормоны, холестерин, витамины, ненасыщенные жирные кислоты. экзогенные субстраты (ксенобиотики) - гидрофобные загрязнители окружающей среды, канцерогены, лекарства, пестициды. Ключевым ферментом в элиминации, детоксикации и метаболической активации экзогенных субстратов является цитохром Р 450.
Цепь микросом печени - универсальная биологическая система, окисляющая Ø Ø неполярные соединения любого происхождения: эндогенные субстраты – стероидные гормоны, холестерин, витамины, ненасыщенные жирные кислоты. экзогенные субстраты (ксенобиотики) - гидрофобные загрязнители окружающей среды, канцерогены, лекарства, пестициды. Ключевым ферментом в элиминации, детоксикации и метаболической активации экзогенных субстратов является цитохром Р 450.
 Элиминация. Окисление молекулярным кислородом приводит к увеличению гидрофильности чужеродных соединений. Детоксикация. Химическая модификация приводит к потере молекулой её биологической активности, токсичности. Метаболическая активация. Продукт реакции становится более активным, чем молекула, из которой он образовался.
Элиминация. Окисление молекулярным кислородом приводит к увеличению гидрофильности чужеродных соединений. Детоксикация. Химическая модификация приводит к потере молекулой её биологической активности, токсичности. Метаболическая активация. Продукт реакции становится более активным, чем молекула, из которой он образовался.
 Микросомальные гидроксилазы могут катализировать не только гидроксилирование, но и другие реакции: Ø эпоксидирование, Ø сульфоокисление, Ø дезалкилирование, Ø восстановление нитросоединений. Полиспецифичность микросомального окисления объясняется тем, что цитохром Р 450 существует в виде различных изоферментов.
Микросомальные гидроксилазы могут катализировать не только гидроксилирование, но и другие реакции: Ø эпоксидирование, Ø сульфоокисление, Ø дезалкилирование, Ø восстановление нитросоединений. Полиспецифичность микросомального окисления объясняется тем, что цитохром Р 450 существует в виде различных изоферментов.
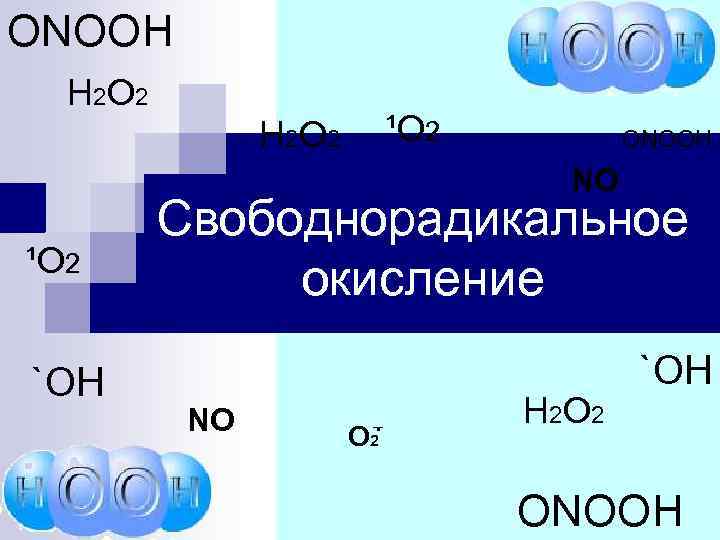 ONOOH Н 2 О 2 ¹О 2 Н 2 О 2 ONOOH NO ¹О 2 `ОН Свободнорадикальное окисление NO . О 2 _ Н 2 О 2 `ОН ONOOH
ONOOH Н 2 О 2 ¹О 2 Н 2 О 2 ONOOH NO ¹О 2 `ОН Свободнорадикальное окисление NO . О 2 _ Н 2 О 2 `ОН ONOOH
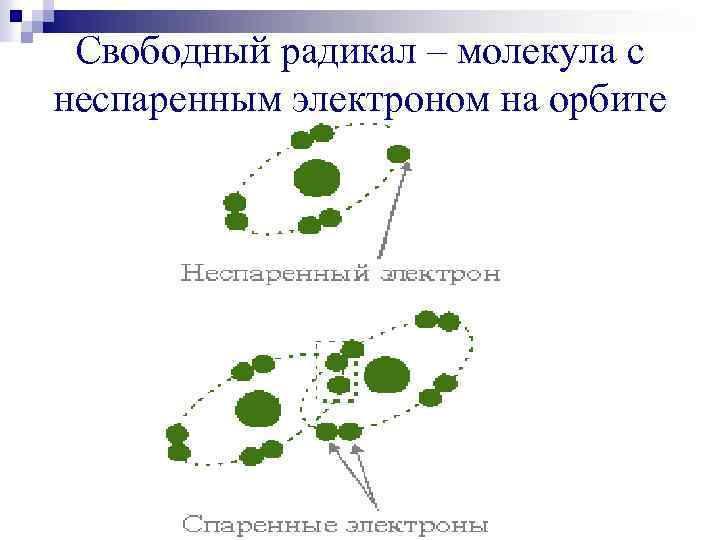 Свободный радикал – молекула с неспаренным электроном на орбите
Свободный радикал – молекула с неспаренным электроном на орбите
 Избыток кислорода повреждает мембраны. При гипероксии образуются свободные радикалы.
Избыток кислорода повреждает мембраны. При гипероксии образуются свободные радикалы.
 Свободнорадикальное окисление – универсальный процесс, сопровождающий нормальную жизнедеятельность и активирующийся при патологии. Ø Ø Свободные радикалы образуются в живом организме в результате естественного метаболизма кислорода, а также в процессе окислительно-восстановительных превращений различных эндогенных субстратов, лекарств, ксенобиотиков. При физиологических условиях 5 -6% потребляемого. ¯ кислорода восстанавливается до О 2
Свободнорадикальное окисление – универсальный процесс, сопровождающий нормальную жизнедеятельность и активирующийся при патологии. Ø Ø Свободные радикалы образуются в живом организме в результате естественного метаболизма кислорода, а также в процессе окислительно-восстановительных превращений различных эндогенных субстратов, лекарств, ксенобиотиков. При физиологических условиях 5 -6% потребляемого. ¯ кислорода восстанавливается до О 2
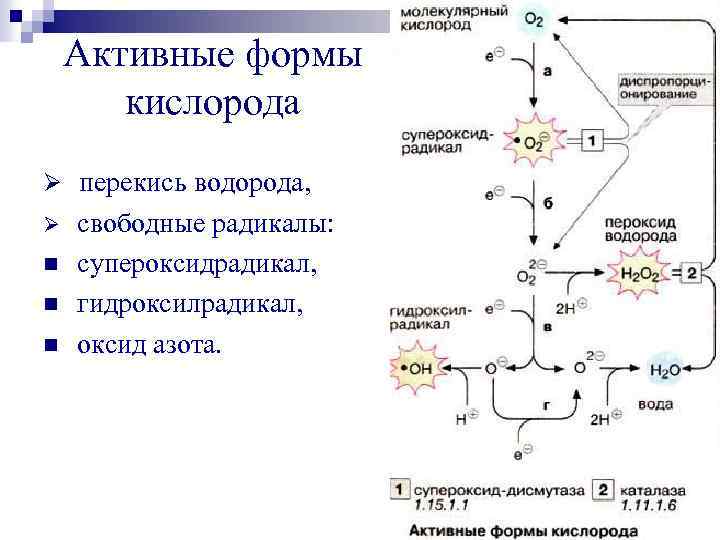 Активные формы кислорода Ø перекись водорода, Ø n n n свободные радикалы: супероксидрадикал, гидроксилрадикал, оксид азота.
Активные формы кислорода Ø перекись водорода, Ø n n n свободные радикалы: супероксидрадикал, гидроксилрадикал, оксид азота.
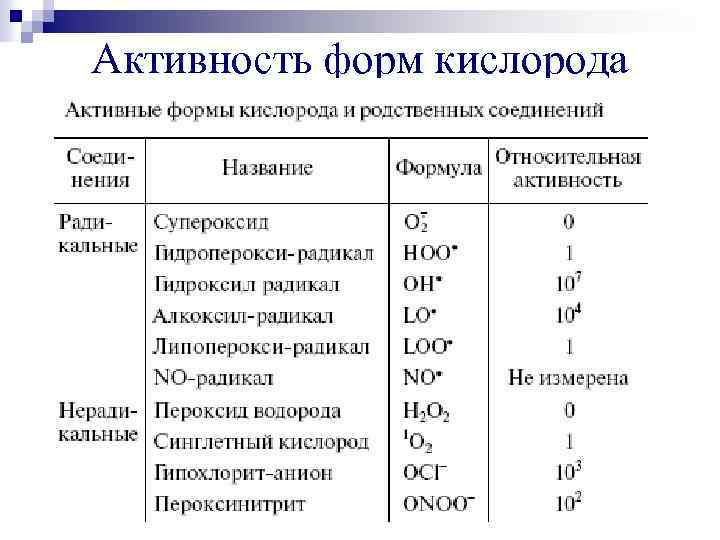 Активность форм кислорода
Активность форм кислорода
 Свободные радикалы промежуточные продукты нормального метаболизма. Образуются: Ø при синтезе простагландинов, Ø при синтезе стероидных гормонов, Ø в дыхательной цепи, Ø в цепи микросомального окисления, Ø при фагоцитозе.
Свободные радикалы промежуточные продукты нормального метаболизма. Образуются: Ø при синтезе простагландинов, Ø при синтезе стероидных гормонов, Ø в дыхательной цепи, Ø в цепи микросомального окисления, Ø при фагоцитозе.
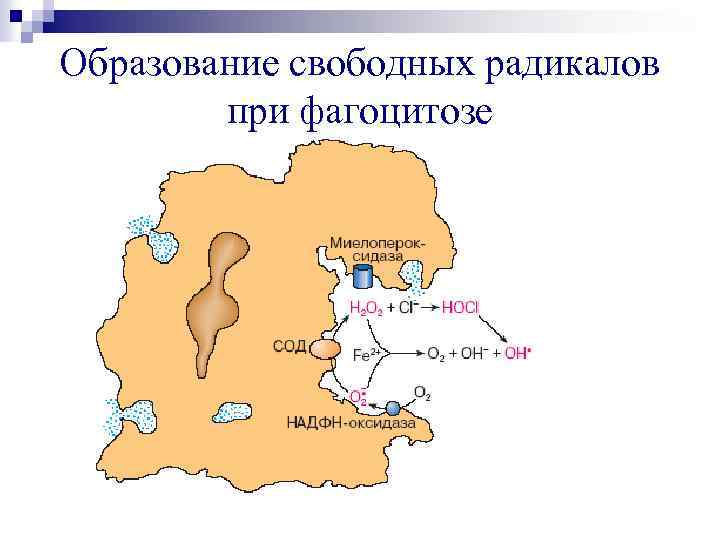 Образование свободных радикалов при фагоцитозе
Образование свободных радикалов при фагоцитозе
 Образование активных форм кислорода Ø Ø Ø Ø При восстановлении кислорода до воды образуются активные формы кислорода. . О 2 + ē → О¯ 2 +. ¯ О 2 + ē + 2 Н → Н 2 О 2. + Н 2 О 2 + ē + Н → Н 2 О + ОН + ē + Н → Н 2 О Конечным этапом четырёхэлектронного восстановления кислорода является вода. + Суммарно: О 2 + 4ē + 4 Н → 2 Н 2 О
Образование активных форм кислорода Ø Ø Ø Ø При восстановлении кислорода до воды образуются активные формы кислорода. . О 2 + ē → О¯ 2 +. ¯ О 2 + ē + 2 Н → Н 2 О 2. + Н 2 О 2 + ē + Н → Н 2 О + ОН + ē + Н → Н 2 О Конечным этапом четырёхэлектронного восстановления кислорода является вода. + Суммарно: О 2 + 4ē + 4 Н → 2 Н 2 О

 Токсичность кислорода Ø Свободные радикалы вовлекаются в механизмы, повышающие выживаемость клеток в неблагоприятных условиях, а снижение генерации свободных радикалов в организме способствует ослаблению клеточного иммунитета.
Токсичность кислорода Ø Свободные радикалы вовлекаются в механизмы, повышающие выживаемость клеток в неблагоприятных условиях, а снижение генерации свободных радикалов в организме способствует ослаблению клеточного иммунитета.
 Пути образования супероксидрадикалов Ø Ферментативные. Супероксидрадикал может продуцироваться в клетках ферментами : ксантиноксидазой, НАДФ-оксидазой, альдегидоксидазой, дигидрооротатоксидазой. Источник супероксидрадикала – убихинон. Ø В процессе одноэлектронного восстановления кислорода. Ø Под влиянием УФО. Ø Путём взаимодействия кислорода с ионами металлов переменной валентности. Ø Неферментативные пути - спонтанное окисление некоторых соединений: гидрохинонов, катехоламинов, лейкофлавинов, тетрагидроптеринов, фередоксина.
Пути образования супероксидрадикалов Ø Ферментативные. Супероксидрадикал может продуцироваться в клетках ферментами : ксантиноксидазой, НАДФ-оксидазой, альдегидоксидазой, дигидрооротатоксидазой. Источник супероксидрадикала – убихинон. Ø В процессе одноэлектронного восстановления кислорода. Ø Под влиянием УФО. Ø Путём взаимодействия кислорода с ионами металлов переменной валентности. Ø Неферментативные пути - спонтанное окисление некоторых соединений: гидрохинонов, катехоламинов, лейкофлавинов, тетрагидроптеринов, фередоксина.
 Супероксидрадикал Ø Гидрофильный супероксидрадикал не может Ø покидать клетку и накапливается в цитоплазме. Его превращения приводят к образованию ряда активных окислителей.
Супероксидрадикал Ø Гидрофильный супероксидрадикал не может Ø покидать клетку и накапливается в цитоплазме. Его превращения приводят к образованию ряда активных окислителей.
 Оксид азота Ø Ø Супероксидрадикал способен активировать NOсинтазу, которая образует в тканях NO-радикал. Реакция окисления L-аргинина, катализируемая NO -синтазой, приводит к образованию двух продуктов свободно-радикальной природы – оксида азота и супероксилрадикала. Взаимодействие этих радикалов приводит к образованию пероксинитрита и гидроксилрадикала, которые являются важными факторами в нейротоксичности оксида азота.
Оксид азота Ø Ø Супероксидрадикал способен активировать NOсинтазу, которая образует в тканях NO-радикал. Реакция окисления L-аргинина, катализируемая NO -синтазой, приводит к образованию двух продуктов свободно-радикальной природы – оксида азота и супероксилрадикала. Взаимодействие этих радикалов приводит к образованию пероксинитрита и гидроксилрадикала, которые являются важными факторами в нейротоксичности оксида азота.
 Перекись водорода Ø Ø инициирует свободнорадикальное окисление, цитотоксична, может генерировать гидроксилрадикал в присутствии ионов железа и ли превращаться в гипохлорит-анион ферментом миелопероксидазой. Гидроксилрадикал и гипохлорит-анион – сильные окислители, способны модифицировать белки, НК, индуцировать ПОЛ, приводить к нарушению мембран, гибели клеток.
Перекись водорода Ø Ø инициирует свободнорадикальное окисление, цитотоксична, может генерировать гидроксилрадикал в присутствии ионов железа и ли превращаться в гипохлорит-анион ферментом миелопероксидазой. Гидроксилрадикал и гипохлорит-анион – сильные окислители, способны модифицировать белки, НК, индуцировать ПОЛ, приводить к нарушению мембран, гибели клеток.
 Пути образования перекиси водорода Ø Ø . - + ē + 2 Н+ → Н 2 О 2, О 2 . образуется теми же ферментами, что и О 2 , в митохондриях СОД, МАО, сарколизиноксидаза, убихинон – источники перекиси водорода, в пероксисомах есть набор ферментов для образования перекиси водорода: уратоксидаза, оксидазы L-АМК. убихинон
Пути образования перекиси водорода Ø Ø . - + ē + 2 Н+ → Н 2 О 2, О 2 . образуется теми же ферментами, что и О 2 , в митохондриях СОД, МАО, сарколизиноксидаза, убихинон – источники перекиси водорода, в пероксисомах есть набор ферментов для образования перекиси водорода: уратоксидаза, оксидазы L-АМК. убихинон
 Гидроксилрадикал. . - Н 2 О 2 + О 2 → ОН + ОH +О 2, 3+ 2+ Супероксидрадикал восстанавливает Fe в Fe, а гидроксилрадикал образуется при разложении перекиси водорода ионом Fe 2+. . + Ø Н 2 О 2 + ē + Н → Н 2 О + ОН, Ø образуется при облучении биологических систем, Ø образуется из гипохлоританиона в присутствии ионов железа, Ø спонтанный распад пероксинитрита. Ø
Гидроксилрадикал. . - Н 2 О 2 + О 2 → ОН + ОH +О 2, 3+ 2+ Супероксидрадикал восстанавливает Fe в Fe, а гидроксилрадикал образуется при разложении перекиси водорода ионом Fe 2+. . + Ø Н 2 О 2 + ē + Н → Н 2 О + ОН, Ø образуется при облучении биологических систем, Ø образуется из гипохлоританиона в присутствии ионов железа, Ø спонтанный распад пероксинитрита. Ø
 ¹О 2 – синглетный кислород – сильный окислитель и инициатор свободнорадикального окисления. Ø Ø ¹О 2 – это не свободный радикал, а активная форма молекулярного кислорода в синглетной форме, то есть со спаренными электронами на каждой из орбиталей, имеющими противоположно направленные спины. . . - + ОН → ОН-+ ¹О 2
¹О 2 – синглетный кислород – сильный окислитель и инициатор свободнорадикального окисления. Ø Ø ¹О 2 – это не свободный радикал, а активная форма молекулярного кислорода в синглетной форме, то есть со спаренными электронами на каждой из орбиталей, имеющими противоположно направленные спины. . . - + ОН → ОН-+ ¹О 2
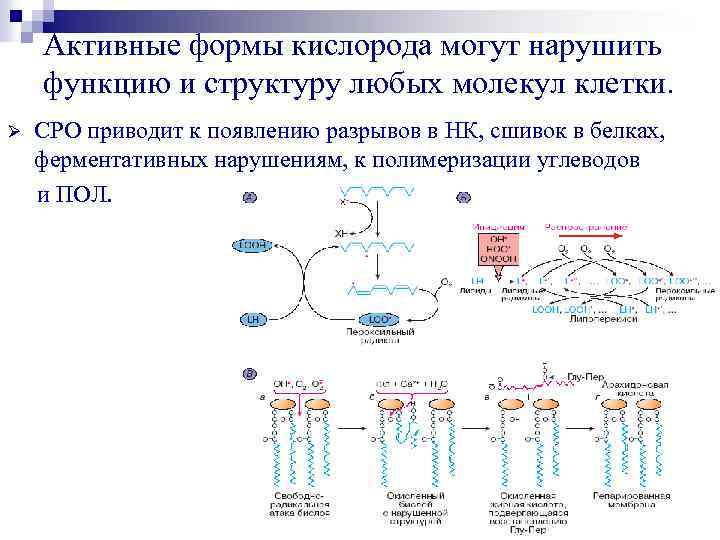 Активные формы кислорода могут нарушить функцию и структуру любых молекул клетки. Ø СРО приводит к появлению разрывов в НК, сшивок в белках, ферментативных нарушениям, к полимеризации углеводов и ПОЛ.
Активные формы кислорода могут нарушить функцию и структуру любых молекул клетки. Ø СРО приводит к появлению разрывов в НК, сшивок в белках, ферментативных нарушениям, к полимеризации углеводов и ПОЛ.
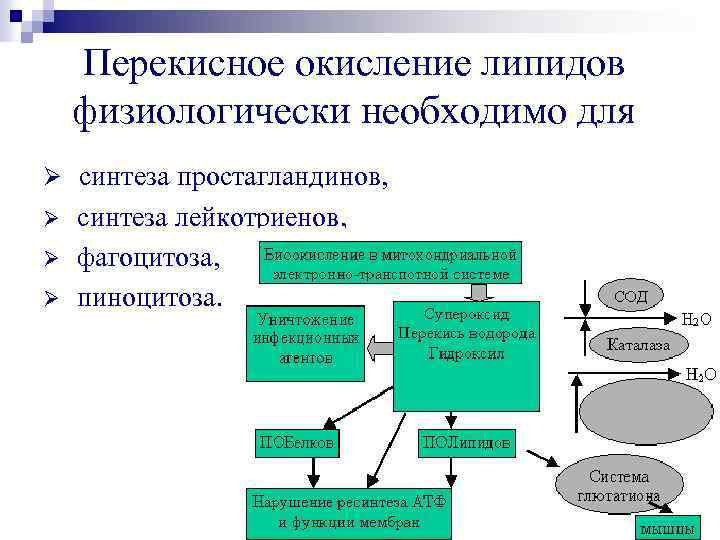 Перекисное окисление липидов физиологически необходимо для Ø синтеза простагландинов, Ø Ø Ø синтеза лейкотриенов, фагоцитоза, пиноцитоза.
Перекисное окисление липидов физиологически необходимо для Ø синтеза простагландинов, Ø Ø Ø синтеза лейкотриенов, фагоцитоза, пиноцитоза.
 Тетрада ПОЛ Ø повреждение мембран и других липопротеинов, Ø Ø Ø инактивация ферментов, подавление деления клеток, накопление инертных полимеров.
Тетрада ПОЛ Ø повреждение мембран и других липопротеинов, Ø Ø Ø инактивация ферментов, подавление деления клеток, накопление инертных полимеров.
 ПОЛ Ø Ø Ø Для развития ПОЛ необходимо образование радикала жирной кислоты, лишённого атома водорода путём его отрыва. RH→R · → ROOH Затем кислород внедряется в ПНЖК с образованием пероксидного радикала ROO· с другой ПНЖК приводит к образованию гидропероксида ROOH и нового радикала R 1 ·. Гидропероксиды липидов ROOH в присутствии ионов железа распадаются с образованием RО· и ·ОН, поддерживая СРО.
ПОЛ Ø Ø Ø Для развития ПОЛ необходимо образование радикала жирной кислоты, лишённого атома водорода путём его отрыва. RH→R · → ROOH Затем кислород внедряется в ПНЖК с образованием пероксидного радикала ROO· с другой ПНЖК приводит к образованию гидропероксида ROOH и нового радикала R 1 ·. Гидропероксиды липидов ROOH в присутствии ионов железа распадаются с образованием RО· и ·ОН, поддерживая СРО.
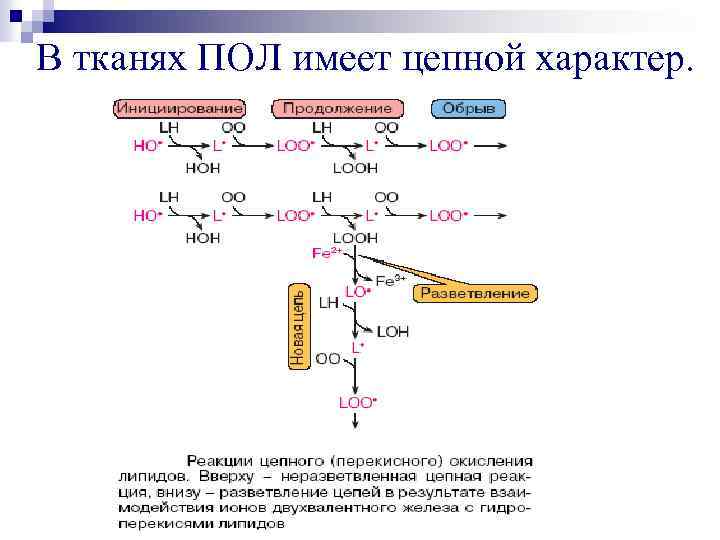 В тканях ПОЛ имеет цепной характер.
В тканях ПОЛ имеет цепной характер.
 В клетках накапливаются вторичные продукты ПОЛ: альдегиды, Ø кетоны, Ø спирты. Накопление вторичных продуктов ПОЛ ведёт к гибели клетки. Фосфолипиды мембран содержат много ПНЖК, они легко окисляются. Ø
В клетках накапливаются вторичные продукты ПОЛ: альдегиды, Ø кетоны, Ø спирты. Накопление вторичных продуктов ПОЛ ведёт к гибели клетки. Фосфолипиды мембран содержат много ПНЖК, они легко окисляются. Ø
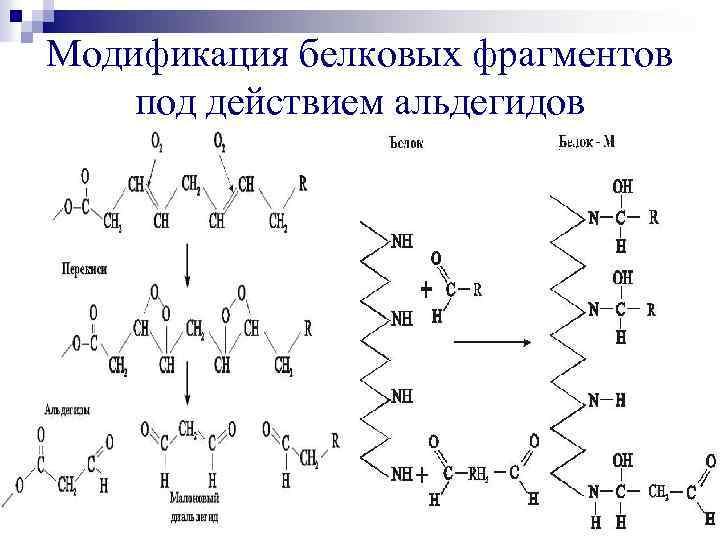 Модификация белковых фрагментов под действием альдегидов
Модификация белковых фрагментов под действием альдегидов
 ПОЛ in vivo катализируется Ø гемовыми соединениями, Ø Ø липооксигеназами тромбоцитов, липооксигеназами лейкоцитов.
ПОЛ in vivo катализируется Ø гемовыми соединениями, Ø Ø липооксигеназами тромбоцитов, липооксигеназами лейкоцитов.
 Активация ПОЛ играет роль в развитии многих патологических процессов Ø лучевые поражения, Ø Ø Ø злокачественный рост, гипоксия, ишемия, атеросклероз, старение, стресс.
Активация ПОЛ играет роль в развитии многих патологических процессов Ø лучевые поражения, Ø Ø Ø злокачественный рост, гипоксия, ишемия, атеросклероз, старение, стресс.
 Резкое усиление СРО при недостаточности АОС приводит к развитию «оксидантного стресса» один из общих механизмов повреждения тканей организма.
Резкое усиление СРО при недостаточности АОС приводит к развитию «оксидантного стресса» один из общих механизмов повреждения тканей организма.
 Антиоксидантная система (АОС) -система защиты биополимеров от деструкции. Различают: Ø ферментативное звено АОС, Ø неферментативное звено АОС.
Антиоксидантная система (АОС) -система защиты биополимеров от деструкции. Различают: Ø ферментативное звено АОС, Ø неферментативное звено АОС.
 Ферменты АО Ø супероксиддисмутаза, Ø Ø Ø каталаза, пероксидаза, глутатионредуктаза, церулоплазмин.
Ферменты АО Ø супероксиддисмутаза, Ø Ø Ø каталаза, пероксидаза, глутатионредуктаза, церулоплазмин.
 Супероксиддисмутаза Ø Ø . . - + О- + 2 Н+ СОДН 2 О 2 + О 2 2 → ионы меди и цинка – кофакторы СОД, СОД осуществляет удаление образовавшегося в клетке супероксидрадикала, применяется для лечения пневмонии, инфаркта миокарда, ожогов глаз.
Супероксиддисмутаза Ø Ø . . - + О- + 2 Н+ СОДН 2 О 2 + О 2 2 → ионы меди и цинка – кофакторы СОД, СОД осуществляет удаление образовавшегося в клетке супероксидрадикала, применяется для лечения пневмонии, инфаркта миокарда, ожогов глаз.
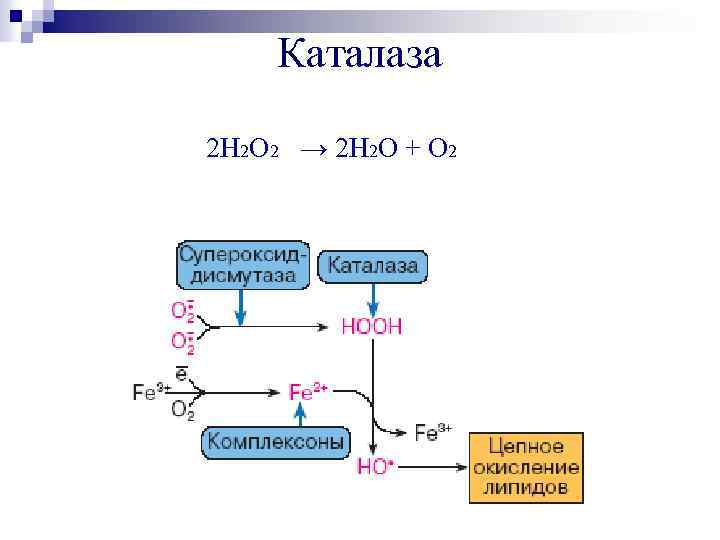 Каталаза 2 Н 2 О 2 → 2 Н 2 О + О 2
Каталаза 2 Н 2 О 2 → 2 Н 2 О + О 2
 Пероксидазная реакция Н 2 О 2 + АН 2 пероксидаза 2 О + А → 2 Н Ø АН 2 - донор протонов (аскорбиновая кислота, фенолы).
Пероксидазная реакция Н 2 О 2 + АН 2 пероксидаза 2 О + А → 2 Н Ø АН 2 - донор протонов (аскорбиновая кислота, фенолы).
 ГПО Ø селеносодержащий фермент, Ø Ø Ø состоит из четырёх субъединиц, в активном центре каждой содержится селен, катализирует восстановление гидропероксида или перекиси водорода с помощью глутатиона. ROOH +2 GSH → ROH + Н 2 О+ GSSG Н 2 О 2 +2 GSH → 2 Н 2 О+ GSSG В отличие от каталазы более активна при малых концентрациях перекиси водорода.
ГПО Ø селеносодержащий фермент, Ø Ø Ø состоит из четырёх субъединиц, в активном центре каждой содержится селен, катализирует восстановление гидропероксида или перекиси водорода с помощью глутатиона. ROOH +2 GSH → ROH + Н 2 О+ GSSG Н 2 О 2 +2 GSH → 2 Н 2 О+ GSSG В отличие от каталазы более активна при малых концентрациях перекиси водорода.
 Церулоплазмин Ø основной антиоксидант плазмы крови, Ø Ø Ø «перехватчик» супероксидрадикалов, обладает ферментативными свойствами, осуществляет окисление Fe 2+в Fe 3+. .
Церулоплазмин Ø основной антиоксидант плазмы крови, Ø Ø Ø «перехватчик» супероксидрадикалов, обладает ферментативными свойствами, осуществляет окисление Fe 2+в Fe 3+. .
 Неферментативные антиоксиданты Антирадикальные ингибиторы отдают подвижный водород свободному радикалу. In. H +ROO· → In + ROOH
Неферментативные антиоксиданты Антирадикальные ингибиторы отдают подвижный водород свободному радикалу. In. H +ROO· → In + ROOH
 Неферментативные антиоксиданты Ø витамины: С, α-токоферол, β-каротин, К, Р, Ø Ø Ø Ø Ø белки: церулоплазмин, лактоферрин, трансферин, альбумин, минеральные вещества: Se, Zn, Co, Fe, Cu, гормоны: эстрогены, тироксин, биогенные амины: серотонин, гистамин, аминокислоты: фен, тир, три, мет, цис, пигмент меланин, мочевая кислота, карнозин, ансерин, глутатион, таурин.
Неферментативные антиоксиданты Ø витамины: С, α-токоферол, β-каротин, К, Р, Ø Ø Ø Ø Ø белки: церулоплазмин, лактоферрин, трансферин, альбумин, минеральные вещества: Se, Zn, Co, Fe, Cu, гормоны: эстрогены, тироксин, биогенные амины: серотонин, гистамин, аминокислоты: фен, тир, три, мет, цис, пигмент меланин, мочевая кислота, карнозин, ансерин, глутатион, таурин.
 Слабыми антиоксидантными свойствами обладают Ø альбумины, Ø Ø Ø трансферин, альбумины лактоферрин. Они связывают ионы железа или меди и тем самым предотвращают образование свободных радикалов из перекиси водорода. лактоферрин трансферин
Слабыми антиоксидантными свойствами обладают Ø альбумины, Ø Ø Ø трансферин, альбумины лактоферрин. Они связывают ионы железа или меди и тем самым предотвращают образование свободных радикалов из перекиси водорода. лактоферрин трансферин
 Антиоксиданты по локализации делятся на: Ø внутриклеточные: ГПО, СОД, каталаза, не расходуются в процессе разрушения свободных радикалов, Ø встроены в мембраны: α-токоферол, β-каротин, убихинон, расходуются в процессе разрушения свободных радикалов, Ø во внеклеточных жидкостях: флавоноиды, полифенолы.
Антиоксиданты по локализации делятся на: Ø внутриклеточные: ГПО, СОД, каталаза, не расходуются в процессе разрушения свободных радикалов, Ø встроены в мембраны: α-токоферол, β-каротин, убихинон, расходуются в процессе разрушения свободных радикалов, Ø во внеклеточных жидкостях: флавоноиды, полифенолы.
 Идентифицируют 3 класса АО Ø Ø Ø - Первичные АО: ГПО, СОД, церулоплазмин, ферритин, трансферин, предупреждают образование новых свободных радикалов. Вторичные АО: витамин Е, С, β-каротин, МК, билирубин, альбумин, удаляют образованные радикалы. Третичные АО: ДНК-репарирующие ферменты, метионинсульфоксидредуктаза, восстанавливают клеточные структуры, повреждённые свободными радикалами.
Идентифицируют 3 класса АО Ø Ø Ø - Первичные АО: ГПО, СОД, церулоплазмин, ферритин, трансферин, предупреждают образование новых свободных радикалов. Вторичные АО: витамин Е, С, β-каротин, МК, билирубин, альбумин, удаляют образованные радикалы. Третичные АО: ДНК-репарирующие ферменты, метионинсульфоксидредуктаза, восстанавливают клеточные структуры, повреждённые свободными радикалами.
 АО могут действовать как прооксиданты Ø Это зависит от их редокс-потенциала и дозы Ø потребления. Приём β-каротина в дозе 20 мг в день повышает частоту возникновения рака лёгкого у курильщиков.
АО могут действовать как прооксиданты Ø Это зависит от их редокс-потенциала и дозы Ø потребления. Приём β-каротина в дозе 20 мг в день повышает частоту возникновения рака лёгкого у курильщиков.
 Синтетические АО Ø Ø Ø Синтетические аналоги витаминов: водорастворимое производное витамина Е – динатриевая соль токоферолфосфата. Ароматические фенолы и полифенолы: дибунол, порбукол. Гетероароматические фенолы. Азотистые гетероциклы. Органическиие кислоты и их производные: мочевая кислота, цистеин, глутатион, фитиновая кислота способны угнетать формирование гидроксилрадикалов.
Синтетические АО Ø Ø Ø Синтетические аналоги витаминов: водорастворимое производное витамина Е – динатриевая соль токоферолфосфата. Ароматические фенолы и полифенолы: дибунол, порбукол. Гетероароматические фенолы. Азотистые гетероциклы. Органическиие кислоты и их производные: мочевая кислота, цистеин, глутатион, фитиновая кислота способны угнетать формирование гидроксилрадикалов.
 Фитиновая кислота способна угнетать формирование гидроксилрадикалов Ø Ø Ø в сое, в рисе, в просе
Фитиновая кислота способна угнетать формирование гидроксилрадикалов Ø Ø Ø в сое, в рисе, в просе


