Lecture_zao_2_311012.ppt
- Количество слайдов: 124
 Окислительно-восстановительные реакции. Степень окисления. Окислительно-восстановительными реакциями (ОВР) называются химические реакции, в которых происходит перераспределение электронов между атомами реагентов с изменением их степени окисления. Окисляется тот атом, который отдает электроны. Он является восстановителем. Восстанавливается атом, который принимает электроны. Он является окислителем. Степенью окисления атома называют тот заряд, который он приобрел бы в соединении, если бы все связи были полностью ионными. Если атом отдал электроны, то его степень окисления имеет знак +, если 1 принял – знак -.
Окислительно-восстановительные реакции. Степень окисления. Окислительно-восстановительными реакциями (ОВР) называются химические реакции, в которых происходит перераспределение электронов между атомами реагентов с изменением их степени окисления. Окисляется тот атом, который отдает электроны. Он является восстановителем. Восстанавливается атом, который принимает электроны. Он является окислителем. Степенью окисления атома называют тот заряд, который он приобрел бы в соединении, если бы все связи были полностью ионными. Если атом отдал электроны, то его степень окисления имеет знак +, если 1 принял – знак -.
 Правила определения степени окисления (СО) 1. 2. 3. 4. 5. 6. СО атомов любого простого вещества равна нулю. H 2, Fe, F 2 СО любого одноатомного иона равна его заряду. H+ (+1), Fe 3+ (+3). СО фтора во всех соединениях равна (-1). Li. F СО элементов 1 группы во всех соединениях равна (+1). Na. F СО элементов 2 группы во всех соединениях равна (+2). Mg. F 2. СО кислорода во всех соединениях равна (-2). H 2 O. Исключения составляют соединение с фтором OF 2 (+2), и соединения с водородом и металлами 1 и 2 групп, содержащие связь O-O, где СО определяется по правилу 8. KO 2 (-1/2), H 2 O 2 (-1). 2
Правила определения степени окисления (СО) 1. 2. 3. 4. 5. 6. СО атомов любого простого вещества равна нулю. H 2, Fe, F 2 СО любого одноатомного иона равна его заряду. H+ (+1), Fe 3+ (+3). СО фтора во всех соединениях равна (-1). Li. F СО элементов 1 группы во всех соединениях равна (+1). Na. F СО элементов 2 группы во всех соединениях равна (+2). Mg. F 2. СО кислорода во всех соединениях равна (-2). H 2 O. Исключения составляют соединение с фтором OF 2 (+2), и соединения с водородом и металлами 1 и 2 групп, содержащие связь O-O, где СО определяется по правилу 8. KO 2 (-1/2), H 2 O 2 (-1). 2
 Степень окисления 7. СО других галогенов (17 группа), кроме фтора, во всех соединениях равна (-1). Na. Cl. Исключения составляют соединения с кислородом и с другими галогенами. В соединениях с кислородом СО положительная (определяется по правилу 8). Cl. O 2 (+4). В соединениях различных галогенов СО галогена, расположенного выше с таблице Менделеева, равна (-1), а расположенного ниже - положительная (определяется по правилу 8). ICl 3 – (+3) у йода. 8. Алгебраическая сумма СО всех атомов в нейтральном соединении равна нулю, а в ионе – заряду иона. Найти СО серы в H 2 SO 4: Н 2 SO 4 (1+)· 2 + X + (2 -)· 4 =0 X=6+ 3
Степень окисления 7. СО других галогенов (17 группа), кроме фтора, во всех соединениях равна (-1). Na. Cl. Исключения составляют соединения с кислородом и с другими галогенами. В соединениях с кислородом СО положительная (определяется по правилу 8). Cl. O 2 (+4). В соединениях различных галогенов СО галогена, расположенного выше с таблице Менделеева, равна (-1), а расположенного ниже - положительная (определяется по правилу 8). ICl 3 – (+3) у йода. 8. Алгебраическая сумма СО всех атомов в нейтральном соединении равна нулю, а в ионе – заряду иона. Найти СО серы в H 2 SO 4: Н 2 SO 4 (1+)· 2 + X + (2 -)· 4 =0 X=6+ 3
 Окисление – процесс отдачи электронов окисляющимися атомами с увеличением их степени окисления. Такие атомы (вещества) – восстановители. 0 +2 Zn – 2ē = Zn 2+ Типичные восстановители: Ø Простые вещества, образованные элементами с низкой электроотрицательностью (металлы 1 и 2 групп) K, Ca Ø Катионы металлов в низкой степени оксиления, способные ее повышать Fe 2+, Cu+ Ø Простые анионы I-, S 2Ø Сложные анионы с элементом в низкой или промежуточной степени окисления, способным ее 4 повышать SO 32 -, NO 2 -
Окисление – процесс отдачи электронов окисляющимися атомами с увеличением их степени окисления. Такие атомы (вещества) – восстановители. 0 +2 Zn – 2ē = Zn 2+ Типичные восстановители: Ø Простые вещества, образованные элементами с низкой электроотрицательностью (металлы 1 и 2 групп) K, Ca Ø Катионы металлов в низкой степени оксиления, способные ее повышать Fe 2+, Cu+ Ø Простые анионы I-, S 2Ø Сложные анионы с элементом в низкой или промежуточной степени окисления, способным ее 4 повышать SO 32 -, NO 2 -
 Восстановление – процесс принятия электронов восстанавливающимися атомами с уменьшением их степени окисления. Такие атомы (вещества) – окислители. 0 -2 S + 2ē = S 2 Типичные окислители: Ø Простые вещества, образованные элементами с высокой электроотрицательностью (неметаллы) Cl 2 , O 2 Ø Катионы металлов в высокой степени окисления, способные ее понижать Fe 3+, Pb 4+ Ø Сложные анионы с элементом в высокой степени окисления, способны Cr 2 O 72 -, SO 425
Восстановление – процесс принятия электронов восстанавливающимися атомами с уменьшением их степени окисления. Такие атомы (вещества) – окислители. 0 -2 S + 2ē = S 2 Типичные окислители: Ø Простые вещества, образованные элементами с высокой электроотрицательностью (неметаллы) Cl 2 , O 2 Ø Катионы металлов в высокой степени окисления, способные ее понижать Fe 3+, Pb 4+ Ø Сложные анионы с элементом в высокой степени окисления, способны Cr 2 O 72 -, SO 425
 Уравнения ОВР Для составления уравнения ОВР обычно записывают уравнения полуреакций окисления и восстановления по отдельности. При составлении уравнений ОВР следует соблюдать следующие правила: 1. Числа атомов всех элементов в левой и правой частях уравнения реакции должны быть равны. 2. Суммы зарядов всех ионов в левой и правой частях уравнения реакции должны быть равны. 3. Числа электронов, участвующих в процессах окисления и восстановления должны быть равны. Для составления уравнений ОВР используют метод электронного баланса и ионно-электронный метод. 6
Уравнения ОВР Для составления уравнения ОВР обычно записывают уравнения полуреакций окисления и восстановления по отдельности. При составлении уравнений ОВР следует соблюдать следующие правила: 1. Числа атомов всех элементов в левой и правой частях уравнения реакции должны быть равны. 2. Суммы зарядов всех ионов в левой и правой частях уравнения реакции должны быть равны. 3. Числа электронов, участвующих в процессах окисления и восстановления должны быть равны. Для составления уравнений ОВР используют метод электронного баланса и ионно-электронный метод. 6
 Метод электронного баланса Напишем уравнение реакции между алюминием и кислородом : Al + O 2 = Al 2 O 3 Баланс – это равенство. Поэтому следует сделать одинаковым количество электронов, которые отдает один элемент и принимает другой элемент в данной реакции. Первоначально это количество выглядит разным, что видно из разных степеней окисления алюминия и кислорода: 0 0 +3 – 2 Al + O 2 = Al 2 O 3 7
Метод электронного баланса Напишем уравнение реакции между алюминием и кислородом : Al + O 2 = Al 2 O 3 Баланс – это равенство. Поэтому следует сделать одинаковым количество электронов, которые отдает один элемент и принимает другой элемент в данной реакции. Первоначально это количество выглядит разным, что видно из разных степеней окисления алюминия и кислорода: 0 0 +3 – 2 Al + O 2 = Al 2 O 3 7
 Метод электронного баланса Алюминий отдает электроны (приобретает положительную степень окисления), а кислород – принимает электроны (приобретает отрицательную степень окисления). Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона: 8
Метод электронного баланса Алюминий отдает электроны (приобретает положительную степень окисления), а кислород – принимает электроны (приобретает отрицательную степень окисления). Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона: 8
 Метод электронного баланса Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе – на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху. Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O 2) – найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al 2 O 3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено: 9 4 Al + 3 O 2 = 2 Al 2 O 3
Метод электронного баланса Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе – на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху. Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O 2) – найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al 2 O 3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено: 9 4 Al + 3 O 2 = 2 Al 2 O 3
 Метод электронного баланса Все преимущества метода электронного баланса проявляются в более сложных случаях. +7 – 1 0 +2 KMn. O 4 + KCl + H 2 SO 4 = Cl 2 +Mn. SO 4 + K 2 SO 4 + H 2 O Определим степени окисления элементов, окислитель и восстановитель. Затем составим схему электронного баланса. 10
Метод электронного баланса Все преимущества метода электронного баланса проявляются в более сложных случаях. +7 – 1 0 +2 KMn. O 4 + KCl + H 2 SO 4 = Cl 2 +Mn. SO 4 + K 2 SO 4 + H 2 O Определим степени окисления элементов, окислитель и восстановитель. Затем составим схему электронного баланса. 10
 Метод электронного баланса Двойка и пятерка – главные коэффициенты уравнения, благодаря которым удается легко подобрать все другие коэффициенты. Перед Cl 2 следует поставить коэффициент 5 (или 2× 5 = 10 перед KСl), а перед KMn. O 4 – коэффициент 2. Все остальные коэффициенты привязывают к этим двум коэффициентам. 2 KMn. O 4 + 10 KCl + 8 H 2 SO 4 = 5 Cl 2 + 2 Mn. SO 4 + 6 K 2 SO 4 + 8 H 2 O 11
Метод электронного баланса Двойка и пятерка – главные коэффициенты уравнения, благодаря которым удается легко подобрать все другие коэффициенты. Перед Cl 2 следует поставить коэффициент 5 (или 2× 5 = 10 перед KСl), а перед KMn. O 4 – коэффициент 2. Все остальные коэффициенты привязывают к этим двум коэффициентам. 2 KMn. O 4 + 10 KCl + 8 H 2 SO 4 = 5 Cl 2 + 2 Mn. SO 4 + 6 K 2 SO 4 + 8 H 2 O 11
 Типы ОВР 1. Реакции МЕЖМОЛЕКУЛЯРНОГО окислениявосстановления (когда окислитель и восстановитель – разные вещества); 2. Реакции ДИСПРОПОРЦИОНИРОВАНИЯ (когда окислителем и восстановителем может служить одно и то же вещество); 3. Реакции ВНУТРИМОЛЕКУЛЯРНОГО окислениявосстановления (когда одна часть молекулы выступает в роли окислителя, а другая – в роли восстановителя). Все уже рассмотренные нами выше реакции являются реакциями межмолекулярного окисления 12 восстановления.
Типы ОВР 1. Реакции МЕЖМОЛЕКУЛЯРНОГО окислениявосстановления (когда окислитель и восстановитель – разные вещества); 2. Реакции ДИСПРОПОРЦИОНИРОВАНИЯ (когда окислителем и восстановителем может служить одно и то же вещество); 3. Реакции ВНУТРИМОЛЕКУЛЯРНОГО окислениявосстановления (когда одна часть молекулы выступает в роли окислителя, а другая – в роли восстановителя). Все уже рассмотренные нами выше реакции являются реакциями межмолекулярного окисления 12 восстановления.
 Реакция цинка с раствором соли меди Cu 2+ + 2 e Cu Zn – 2 e Zn 2+ Zn + Cu 2+ Zn 2+ + Cu Реакция протекает самопроизвольно! 13
Реакция цинка с раствором соли меди Cu 2+ + 2 e Cu Zn – 2 e Zn 2+ Zn + Cu 2+ Zn 2+ + Cu Реакция протекает самопроизвольно! 13
 Электрохимические процессы – это окислительновосстановительные процессы, сопровождающиеся превращениями химической энергии в электрическую или наоборот. Гальванический элемент – это устройство, в котором химическая энергия окислительно-восстановительной реакции непосредственно преобразуется в электрический ток. Гальванический элемент состоит из двух электродов, соединенных металлическим проводником. Работа гальванических элементов основана на пространственном разделении процессов окисления и восстановления. 14
Электрохимические процессы – это окислительновосстановительные процессы, сопровождающиеся превращениями химической энергии в электрическую или наоборот. Гальванический элемент – это устройство, в котором химическая энергия окислительно-восстановительной реакции непосредственно преобразуется в электрический ток. Гальванический элемент состоит из двух электродов, соединенных металлическим проводником. Работа гальванических элементов основана на пространственном разделении процессов окисления и восстановления. 14
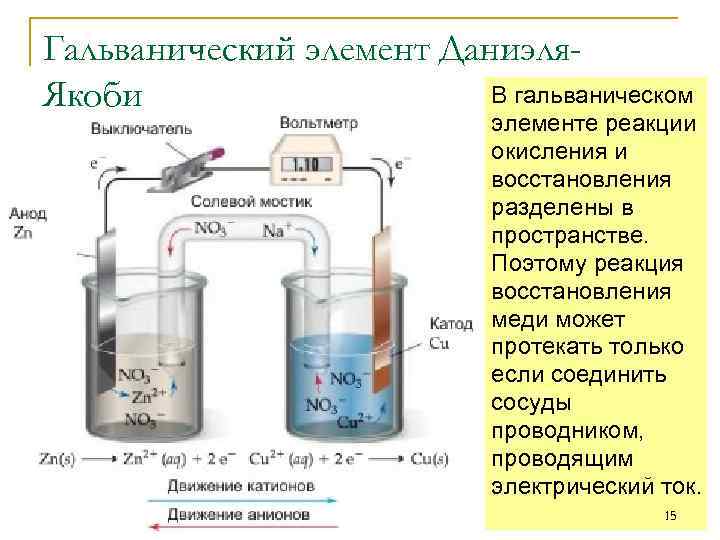 Гальванический элемент Даниэля. В гальваническом Якоби элементе реакции окисления и восстановления разделены в пространстве. Поэтому реакция восстановления меди может протекать только если соединить сосуды проводником, проводящим электрический ток. 15
Гальванический элемент Даниэля. В гальваническом Якоби элементе реакции окисления и восстановления разделены в пространстве. Поэтому реакция восстановления меди может протекать только если соединить сосуды проводником, проводящим электрический ток. 15
 Гальванический элемент Пластинка металла или другого проводника, на которой происходит реакция окисления или восстановления, называется электродом. Электрод, на котором происходит реакция окисления называется анодом. В ходе реакции анод принимает электроны и заряжается отрицательно. Электрод, на котором происходит реакция восстановление называется катодом. В ходе реакции катод отдает электроны и получает положительный заряд. Для непрерывной работы гальванического элемента растворы, в которые опущены электроды должны оставаться электрически нейтральными. Поэтому нужно обеспечить транспорт положительных ионов из катодного отделения в анодное. Для этого из соединяют солевым мостиком или пористой перегородкой, через которые могут перемещаться 16 заряженные ионы.
Гальванический элемент Пластинка металла или другого проводника, на которой происходит реакция окисления или восстановления, называется электродом. Электрод, на котором происходит реакция окисления называется анодом. В ходе реакции анод принимает электроны и заряжается отрицательно. Электрод, на котором происходит реакция восстановление называется катодом. В ходе реакции катод отдает электроны и получает положительный заряд. Для непрерывной работы гальванического элемента растворы, в которые опущены электроды должны оставаться электрически нейтральными. Поэтому нужно обеспечить транспорт положительных ионов из катодного отделения в анодное. Для этого из соединяют солевым мостиком или пористой перегородкой, через которые могут перемещаться 16 заряженные ионы.
 Электродвижущая сила Как вода самопроизвольно падает к утеса за счет разницы потенциальной энергии на вершине водопада и внизу, так и электроны самопроизвольно движутся от анода к катоду под действием разницы потенциалов между двумя электродами. Поскольку такая разница потенциалов приводит в движение электроны, она получила название электродвижущей силы (эдс). Также она называется потенциалом гальванического элемента. Единицей измерения потенциала в системе СИ является Вольт (В). Ее можно измерить прибором с высоким сопротивлением, называемым вольтметром. Потенциал любого элемента, где протекает самопроизвольная реакция, считается положительным. 17
Электродвижущая сила Как вода самопроизвольно падает к утеса за счет разницы потенциальной энергии на вершине водопада и внизу, так и электроны самопроизвольно движутся от анода к катоду под действием разницы потенциалов между двумя электродами. Поскольку такая разница потенциалов приводит в движение электроны, она получила название электродвижущей силы (эдс). Также она называется потенциалом гальванического элемента. Единицей измерения потенциала в системе СИ является Вольт (В). Ее можно измерить прибором с высоким сопротивлением, называемым вольтметром. Потенциал любого элемента, где протекает самопроизвольная реакция, считается положительным. 17
 Стандартный потенциал Оказалось, что потенциал элемента зависит от типа реакций, протекающих на катоде и аноде, концентраций реагентов и продуктов, а также температуры. В стандартных условиях потенциал зависит только от типа реакций. Стандартные условия – температура – 25°С, концентрация растворенных веществ – 1 М, давление газообразных веществ – 1 атм. Потенциал элемента в стандартных условия называется стандартным и обозначается E°. Для медь цинкового элемента – стандартный потенциал равен 1, 10 В. 18
Стандартный потенциал Оказалось, что потенциал элемента зависит от типа реакций, протекающих на катоде и аноде, концентраций реагентов и продуктов, а также температуры. В стандартных условиях потенциал зависит только от типа реакций. Стандартные условия – температура – 25°С, концентрация растворенных веществ – 1 М, давление газообразных веществ – 1 атм. Потенциал элемента в стандартных условия называется стандартным и обозначается E°. Для медь цинкового элемента – стандартный потенциал равен 1, 10 В. 18
 Стандартный электродный потенциал Каждое из двух отделение гальванического элемента называется полуячейкой. В каждой полуячейке протекает или реакция окисления или реакция восстановления. Оказалось, каждой индивидуальной полуячейке можно приписать свой потенциал. Принято записывать потенциал каждой полуячейки (электрода) как потенциал реакции восстановления, протекающей на этом электроде. В этой случае потенциал гальванического элемента будет равен разности потенциалов полуячеек. E = Eкат - Eан Для самопроизвольной реакции E > 0. Потенциал реакции восстановления, протекающей на электроде в стандартных условиях, называют стандартным 19 электродным потенциалом.
Стандартный электродный потенциал Каждое из двух отделение гальванического элемента называется полуячейкой. В каждой полуячейке протекает или реакция окисления или реакция восстановления. Оказалось, каждой индивидуальной полуячейке можно приписать свой потенциал. Принято записывать потенциал каждой полуячейки (электрода) как потенциал реакции восстановления, протекающей на этом электроде. В этой случае потенциал гальванического элемента будет равен разности потенциалов полуячеек. E = Eкат - Eан Для самопроизвольной реакции E > 0. Потенциал реакции восстановления, протекающей на электроде в стандартных условиях, называют стандартным 19 электродным потенциалом.
 Стандартный водородный электрод Как и в случае потенциальной энергии, физический смысл имеет только разность потенциалов полуячеек. Поэтому необходимо было выбрать стандартный потенциал какого-то электрода за ноль и измерять потенциалы остальных электродов по отношению к нему. Согласно международному соглашению в качестве такого электрода был выбран водородный электрод, потенциал которого принят равным нулю. Водородный электрод состоит из платиновой пластины, покрытой тонким слоем платиной черни и опущенной в водный раствор серной кислоты с активной концентрацией Н+, равной 1 М. Через этот раствор пропускается ток чистого водорода под давлением 1 атм. 20
Стандартный водородный электрод Как и в случае потенциальной энергии, физический смысл имеет только разность потенциалов полуячеек. Поэтому необходимо было выбрать стандартный потенциал какого-то электрода за ноль и измерять потенциалы остальных электродов по отношению к нему. Согласно международному соглашению в качестве такого электрода был выбран водородный электрод, потенциал которого принят равным нулю. Водородный электрод состоит из платиновой пластины, покрытой тонким слоем платиной черни и опущенной в водный раствор серной кислоты с активной концентрацией Н+, равной 1 М. Через этот раствор пропускается ток чистого водорода под давлением 1 атм. 20
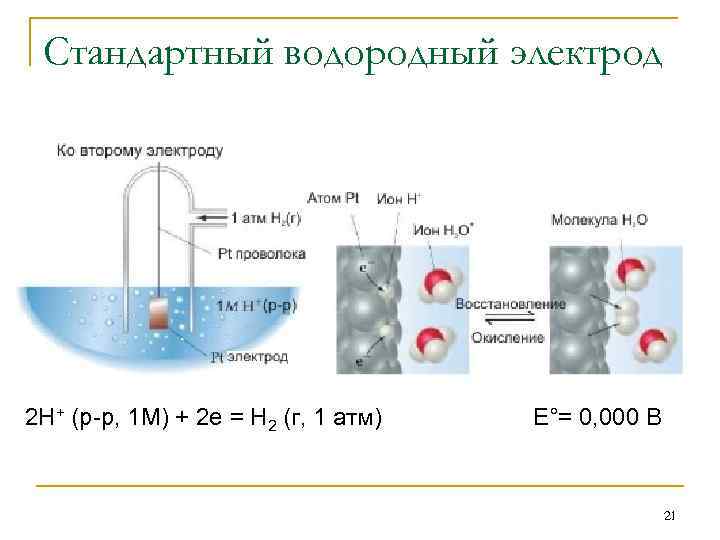 Стандартный водородный электрод 2 H+ (р-р, 1 M) + 2 e = H 2 (г, 1 атм) E°= 0, 000 В 21
Стандартный водородный электрод 2 H+ (р-р, 1 M) + 2 e = H 2 (г, 1 атм) E°= 0, 000 В 21
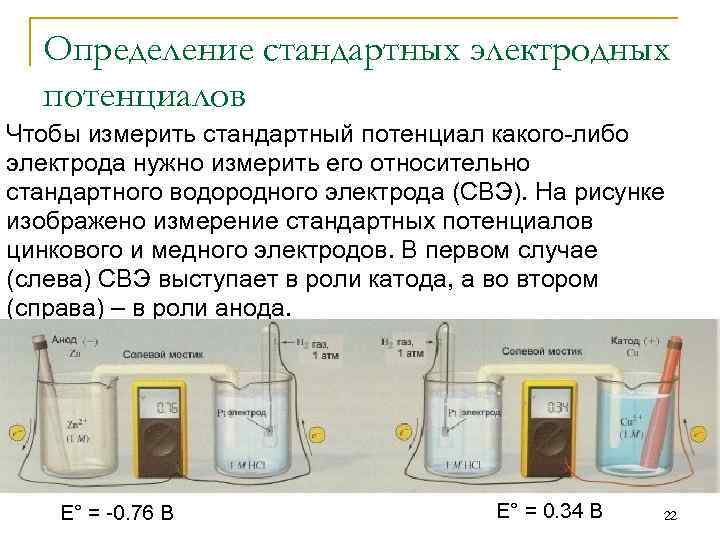 Определение стандартных электродных потенциалов Чтобы измерить стандартный потенциал какого-либо электрода нужно измерить его относительно стандартного водородного электрода (СВЭ). На рисунке изображено измерение стандартных потенциалов цинкового и медного электродов. В первом случае (слева) СВЭ выступает в роли катода, а во втором (справа) – в роли анода. E° = -0. 76 В E° = 0. 34 В 22
Определение стандартных электродных потенциалов Чтобы измерить стандартный потенциал какого-либо электрода нужно измерить его относительно стандартного водородного электрода (СВЭ). На рисунке изображено измерение стандартных потенциалов цинкового и медного электродов. В первом случае (слева) СВЭ выступает в роли катода, а во втором (справа) – в роли анода. E° = -0. 76 В E° = 0. 34 В 22
 Определение стандартных электродных потенциалов Потенциал цинкового электрода отрицательный, потому что в элементе с СВЭ он выполняет роль анода. E° = E°кат – E°ан 0, 76 В = 0 В - E°(Zn 2+/Zn) = - 0, 76 В Медный электрод выполняет роль катода. Поэтому его стандартный потенциал положительный. E°(Cu 2+/Cu) = 0, 34 В Следует отметить, что стандартный водородный электрод неудобен для практического применения. Однако, на практике можно измерять потенциалы неизвестных электродов относительно любого электрода, стандартный потенциал которого известен! Стандартный электродный потенциал – величина интенсивная, т. е. не зависит от стехиометрического 23 коэффициента!
Определение стандартных электродных потенциалов Потенциал цинкового электрода отрицательный, потому что в элементе с СВЭ он выполняет роль анода. E° = E°кат – E°ан 0, 76 В = 0 В - E°(Zn 2+/Zn) = - 0, 76 В Медный электрод выполняет роль катода. Поэтому его стандартный потенциал положительный. E°(Cu 2+/Cu) = 0, 34 В Следует отметить, что стандартный водородный электрод неудобен для практического применения. Однако, на практике можно измерять потенциалы неизвестных электродов относительно любого электрода, стандартный потенциал которого известен! Стандартный электродный потенциал – величина интенсивная, т. е. не зависит от стехиометрического 23 коэффициента!
 Сокращенная запись процессов в гальванических элементах Химиками была разработана условная сокращенная запись гальванических элементов. Схема медно-цинкового элемента записывается как: Zn | Zn 2+ || Cu 2+ | Cu Слева в такой записи записывается анодная полуреакция. При этом вещества, находящиеся в разных фазах обычно разделяют одинарной вертикальной чертой. Анодная полуреакция отделяется от катодной двойной вертикальной чертой. Если в реакции участвует инертный электрод, как в СВЭ, то его записывают снаружи. Также можно записать концентрацию ионов и давление газов. Например, элементы для определения потенциалов Zn и Cu электродов относительно СВЭ записываются так: Zn | Zn 2+ || H+ | H 2 | Pt Pt | H 2 | H+ || Cu 2+ | Cu 24
Сокращенная запись процессов в гальванических элементах Химиками была разработана условная сокращенная запись гальванических элементов. Схема медно-цинкового элемента записывается как: Zn | Zn 2+ || Cu 2+ | Cu Слева в такой записи записывается анодная полуреакция. При этом вещества, находящиеся в разных фазах обычно разделяют одинарной вертикальной чертой. Анодная полуреакция отделяется от катодной двойной вертикальной чертой. Если в реакции участвует инертный электрод, как в СВЭ, то его записывают снаружи. Также можно записать концентрацию ионов и давление газов. Например, элементы для определения потенциалов Zn и Cu электродов относительно СВЭ записываются так: Zn | Zn 2+ || H+ | H 2 | Pt Pt | H 2 | H+ || Cu 2+ | Cu 24
 Связь потенциала и энергии Гиббса Знак потенциала элемента определяет возможность самопроизвольного протекания окислительно-восстановительного процесса. Поэтому этот потенциал должен быть связан с изменением энергии Гиббса с этой реакции. Такая связь была установлена Майкл Фарадей Фарадеем. (1791 -1867) G = - n. FE Здесь n – число переносимых в реакции электронов, F – постоянная Фарадея = 96485 Кл/моль = 96485 Дж/(В * моль) В стандартных условиях G° = - n. FE° 25
Связь потенциала и энергии Гиббса Знак потенциала элемента определяет возможность самопроизвольного протекания окислительно-восстановительного процесса. Поэтому этот потенциал должен быть связан с изменением энергии Гиббса с этой реакции. Такая связь была установлена Майкл Фарадей Фарадеем. (1791 -1867) G = - n. FE Здесь n – число переносимых в реакции электронов, F – постоянная Фарадея = 96485 Кл/моль = 96485 Дж/(В * моль) В стандартных условиях G° = - n. FE° 25
 Зависимость потенциала элемента от концентрации Потенциал гальванического элемента зависит от концентраций ионов согласно уравнению Нернста. E = E° - RT/n. F * ln ([прод]/[реаг]). Здесь, R – универсальная газовая постоянная, T – абсолютная температура, n – число электронов, переносимых в реакции, F – постоянная Фарадея, [прод] – произведение концентраций всех продуктов, [реаг] – произведение концентраций всех реагентов. При 25°С оно приобретает вид: E = E° - 0, 0592/n * lg ([прод]/[реаг]). Вальтер Герман Нернст (1864 -1941) Нобелевская премия по химии 1920 г. 26
Зависимость потенциала элемента от концентрации Потенциал гальванического элемента зависит от концентраций ионов согласно уравнению Нернста. E = E° - RT/n. F * ln ([прод]/[реаг]). Здесь, R – универсальная газовая постоянная, T – абсолютная температура, n – число электронов, переносимых в реакции, F – постоянная Фарадея, [прод] – произведение концентраций всех продуктов, [реаг] – произведение концентраций всех реагентов. При 25°С оно приобретает вид: E = E° - 0, 0592/n * lg ([прод]/[реаг]). Вальтер Герман Нернст (1864 -1941) Нобелевская премия по химии 1920 г. 26
 Электролизом называется совокупность химических процессов, протекающих при пропускании постоянного электрического тока через растворы или расплавы электролитов. При электролизе химическая (окислительновосстановительная реакция) протекает за счет энергии электрического тока. Ячейка для электролиза называется электролизером, состоит из двух электродов, погруженных в электролит. Электрод, подключенный к отрицательному полюсу внешнего источника тока, называется катодом. На нем протекают реакции восстановления. Электрод, подключенный к положительному полюсу внешнего источника тока, называется анодом, на нем протекают реакции окисления. 27
Электролизом называется совокупность химических процессов, протекающих при пропускании постоянного электрического тока через растворы или расплавы электролитов. При электролизе химическая (окислительновосстановительная реакция) протекает за счет энергии электрического тока. Ячейка для электролиза называется электролизером, состоит из двух электродов, погруженных в электролит. Электрод, подключенный к отрицательному полюсу внешнего источника тока, называется катодом. На нем протекают реакции восстановления. Электрод, подключенный к положительному полюсу внешнего источника тока, называется анодом, на нем протекают реакции окисления. 27
 Реакции на катоде при электролизе На катоде в первую очередь восстанавливаются наиболее сильные окислители с большим значением электродного потенциала: 1) легко восстанавливаются катионы металлов, имеющие положительные значения стандартных электродных потенциалов (Au+, Pt 2+, Hg 2+, Cu 2+ и т. д. ), а также другие окислители (Pb. O 2, Gal 2, O 2 и т. д. ); 2) не восстанавливаются из водных растворов катионы металлов, имеющих значения стандартных электродных потенциалов меньше – 0, 8 В (Na+, Mg 2+, Al 3+ и т. д. ), а восстанавливаются катионы водорода (при р. Н < 7) или молекулы воды (при р. Н ≥ 7): 2 H+ + 2ē → H 2, 2 H 2 O + 2ē → H 2 + 2 OH–; 3) при больших плотностях тока, восстанавливаются катионы металлов со значением потенциала от – 0, 8 В до 0, 0 В (Zn 2+, Fe 2+, Ni 2+ и т. д. ). Если в растворе электролита находится смесь катионов, то они восстанавливаются на катоде в порядке уменьшения величины стандартного электродного потенциала. 28
Реакции на катоде при электролизе На катоде в первую очередь восстанавливаются наиболее сильные окислители с большим значением электродного потенциала: 1) легко восстанавливаются катионы металлов, имеющие положительные значения стандартных электродных потенциалов (Au+, Pt 2+, Hg 2+, Cu 2+ и т. д. ), а также другие окислители (Pb. O 2, Gal 2, O 2 и т. д. ); 2) не восстанавливаются из водных растворов катионы металлов, имеющих значения стандартных электродных потенциалов меньше – 0, 8 В (Na+, Mg 2+, Al 3+ и т. д. ), а восстанавливаются катионы водорода (при р. Н < 7) или молекулы воды (при р. Н ≥ 7): 2 H+ + 2ē → H 2, 2 H 2 O + 2ē → H 2 + 2 OH–; 3) при больших плотностях тока, восстанавливаются катионы металлов со значением потенциала от – 0, 8 В до 0, 0 В (Zn 2+, Fe 2+, Ni 2+ и т. д. ). Если в растворе электролита находится смесь катионов, то они восстанавливаются на катоде в порядке уменьшения величины стандартного электродного потенциала. 28
 Реакции на аноде при электролизе На аноде протекают процессы окисления восстановителей, веществ с меньшим значением потенциала. Различают процессы с растворимым и нерастворимым анодом. В качестве нерастворимого (инертного) анода чаще всего используется графит, золото, платина, а также диоксид свинца и оксид рутения. В случае нерастворимого анода: 1) легко окисляются анионы бескислородных кислот (Сl–, Br–, S 2–); 2) не окисляются из водного раствора анионы кислородсодержащих кислот (SO 42–, NO 3–, PO 43–и т. д. ), а окисляются гидроксо-группы (при р. Н≥ 7) или молекулы воды (при р. Н≤ 7): 4 OH– – 4ē → O 2 + 2 H 2 O, 2 H 2 O – 4ē → O 2 + 4 H+. Если потенциал анода имеет меньшее значение, чем потенциалы других восстановителей в растворе, то происходит растворение (окисление) анода: Me 0 – nē → Men+. 29
Реакции на аноде при электролизе На аноде протекают процессы окисления восстановителей, веществ с меньшим значением потенциала. Различают процессы с растворимым и нерастворимым анодом. В качестве нерастворимого (инертного) анода чаще всего используется графит, золото, платина, а также диоксид свинца и оксид рутения. В случае нерастворимого анода: 1) легко окисляются анионы бескислородных кислот (Сl–, Br–, S 2–); 2) не окисляются из водного раствора анионы кислородсодержащих кислот (SO 42–, NO 3–, PO 43–и т. д. ), а окисляются гидроксо-группы (при р. Н≥ 7) или молекулы воды (при р. Н≤ 7): 4 OH– – 4ē → O 2 + 2 H 2 O, 2 H 2 O – 4ē → O 2 + 4 H+. Если потенциал анода имеет меньшее значение, чем потенциалы других восстановителей в растворе, то происходит растворение (окисление) анода: Me 0 – nē → Men+. 29
 1 -й закон Фарадея Законы Фарадея устанавливают зависимость между количеством прошедшего электричества и количеством вещества, испытавшего химическое превращение на электроде. 1 -й закон: масса вещества, испытавшего электрохимическое превращение на электроде, прямо пропорционально количеству прошедшего электричества: m = M 1/z * I * t / F = M * I * t / (n * F) где m – масса вещества, г; M 1/z – молярная масса эквивалента вещества, г/моль; M - молярная масса вещества, г/моль; I – сила тока, А; t – время процесса, с; F – постоянная Фарадея, равная 96485 Кл/моль; n – количество электронов в реакции на электроде. 30
1 -й закон Фарадея Законы Фарадея устанавливают зависимость между количеством прошедшего электричества и количеством вещества, испытавшего химическое превращение на электроде. 1 -й закон: масса вещества, испытавшего электрохимическое превращение на электроде, прямо пропорционально количеству прошедшего электричества: m = M 1/z * I * t / F = M * I * t / (n * F) где m – масса вещества, г; M 1/z – молярная масса эквивалента вещества, г/моль; M - молярная масса вещества, г/моль; I – сила тока, А; t – время процесса, с; F – постоянная Фарадея, равная 96485 Кл/моль; n – количество электронов в реакции на электроде. 30
 2 -й закон Фарадея: массы прореагировавших на электродах веществ, при постоянном количестве электричества, относятся друг к другу как их химические эквиваленты: m 1: m 2: m 3 = M 1/z 1: M 1/z 2: M 1/z 3. На законах Фарадея основаны расчеты электрохимических установок: зная количество вещества, испытавшего превращение на электроде, можно рассчитать количество электричества, затраченное на процесс электролиза. 31
2 -й закон Фарадея: массы прореагировавших на электродах веществ, при постоянном количестве электричества, относятся друг к другу как их химические эквиваленты: m 1: m 2: m 3 = M 1/z 1: M 1/z 2: M 1/z 3. На законах Фарадея основаны расчеты электрохимических установок: зная количество вещества, испытавшего превращение на электроде, можно рассчитать количество электричества, затраченное на процесс электролиза. 31
 Поляризация электродов При прохождении электрического тока через электролизёр на каждом электроде происходит отклонение их потенциалов от своих равновесных значений – поляризация: ΔЕ = Еi – Ер, где ΔЕ – поляризация электрода, В; Еi – потенциал электрода при прохождении тока, В; Ер – равновесный потенциал электрода, В. Различают катодную и анодную поляризацию. Вследствие катодной поляризации (ΔЕк) потенциал катода становится более отрицательным, а в результате анодной поляризации (ΔЕа) потенциал анода – более положительным. ΔЕ = ΔЕк + ΔЕа Следовательно, разность потенциалов электродов при электролизе гораздо больше, чем разность равновесных электродных потенциалов. 32
Поляризация электродов При прохождении электрического тока через электролизёр на каждом электроде происходит отклонение их потенциалов от своих равновесных значений – поляризация: ΔЕ = Еi – Ер, где ΔЕ – поляризация электрода, В; Еi – потенциал электрода при прохождении тока, В; Ер – равновесный потенциал электрода, В. Различают катодную и анодную поляризацию. Вследствие катодной поляризации (ΔЕк) потенциал катода становится более отрицательным, а в результате анодной поляризации (ΔЕа) потенциал анода – более положительным. ΔЕ = ΔЕк + ΔЕа Следовательно, разность потенциалов электродов при электролизе гораздо больше, чем разность равновесных электродных потенциалов. 32
 Коррозия Коррозией называется процесс самопроизвольного разрушения металлов под влиянием внешней среды, например образование ржавчины из железа. Потери металлов от коррозии очень велики и только в США оцениваются в 70 миллиардов долларов в год. В процессе коррозии происходит переход из металлического состояния в ионное. Коррозия – самопроизвольный процесс, сопровождается уменьшением свободной энергии (ΔG<0), увеличением энтропии системы и определенным энергетическим 33 эффектом.
Коррозия Коррозией называется процесс самопроизвольного разрушения металлов под влиянием внешней среды, например образование ржавчины из железа. Потери металлов от коррозии очень велики и только в США оцениваются в 70 миллиардов долларов в год. В процессе коррозии происходит переход из металлического состояния в ионное. Коррозия – самопроизвольный процесс, сопровождается уменьшением свободной энергии (ΔG<0), увеличением энтропии системы и определенным энергетическим 33 эффектом.
 Химическая коррозия обусловлена взаимодействием металла с сухими газами или жидкостями, не проводящими электрического тока. Химической коррозии подвергаются детали и узлы машин, работающих в атмосфере кислорода, галогенов, при высоких температурах (турбинные, ракетные двигатели, оборудование химических производств). Так, на железе при 250 -300 С появляется видимая пленка оксидов, при 600 С и выше поверхность металла покрывается слоем окалины, состоящей из оксидов железа различной степени окисления (Fe. O, Fe 3 O 4, Fe 2 O 3). Образующиеся на металле оксидные пленки часто препятствуют дальнейшему окислению (образуется так называемая «защитная» пленка, которая препятствует проникновению к металлу как газов, так и жидкостей). Защитными свойствами обладает только та пленка, которая 34 может покрывать сплошь весь металл.
Химическая коррозия обусловлена взаимодействием металла с сухими газами или жидкостями, не проводящими электрического тока. Химической коррозии подвергаются детали и узлы машин, работающих в атмосфере кислорода, галогенов, при высоких температурах (турбинные, ракетные двигатели, оборудование химических производств). Так, на железе при 250 -300 С появляется видимая пленка оксидов, при 600 С и выше поверхность металла покрывается слоем окалины, состоящей из оксидов железа различной степени окисления (Fe. O, Fe 3 O 4, Fe 2 O 3). Образующиеся на металле оксидные пленки часто препятствуют дальнейшему окислению (образуется так называемая «защитная» пленка, которая препятствует проникновению к металлу как газов, так и жидкостей). Защитными свойствами обладает только та пленка, которая 34 может покрывать сплошь весь металл.
 Электрохимическая коррозия Разрушение металла при соприкосновении с электролитом с возникновением в системе электрического тока называется электрохимической коррозией. В атмосферных условиях роль электролита играет водная пленка на металлической поверхности, в которых часто растворены электропроводящие примеси. Электродами обычно являются сам металл и примеси в нем содержащиеся. Поскольку электрохимическая коррозия обусловлена деятельностью гальванических элементов, можно сделать вывод, что факторы способствующие деятельности гальванических элементов усиливают коррозию. Скорость коррозии тем больше, чем дальше отстоят в ряду напряжений металлы, из которых образовалась гальваническая пара. Скорость коррозии возрастает с 35 ростом температуры и с увеличением концентрации
Электрохимическая коррозия Разрушение металла при соприкосновении с электролитом с возникновением в системе электрического тока называется электрохимической коррозией. В атмосферных условиях роль электролита играет водная пленка на металлической поверхности, в которых часто растворены электропроводящие примеси. Электродами обычно являются сам металл и примеси в нем содержащиеся. Поскольку электрохимическая коррозия обусловлена деятельностью гальванических элементов, можно сделать вывод, что факторы способствующие деятельности гальванических элементов усиливают коррозию. Скорость коррозии тем больше, чем дальше отстоят в ряду напряжений металлы, из которых образовалась гальваническая пара. Скорость коррозии возрастает с 35 ростом температуры и с увеличением концентрации
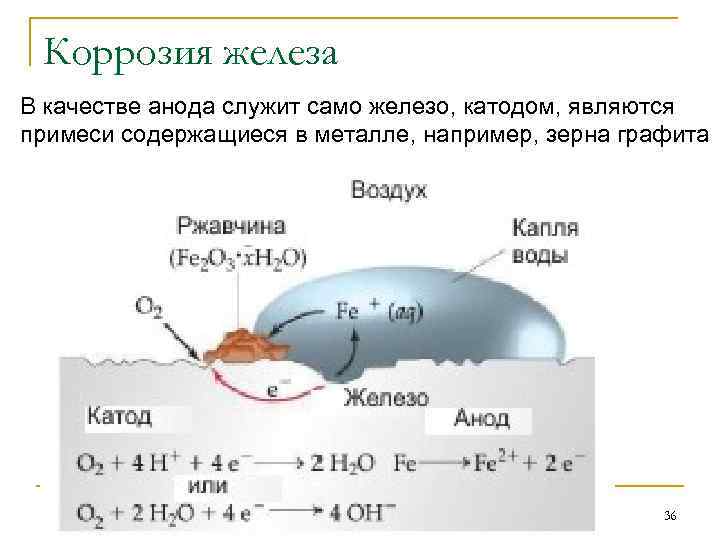 Коррозия железа В качестве анода служит само железо, катодом, являются примеси содержащиеся в металле, например, зерна графита 36
Коррозия железа В качестве анода служит само железо, катодом, являются примеси содержащиеся в металле, например, зерна графита 36
 Методы защиты от коррозии Широко применяются следующие методы защиты металлических конструкций от коррозии: 1. Защитные покрытия. 2. Антикоррозионное легирование металла. 3. Электрохимическая защита. 4. Обработка коррозионной среды. 5. Разработка и производство новых металлических конструкционных материалов повышенной коррозионной устойчивости. Выбор одного из методов защиты основывается не только на технических соображениях, но и на экономических расчетах. Самым дешевым и распространенным методом являются лакокрасочные покрытия. 37
Методы защиты от коррозии Широко применяются следующие методы защиты металлических конструкций от коррозии: 1. Защитные покрытия. 2. Антикоррозионное легирование металла. 3. Электрохимическая защита. 4. Обработка коррозионной среды. 5. Разработка и производство новых металлических конструкционных материалов повышенной коррозионной устойчивости. Выбор одного из методов защиты основывается не только на технических соображениях, но и на экономических расчетах. Самым дешевым и распространенным методом являются лакокрасочные покрытия. 37
 Дисперсные системы Дисперсными называют гетерогенные системы содержащие частицы маленького размера. Они состоят из сплошной непрерывной фазы – дисперсионной среды, и находящихся в этой среде раздробленных частиц диспергируемого вещества того или иного размера и формы – дисперсной фазы. Обязательным условием образования дисперных систем является взаимная нерастворимость диспергируемого вещества и дисперсионной среды. Различают двумерные (пленочнодисперсные) (а), одномерные (волокнисто-дисперсные) (б) и нульмерные (корпускулярнодисперсные (в) системы. 38
Дисперсные системы Дисперсными называют гетерогенные системы содержащие частицы маленького размера. Они состоят из сплошной непрерывной фазы – дисперсионной среды, и находящихся в этой среде раздробленных частиц диспергируемого вещества того или иного размера и формы – дисперсной фазы. Обязательным условием образования дисперных систем является взаимная нерастворимость диспергируемого вещества и дисперсионной среды. Различают двумерные (пленочнодисперсные) (а), одномерные (волокнисто-дисперсные) (б) и нульмерные (корпускулярнодисперсные (в) системы. 38
 Классификация дисперсных систем по размеру Количественной характеристикой дисперсности является степень дисперсности (D) – величина обратная размеру дисперсных частиц. D = 1/a, где a – средний диаметр или размер ребра волокнистых или корпускулярных частиц, либо средняя толщина пленок. 39
Классификация дисперсных систем по размеру Количественной характеристикой дисперсности является степень дисперсности (D) – величина обратная размеру дисперсных частиц. D = 1/a, где a – средний диаметр или размер ребра волокнистых или корпускулярных частиц, либо средняя толщина пленок. 39
 Наночастицы и наноматериалы Высокодисперсные системы с средним размером частиц 1100 нм(10 -7 – 10 -5 см) в последнее время стали называть наноматериалами. Аналогично дисперсным системам различают наночастицы (нульмерные), нановолокна и нанотрубки (одномерные) и нанопленки (двумерные). Многие физические и химические свойства наноматериалов часто значительно отличаются от свойств тех же веществ в молекулярной и грубодисперсной формах. В последнее десятилетие ученые всего мира изучают исследуют наноматериалы, т. к. только сейчас были разработаны методы получения и исследования таких систем. Область науки, изучающая физические и химические закономерности поверхностных явлений и гетерогенных 40 высокодисперсных систем, называется коллоидной химией.
Наночастицы и наноматериалы Высокодисперсные системы с средним размером частиц 1100 нм(10 -7 – 10 -5 см) в последнее время стали называть наноматериалами. Аналогично дисперсным системам различают наночастицы (нульмерные), нановолокна и нанотрубки (одномерные) и нанопленки (двумерные). Многие физические и химические свойства наноматериалов часто значительно отличаются от свойств тех же веществ в молекулярной и грубодисперсной формах. В последнее десятилетие ученые всего мира изучают исследуют наноматериалы, т. к. только сейчас были разработаны методы получения и исследования таких систем. Область науки, изучающая физические и химические закономерности поверхностных явлений и гетерогенных 40 высокодисперсных систем, называется коллоидной химией.
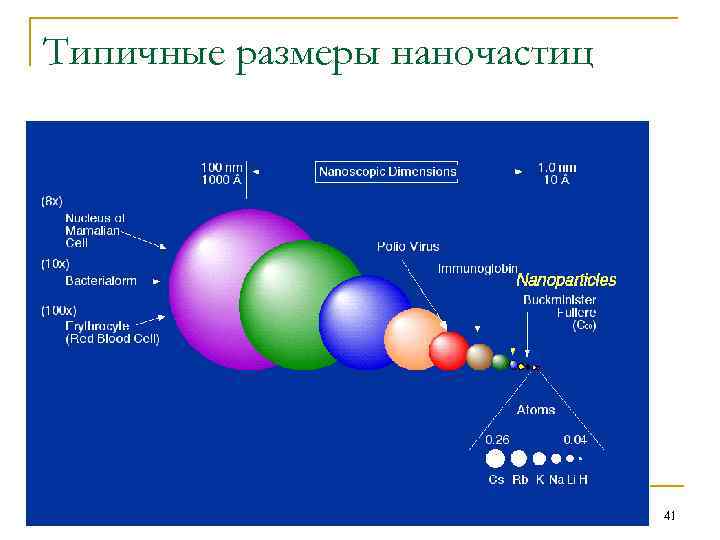 Типичные размеры наночастиц 41
Типичные размеры наночастиц 41
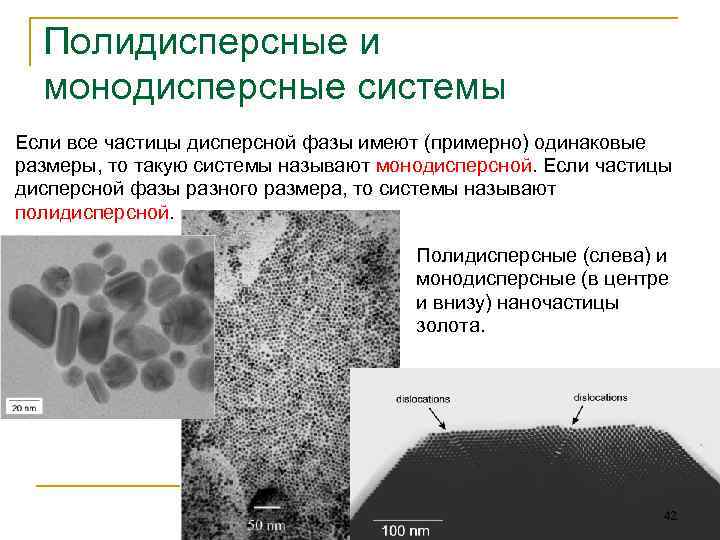 Полидисперсные и монодисперсные системы Если все частицы дисперсной фазы имеют (примерно) одинаковые размеры, то такую системы называют монодисперсной. Если частицы дисперсной фазы разного размера, то системы называют полидисперсной. Полидисперсные (слева) и монодисперсные (в центре и внизу) наночастицы золота. 42
Полидисперсные и монодисперсные системы Если все частицы дисперсной фазы имеют (примерно) одинаковые размеры, то такую системы называют монодисперсной. Если частицы дисперсной фазы разного размера, то системы называют полидисперсной. Полидисперсные (слева) и монодисперсные (в центре и внизу) наночастицы золота. 42
 Типы дисперсных систем Вещества, образующие дисперсные системы, могут находиться в любом агрегатном состоянии. При схематической записи агрегатного состояния дисперсных систем первым указывают состояние дисперсионной среды буквой Г (газ), Ж (жидкость) или Т (твердое), затем ставят тире и указывают буквой агрегатное состояние дисперсной фазы. Дисперсные системы с газообразной дисперсионной средой называют аэрозолями. Туманы представляют собой аэрозоли с жидкой дисперсной фазой (Г 1 -Ж 2). Пыль и дым – аэрозоли с твердой дисперсной фазой (Г 1 -Т 2). К этой же категории относятся порошки наноматериалов. Пена – дисперсия газа в жидкости (Ж 1 -Г 2). Эмульсиями называют дисперсные системы, в которых одна жидкость раздроблена в другой (Ж 1 -Ж 2). Грубодисперсные системы твердых частиц в жидкостях (Ж 1 -Т 2) называют суспензиями или взвесями. Аналогичные высокодисперсные системы называют коллоидными 43 растворами или золями.
Типы дисперсных систем Вещества, образующие дисперсные системы, могут находиться в любом агрегатном состоянии. При схематической записи агрегатного состояния дисперсных систем первым указывают состояние дисперсионной среды буквой Г (газ), Ж (жидкость) или Т (твердое), затем ставят тире и указывают буквой агрегатное состояние дисперсной фазы. Дисперсные системы с газообразной дисперсионной средой называют аэрозолями. Туманы представляют собой аэрозоли с жидкой дисперсной фазой (Г 1 -Ж 2). Пыль и дым – аэрозоли с твердой дисперсной фазой (Г 1 -Т 2). К этой же категории относятся порошки наноматериалов. Пена – дисперсия газа в жидкости (Ж 1 -Г 2). Эмульсиями называют дисперсные системы, в которых одна жидкость раздроблена в другой (Ж 1 -Ж 2). Грубодисперсные системы твердых частиц в жидкостях (Ж 1 -Т 2) называют суспензиями или взвесями. Аналогичные высокодисперсные системы называют коллоидными 43 растворами или золями.
 Твердые дисперсные системы В твердой дисперсной среде могут быть диспергированы газы жидкости или твердые фазы. К твердым пенам (Т 1 -Г 2) относятся пенопласты, пенобетон, шлак. В качестве твердых пен можно рассматривать хлебобулочные изделия. В твердых пенах газ находится в виде отдельных ячеек, разделенных твердой дисперсионной средой. Большое практическое значения имеют дисперсные системы (Т 1 -Т 2) – композиты. К ним относятся важные строительные материалы, например, бетон, металлокерамические композиты, металлопластики, прочие современные композитные материалы на основе пластиков, эмали, цветные стекла, многие минералы и драгоценные камни. Примеров системы (Т 1 -Ж 2) является натуральный жемчуг, в 44 котором вода диспергирована в карбонате кальция.
Твердые дисперсные системы В твердой дисперсной среде могут быть диспергированы газы жидкости или твердые фазы. К твердым пенам (Т 1 -Г 2) относятся пенопласты, пенобетон, шлак. В качестве твердых пен можно рассматривать хлебобулочные изделия. В твердых пенах газ находится в виде отдельных ячеек, разделенных твердой дисперсионной средой. Большое практическое значения имеют дисперсные системы (Т 1 -Т 2) – композиты. К ним относятся важные строительные материалы, например, бетон, металлокерамические композиты, металлопластики, прочие современные композитные материалы на основе пластиков, эмали, цветные стекла, многие минералы и драгоценные камни. Примеров системы (Т 1 -Ж 2) является натуральный жемчуг, в 44 котором вода диспергирована в карбонате кальция.
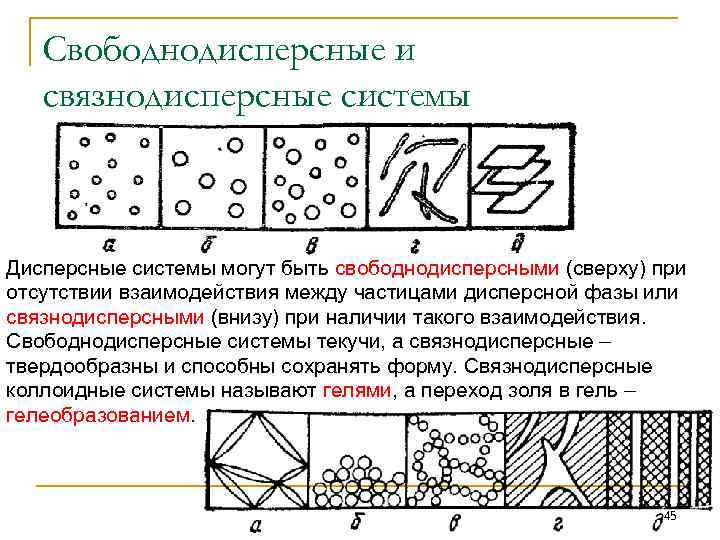 Свободнодисперсные и связнодисперсные системы Дисперсные системы могут быть свободнодисперсными (сверху) при отсутствии взаимодействия между частицами дисперсной фазы или связнодисперсными (внизу) при наличии такого взаимодействия. Свободнодисперсные системы текучи, а связнодисперсные – твердообразны и способны сохранять форму. Связнодисперсные коллоидные системы называют гелями, а переход золя в гель – гелеобразованием. 45
Свободнодисперсные и связнодисперсные системы Дисперсные системы могут быть свободнодисперсными (сверху) при отсутствии взаимодействия между частицами дисперсной фазы или связнодисперсными (внизу) при наличии такого взаимодействия. Свободнодисперсные системы текучи, а связнодисперсные – твердообразны и способны сохранять форму. Связнодисперсные коллоидные системы называют гелями, а переход золя в гель – гелеобразованием. 45
 Поверхностная энергия Молекулярные силы, действующие в фазах, составляющих дисперсные системы различны. Чем больше такое различие, тем больше потенциальная энергия межфазной границы, называемая поверхностной энергией. Для границы жидкости с ее парами такую энергию называют поверхностным натяжением. Растворенные вещества, которые снижают поверхностное натяжение растворителя, называют поверхностно-активными веществами (ПАВ). В воде это полярные органические вещества – кислоты, спирты и т. д. 46
Поверхностная энергия Молекулярные силы, действующие в фазах, составляющих дисперсные системы различны. Чем больше такое различие, тем больше потенциальная энергия межфазной границы, называемая поверхностной энергией. Для границы жидкости с ее парами такую энергию называют поверхностным натяжением. Растворенные вещества, которые снижают поверхностное натяжение растворителя, называют поверхностно-активными веществами (ПАВ). В воде это полярные органические вещества – кислоты, спирты и т. д. 46
 Коагуляция Все самопроизвольные процессы проходят в сторону уменьшения свободной энергии Гиббса. Поэтому, дисперсные системы принципиально термодинамически неустойчивы. Самопроизвольно происходят процессы уменьшения суммарной поверхности, т. е. укрупнения частиц. Это приводит к разрушению дисперсных систем: дождевые облака проливаются дождем, эмульсии расслаиваются, коллоидные растворы коагулируют, т. е. разделяются на осадок дисперсной фазы и дисперсионную среду. Способность дисперсных систем сохранять присущую степень дисперсности называется агрегатной устойчивостью. Коллоидное состояние агрегатно неустойчивое, в отличии от грубодисперсных и молекулярных систем, но устойчиво кинетически. 47
Коагуляция Все самопроизвольные процессы проходят в сторону уменьшения свободной энергии Гиббса. Поэтому, дисперсные системы принципиально термодинамически неустойчивы. Самопроизвольно происходят процессы уменьшения суммарной поверхности, т. е. укрупнения частиц. Это приводит к разрушению дисперсных систем: дождевые облака проливаются дождем, эмульсии расслаиваются, коллоидные растворы коагулируют, т. е. разделяются на осадок дисперсной фазы и дисперсионную среду. Способность дисперсных систем сохранять присущую степень дисперсности называется агрегатной устойчивостью. Коллоидное состояние агрегатно неустойчивое, в отличии от грубодисперсных и молекулярных систем, но устойчиво кинетически. 47
 Открытие электрона 1807 Дейви предположил, что электрические силы удерживают вещества 1833 Фарадей определил соотношение между массой атомов и количеством электричества, необходимого для выделения простого вещества при элетролизе 1891 Стоуни предположил, что электричество переносится отдельными частицами, которые он назвал электронами 1897 Томсон первым количественно определил свойства электронов 48
Открытие электрона 1807 Дейви предположил, что электрические силы удерживают вещества 1833 Фарадей определил соотношение между массой атомов и количеством электричества, необходимого для выделения простого вещества при элетролизе 1891 Стоуни предположил, что электричество переносится отдельными частицами, которые он назвал электронами 1897 Томсон первым количественно определил свойства электронов 48
 Открытие электрона Если прикладывать разность потенциалов к металлическим пластинам, помещенным внутрь стеклянной трубки с частично откачанным воздухом, наблюдается светящийся поток, который отклоняется под действием магнитного поля. Он состоит из отрицательно заряженных частиц, названных электронами. Заряд электрона -1, 602 * 10 -19 Кл Масса электрона 9, 109 * 10 -31 кг 49
Открытие электрона Если прикладывать разность потенциалов к металлическим пластинам, помещенным внутрь стеклянной трубки с частично откачанным воздухом, наблюдается светящийся поток, который отклоняется под действием магнитного поля. Он состоит из отрицательно заряженных частиц, названных электронами. Заряд электрона -1, 602 * 10 -19 Кл Масса электрона 9, 109 * 10 -31 кг 49
 Модель атома Томсона После открытия электрона Томсон предложил модель атома, в которой электроны находятся внутри шара с положительным зарядом (модель пудинга с изюмом). Сэр Джозеф Джон Томсон (1856 – 1940) Нобелевская премия по физике 1906 г. 50
Модель атома Томсона После открытия электрона Томсон предложил модель атома, в которой электроны находятся внутри шара с положительным зарядом (модель пудинга с изюмом). Сэр Джозеф Джон Томсон (1856 – 1940) Нобелевская премия по физике 1906 г. 50
 Открытие ядра В 1909 Резерфорд бомбардировал тонкую золотую фольгу потоком положительно заряженных альфа-частиц. При этом очень небольшая часть их отклонялась на значительные углы. Из этого был сделан вывод, что положительный заряд атомов сосредоточен с очень маленьком объеме, названным ядром. Эрнест Резерфорд (1871 – 1937) Нобелевская премия по физике 1908 г. 51
Открытие ядра В 1909 Резерфорд бомбардировал тонкую золотую фольгу потоком положительно заряженных альфа-частиц. При этом очень небольшая часть их отклонялась на значительные углы. Из этого был сделан вывод, что положительный заряд атомов сосредоточен с очень маленьком объеме, названным ядром. Эрнест Резерфорд (1871 – 1937) Нобелевская премия по физике 1908 г. 51
 Заряд ядра Резерфорд оценил, что ядро обладает положительным зарядом, по величине примерно равным половине массы атома помноженной на заряд электрона. Позже Мосли точно установил, что заряд ядра равен целому числу зарядов электрона. По величине он совпадает с зарядом всех электронов в атоме, но обладает противоположным знаком. Наименьшим зарядом обладало ядро атома водорода. Было принято, что оно содержит одну положительно заряженную элементарную частицу – протон. Масса протона – 1, 6726 * 10 -27 кг Модель атома Резерфорда Положительно заряженное ядро Отрицательно заряженное облако электронов 52
Заряд ядра Резерфорд оценил, что ядро обладает положительным зарядом, по величине примерно равным половине массы атома помноженной на заряд электрона. Позже Мосли точно установил, что заряд ядра равен целому числу зарядов электрона. По величине он совпадает с зарядом всех электронов в атоме, но обладает противоположным знаком. Наименьшим зарядом обладало ядро атома водорода. Было принято, что оно содержит одну положительно заряженную элементарную частицу – протон. Масса протона – 1, 6726 * 10 -27 кг Модель атома Резерфорда Положительно заряженное ядро Отрицательно заряженное облако электронов 52
 Открытие нейтрона Через 30 лет после открытия электрона Жолио-Кюри обнаружила, что при направлении альфа-частиц на ядра бериллия образуется поток лучей, проникающий практически через все. В 1932 г. Чедвик обнаружил, что этот поток не отклоняется под действием магнита, т. е. не обладает зарядом. Такие частицы были названы нейтронами. Наряду с протонами они входят в состав ядер всех атомов, кроме водорода. Масса нейтрона – 1, 6749 * 10 -27 кг Ирен Жолио. Кюри (1897 – 1956) Нобелевская премия по химии 1935 г. Сэр Джеймс Чедвик (1891 – 1974) Нобелевская премия по физике 1935 г. 53
Открытие нейтрона Через 30 лет после открытия электрона Жолио-Кюри обнаружила, что при направлении альфа-частиц на ядра бериллия образуется поток лучей, проникающий практически через все. В 1932 г. Чедвик обнаружил, что этот поток не отклоняется под действием магнита, т. е. не обладает зарядом. Такие частицы были названы нейтронами. Наряду с протонами они входят в состав ядер всех атомов, кроме водорода. Масса нейтрона – 1, 6749 * 10 -27 кг Ирен Жолио. Кюри (1897 – 1956) Нобелевская премия по химии 1935 г. Сэр Джеймс Чедвик (1891 – 1974) Нобелевская премия по физике 1935 г. 53
 Число протонов и нейтронов в атомах Химические элементы различаются количеством протонов в ядре. Их число равно атомному номеру в таблице Менделеева. Оно определяет химические свойства элемента. Практически для каждого элемента известно по нескольку изотопов с различной массой атома. В них число протонов одинаково, но число нейтронов различно. Химические свойства изотопов одного элемента различаются мало. Масса протона и нейтрона примерно равна 1 а. е. м. Поэтому число нейтронов в атоме можно определить как разницу между его атомной массой и атомным номером (числом протонов). Атомная масса изотопа Атомный номер (число протонов) Изотоп бериллий-9 Число нейтронов = 9 - 4 = 5 54
Число протонов и нейтронов в атомах Химические элементы различаются количеством протонов в ядре. Их число равно атомному номеру в таблице Менделеева. Оно определяет химические свойства элемента. Практически для каждого элемента известно по нескольку изотопов с различной массой атома. В них число протонов одинаково, но число нейтронов различно. Химические свойства изотопов одного элемента различаются мало. Масса протона и нейтрона примерно равна 1 а. е. м. Поэтому число нейтронов в атоме можно определить как разницу между его атомной массой и атомным номером (числом протонов). Атомная масса изотопа Атомный номер (число протонов) Изотоп бериллий-9 Число нейтронов = 9 - 4 = 5 54
 Спектры испускания атомов В отличие от Солнца или раскаленного металла, которые испускают свет непрерывно во всем спектре, химические элементы испускают свет только определенных длин волн, характерных для каждого элемента. 55
Спектры испускания атомов В отличие от Солнца или раскаленного металла, которые испускают свет непрерывно во всем спектре, химические элементы испускают свет только определенных длин волн, характерных для каждого элемента. 55
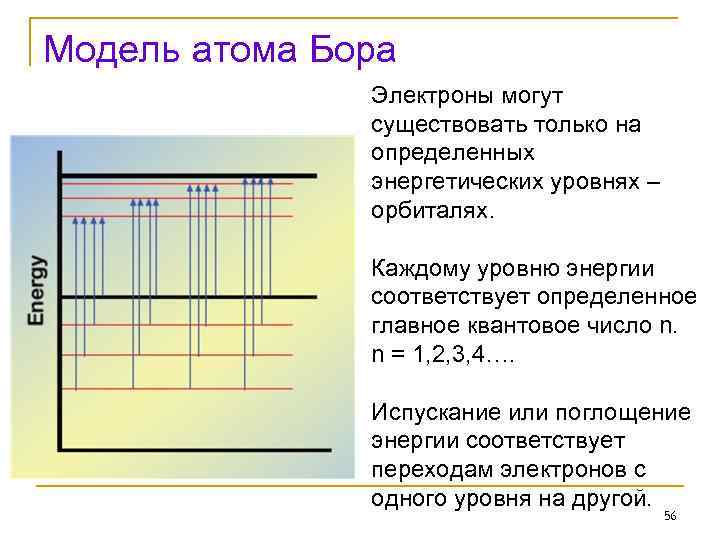 Модель атома Бора Электроны могут существовать только на определенных энергетических уровнях – орбиталях. Каждому уровню энергии соответствует определенное главное квантовое число n. n = 1, 2, 3, 4…. Испускание или поглощение энергии соответствует переходам электронов с одного уровня на другой. 56
Модель атома Бора Электроны могут существовать только на определенных энергетических уровнях – орбиталях. Каждому уровню энергии соответствует определенное главное квантовое число n. n = 1, 2, 3, 4…. Испускание или поглощение энергии соответствует переходам электронов с одного уровня на другой. 56
 Модель атома Бора Нильс Хенрик Давид Бор (1885 -1962) Нобелевская премия по физике 1922 г. Бор предложил «планетарную» модель атома, в которой электроны вращаются вокруг ядра на определенных уровнях – орбитах. Хотя эта модель правильно предсказывала энергию линий в спектре атома водорода, она не работала для других атомов и не объясняла почему существуют только такие уровни энергии электронов. 57
Модель атома Бора Нильс Хенрик Давид Бор (1885 -1962) Нобелевская премия по физике 1922 г. Бор предложил «планетарную» модель атома, в которой электроны вращаются вокруг ядра на определенных уровнях – орбитах. Хотя эта модель правильно предсказывала энергию линий в спектре атома водорода, она не работала для других атомов и не объясняла почему существуют только такие уровни энергии электронов. 57
 Квантовые числа Главное квантовое число n характеризует энергию орбитали, ее размер и степень удаленности от ядра. n принимает любые положительные целые значения: n = 1, 2, 3, 4…. Орбитальное квантовое число l определяет число подуровней на каждом уровне и форму орбиталей. l принимает целые значения от 0 до n-1. В зависимости от l орбитали именуются латинскими буквами: Магнитное квантовое число ml определяет ориентацию орбиталей в пространстве. ml принимает целые значения от -l до l. Спиновое квантовое число ms характеризует спин и принимает значения ½ и - ½. 58
Квантовые числа Главное квантовое число n характеризует энергию орбитали, ее размер и степень удаленности от ядра. n принимает любые положительные целые значения: n = 1, 2, 3, 4…. Орбитальное квантовое число l определяет число подуровней на каждом уровне и форму орбиталей. l принимает целые значения от 0 до n-1. В зависимости от l орбитали именуются латинскими буквами: Магнитное квантовое число ml определяет ориентацию орбиталей в пространстве. ml принимает целые значения от -l до l. Спиновое квантовое число ms характеризует спин и принимает значения ½ и - ½. 58
 Уровни энергии в атоме водорода В атоме водорода главное квантовое число определяет уровень энергии электронов. Все подуровни, различающиеся другими квантовыми числами, обладают одинаковыми энергиями. Количество орбиталей на уровне с главным квантовым числом n равно n 2. 16 орбиталей 9 орбиталей 4 орбитали 1 орбиталь 59
Уровни энергии в атоме водорода В атоме водорода главное квантовое число определяет уровень энергии электронов. Все подуровни, различающиеся другими квантовыми числами, обладают одинаковыми энергиями. Количество орбиталей на уровне с главным квантовым числом n равно n 2. 16 орбиталей 9 орбиталей 4 орбитали 1 орбиталь 59
 Электронная конфигурация В многоэлектронных атомах энергия орбиталей зависит не только от взаимодействия электронов с ядром, но и от взаимного отталкивания электронов, а также экранирования другими электронами ядра. В результате энергия орбиталей зависит не только от n, но и от l (орбитального квантового числа). Принцип наименьших энергий В первую очередь заполняются орбитали с более низкой энергией. 60
Электронная конфигурация В многоэлектронных атомах энергия орбиталей зависит не только от взаимодействия электронов с ядром, но и от взаимного отталкивания электронов, а также экранирования другими электронами ядра. В результате энергия орбиталей зависит не только от n, но и от l (орбитального квантового числа). Принцип наименьших энергий В первую очередь заполняются орбитали с более низкой энергией. 60
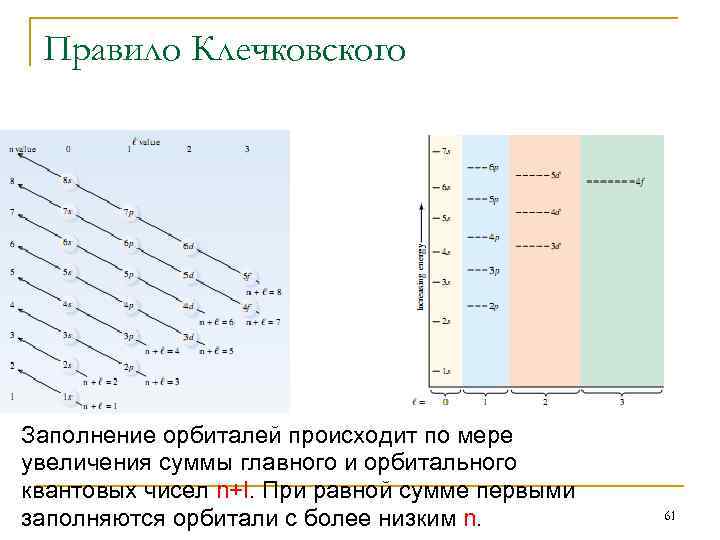 Правило Клечковского Заполнение орбиталей происходит по мере увеличения суммы главного и орбитального квантовых чисел n+l. При равной сумме первыми заполняются орбитали с более низким n. 61
Правило Клечковского Заполнение орбиталей происходит по мере увеличения суммы главного и орбитального квантовых чисел n+l. При равной сумме первыми заполняются орбитали с более низким n. 61
 Принцип Паули Не может быть 2 электронов с одинаковым значением всех квантовых чисел. Соответственно, каждая электронная орбиталь может содержать не более 2 электронов, различающихся значениями спинового квантового числа. Электронная конфигурация элемента – это запись распределения электронов в его атомах по оболочкам, подоболочкам и орбиталям. Вольфганг Эрнст Паули (1900 -1958) Нобелевская премия по физике 1945 г. 62
Принцип Паули Не может быть 2 электронов с одинаковым значением всех квантовых чисел. Соответственно, каждая электронная орбиталь может содержать не более 2 электронов, различающихся значениями спинового квантового числа. Электронная конфигурация элемента – это запись распределения электронов в его атомах по оболочкам, подоболочкам и орбиталям. Вольфганг Эрнст Паули (1900 -1958) Нобелевская премия по физике 1945 г. 62
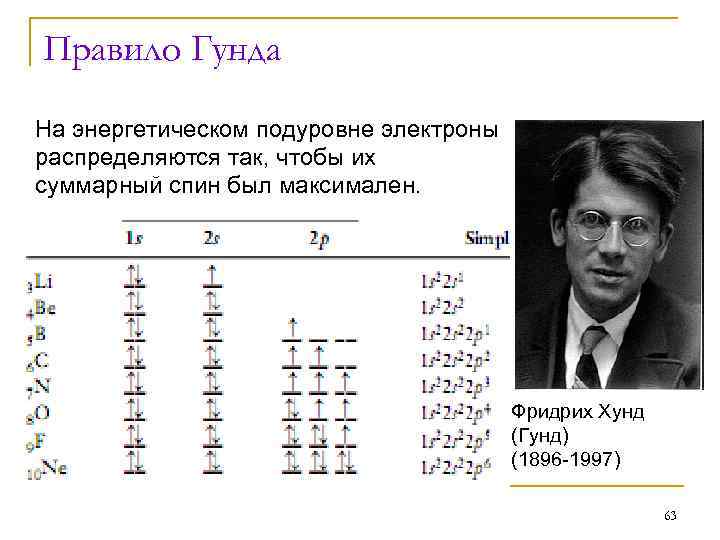 Правило Гунда На энергетическом подуровне электроны распределяются так, чтобы их суммарный спин был максимален. Фридрих Хунд (Гунд) (1896 -1997) 63
Правило Гунда На энергетическом подуровне электроны распределяются так, чтобы их суммарный спин был максимален. Фридрих Хунд (Гунд) (1896 -1997) 63
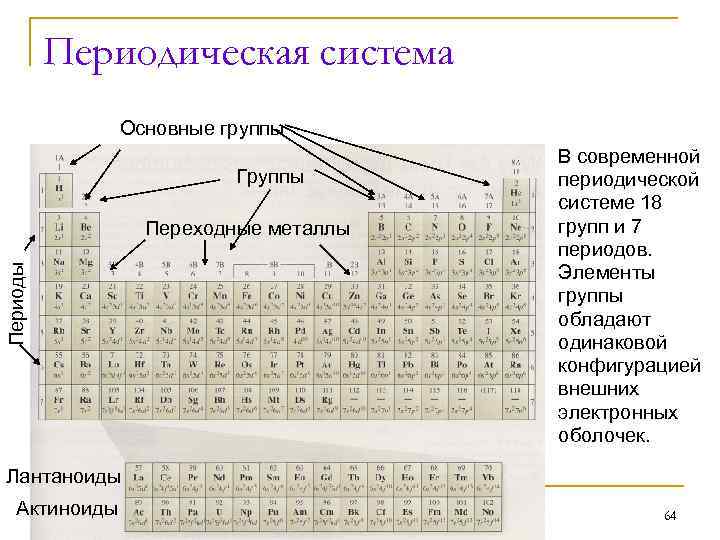 Периодическая система Основные группы Группы Периоды Переходные металлы В современной периодической системе 18 групп и 7 периодов. Элементы группы обладают одинаковой конфигурацией внешних электронных оболочек. Лантаноиды Актиноиды 64
Периодическая система Основные группы Группы Периоды Переходные металлы В современной периодической системе 18 групп и 7 периодов. Элементы группы обладают одинаковой конфигурацией внешних электронных оболочек. Лантаноиды Актиноиды 64
 Ионы – это заряженные частицы, образующиеся в результате присоединения электрона к нейтральному атому или молекуле, либо в результате отрыва электрона от нейтрального атома или молекулы. Катионы – положительно заряженные ионы, которые образуются при отрыве электронов от атомов. Анионы – отрицательно заряженные ионы, которые образуются присоединении электронов к атомам. 65
Ионы – это заряженные частицы, образующиеся в результате присоединения электрона к нейтральному атому или молекуле, либо в результате отрыва электрона от нейтрального атома или молекулы. Катионы – положительно заряженные ионы, которые образуются при отрыве электронов от атомов. Анионы – отрицательно заряженные ионы, которые образуются присоединении электронов к атомам. 65
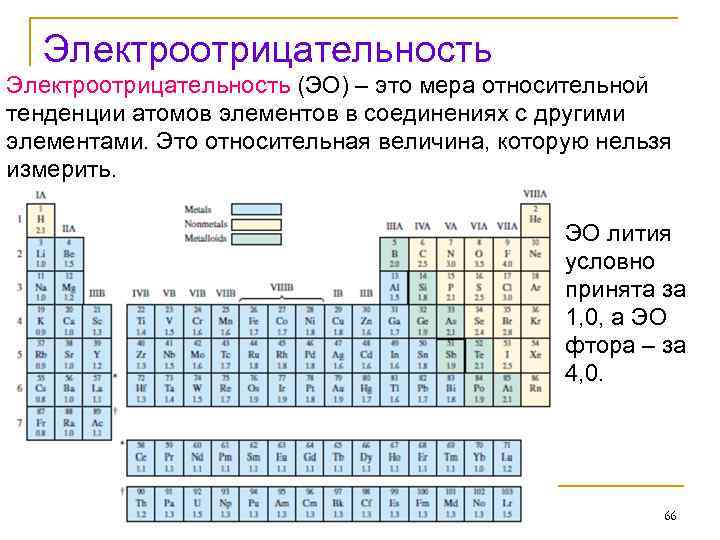 Электроотрицательность (ЭО) – это мера относительной тенденции атомов элементов в соединениях с другими элементами. Это относительная величина, которую нельзя измерить. ЭО лития условно принята за 1, 0, а ЭО фтора – за 4, 0. 66
Электроотрицательность (ЭО) – это мера относительной тенденции атомов элементов в соединениях с другими элементами. Это относительная величина, которую нельзя измерить. ЭО лития условно принята за 1, 0, а ЭО фтора – за 4, 0. 66
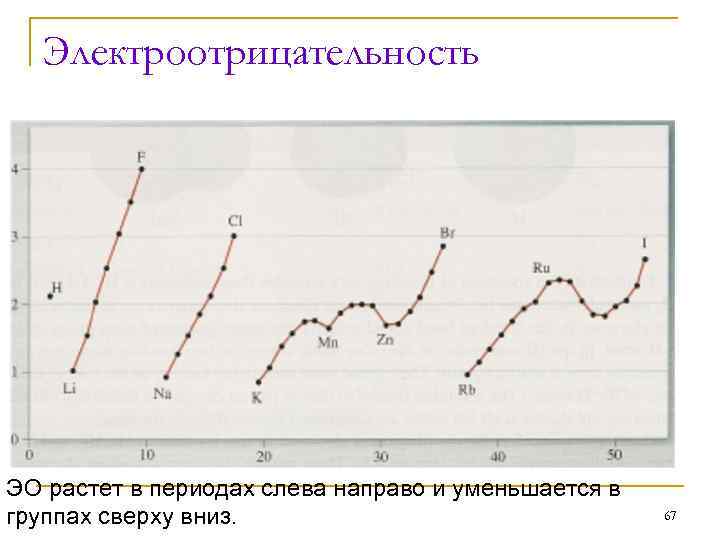 Электроотрицательность ЭО растет в периодах слева направо и уменьшается в группах сверху вниз. 67
Электроотрицательность ЭО растет в периодах слева направо и уменьшается в группах сверху вниз. 67
 Периодические химические свойства ü Реакционная способность металлов основных групп растет сверху вниз. ü Реакционная способность переходных металлов уменьшается в группах сверху вниз. ü Реакционная способность неметаллов уменьшается сверху вниз. ü Сила оснований растет в группе сверху вниз и уменьшается в периоде слева направо. üСила кислот уменьшается в группе сверху вниз и растет в периоде слева направо. 68
Периодические химические свойства ü Реакционная способность металлов основных групп растет сверху вниз. ü Реакционная способность переходных металлов уменьшается в группах сверху вниз. ü Реакционная способность неметаллов уменьшается сверху вниз. ü Сила оснований растет в группе сверху вниз и уменьшается в периоде слева направо. üСила кислот уменьшается в группе сверху вниз и растет в периоде слева направо. 68
 Химические связи Атомы образуют молекулы за счет образования химических связей, в которых принимают участие внешние (валентные) электроны. Образование химических связей сопровождается снижением энергии системы атомов, образующих молекулу. В соединениях существуют следующие типы химических связей: Ионные; Ковалентные – полярные или неполярные; Металлические; Водородные; Ван-Дер-Ваальсовы. 69
Химические связи Атомы образуют молекулы за счет образования химических связей, в которых принимают участие внешние (валентные) электроны. Образование химических связей сопровождается снижением энергии системы атомов, образующих молекулу. В соединениях существуют следующие типы химических связей: Ионные; Ковалентные – полярные или неполярные; Металлические; Водородные; Ван-Дер-Ваальсовы. 69
 Ионная связь Ионные связи образуются за счет электростатического взаимодействия между положительно и отрицательно заряженными ионами. Они особенно характерны для соединений металлов 1 или 2 групп с неметаллами 16 или 17 групп. Простые ионы образуются из атомов для счет приобретения или отдачи электронов для удовлетворения правилу октета. Как правило, они образуются таким образом, чтобы октет получался в результате принятия или отдачи наименьшего числа электронов. Ионная связь не направленная – электростатические силы действуют во всех направлениях. Ионная связь не обладает насыщаемостью. 70
Ионная связь Ионные связи образуются за счет электростатического взаимодействия между положительно и отрицательно заряженными ионами. Они особенно характерны для соединений металлов 1 или 2 групп с неметаллами 16 или 17 групп. Простые ионы образуются из атомов для счет приобретения или отдачи электронов для удовлетворения правилу октета. Как правило, они образуются таким образом, чтобы октет получался в результате принятия или отдачи наименьшего числа электронов. Ионная связь не направленная – электростатические силы действуют во всех направлениях. Ионная связь не обладает насыщаемостью. 70
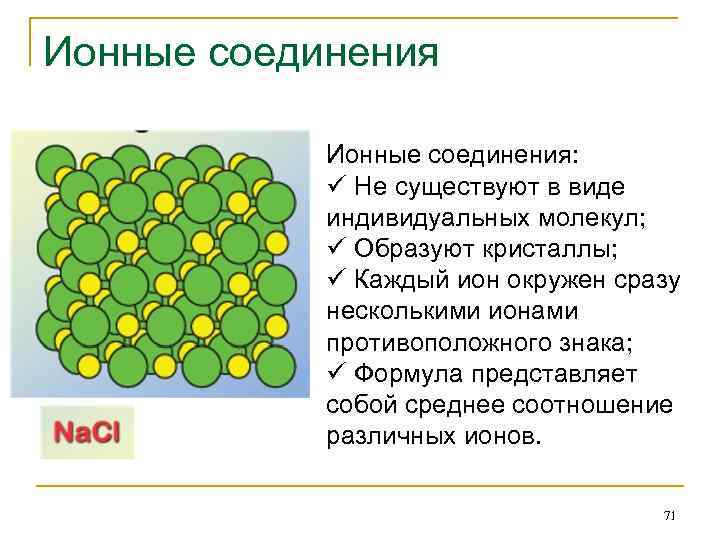 Ионные соединения: ü Не существуют в виде индивидуальных молекул; ü Образуют кристаллы; ü Каждый ион окружен сразу несколькими ионами противоположного знака; ü Формула представляет собой среднее соотношение различных ионов. 71
Ионные соединения: ü Не существуют в виде индивидуальных молекул; ü Образуют кристаллы; ü Каждый ион окружен сразу несколькими ионами противоположного знака; ü Формула представляет собой среднее соотношение различных ионов. 71
 Символы Льюиса и ковалентная связь В соединениях с ковалентными связями атомы объединяют электроны. Типы электронных пар в таких соединениях: Общие – пара валентных электронов, принадлежащих одновременно двум атомам, образуя ковалентную связь. Неподеленные – пара электронов, принадлежащих целиком одному из атомов и не участвующих в образовании связей. Неподеленная пара. Общая пара 72
Символы Льюиса и ковалентная связь В соединениях с ковалентными связями атомы объединяют электроны. Типы электронных пар в таких соединениях: Общие – пара валентных электронов, принадлежащих одновременно двум атомам, образуя ковалентную связь. Неподеленные – пара электронов, принадлежащих целиком одному из атомов и не участвующих в образовании связей. Неподеленная пара. Общая пара 72
 Неполярные ковалентные связи Неполярные связи образуются между атомами в равной степени делящими между собой пару электронов. Это либо одинаковые атомы, либо атомы с равной электроотрицательностью. Черточка между атомами обозначает общую электронную пару при образовании ковалентной связи. 73
Неполярные ковалентные связи Неполярные связи образуются между атомами в равной степени делящими между собой пару электронов. Это либо одинаковые атомы, либо атомы с равной электроотрицательностью. Черточка между атомами обозначает общую электронную пару при образовании ковалентной связи. 73
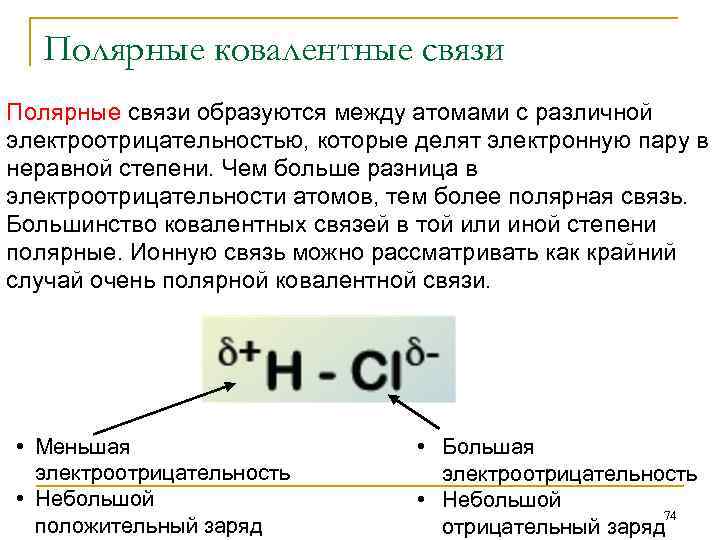 Полярные ковалентные связи Полярные связи образуются между атомами с различной электроотрицательностью, которые делят электронную пару в неравной степени. Чем больше разница в электроотрицательности атомов, тем более полярная связь. Большинство ковалентных связей в той или иной степени полярные. Ионную связь можно рассматривать как крайний случай очень полярной ковалентной связи. • Меньшая электроотрицательность • Небольшой положительный заряд • Большая электроотрицательность • Небольшой 74 отрицательный заряд
Полярные ковалентные связи Полярные связи образуются между атомами с различной электроотрицательностью, которые делят электронную пару в неравной степени. Чем больше разница в электроотрицательности атомов, тем более полярная связь. Большинство ковалентных связей в той или иной степени полярные. Ионную связь можно рассматривать как крайний случай очень полярной ковалентной связи. • Меньшая электроотрицательность • Небольшой положительный заряд • Большая электроотрицательность • Небольшой 74 отрицательный заряд
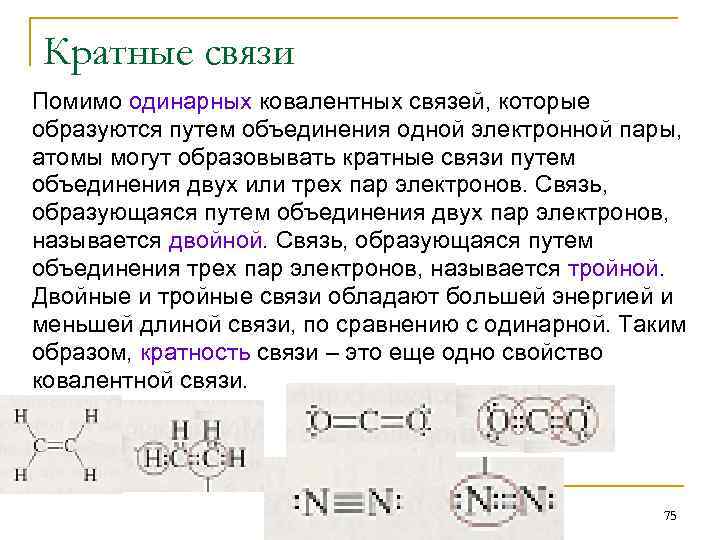 Кратные связи Помимо одинарных ковалентных связей, которые образуются путем объединения одной электронной пары, атомы могут образовывать кратные связи путем объединения двух или трех пар электронов. Связь, образующаяся путем объединения двух пар электронов, называется двойной. Связь, образующаяся путем объединения трех пар электронов, называется тройной. Двойные и тройные связи обладают большей энергией и меньшей длиной связи, по сравнению с одинарной. Таким образом, кратность связи – это еще одно свойство ковалентной связи. 75
Кратные связи Помимо одинарных ковалентных связей, которые образуются путем объединения одной электронной пары, атомы могут образовывать кратные связи путем объединения двух или трех пар электронов. Связь, образующаяся путем объединения двух пар электронов, называется двойной. Связь, образующаяся путем объединения трех пар электронов, называется тройной. Двойные и тройные связи обладают большей энергией и меньшей длиной связи, по сравнению с одинарной. Таким образом, кратность связи – это еще одно свойство ковалентной связи. 75
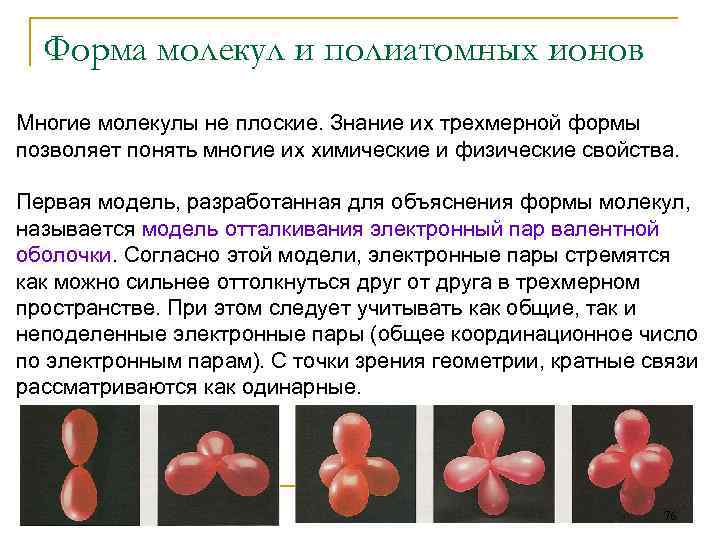 Форма молекул и полиатомных ионов Многие молекулы не плоские. Знание их трехмерной формы позволяет понять многие их химические и физические свойства. Первая модель, разработанная для объяснения формы молекул, называется модель отталкивания электронный пар валентной оболочки. Согласно этой модели, электронные пары стремятся как можно сильнее оттолкнуться друг от друга в трехмерном пространстве. При этом следует учитывать как общие, так и неподеленные электронные пары (общее координационное число по электронным парам). С точки зрения геометрии, кратные связи рассматриваются как одинарные. 76
Форма молекул и полиатомных ионов Многие молекулы не плоские. Знание их трехмерной формы позволяет понять многие их химические и физические свойства. Первая модель, разработанная для объяснения формы молекул, называется модель отталкивания электронный пар валентной оболочки. Согласно этой модели, электронные пары стремятся как можно сильнее оттолкнуться друг от друга в трехмерном пространстве. При этом следует учитывать как общие, так и неподеленные электронные пары (общее координационное число по электронным парам). С точки зрения геометрии, кратные связи рассматриваются как одинарные. 76
 Типичные геометрические формы молекул Форма молекул Линейная Число различных электронных пар 2 Плоская тригональная Тетраэдр CO 3 BCl 3 4 Тригональная пирамида 4 Изогнутая Пример 4 CH 4 NH 3 H 2 O 77
Типичные геометрические формы молекул Форма молекул Линейная Число различных электронных пар 2 Плоская тригональная Тетраэдр CO 3 BCl 3 4 Тригональная пирамида 4 Изогнутая Пример 4 CH 4 NH 3 H 2 O 77
 Гибридизация атомных орбиталей Для объяснения строения многих молекул в рамках метода валентных связей требуется привлекать предположение о гибридизации атомных орбиталей. Гибридизация – перераспределение электронной плотности между разными, но близкими по энергии орбиталями. В результате из нескольких орбиталей разной формы образуется такое же количество одинаковых гибридных орбиталей. sp - гибридизация В молекуле Be. Cl 2 атом бериллия образует две одинаковые связи с атомами хлора, направленные в противоположные стороны. Но ведь в атоме бериллия все электроны спарены, конфигурация 1 s 22 s 2. Экспериментальные данные можно объяснить, если предположить, что один из электронов переходит на одну из 2 p орбиталей, при этом образуется 2 эквивалентных sp орбитали, направленных под углом 180° 78
Гибридизация атомных орбиталей Для объяснения строения многих молекул в рамках метода валентных связей требуется привлекать предположение о гибридизации атомных орбиталей. Гибридизация – перераспределение электронной плотности между разными, но близкими по энергии орбиталями. В результате из нескольких орбиталей разной формы образуется такое же количество одинаковых гибридных орбиталей. sp - гибридизация В молекуле Be. Cl 2 атом бериллия образует две одинаковые связи с атомами хлора, направленные в противоположные стороны. Но ведь в атоме бериллия все электроны спарены, конфигурация 1 s 22 s 2. Экспериментальные данные можно объяснить, если предположить, что один из электронов переходит на одну из 2 p орбиталей, при этом образуется 2 эквивалентных sp орбитали, направленных под углом 180° 78
 Гибридные орбитали sp 2 - гибридизация Аналогично можно объяснить геометрию молекулы BF 3, имеющей форму плоского равностороннего треугольника. Происходит возбуждение одного электрона с 2 s орбитали на 2 p, с последующим образованием трех гибридных sp 2 орбиталей, направленных под углом 120°. 79
Гибридные орбитали sp 2 - гибридизация Аналогично можно объяснить геометрию молекулы BF 3, имеющей форму плоского равностороннего треугольника. Происходит возбуждение одного электрона с 2 s орбитали на 2 p, с последующим образованием трех гибридных sp 2 орбиталей, направленных под углом 120°. 79
 Гибридные орбитали sp 3 -гибридизация Аналогично можно объяснить геометрию молекулы CH 4, имеющей форму тетраэдра. Происходит возбуждение одного электрона с 2 s орбитали на 2 p, с последующим образованием четырех гибридных sp 3 орбиталей, направленных под углом 109, 5° по направлению к вершинам тетраэдра. 80
Гибридные орбитали sp 3 -гибридизация Аналогично можно объяснить геометрию молекулы CH 4, имеющей форму тетраэдра. Происходит возбуждение одного электрона с 2 s орбитали на 2 p, с последующим образованием четырех гибридных sp 3 орбиталей, направленных под углом 109, 5° по направлению к вершинам тетраэдра. 80
 Особенности - и -связей n n -связь всегда образуется в дополнение к -связи при образовании кратной связи. -связь может образоваться только чистыми орбиталями, а -связь может образовываться как чистыми, так и гибридными орбиталями. -связь обладает большей прочностью, чем -связь обладает осевой симметрией. 81
Особенности - и -связей n n -связь всегда образуется в дополнение к -связи при образовании кратной связи. -связь может образоваться только чистыми орбиталями, а -связь может образовываться как чистыми, так и гибридными орбиталями. -связь обладает большей прочностью, чем -связь обладает осевой симметрией. 81
 Связи между атомами углерода Основной особенностью органических соединений является наличие связей между атомами углерода. Атом углерода в органических соединениях всегда образует 4 ковалентных связи. Атомы водорода – 1 ковалентную связь. В структурах химических соединений черточка между атомами обозначает одну связь (обычно ковалентную). 82
Связи между атомами углерода Основной особенностью органических соединений является наличие связей между атомами углерода. Атом углерода в органических соединениях всегда образует 4 ковалентных связи. Атомы водорода – 1 ковалентную связь. В структурах химических соединений черточка между атомами обозначает одну связь (обычно ковалентную). 82
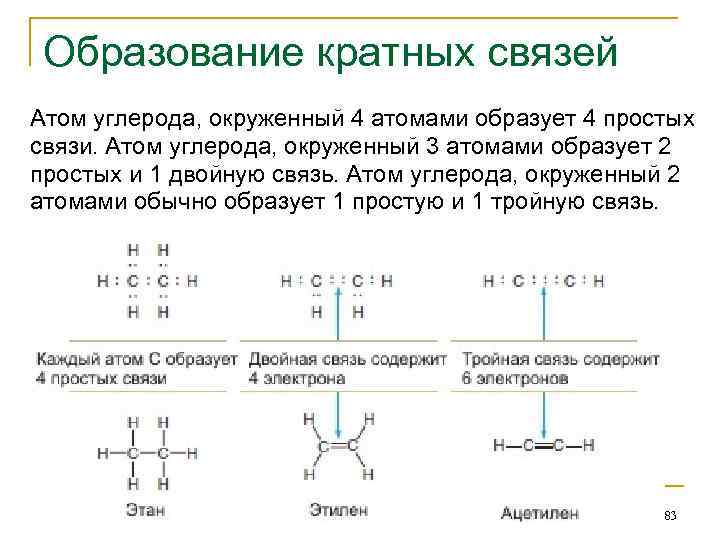 Образование кратных связей Атом углерода, окруженный 4 атомами образует 4 простых связи. Атом углерода, окруженный 3 атомами образует 2 простых и 1 двойную связь. Атом углерода, окруженный 2 атомами обычно образует 1 простую и 1 тройную связь. 83
Образование кратных связей Атом углерода, окруженный 4 атомами образует 4 простых связи. Атом углерода, окруженный 3 атомами образует 2 простых и 1 двойную связь. Атом углерода, окруженный 2 атомами обычно образует 1 простую и 1 тройную связь. 83
 Типы органических соединений по структуре углеродного скелета По структуре углеродного скелета различают соединения алифатические, т. е. содержащие незамкнутую углеродную цепь с простыми или кратными связями, алициклические, т. е. содержащие замкнутые кольца атомов углеродов с простыми или кратными связями, ароматические, т. е. содержащие по крайней мере одно кольцо из атомов углерода с делокализованными электронами, и гетероциклические, т. е. содержащие замкнутый цикл из атомов углерода и одного или нескольких гетероатомов. Гетероатомом в органических соединениях называется любой атом, кроме углерода и водорода. 84
Типы органических соединений по структуре углеродного скелета По структуре углеродного скелета различают соединения алифатические, т. е. содержащие незамкнутую углеродную цепь с простыми или кратными связями, алициклические, т. е. содержащие замкнутые кольца атомов углеродов с простыми или кратными связями, ароматические, т. е. содержащие по крайней мере одно кольцо из атомов углерода с делокализованными электронами, и гетероциклические, т. е. содержащие замкнутый цикл из атомов углерода и одного или нескольких гетероатомов. Гетероатомом в органических соединениях называется любой атом, кроме углерода и водорода. 84
 Гетероатомы образуют разное число ковалентных связей, определяемое их положением в таблице Менделеева. Большинство гетероатомов также имеют одну или несколько пар несвязывающих неподеленных электронов, так что общее число s и p электронов на внешних орбиталях равно 8. 85
Гетероатомы образуют разное число ковалентных связей, определяемое их положением в таблице Менделеева. Большинство гетероатомов также имеют одну или несколько пар несвязывающих неподеленных электронов, так что общее число s и p электронов на внешних орбиталях равно 8. 85
 Функциональные группы Функциональной группой называется атом или группа атомов, придающие веществу характеристические физические и химические свойства. Фунциональные группы могут содержать гетероатом, кратную связь или и то и другое. 86
Функциональные группы Функциональной группой называется атом или группа атомов, придающие веществу характеристические физические и химические свойства. Фунциональные группы могут содержать гетероатом, кратную связь или и то и другое. 86
 Углеводороды – это органические соединения, в состав которых входят только два элемента: углерод и водород, например CH 4, C 2 H 4, C 6 H 6. Природные источниками углеводородов являются нефть, природный и попутный газ, торф. Насыщенные углеводороды содержат только простые C-C и C-H cвязи и не содержат кратных (двойных или тройных) связей. Насыщенные алифатические углеводороды называются алканы и имеют общую формулу Cn. H 2 n+2. Название алканов заканчиваются суффиксом –ан. Насыщенные углеводороды, имеющие хотя бы один цикл называются циклоалканы. Общая формула циклоалканов с одним кольцом Cn. H 2 n. Названия циклоалканов начинаются приставкой цикло- и заканчиваются суффиксом –ан. 87
Углеводороды – это органические соединения, в состав которых входят только два элемента: углерод и водород, например CH 4, C 2 H 4, C 6 H 6. Природные источниками углеводородов являются нефть, природный и попутный газ, торф. Насыщенные углеводороды содержат только простые C-C и C-H cвязи и не содержат кратных (двойных или тройных) связей. Насыщенные алифатические углеводороды называются алканы и имеют общую формулу Cn. H 2 n+2. Название алканов заканчиваются суффиксом –ан. Насыщенные углеводороды, имеющие хотя бы один цикл называются циклоалканы. Общая формула циклоалканов с одним кольцом Cn. H 2 n. Названия циклоалканов начинаются приставкой цикло- и заканчиваются суффиксом –ан. 87
 Гомологи Среди многообразия органических соединений можно выделить группы веществ, сходных по химическим свойствам и отличающихся друг от друга на одну или несколько групп СН 2. Такие соединения называются гомологами. Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд, а группа СН 2 называется гомологической разностью. Примером гомологического ряда может служить ряд предельных, углеводородов (алканов). Простейший его представитель - метан СН 4. Гомологами метана являются: этан С 2 Н 6, пропан С 3 Н 8, бутан С 4 Н 10, пентан С 5 Н 12, гексан С 6 Н 14, гептан С 7 Н 16 и т. д. Итак, формула любого последующего гомолога может быть получена прибавлением к формуле предыдущего углеводорода гомологической разности. 88
Гомологи Среди многообразия органических соединений можно выделить группы веществ, сходных по химическим свойствам и отличающихся друг от друга на одну или несколько групп СН 2. Такие соединения называются гомологами. Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд, а группа СН 2 называется гомологической разностью. Примером гомологического ряда может служить ряд предельных, углеводородов (алканов). Простейший его представитель - метан СН 4. Гомологами метана являются: этан С 2 Н 6, пропан С 3 Н 8, бутан С 4 Н 10, пентан С 5 Н 12, гексан С 6 Н 14, гептан С 7 Н 16 и т. д. Итак, формула любого последующего гомолога может быть получена прибавлением к формуле предыдущего углеводорода гомологической разности. 88
 Алканы Число атомов углерода Т Т кипения, плавления, °C °C Названия всех алканов, начиная с пентана, строятся добавлением суффикса –ан к числовому префиксу. 89
Алканы Число атомов углерода Т Т кипения, плавления, °C °C Названия всех алканов, начиная с пентана, строятся добавлением суффикса –ан к числовому префиксу. 89
 Химические свойства алканов Углеводороды ряда метана при обычной температуре химически весьма инертны, почему и получили название парафинов (от лат. parum affinis - обладающий малым сродством). При сравнительно невысоких температурах они вступают лишь в небольшое число реакций, при которых происходит замещение атомов водорода на различные атомы и группы. На свету алканы могут последовательно замещать атомы водорода на атомы галогена. Реакция протекает по свободнорадикальному механизму. Под действием света молекулы хлора распадаются на неорганические радикалы. Неорганический радикал CI • отрывает от молекулы метана атом водорода одним электроном, при этом образуются HCl и свободный радикал СН 3 • . 90
Химические свойства алканов Углеводороды ряда метана при обычной температуре химически весьма инертны, почему и получили название парафинов (от лат. parum affinis - обладающий малым сродством). При сравнительно невысоких температурах они вступают лишь в небольшое число реакций, при которых происходит замещение атомов водорода на различные атомы и группы. На свету алканы могут последовательно замещать атомы водорода на атомы галогена. Реакция протекает по свободнорадикальному механизму. Под действием света молекулы хлора распадаются на неорганические радикалы. Неорганический радикал CI • отрывает от молекулы метана атом водорода одним электроном, при этом образуются HCl и свободный радикал СН 3 • . 90
 Химические свойства алканов Известны и другие реакции алканов, протекающие по свободнорадикальному механизму. Метан при обычной температуре обладает большой стойкостью кислотам, щелочам и многим окислителям. Однако он вступает в реакцию с азотной кислотой реакция нитрования. Однако известны процессы, при которых происходит не только расщеплена связей С-Н, но и разрыв цепи углеродных атомов (у гомологов метана). Эти реакции дегидрирования (а) и крекинга (б) протекают при высоких температурах и в присутствии катализаторов. 91
Химические свойства алканов Известны и другие реакции алканов, протекающие по свободнорадикальному механизму. Метан при обычной температуре обладает большой стойкостью кислотам, щелочам и многим окислителям. Однако он вступает в реакцию с азотной кислотой реакция нитрования. Однако известны процессы, при которых происходит не только расщеплена связей С-Н, но и разрыв цепи углеродных атомов (у гомологов метана). Эти реакции дегидрирования (а) и крекинга (б) протекают при высоких температурах и в присутствии катализаторов. 91
 Горение алканов При высоких температурах на воздухе алканы, как и большинство органических веществ, горят. Реакция протекает по сложному свободно-радикальному механизму. Реакция горения сопровождается выделением энергии и широко применяется для получения электроэнергии, обогрева домов, движения автомобилей, приготовления пищи, и т. д. 92
Горение алканов При высоких температурах на воздухе алканы, как и большинство органических веществ, горят. Реакция протекает по сложному свободно-радикальному механизму. Реакция горения сопровождается выделением энергии и широко применяется для получения электроэнергии, обогрева домов, движения автомобилей, приготовления пищи, и т. д. 92
 Алкены Ненасыщенными называются органические соединения, содержащие хотя бы одну двойную или тройную С-С связь. Алифатические углеводороды, в молекулах которых имеется одна двойная связь, называются алкены (олефины) и имеют общую формулу Cn. H 2 n. Названия алкенов образуются от названий соответствующих алканов заменой суффикса –ан на -ен. Тривиальные названия простейших алкенов: C 2 H 4 – этилен, C 3 H 6 – пропилен, C 4 H 8 – бутилен. Углеводороды, имеющие в своем составе один цикл и одну двойную связь называются циклоалкены. Этилен (этен) C 2 H 4 120° 93
Алкены Ненасыщенными называются органические соединения, содержащие хотя бы одну двойную или тройную С-С связь. Алифатические углеводороды, в молекулах которых имеется одна двойная связь, называются алкены (олефины) и имеют общую формулу Cn. H 2 n. Названия алкенов образуются от названий соответствующих алканов заменой суффикса –ан на -ен. Тривиальные названия простейших алкенов: C 2 H 4 – этилен, C 3 H 6 – пропилен, C 4 H 8 – бутилен. Углеводороды, имеющие в своем составе один цикл и одну двойную связь называются циклоалкены. Этилен (этен) C 2 H 4 120° 93
 Номенклатура алкенов Систематические названия алкенов строятся по тем же общим правилам, что и для алканов. При этом выбирается самая длинная углеродная цепь, содержащая функциональную группу (в данном случае двойную связь). Она нумеруется так, чтобы у двойной связи был минимальный номер. Он указывается после названия алкена. бутен-1 бут-1 -ен 1 -бутен Принято в России Рекомендовано ИЮПАК Принято в США 2 -пропилгексен-1 94
Номенклатура алкенов Систематические названия алкенов строятся по тем же общим правилам, что и для алканов. При этом выбирается самая длинная углеродная цепь, содержащая функциональную группу (в данном случае двойную связь). Она нумеруется так, чтобы у двойной связи был минимальный номер. Он указывается после названия алкена. бутен-1 бут-1 -ен 1 -бутен Принято в России Рекомендовано ИЮПАК Принято в США 2 -пропилгексен-1 94
 Геометрические изомеры В ряду этиленовых углеводородов возможен еще один вид изомерии, характерный только для соединений с двойной связью. Если вокруг σ-связи возможно свободное вращение атомов и атомных группировок, то двойная связь препятствует такому вращению (в противном случае происходит разрыв π-связи). Отсутствие свободного вращения вокруг двойной связи и приводит к возникновению геометрических, или цистранс-изомеров для тех алкенов, у которых при каждом из двух атомов углерода, связанных двойной связью, имеются разные заместители. Геометрическая изомерия является одним из видов пространственной изомерии. Изомеры, у которых заместители (или одинаковые заместители) расположены по одну сторону двойной связи, называют цис-изомерами, а по разные стороны - транс-изомерами. 95
Геометрические изомеры В ряду этиленовых углеводородов возможен еще один вид изомерии, характерный только для соединений с двойной связью. Если вокруг σ-связи возможно свободное вращение атомов и атомных группировок, то двойная связь препятствует такому вращению (в противном случае происходит разрыв π-связи). Отсутствие свободного вращения вокруг двойной связи и приводит к возникновению геометрических, или цистранс-изомеров для тех алкенов, у которых при каждом из двух атомов углерода, связанных двойной связью, имеются разные заместители. Геометрическая изомерия является одним из видов пространственной изомерии. Изомеры, у которых заместители (или одинаковые заместители) расположены по одну сторону двойной связи, называют цис-изомерами, а по разные стороны - транс-изомерами. 95
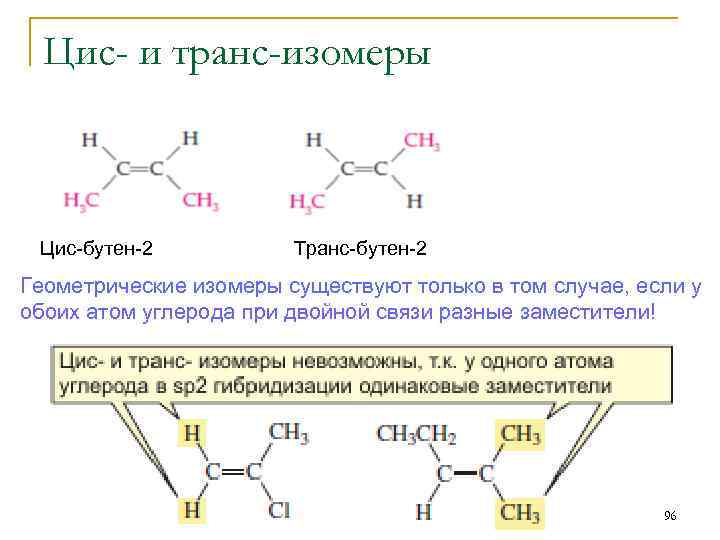 Цис- и транс-изомеры Цис-бутен-2 Транс-бутен-2 Геометрические изомеры существуют только в том случае, если у обоих атом углерода при двойной связи разные заместители! 96
Цис- и транс-изомеры Цис-бутен-2 Транс-бутен-2 Геометрические изомеры существуют только в том случае, если у обоих атом углерода при двойной связи разные заместители! 96
 Химические свойства алкенов Для предсказания химических свойств алкенов следует учесть, что -связь в них оказывается гораздо менее прочной, чем -связь С-С. Кроме того, она пространственно более доступна для атаки реагентами. Поэтому алкены гораздо более реакционноспособны, чем алканы. Наиболее характерна для них реакция присоединения, приводящая к разрыву -связи с образованием двух новых -связей с участием реагента. Однако алканы способны и к реакции замещения. Можно выделить следующие важнейшие типы реакций алкенов: - каталитическое гидрирование; - электрофильное присоединение по двойной связи; - окисление, сопровождающееся разрывом кратной связи; - полимеризация. 97
Химические свойства алкенов Для предсказания химических свойств алкенов следует учесть, что -связь в них оказывается гораздо менее прочной, чем -связь С-С. Кроме того, она пространственно более доступна для атаки реагентами. Поэтому алкены гораздо более реакционноспособны, чем алканы. Наиболее характерна для них реакция присоединения, приводящая к разрыву -связи с образованием двух новых -связей с участием реагента. Однако алканы способны и к реакции замещения. Можно выделить следующие важнейшие типы реакций алкенов: - каталитическое гидрирование; - электрофильное присоединение по двойной связи; - окисление, сопровождающееся разрывом кратной связи; - полимеризация. 97
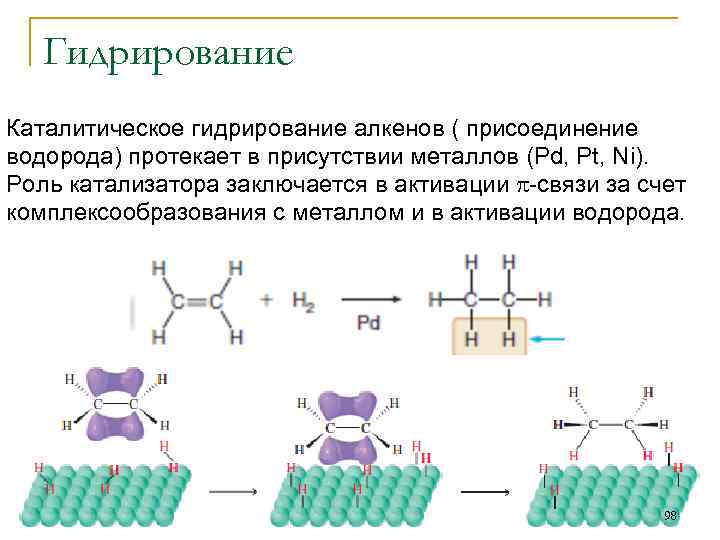 Гидрирование Каталитическое гидрирование алкенов ( присоединение водорода) протекает в присутствии металлов (Pd, Pt, Ni). Роль катализатора заключается в активации -связи за счет комплексообразования с металлом и в активации водорода. 98
Гидрирование Каталитическое гидрирование алкенов ( присоединение водорода) протекает в присутствии металлов (Pd, Pt, Ni). Роль катализатора заключается в активации -связи за счет комплексообразования с металлом и в активации водорода. 98
 Полимеризация алкенов Полимеризацией называют химический процесс, в котором молекулы ненасыщенного соединения присоединяются одна к другой за счет разрыва -связей и образования новых -связей. Молекулы, вступающие в реакцию полимеризации, называются мономерами. Высокомолекулярные соединения, образующиеся в процессе полимеризации называются полимерами. Реакции полимеризации протекают по цепному механизму в присутствии катализаторов. Он может быть радикальным или ионным. Число молекул, соединяющихся друг с другом называется степенью полимеризации. 99
Полимеризация алкенов Полимеризацией называют химический процесс, в котором молекулы ненасыщенного соединения присоединяются одна к другой за счет разрыва -связей и образования новых -связей. Молекулы, вступающие в реакцию полимеризации, называются мономерами. Высокомолекулярные соединения, образующиеся в процессе полимеризации называются полимерами. Реакции полимеризации протекают по цепному механизму в присутствии катализаторов. Он может быть радикальным или ионным. Число молекул, соединяющихся друг с другом называется степенью полимеризации. 99
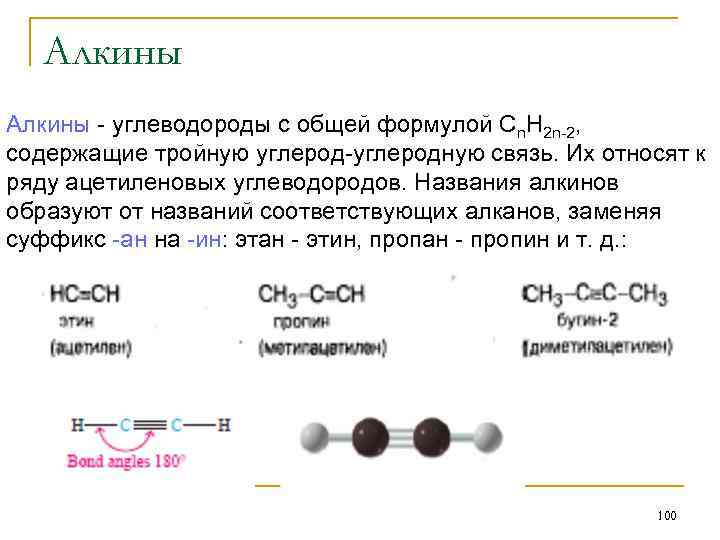 Алкины - углеводороды с общей формулой Cn. H 2 n-2, содержащие тройную углерод-углеродную связь. Их относят к ряду ацетиленовых углеводородов. Названия алкинов образуют от названий соответствующих алканов, заменяя суффикс -ан на -ин: этан - этин, пропан - пропин и т. д. : 100
Алкины - углеводороды с общей формулой Cn. H 2 n-2, содержащие тройную углерод-углеродную связь. Их относят к ряду ацетиленовых углеводородов. Названия алкинов образуют от названий соответствующих алканов, заменяя суффикс -ан на -ин: этан - этин, пропан - пропин и т. д. : 100
 Химические свойства алкинов Наличие -связей обусловливает способность алкинов, так же как и алкенов, вступать в реакции присоединения (электрофильного или радикального). Однако особенностью тройной связи является ее пониженная по сравнению с алкенами реакционная способность по отношению к электрофилам. К важнейшим химическим свойствам ацетиленов можно отнести: - реакции электрофильного присоединения к кратной связи, - реакции ди-, три- и полимеризации, - реакции, в которых ацетилены проявляют свойства слабых кислот. 101
Химические свойства алкинов Наличие -связей обусловливает способность алкинов, так же как и алкенов, вступать в реакции присоединения (электрофильного или радикального). Однако особенностью тройной связи является ее пониженная по сравнению с алкенами реакционная способность по отношению к электрофилам. К важнейшим химическим свойствам ацетиленов можно отнести: - реакции электрофильного присоединения к кратной связи, - реакции ди-, три- и полимеризации, - реакции, в которых ацетилены проявляют свойства слабых кислот. 101
 Кислотные свойства алкинов Алкины с тройной связью на конце молекулы проявляют очень слабые кислотные свойства. Под действием соединений с гораздо более сильными основными свойствами, чем у щелочей, например металлического натрия, амида или гидрида натрия, образуются соответствующие ацетилениды: 102
Кислотные свойства алкинов Алкины с тройной связью на конце молекулы проявляют очень слабые кислотные свойства. Под действием соединений с гораздо более сильными основными свойствами, чем у щелочей, например металлического натрия, амида или гидрида натрия, образуются соответствующие ацетилениды: 102
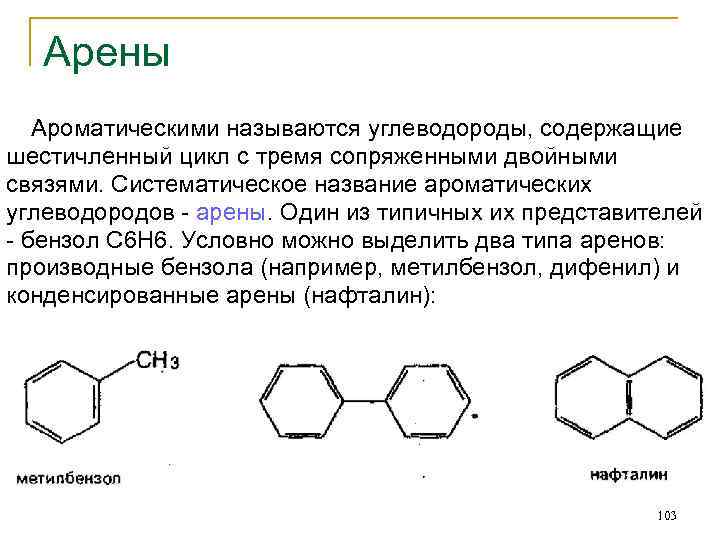 Арены Ароматическими называются углеводороды, содержащие шестичленный цикл с тремя сопряженными двойными связями. Систематическое название ароматических углеводородов - арены. Один из типичных их представителей - бензол С 6 Н 6. Условно можно выделить два типа аренов: производные бензола (например, метилбензол, дифенил) и конденсированные арены (нафталин): 103
Арены Ароматическими называются углеводороды, содержащие шестичленный цикл с тремя сопряженными двойными связями. Систематическое название ароматических углеводородов - арены. Один из типичных их представителей - бензол С 6 Н 6. Условно можно выделить два типа аренов: производные бензола (например, метилбензол, дифенил) и конденсированные арены (нафталин): 103
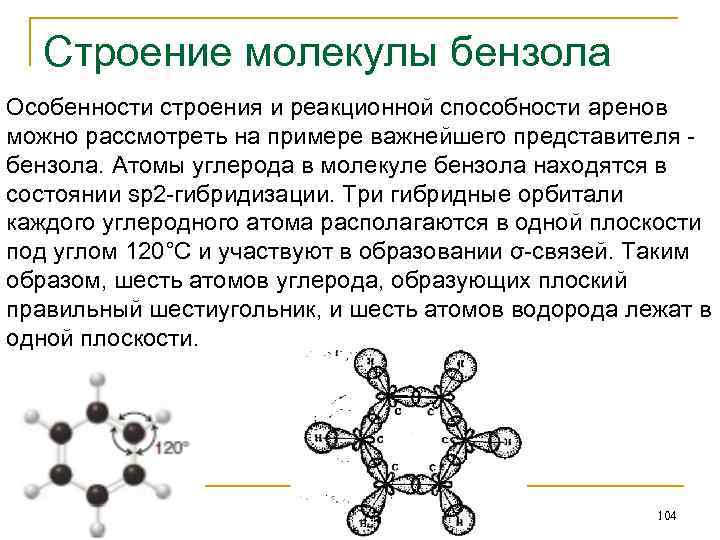 Строение молекулы бензола Особенности строения и реакционной способности аренов можно рассмотреть на примере важнейшего представителя бензола. Атомы углерода в молекуле бензола находятся в состоянии sр2 -гибридизации. Три гибридные орбитали каждого углеродного атома располагаются в одной плоскости под углом 120°С и участвуют в образовании σ-связей. Таким образом, шесть атомов углерода, образующих плоский правильный шестиугольник, и шесть атомов водорода лежат в одной плоскости. 104
Строение молекулы бензола Особенности строения и реакционной способности аренов можно рассмотреть на примере важнейшего представителя бензола. Атомы углерода в молекуле бензола находятся в состоянии sр2 -гибридизации. Три гибридные орбитали каждого углеродного атома располагаются в одной плоскости под углом 120°С и участвуют в образовании σ-связей. Таким образом, шесть атомов углерода, образующих плоский правильный шестиугольник, и шесть атомов водорода лежат в одной плоскости. 104
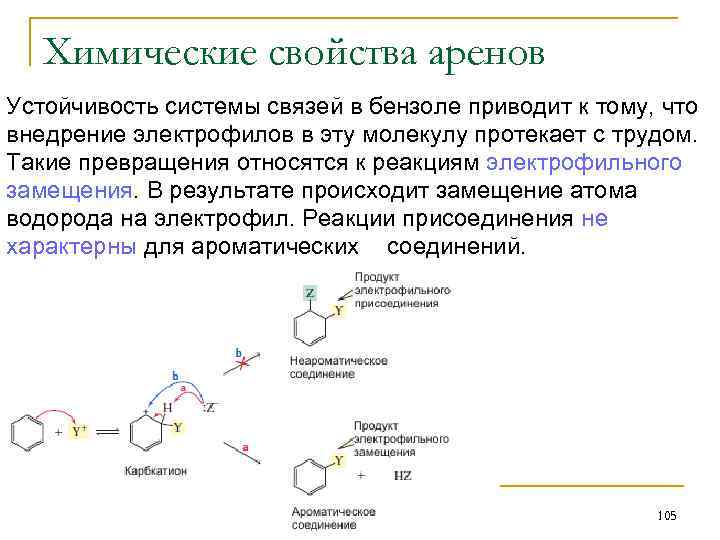 Химические свойства аренов Устойчивость системы связей в бензоле приводит к тому, что внедрение электрофилов в эту молекулу протекает с трудом. Такие превращения относятся к реакциям электрофильного замещения. В результате происходит замещение атома водорода на электрофил. Реакции присоединения не характерны для ароматических соединений. 105
Химические свойства аренов Устойчивость системы связей в бензоле приводит к тому, что внедрение электрофилов в эту молекулу протекает с трудом. Такие превращения относятся к реакциям электрофильного замещения. В результате происходит замещение атома водорода на электрофил. Реакции присоединения не характерны для ароматических соединений. 105
 Спирты - это органические соединения, в молекулах которых содержится одна или несколько гидроксильных групп, соединённых с углеводородным радикалом. Их можно рассматривать как производные углеводородов, в молекулах которых атомы водорода замещены на гидроксильные группы. Названия спиртов в международной номенклатуре производятся от названий радикалов, а также от названий углеводородов прибавлением суффикса -ол: СН 3 ОН - метиловый спирт или метанол, C 2 H 5 ОH этиловый спирт, или этанол, С 3 Н 7 ОН - пропиловый спирт, или пропанол, и т. д. Для гидроксильной группы в спиртах характерная изогнутая форма, похожая на форму молекулы воды. 106
Спирты - это органические соединения, в молекулах которых содержится одна или несколько гидроксильных групп, соединённых с углеводородным радикалом. Их можно рассматривать как производные углеводородов, в молекулах которых атомы водорода замещены на гидроксильные группы. Названия спиртов в международной номенклатуре производятся от названий радикалов, а также от названий углеводородов прибавлением суффикса -ол: СН 3 ОН - метиловый спирт или метанол, C 2 H 5 ОH этиловый спирт, или этанол, С 3 Н 7 ОН - пропиловый спирт, или пропанол, и т. д. Для гидроксильной группы в спиртах характерная изогнутая форма, похожая на форму молекулы воды. 106
 Химические свойства спиртов обусловлены наличием в их молекулах двух полярных ковалентных связей: С-О и О-Н. Спирты вступают в реакцию с разрывом одной из этих связей. Так как обе связи полярны, то их разрыв происходит по ионному механизму с образованием органических анионов или катионов. Диссоциация спиртов на ионы происходит в незначительной степени, поэтому спирты дают нейтральную реакцию - в их присутствии не изменяется окраска лакмуса или фенолфталеина. 107
Химические свойства спиртов обусловлены наличием в их молекулах двух полярных ковалентных связей: С-О и О-Н. Спирты вступают в реакцию с разрывом одной из этих связей. Так как обе связи полярны, то их разрыв происходит по ионному механизму с образованием органических анионов или катионов. Диссоциация спиртов на ионы происходит в незначительной степени, поэтому спирты дают нейтральную реакцию - в их присутствии не изменяется окраска лакмуса или фенолфталеина. 107
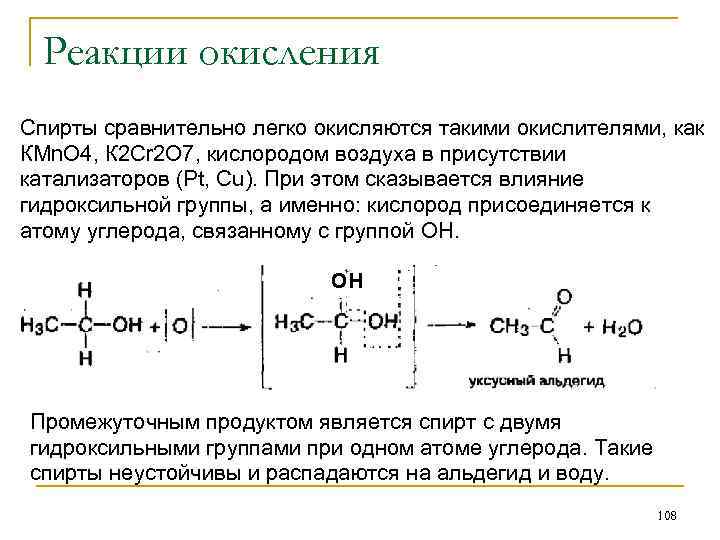 Реакции окисления Спирты сравнительно легко окисляются такими окислителями, как КМn. О 4, К 2 Сr 2 О 7, кислородом воздуха в присутствии катализаторов (Pt, Сu). При этом сказывается влияние гидроксильной группы, а именно: кислород присоединяется к атому углерода, связанному с группой ОН. OH Промежуточным продуктом является спирт с двумя гидроксильными группами при одном атоме углерода. Такие спирты неустойчивы и распадаются на альдегид и воду. 108
Реакции окисления Спирты сравнительно легко окисляются такими окислителями, как КМn. О 4, К 2 Сr 2 О 7, кислородом воздуха в присутствии катализаторов (Pt, Сu). При этом сказывается влияние гидроксильной группы, а именно: кислород присоединяется к атому углерода, связанному с группой ОН. OH Промежуточным продуктом является спирт с двумя гидроксильными группами при одном атоме углерода. Такие спирты неустойчивы и распадаются на альдегид и воду. 108
 Реакция с щелочами Со щелочами одноатомные спирты обратимо взаимодействуют: С 2 Н 5 ОН + Na. OH↔C 2 H 5 ONa + Н 2 О При этом равновесие сильно смещено влево. Однако при определенных условиях его можно сместить в сторону алкоголята. Кислотность спиртов падает в ряду: метанол > первичные > вторичные > третичные спирты, что объясняется дестабилизацией аниона алкоголята за счет +/- эффекта алкильной группы. Например, кислотность метанола соизмерима с кислотностью воды, поэтому при взаимодействии метанола с гидроксидом натрия устанавливается равновесие между спиртом и алкоголятом: СН 3 ОН + Na. OH↔CH=ONa + Н 2 О Однако уже в случае трет-бутилового спирта равновесие полностью сдвинуто влево. 109
Реакция с щелочами Со щелочами одноатомные спирты обратимо взаимодействуют: С 2 Н 5 ОН + Na. OH↔C 2 H 5 ONa + Н 2 О При этом равновесие сильно смещено влево. Однако при определенных условиях его можно сместить в сторону алкоголята. Кислотность спиртов падает в ряду: метанол > первичные > вторичные > третичные спирты, что объясняется дестабилизацией аниона алкоголята за счет +/- эффекта алкильной группы. Например, кислотность метанола соизмерима с кислотностью воды, поэтому при взаимодействии метанола с гидроксидом натрия устанавливается равновесие между спиртом и алкоголятом: СН 3 ОН + Na. OH↔CH=ONa + Н 2 О Однако уже в случае трет-бутилового спирта равновесие полностью сдвинуто влево. 109
 Реакции дегидратации Важным свойством спиртов является их способность к дегидратации (потере воды). Дегидратация происходит при нагревании спирта (>140 °С) с водоотнимающими веществами, например с концентрированной серной кислотой: В этом случае молекула воды отщепилась от одной молекулы спирта. В других условиях (при избытке спирта и при более низкой температуре) молекула воды отщепляется от двух молекул спирта, в результате чего образуется простой) эфир 110
Реакции дегидратации Важным свойством спиртов является их способность к дегидратации (потере воды). Дегидратация происходит при нагревании спирта (>140 °С) с водоотнимающими веществами, например с концентрированной серной кислотой: В этом случае молекула воды отщепилась от одной молекулы спирта. В других условиях (при избытке спирта и при более низкой температуре) молекула воды отщепляется от двух молекул спирта, в результате чего образуется простой) эфир 110
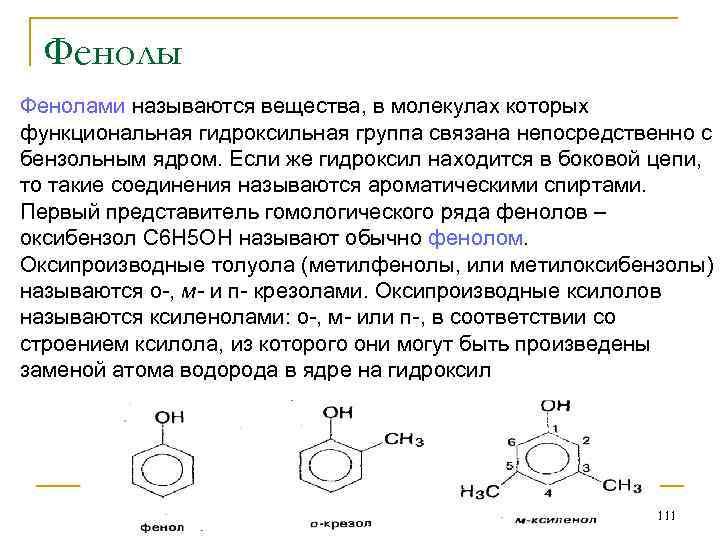 Фенолы Фенолами называются вещества, в молекулах которых функциональная гидроксильная группа связана непосредственно с бензольным ядром. Если же гидроксил находится в боковой цепи, то такие соединения называются ароматическими спиртами. Первый представитель гомологического ряда фенолов – оксибензол C 6 H 5 OH называют обычно фенолом. Оксипроизводные толуола (метилфенолы, или метилоксибензолы) называются о-, м- и п- крезолами. Оксипроизводные ксилолов называются ксиленолами: о-, м- или п-, в соответствии со строением ксилола, из которого они могут быть произведены заменой атома водорода в ядре на гидроксил 111
Фенолы Фенолами называются вещества, в молекулах которых функциональная гидроксильная группа связана непосредственно с бензольным ядром. Если же гидроксил находится в боковой цепи, то такие соединения называются ароматическими спиртами. Первый представитель гомологического ряда фенолов – оксибензол C 6 H 5 OH называют обычно фенолом. Оксипроизводные толуола (метилфенолы, или метилоксибензолы) называются о-, м- и п- крезолами. Оксипроизводные ксилолов называются ксиленолами: о-, м- или п-, в соответствии со строением ксилола, из которого они могут быть произведены заменой атома водорода в ядре на гидроксил 111
 Простые эфиры Простыми эфирами называют соединения, в которых атом кислорода связан с двумя углеводородными радикалами СН 3−СН 2—О−СН 2−СН 3 пропилэтиловый эфир Простые эфиры можно также рассматривать как продукты замещения в молекуле воды обоих атомов водорода на одновалентные углеводородные радикалы. Простые эфиры, содержащие два разных радикала, называются смешанными эфирами. Названия эфиров производят от названий радикалов: диметиловый (метиловый) эфир, метилэтиловый эфир, диэтиловый эфир (этиловый), метилпропиловый, метилизопропиловый эфиры и т. д. 112
Простые эфиры Простыми эфирами называют соединения, в которых атом кислорода связан с двумя углеводородными радикалами СН 3−СН 2—О−СН 2−СН 3 пропилэтиловый эфир Простые эфиры можно также рассматривать как продукты замещения в молекуле воды обоих атомов водорода на одновалентные углеводородные радикалы. Простые эфиры, содержащие два разных радикала, называются смешанными эфирами. Названия эфиров производят от названий радикалов: диметиловый (метиловый) эфир, метилэтиловый эфир, диэтиловый эфир (этиловый), метилпропиловый, метилизопропиловый эфиры и т. д. 112
 Химические свойства простых эфиров Простые эфиры - нейтральные вещества. Они довольно трудно вступают в реакции. Так, атомы водорода в них не могут замещаться на металл, но легко замещаются на атомы хлора. 1. Йодистоводородная кислота может реагировать с простым эфиром, превращая его в спирт и йодистый алкил: СН 3 -О-С 2 Н 5 + HI→ CH 3 I + С 2 Н 5 ОН 2. Простые эфиры при стоянии медленно окисляются кислородом воздуха. При этом образуются гидроперекиси эфиров. Эти вещества чрезвычайно взрывчаты и являются причиной сильных взрывов в лабораториях. 3. Натрий при низких температурах не действует на простые эфиры. При более высоких температурах последние расщепляются по уравнению: R-OR + 2 Na→R-ONa + R-Na Еще легче реагирует калий и особенно легко - литий. 113
Химические свойства простых эфиров Простые эфиры - нейтральные вещества. Они довольно трудно вступают в реакции. Так, атомы водорода в них не могут замещаться на металл, но легко замещаются на атомы хлора. 1. Йодистоводородная кислота может реагировать с простым эфиром, превращая его в спирт и йодистый алкил: СН 3 -О-С 2 Н 5 + HI→ CH 3 I + С 2 Н 5 ОН 2. Простые эфиры при стоянии медленно окисляются кислородом воздуха. При этом образуются гидроперекиси эфиров. Эти вещества чрезвычайно взрывчаты и являются причиной сильных взрывов в лабораториях. 3. Натрий при низких температурах не действует на простые эфиры. При более высоких температурах последние расщепляются по уравнению: R-OR + 2 Na→R-ONa + R-Na Еще легче реагирует калий и особенно легко - литий. 113
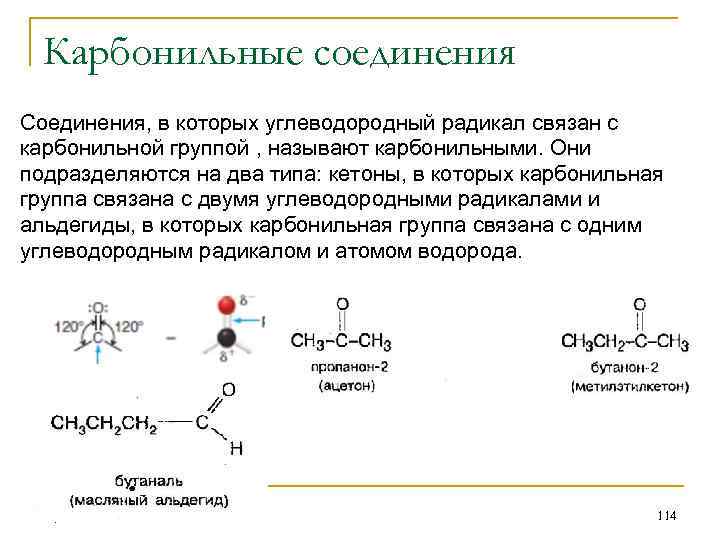 Карбонильные соединения Соединения, в которых углеводородный радикал связан с карбонильной группой , называют карбонильными. Они подразделяются на два типа: кетоны, в которых карбонильная группа связана с двумя углеводородными радикалами и альдегиды, в которых карбонильная группа связана с одним углеводородным радикалом и атомом водорода. 114
Карбонильные соединения Соединения, в которых углеводородный радикал связан с карбонильной группой , называют карбонильными. Они подразделяются на два типа: кетоны, в которых карбонильная группа связана с двумя углеводородными радикалами и альдегиды, в которых карбонильная группа связана с одним углеводородным радикалом и атомом водорода. 114
 Альдегиды Простейший альдегид, называемый муравьиным альдегидом или формальдегидом, содержит альдегидную группу, связанную с атомом водорода, и имеет строение Н-СНО. В остальных альдегидах предельного ряда место одного атома водорода занимает алкил Сn. Н 2 n+1 -СНО. Альдегиды можно также рассматривать как продукт замещения в предельных углеводородах атома водорода на альдегидную группу, т. е. как однозамещенные производные углеводородов гомологического ряда метана. Названия альдегидов производят от тривиальных названий кислот с тем же числом атомов углерода в молекуле. Так, альдегид СН 3 -СНО называется уксусным альдегидом или ацетальдегидом, СН 3 -СН 2 -СНО – пропионовым альдегидом и т. д. По международной номенклатуре названия альдегидов производят от названий углеводородов с тем же числом углеродных атомов, присоединяя к ним суффикс -аль. Например: метаналь Н-СНО, этаналь СН 3 -СНО, 2 -метилпропаналь 115 СН СН(СН )-СНО и т. д.
Альдегиды Простейший альдегид, называемый муравьиным альдегидом или формальдегидом, содержит альдегидную группу, связанную с атомом водорода, и имеет строение Н-СНО. В остальных альдегидах предельного ряда место одного атома водорода занимает алкил Сn. Н 2 n+1 -СНО. Альдегиды можно также рассматривать как продукт замещения в предельных углеводородах атома водорода на альдегидную группу, т. е. как однозамещенные производные углеводородов гомологического ряда метана. Названия альдегидов производят от тривиальных названий кислот с тем же числом атомов углерода в молекуле. Так, альдегид СН 3 -СНО называется уксусным альдегидом или ацетальдегидом, СН 3 -СН 2 -СНО – пропионовым альдегидом и т. д. По международной номенклатуре названия альдегидов производят от названий углеводородов с тем же числом углеродных атомов, присоединяя к ним суффикс -аль. Например: метаналь Н-СНО, этаналь СН 3 -СНО, 2 -метилпропаналь 115 СН СН(СН )-СНО и т. д.
 Кетоны От простейшего кетона диметилкетона (ацетона) СН 3 -СО-СН 3 можно произвести гомологический ряд последовательным замещением атомов водорода на метил. Таким образом, следующий гомолог ацетона - метилэтилкетон - имеет строение СН 3 -СО-СН 2 -СН 3. Третий гомолог может существовать в трех изомерных формах: СН 3 -СО-СН 2 СН 3 -СО-СН(СН 3)2 СН 3 СН 2 -СО-СН 2 СН 3 метилпропилкетон метилизопропилкетон диэтилкетон Альдегиды и кетоны с одинаковым числом атомов углерода в молекуле изомерны другу. Общая формула для гомологических рядов предельных альдегидов и кетонов: Сn. Н 2 n. О. 116
Кетоны От простейшего кетона диметилкетона (ацетона) СН 3 -СО-СН 3 можно произвести гомологический ряд последовательным замещением атомов водорода на метил. Таким образом, следующий гомолог ацетона - метилэтилкетон - имеет строение СН 3 -СО-СН 2 -СН 3. Третий гомолог может существовать в трех изомерных формах: СН 3 -СО-СН 2 СН 3 -СО-СН(СН 3)2 СН 3 СН 2 -СО-СН 2 СН 3 метилпропилкетон метилизопропилкетон диэтилкетон Альдегиды и кетоны с одинаковым числом атомов углерода в молекуле изомерны другу. Общая формула для гомологических рядов предельных альдегидов и кетонов: Сn. Н 2 n. О. 116
 Химические свойства альдегидов и кетонов определяются карбонильной группой. Электронное облако связи смещено к кислороду как более электроотрицательному атому, в результате чего он приобретает частичный отрицательный заряд (δ-). В то же время карбонильный углерод в результате оттягивания от него электронов приобретает частичный положительный заряд (δ+): Таким образом, группа сильно поляризована, что обусловливает большую реакционную способность органических соединений, содержащих карбонильную группу: с одной стороны, атом кислорода в альдегидах оказывает влияние на атом водорода, соединенный с карбонильной группой, в результате чего он легко окисляется; с другой стороны, для группы , как и для всех кратных связей, характерны реакции присоединения и полимеризации. 117
Химические свойства альдегидов и кетонов определяются карбонильной группой. Электронное облако связи смещено к кислороду как более электроотрицательному атому, в результате чего он приобретает частичный отрицательный заряд (δ-). В то же время карбонильный углерод в результате оттягивания от него электронов приобретает частичный положительный заряд (δ+): Таким образом, группа сильно поляризована, что обусловливает большую реакционную способность органических соединений, содержащих карбонильную группу: с одной стороны, атом кислорода в альдегидах оказывает влияние на атом водорода, соединенный с карбонильной группой, в результате чего он легко окисляется; с другой стороны, для группы , как и для всех кратных связей, характерны реакции присоединения и полимеризации. 117
 Окисление альдегидов протекает очень легко - альдегиды способны отнимать кислород от многих соединений, даже кислород воздуха. Так, при нагревании формальдегида с аммиачным раствором оксида серебра происходит окисление формальдегида в муравьиную кислоту HСОOH и восстановление серебра. При этом серебро выделяется в виде тонкого налета на стенках сосуда, образуя зеркальный налет, - так называемая "реакция серебряного зеркала". Образование "серебряного зеркала" служит качественной реакцией на альдегидную группу. Кетоны в эту реакцию не вступают! 118
Окисление альдегидов протекает очень легко - альдегиды способны отнимать кислород от многих соединений, даже кислород воздуха. Так, при нагревании формальдегида с аммиачным раствором оксида серебра происходит окисление формальдегида в муравьиную кислоту HСОOH и восстановление серебра. При этом серебро выделяется в виде тонкого налета на стенках сосуда, образуя зеркальный налет, - так называемая "реакция серебряного зеркала". Образование "серебряного зеркала" служит качественной реакцией на альдегидную группу. Кетоны в эту реакцию не вступают! 118
 Восстановление альдегидов и кетонов Важной реакцией присоединения по карбонильной группе является восстановление альдегидов и кетонов до спиртов. При этом альдегиды восстанавливаются до первичных спиртов, а кетоны – до вторичных. В промышленности обычно предпочитают проводить каталитическое гидрирование на металлических катализаторах. 119
Восстановление альдегидов и кетонов Важной реакцией присоединения по карбонильной группе является восстановление альдегидов и кетонов до спиртов. При этом альдегиды восстанавливаются до первичных спиртов, а кетоны – до вторичных. В промышленности обычно предпочитают проводить каталитическое гидрирование на металлических катализаторах. 119
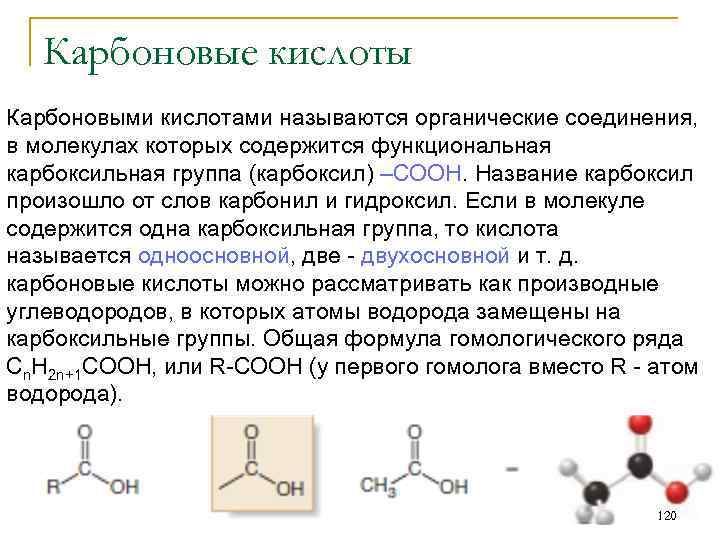 Карбоновые кислоты Карбоновыми кислотами называются органические соединения, в молекулах которых содержится функциональная карбоксильная группа (карбоксил) –COOH. Название карбоксил произошло от слов карбонил и гидроксил. Если в молекуле содержится одна карбоксильная группа, то кислота называется одноосновной, две - двухосновной и т. д. карбоновые кислоты можно рассматривать как производные углеводородов, в которых атомы водорода замещены на карбоксильные группы. Общая формула гомологического ряда Сn. Н 2 n+1 СООН, или R-COОH (у первого гомолога вместо R - атом водорода). 120
Карбоновые кислоты Карбоновыми кислотами называются органические соединения, в молекулах которых содержится функциональная карбоксильная группа (карбоксил) –COOH. Название карбоксил произошло от слов карбонил и гидроксил. Если в молекуле содержится одна карбоксильная группа, то кислота называется одноосновной, две - двухосновной и т. д. карбоновые кислоты можно рассматривать как производные углеводородов, в которых атомы водорода замещены на карбоксильные группы. Общая формула гомологического ряда Сn. Н 2 n+1 СООН, или R-COОH (у первого гомолога вместо R - атом водорода). 120
 Химические свойства карбоновых кислот Для карбоновых кислот характерны свойства как карбонильных соединений (например, присоединение по связи С=О), так и свойства спиртов (например, кислотные свойства, возможность замены гидроксила на другие группы RO-, галогены и т. д. ). С одной стороны, сопряжение между карбонилом и атомом кислорода гидроксила уменьшает частичный положительный заряд на атоме углерода и затрудняет нуклеофильное присоединение по карбонильной группе. С другой стороны, карбонильная группа стабилизирует анион карбоновой кислоты, что резко увеличивает кислотность гидроксильной группы. Таким образом, важнейшие направления реакций карбоновых кислот: - проявление карбоновыми кислотами свойств слабой кислоты, - замена гидроксильной группы в карбоновых кислотах на другие функциональные группы (на галоген, алкоксигруппы и др. ). 121
Химические свойства карбоновых кислот Для карбоновых кислот характерны свойства как карбонильных соединений (например, присоединение по связи С=О), так и свойства спиртов (например, кислотные свойства, возможность замены гидроксила на другие группы RO-, галогены и т. д. ). С одной стороны, сопряжение между карбонилом и атомом кислорода гидроксила уменьшает частичный положительный заряд на атоме углерода и затрудняет нуклеофильное присоединение по карбонильной группе. С другой стороны, карбонильная группа стабилизирует анион карбоновой кислоты, что резко увеличивает кислотность гидроксильной группы. Таким образом, важнейшие направления реакций карбоновых кислот: - проявление карбоновыми кислотами свойств слабой кислоты, - замена гидроксильной группы в карбоновых кислотах на другие функциональные группы (на галоген, алкоксигруппы и др. ). 121
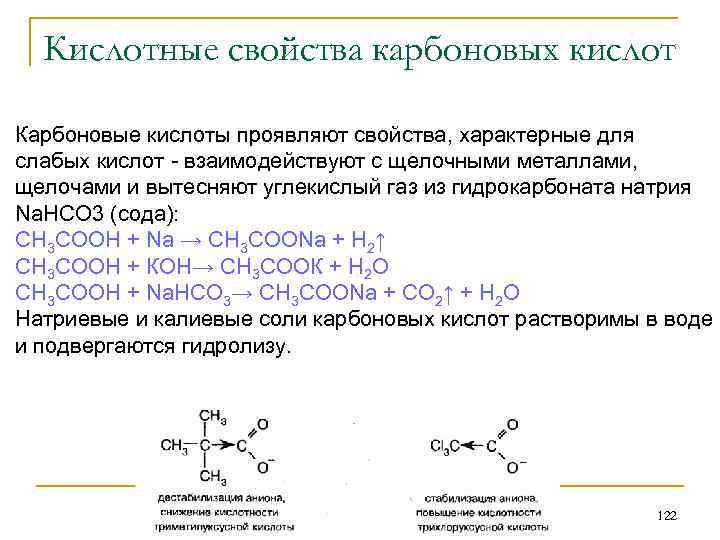 Кислотные свойства карбоновых кислот Карбоновые кислоты проявляют свойства, характерные для слабых кислот - взаимодействуют с щелочными металлами, щелочами и вытесняют углекислый газ из гидрокарбоната натрия Na. HCО 3 (сода): СН 3 СООН + Na → CH 3 COONa + Н 2↑ СН 3 СООН + КОН→ СН 3 СООК + Н 2 О СН 3 СООН + Na. HCО 3→ CH 3 COONa + СО 2↑ + Н 2 О Натриевые и калиевые соли карбоновых кислот растворимы в воде и подвергаются гидролизу. 122
Кислотные свойства карбоновых кислот Карбоновые кислоты проявляют свойства, характерные для слабых кислот - взаимодействуют с щелочными металлами, щелочами и вытесняют углекислый газ из гидрокарбоната натрия Na. HCО 3 (сода): СН 3 СООН + Na → CH 3 COONa + Н 2↑ СН 3 СООН + КОН→ СН 3 СООК + Н 2 О СН 3 СООН + Na. HCО 3→ CH 3 COONa + СО 2↑ + Н 2 О Натриевые и калиевые соли карбоновых кислот растворимы в воде и подвергаются гидролизу. 122
 Образование сложных эфиров При взаимодействии карбоновых кислот со спиртами в присутствии катализатора (концентрированной серной кислоты) получают сложные эфиры. Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации (от греч. "этер" - эфир). Сложные эфиры (где R и R' углеводородные радикалы) можно рассматривать как производные кислот, у которых водород в гидроксиле замещен на радикал. Названия сложных эфиров состоит из названия спиртового радикала и названия соли кислоты. 123
Образование сложных эфиров При взаимодействии карбоновых кислот со спиртами в присутствии катализатора (концентрированной серной кислоты) получают сложные эфиры. Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации (от греч. "этер" - эфир). Сложные эфиры (где R и R' углеводородные радикалы) можно рассматривать как производные кислот, у которых водород в гидроксиле замещен на радикал. Названия сложных эфиров состоит из названия спиртового радикала и названия соли кислоты. 123
 Жиры являются сложными эфирами, образованные высшими одноосновными карбоновыми кислотами, главным образом пальмитиновой, стеариновой (насыщенные кислоты) и олеиновой (ненасыщенная кислота) и трехатомным спиртом глицерином. Общие названия таких соединений триглицериды. Природные жиры представляют собой не индивидуальное вещество, а смесь различных триглицеридов. Образование одного из триглицеридов, например триглицерида стеариновой кислоты, можно изобразить уравнением: 124
Жиры являются сложными эфирами, образованные высшими одноосновными карбоновыми кислотами, главным образом пальмитиновой, стеариновой (насыщенные кислоты) и олеиновой (ненасыщенная кислота) и трехатомным спиртом глицерином. Общие названия таких соединений триглицериды. Природные жиры представляют собой не индивидуальное вещество, а смесь различных триглицеридов. Образование одного из триглицеридов, например триглицерида стеариновой кислоты, можно изобразить уравнением: 124


