Окислительно-восстановительные реакции.ppt
- Количество слайдов: 23
 Окислительно- восстановительные реакции Первоначально окислением называли только реакции веществ с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует
Окислительно- восстановительные реакции Первоначально окислением называли только реакции веществ с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует
 Определение В основе жизни лежат окислительно-восстановительные реакции, происходящие при фотосинтезе, дыхании, они же обеспечивают основную часть энергопотребления человечества за счет сжигания органического топлива. Получение металлов, извлечение энергии взрыва основано на окислительно-восстановительных реакциях Окислительно-восстановительными называют реакции, сопровождающиеся переходом электронов от одних атомов к другим
Определение В основе жизни лежат окислительно-восстановительные реакции, происходящие при фотосинтезе, дыхании, они же обеспечивают основную часть энергопотребления человечества за счет сжигания органического топлива. Получение металлов, извлечение энергии взрыва основано на окислительно-восстановительных реакциях Окислительно-восстановительными называют реакции, сопровождающиеся переходом электронов от одних атомов к другим
 Примером таких реакций являются процессы: Sn+2 Cl 2 + 2 Fе+3 Сl 3 = Sn+4 Cl 4 + 2 Fe+2 Cl 2 2 KMn+7 O 4 +16 HCl-1 = 2 KCl +2 Mn+2 Cl 2 +5 Cl 20 + 8 H 2 O 4 Zn + 10 HNO 3 разб. = 4 Zn(NO 3)2 + NH 4 NO 3 + 3 H 2 O 18 P + 20 Cu. SO 4 + 32 H 2 O = 8 H 3 PO 4 + 5 Cu 3 P 2 + 20 H 2 SO 4
Примером таких реакций являются процессы: Sn+2 Cl 2 + 2 Fе+3 Сl 3 = Sn+4 Cl 4 + 2 Fe+2 Cl 2 2 KMn+7 O 4 +16 HCl-1 = 2 KCl +2 Mn+2 Cl 2 +5 Cl 20 + 8 H 2 O 4 Zn + 10 HNO 3 разб. = 4 Zn(NO 3)2 + NH 4 NO 3 + 3 H 2 O 18 P + 20 Cu. SO 4 + 32 H 2 O = 8 H 3 PO 4 + 5 Cu 3 P 2 + 20 H 2 SO 4
 Изменение окислительно-восстановительных свойств элементов с точки зрения строения атома • В периодах с возрастанием порядкового номера элементов их восстановительные свойства ослабевают. Это связано с увеличением заряда ядра и уменьшением атомного радиуса • В главных подгруппах с увеличением номера периода восстановительные свойства элементов возрастают. Это связано с увеличением атомного радиуса
Изменение окислительно-восстановительных свойств элементов с точки зрения строения атома • В периодах с возрастанием порядкового номера элементов их восстановительные свойства ослабевают. Это связано с увеличением заряда ядра и уменьшением атомного радиуса • В главных подгруппах с увеличением номера периода восстановительные свойства элементов возрастают. Это связано с увеличением атомного радиуса
 Изменение высших и низших степеней окисления у элементов IA-VIIA-групп во втором, третьем и четвертом периодах: Период I II III IY Y YI 2 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F +1 +2 +3 от +4 до − 4 от +5 до − 3 от +2 (со фтором) − 1 до − 2 3 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl +1 +2 +3 от +4 до − 4 от +5 до − 3 от +6 до − 2 от +7 до − 1 4 19 K 20 Ca 31 Ga 32 Ge 33 As 34 Se 35 Br +1 +2 +3 от +4 до − 4 от +5 до − 3 от +6 до − 2 от +7 до − 1
Изменение высших и низших степеней окисления у элементов IA-VIIA-групп во втором, третьем и четвертом периодах: Период I II III IY Y YI 2 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F +1 +2 +3 от +4 до − 4 от +5 до − 3 от +2 (со фтором) − 1 до − 2 3 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl +1 +2 +3 от +4 до − 4 от +5 до − 3 от +6 до − 2 от +7 до − 1 4 19 K 20 Ca 31 Ga 32 Ge 33 As 34 Se 35 Br +1 +2 +3 от +4 до − 4 от +5 до − 3 от +6 до − 2 от +7 до − 1
 Окисли тельно-восстанови тельные реа кции, ОВР, редокс Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель: окислитель + n e− ↔ сопряжённый восстановитель Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель: восстановитель — n e− ↔ сопряжённый окислитель Несвязанный, свободный электрон является сильнейшим восстановителем
Окисли тельно-восстанови тельные реа кции, ОВР, редокс Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель: окислитель + n e− ↔ сопряжённый восстановитель Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель: восстановитель — n e− ↔ сопряжённый окислитель Несвязанный, свободный электрон является сильнейшим восстановителем
 Окислители Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, так как они уже отдали все свои валентные электроны и способны только принимать электроны
Окислители Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, так как они уже отдали все свои валентные электроны и способны только принимать электроны
 Важнейшие окислители Сильные Слабые §F 2, O 3, H 2 O 2, Cl 2 §I 2, Br 2, §HCl. O, HCl. O 3, §SO 2 §H 2 SO 4, HNO 3 §HNO 2 §Царская водка §NO 2 §KMn. O 4, Mn. O 2 §K 2 Cr 2 O 7, Cr. O 3 §Pb. O 2
Важнейшие окислители Сильные Слабые §F 2, O 3, H 2 O 2, Cl 2 §I 2, Br 2, §HCl. O, HCl. O 3, §SO 2 §H 2 SO 4, HNO 3 §HNO 2 §Царская водка §NO 2 §KMn. O 4, Mn. O 2 §K 2 Cr 2 O 7, Cr. O 3 §Pb. O 2
 Важнейшие восстановители Сильные Слабые §Щелочные и щелочно- §Малоактивные металлы земельные металлы (Pb, Cu, Ag, Hg) §Mg, Al, H 2 §HCl §HI и йодиды §SO 2 §HBr и бромиды §HNO 2 §H 2 S и сульфиды §Альдегиды, спирты, §NH 3, PH 3, H 3 PO 3 муравьиная кислота, §C, CO щавелевая кислота, §Соединения Fe 2+, Cr 2+ глюкоза
Важнейшие восстановители Сильные Слабые §Щелочные и щелочно- §Малоактивные металлы земельные металлы (Pb, Cu, Ag, Hg) §Mg, Al, H 2 §HCl §HI и йодиды §SO 2 §HBr и бромиды §HNO 2 §H 2 S и сульфиды §Альдегиды, спирты, §NH 3, PH 3, H 3 PO 3 муравьиная кислота, §C, CO щавелевая кислота, §Соединения Fe 2+, Cr 2+ глюкоза
 Восстановители Соединения, содержащие атомы элементов с минимальной степенью окисления могут служить только восстановителями, поскольку они способны лишь отдавать электроны. Им легче с внешнего энергетического уровня отдать небольшое количество электронов, чтобы достигнуть октета тест
Восстановители Соединения, содержащие атомы элементов с минимальной степенью окисления могут служить только восстановителями, поскольку они способны лишь отдавать электроны. Им легче с внешнего энергетического уровня отдать небольшое количество электронов, чтобы достигнуть октета тест
 И окислители , и восстановители У многовалентных элементов может быть несколько степеней окисления: так например, для серы степени окисления могут быть равными -2 – низшая, 0, +2, +4 – промежуточные и +6 – высшая. Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями и восстановителями, в зависимости от партнера, с которым взаимодействуют и от условий реакции
И окислители , и восстановители У многовалентных элементов может быть несколько степеней окисления: так например, для серы степени окисления могут быть равными -2 – низшая, 0, +2, +4 – промежуточные и +6 – высшая. Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями и восстановителями, в зависимости от партнера, с которым взаимодействуют и от условий реакции
 Классификация окислительно-восстановительных реакций Межмолекулярные 2 Mg 0 + O 20 = 2 Mg+2 O– 2 3 Мn+2 SO 4 + 2 KMn+7 O 4 + 2 Н 2 O = 5 Mn+4 O 2 + 2 KHSO 4 + H 2 SO 4 Внутримолекулярные 2 KCl+5 O 3 -2 = 2 KCl-1 + 3 O 20 Cl+5 - окислитель; О-2 восстановитель (N-3 H 4)2 Cr 2+6 O 7 = Cr 2+3 O 3 + N 20 + 4 H 2 O Cr+6 - окислитель; N-3 - восстановитель Диспропорционирования, дисмутации 4 KCl+5 O 3 = ЗКСl+7 O 4 + КСl– 1 Cl 20 + 2 KOH = KCl+1 O + KCl-1 + H 2 O Коммутации, компропорцонирования, контрдиспропорционирования 2 H 2 S-2 + H 2 S+4 O 3 = 3 S 0 + 3 H 2 O
Классификация окислительно-восстановительных реакций Межмолекулярные 2 Mg 0 + O 20 = 2 Mg+2 O– 2 3 Мn+2 SO 4 + 2 KMn+7 O 4 + 2 Н 2 O = 5 Mn+4 O 2 + 2 KHSO 4 + H 2 SO 4 Внутримолекулярные 2 KCl+5 O 3 -2 = 2 KCl-1 + 3 O 20 Cl+5 - окислитель; О-2 восстановитель (N-3 H 4)2 Cr 2+6 O 7 = Cr 2+3 O 3 + N 20 + 4 H 2 O Cr+6 - окислитель; N-3 - восстановитель Диспропорционирования, дисмутации 4 KCl+5 O 3 = ЗКСl+7 O 4 + КСl– 1 Cl 20 + 2 KOH = KCl+1 O + KCl-1 + H 2 O Коммутации, компропорцонирования, контрдиспропорционирования 2 H 2 S-2 + H 2 S+4 O 3 = 3 S 0 + 3 H 2 O
 Методы установления электронного баланса в уравнениях окислительно-восстановительных реакций Метод электронного баланса Метод ионно-электронного баланса применяется при рассмотрении ОВР, (метод полуреакций) протекающих при: применяется при рассмотрении ОВР, Øсплавлении веществ, протекающих: Øтермическом разложении, Ø взаимодействии твердого вещества с газообразным (обжиг), Ø в водных растворах Øпри взаимодействии сухих солей и металлов с практически безводными кислотами
Методы установления электронного баланса в уравнениях окислительно-восстановительных реакций Метод электронного баланса Метод ионно-электронного баланса применяется при рассмотрении ОВР, (метод полуреакций) протекающих при: применяется при рассмотрении ОВР, Øсплавлении веществ, протекающих: Øтермическом разложении, Ø взаимодействии твердого вещества с газообразным (обжиг), Ø в водных растворах Øпри взаимодействии сухих солей и металлов с практически безводными кислотами
 Правила составления уравнений окислительно- восстановительных реакций 1. Определить окислитель и восстановитель в реакции 2. Установить, сколько электронов отдано восстановителем и сколько приобретено окислителем. Окисление отождествляется с отдачей электронов, а восстановление – с приобретением электронов, то есть в методе электронного баланса не принимается во внимание строение частиц, природа химической связи в них и механизм протекающего процесса 4. Найти наименьшее общее кратное между числом электронов, перешедших при окислительном и восстановительном процессах 5. Разделить это число на количество перемещённых электронов: получатся коэффициенты в уравнении Метод подбора, сводящийся к подсчету количеств атомов в правой и левой частях уравнения, не всегда гарантирует правильное определение коэффициентов
Правила составления уравнений окислительно- восстановительных реакций 1. Определить окислитель и восстановитель в реакции 2. Установить, сколько электронов отдано восстановителем и сколько приобретено окислителем. Окисление отождествляется с отдачей электронов, а восстановление – с приобретением электронов, то есть в методе электронного баланса не принимается во внимание строение частиц, природа химической связи в них и механизм протекающего процесса 4. Найти наименьшее общее кратное между числом электронов, перешедших при окислительном и восстановительном процессах 5. Разделить это число на количество перемещённых электронов: получатся коэффициенты в уравнении Метод подбора, сводящийся к подсчету количеств атомов в правой и левой частях уравнения, не всегда гарантирует правильное определение коэффициентов
 Пример подбора коэффициентов в окислительно- восстановительном процессе методом электронного баланса Fe 0 + HCl → Fe. Cl 2 + H 2 0↑ 1 Fe 0 − 2ē = Fe+2 1 2 H+ + 2ē = H 2 Fe 0 + 2 H+ = Fe+2 + H 20↑ Fe 0 + 2 HCl = Fe. Cl 2 + H 2 0↑
Пример подбора коэффициентов в окислительно- восстановительном процессе методом электронного баланса Fe 0 + HCl → Fe. Cl 2 + H 2 0↑ 1 Fe 0 − 2ē = Fe+2 1 2 H+ + 2ē = H 2 Fe 0 + 2 H+ = Fe+2 + H 20↑ Fe 0 + 2 HCl = Fe. Cl 2 + H 2 0↑
 Влияние некоторых факторов на характер протекания реакции Степень окисления элемента в продуктах реакции зависит от условия проведения этой реакции: § от силы окислителя и восстановителя § от концентрации окислителя и восстановителя § от характера среды (кислотности раствора) § от температуры
Влияние некоторых факторов на характер протекания реакции Степень окисления элемента в продуктах реакции зависит от условия проведения этой реакции: § от силы окислителя и восстановителя § от концентрации окислителя и восстановителя § от характера среды (кислотности раствора) § от температуры
 Влияние силы (активности) восстановителя и концентрации веществ на характер протекания реакции 4 HNO 3(конц. ) + Cu = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O, 8 HNO 3(разб. ) + 3 Cu = 3 Cu(NO 3)2 + 2 NO + 4 H 2 O, 10 HNO 3(конц. ) + 4 Мg = 4 Mg(NO 3)2 + N 2 O + 5 H 2 O, 10 HNO 3(c. разб. ) + 4 Мg = 4 Mg(NO 3)2 + NH 4 NO 3 + 3 H 2 O
Влияние силы (активности) восстановителя и концентрации веществ на характер протекания реакции 4 HNO 3(конц. ) + Cu = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O, 8 HNO 3(разб. ) + 3 Cu = 3 Cu(NO 3)2 + 2 NO + 4 H 2 O, 10 HNO 3(конц. ) + 4 Мg = 4 Mg(NO 3)2 + N 2 O + 5 H 2 O, 10 HNO 3(c. разб. ) + 4 Мg = 4 Mg(NO 3)2 + NH 4 NO 3 + 3 H 2 O
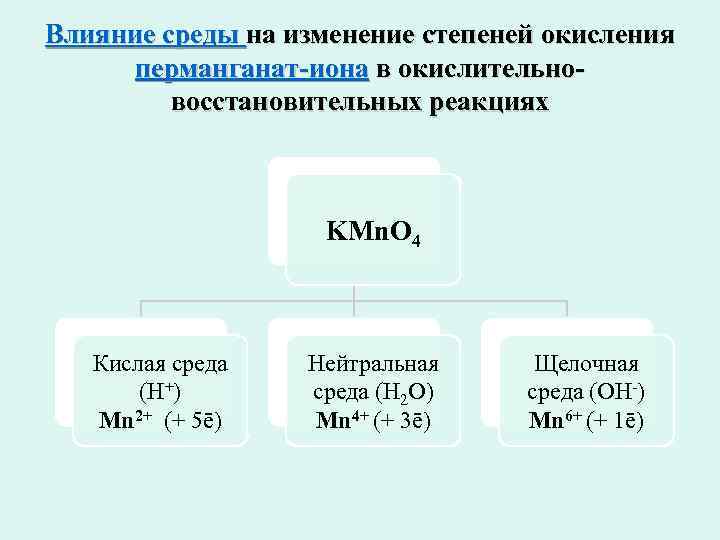 Влияние среды на изменение степеней окисления перманганат-иона в окислительно- восстановительных реакциях KMn. O 4 Кислая среда Нейтральная Щелочная (Н+) среда (Н 2 О) среда (ОН-) Mn 2+ (+ 5ē) Mn 4+ (+ 3ē) Mn 6+ (+ 1ē)
Влияние среды на изменение степеней окисления перманганат-иона в окислительно- восстановительных реакциях KMn. O 4 Кислая среда Нейтральная Щелочная (Н+) среда (Н 2 О) среда (ОН-) Mn 2+ (+ 5ē) Mn 4+ (+ 3ē) Mn 6+ (+ 1ē)
 Влияние температуры на характер протекания реакции Cl 2 + KOH хол. → KCI + KCIO + H 2 O CI 0 + 1 e– → CI– 1 восстановление, окислитель CI 0 – 1 e– → CI+1 окисление, восстановитель 3 CI 2 + 6 KOH гор. → 5 KCI + KCIO 3 + 3 H 2 O 5 │ CI 0 + 1 e– → CI– 1 восстановление, окислитель 1 │ CI 0 – 5 e– → CI+5 окисление, восстановитель.
Влияние температуры на характер протекания реакции Cl 2 + KOH хол. → KCI + KCIO + H 2 O CI 0 + 1 e– → CI– 1 восстановление, окислитель CI 0 – 1 e– → CI+1 окисление, восстановитель 3 CI 2 + 6 KOH гор. → 5 KCI + KCIO 3 + 3 H 2 O 5 │ CI 0 + 1 e– → CI– 1 восстановление, окислитель 1 │ CI 0 – 5 e– → CI+5 окисление, восстановитель.
 Получение электрической энергии из электрохимических процессов Если процессы окисления и восстановления пространственно разделить, то любую окислительно- восстановительную реакцию можно использовать для получения электрической энергии. При замыкании внешней цепи проводником первого рода начинается окислительно-восстановительная реакция, о чем свидетельствует возникновение электродвижущей силы (ЭДС). Основой гальванического элемента Даниэля– Якоби является схема (–)Zn¦Zn 2+||Cu 2+¦Cu(+)
Получение электрической энергии из электрохимических процессов Если процессы окисления и восстановления пространственно разделить, то любую окислительно- восстановительную реакцию можно использовать для получения электрической энергии. При замыкании внешней цепи проводником первого рода начинается окислительно-восстановительная реакция, о чем свидетельствует возникновение электродвижущей силы (ЭДС). Основой гальванического элемента Даниэля– Якоби является схема (–)Zn¦Zn 2+||Cu 2+¦Cu(+)
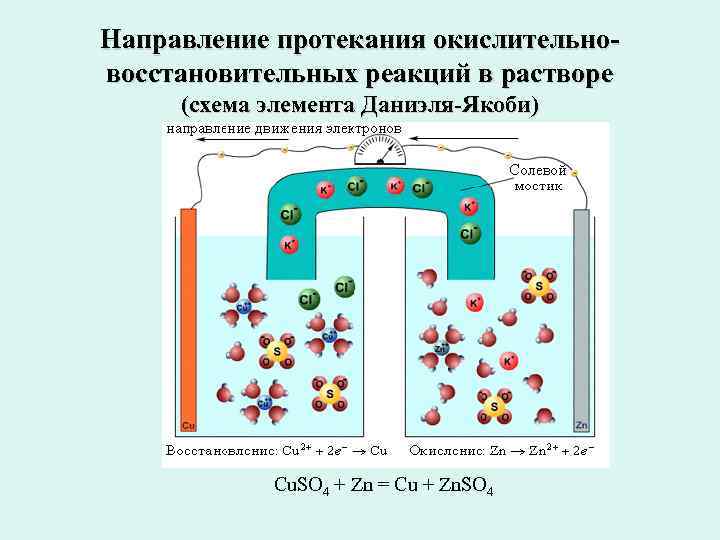 Направление протекания окислительно- восстановительных реакций в растворе (схема элемента Даниэля-Якоби) Cu. SO 4 + Zn = Cu + Zn. SO 4
Направление протекания окислительно- восстановительных реакций в растворе (схема элемента Даниэля-Якоби) Cu. SO 4 + Zn = Cu + Zn. SO 4
 Характеристика активности окислителя и восстановителя Для каждой окислительно-восстановительной реакции, зная потенциалы полуреакций, можно определить электродвижущую силу, для этого: ЭДС = Е 0 ок-ля - Е 0 восст-ля, где Е 0 - стандартный электродный потенциал Если ЭДС имеет положительное значение, то реакция может протекать слева направо
Характеристика активности окислителя и восстановителя Для каждой окислительно-восстановительной реакции, зная потенциалы полуреакций, можно определить электродвижущую силу, для этого: ЭДС = Е 0 ок-ля - Е 0 восст-ля, где Е 0 - стандартный электродный потенциал Если ЭДС имеет положительное значение, то реакция может протекать слева направо
 Расчет электрохимического потенциала уравнение Нернста E = E 0 + (2, 3 RT/ n F) • lg([Ox]/[Red]), E = E 0 + (0, 058 / n) • lg. C где E - искомый потенциал металла (в вольтах) E 0 - его нормальный потенциал n - валентность ионов металла С - концентрация ионов в растворе (г-ион/л)
Расчет электрохимического потенциала уравнение Нернста E = E 0 + (2, 3 RT/ n F) • lg([Ox]/[Red]), E = E 0 + (0, 058 / n) • lg. C где E - искомый потенциал металла (в вольтах) E 0 - его нормальный потенциал n - валентность ионов металла С - концентрация ионов в растворе (г-ион/л)


