Презентация на 15.10.2014 Ок-вост-ые процессы.pptx
- Количество слайдов: 10
 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ ПРИ СВАРКЕ ПОД УГЛЕРОДСОДЕРЖАЩИМ ФЛЮСОМ Докладчики: Крюков Р. Е ; Осетковский И. В. ; Махин Д. И. Авторы: Р. Е. Крюков, Ю. В. Бендре, Н. А. Козырев, И. В. Осетковский, Д. И. Махин 1 - Работа выполнена в Сиб. ГИУ в рамках проектной части Государственного задания Минобрнауки РФ № 11. 1531. 2014/к Новокузнецк, 2014
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ ПРИ СВАРКЕ ПОД УГЛЕРОДСОДЕРЖАЩИМ ФЛЮСОМ Докладчики: Крюков Р. Е ; Осетковский И. В. ; Махин Д. И. Авторы: Р. Е. Крюков, Ю. В. Бендре, Н. А. Козырев, И. В. Осетковский, Д. И. Махин 1 - Работа выполнена в Сиб. ГИУ в рамках проектной части Государственного задания Минобрнауки РФ № 11. 1531. 2014/к Новокузнецк, 2014
 Сварка под флюсом сопровождается интенсивными процессами массообмена между жидким расплавленным металлом и шлаком, сформированным из сварочного флюса. Процесс сопровождается реакциями восстановления и окисления марганца, железа и кремния и др. При этом продуктами данных реакций являются оксидные соединения кремния, марганца, железа, алюминия и др. , которые в процессе сварки чаще всего не успевают всплыть и ассимилироваться образующимся из сварочных флюсов шлаком, что приводит к увеличению уровня загрязненности металла сварного шва неметаллическими включениями, в результате чего значительно снижается комплекс физико-механических свойств. Решение проблемы: Для исключения загрязнения металла шва, по-видимому, целесообразно использование восстановителей, образующих газообразные продукты реакции. Таким восстановителем может быть углерод, образующий при взаимодействии с окислителями газообразные соединения CO 2 и CO. В настоящей работе была оценена термодинамическая вероятность протекания окислительно-восстановительных реакций с участием Fe, Mn, Si, Al, C и их оксидов. При этом сравнивали восстановительные свойства углерода с другими восстановителями, присутствующими в изучаемой системе жидкий металл шва – оксидный расплав – газ. Необходимые для оценки восстановительных свойств термодинамические характеристики реакций в стандартных условиях, рассчитывали известными методами в интервале температуры сварочных процессов 1700 – 2200 К. в качестве стандартных для веществ – реагентов были выбраны состояния: Fe. Oж, Mn. Oж, Si. O 2 ж, Al 2 O 3 ж, Alж, Siж, Cтв, графит, Mnж, Feж, COг, CO 2 г в соответствии с реальным агрегатным состоянием фаз в изучаемой системе. 2
Сварка под флюсом сопровождается интенсивными процессами массообмена между жидким расплавленным металлом и шлаком, сформированным из сварочного флюса. Процесс сопровождается реакциями восстановления и окисления марганца, железа и кремния и др. При этом продуктами данных реакций являются оксидные соединения кремния, марганца, железа, алюминия и др. , которые в процессе сварки чаще всего не успевают всплыть и ассимилироваться образующимся из сварочных флюсов шлаком, что приводит к увеличению уровня загрязненности металла сварного шва неметаллическими включениями, в результате чего значительно снижается комплекс физико-механических свойств. Решение проблемы: Для исключения загрязнения металла шва, по-видимому, целесообразно использование восстановителей, образующих газообразные продукты реакции. Таким восстановителем может быть углерод, образующий при взаимодействии с окислителями газообразные соединения CO 2 и CO. В настоящей работе была оценена термодинамическая вероятность протекания окислительно-восстановительных реакций с участием Fe, Mn, Si, Al, C и их оксидов. При этом сравнивали восстановительные свойства углерода с другими восстановителями, присутствующими в изучаемой системе жидкий металл шва – оксидный расплав – газ. Необходимые для оценки восстановительных свойств термодинамические характеристики реакций в стандартных условиях, рассчитывали известными методами в интервале температуры сварочных процессов 1700 – 2200 К. в качестве стандартных для веществ – реагентов были выбраны состояния: Fe. Oж, Mn. Oж, Si. O 2 ж, Al 2 O 3 ж, Alж, Siж, Cтв, графит, Mnж, Feж, COг, CO 2 г в соответствии с реальным агрегатным состоянием фаз в изучаемой системе. 2
![Реакции, взятые для расчета Энергии Гиббса (24) (Fe. O) + [Mn] = [Fe] + Реакции, взятые для расчета Энергии Гиббса (24) (Fe. O) + [Mn] = [Fe] +](https://present5.com/presentation/14942059_333697532/image-3.jpg) Реакции, взятые для расчета Энергии Гиббса (24) (Fe. O) + [Mn] = [Fe] + (Mn. O) ; (Mn. O) + 1/2[Si] = [Mn] + 1/2(Si. O 2) ; (Fe. O) + 1/2[Si] = [Fe] + 1/2(Si. O 2) ; (Mn. O) + [Fe] = [Mn] + (Fe. O) ; (Mn. O) + Cтв = [Mn] + COг ; (Fe. O) + Cтв = [Fe] + COг, ; (Fe. O) + 1/2 Cтв = [Fe] + 1/2 CO 2 г, ; (Mn. O) + 1/2 Cтв = [Mn] + 1/2 CO 2 г ; (Fe. O) + COг = [Fe] + CO 2 г, ; (Mn. O) + COг = [Mn] + CO 2 г ; (Fe. O) + 2/3[Al] = [Fe] + 1/3(Al 2 O 3) ; (Mn. O) + 2/3[Al] = [Mn] + 1/3(Al 2 O 3) ; (Si. O 2) + 2[Mn] = [Si] + 2(Mn. O) ; (Al 2 O 3) + 3/2[Si] = 2[Al] + 3/2(Si. O 2) ; (Si. O 2) + 2[Fe] = [Si] + 2(Fe. O) ; (Al 2 O 3) + 3[Fe] = 2[Al] + 3(Fe. O) ; (Si. O 2) + 2 Cтв = [Si] + 2 COг ; (Al 2 O 3) + 3[Mn] = 2[Al] + 3(Mn. O) ; (Si. O 2) + Cтв = [Si] + CO 2 г ; (Al 2 O 3) + 3 Cтв = 2[Al] + 3 COг ; (Si. O 2) + 2 COг = [Si] + 2 CO 2 г ; (Al 2 O 3) + 3/2 Cтв = 2[Al] + 3/2 CO 2 г; (Si. O 2) + 4/3[Al] = [Si] + 2/3(Al 2 O 3) ; (Al 2 O 3) + 3 COг = 2[Al] + 3 CO 2 г. 3
Реакции, взятые для расчета Энергии Гиббса (24) (Fe. O) + [Mn] = [Fe] + (Mn. O) ; (Mn. O) + 1/2[Si] = [Mn] + 1/2(Si. O 2) ; (Fe. O) + 1/2[Si] = [Fe] + 1/2(Si. O 2) ; (Mn. O) + [Fe] = [Mn] + (Fe. O) ; (Mn. O) + Cтв = [Mn] + COг ; (Fe. O) + Cтв = [Fe] + COг, ; (Fe. O) + 1/2 Cтв = [Fe] + 1/2 CO 2 г, ; (Mn. O) + 1/2 Cтв = [Mn] + 1/2 CO 2 г ; (Fe. O) + COг = [Fe] + CO 2 г, ; (Mn. O) + COг = [Mn] + CO 2 г ; (Fe. O) + 2/3[Al] = [Fe] + 1/3(Al 2 O 3) ; (Mn. O) + 2/3[Al] = [Mn] + 1/3(Al 2 O 3) ; (Si. O 2) + 2[Mn] = [Si] + 2(Mn. O) ; (Al 2 O 3) + 3/2[Si] = 2[Al] + 3/2(Si. O 2) ; (Si. O 2) + 2[Fe] = [Si] + 2(Fe. O) ; (Al 2 O 3) + 3[Fe] = 2[Al] + 3(Fe. O) ; (Si. O 2) + 2 Cтв = [Si] + 2 COг ; (Al 2 O 3) + 3[Mn] = 2[Al] + 3(Mn. O) ; (Si. O 2) + Cтв = [Si] + CO 2 г ; (Al 2 O 3) + 3 Cтв = 2[Al] + 3 COг ; (Si. O 2) + 2 COг = [Si] + 2 CO 2 г ; (Al 2 O 3) + 3/2 Cтв = 2[Al] + 3/2 CO 2 г; (Si. O 2) + 4/3[Al] = [Si] + 2/3(Al 2 O 3) ; (Al 2 O 3) + 3 COг = 2[Al] + 3 CO 2 г. 3
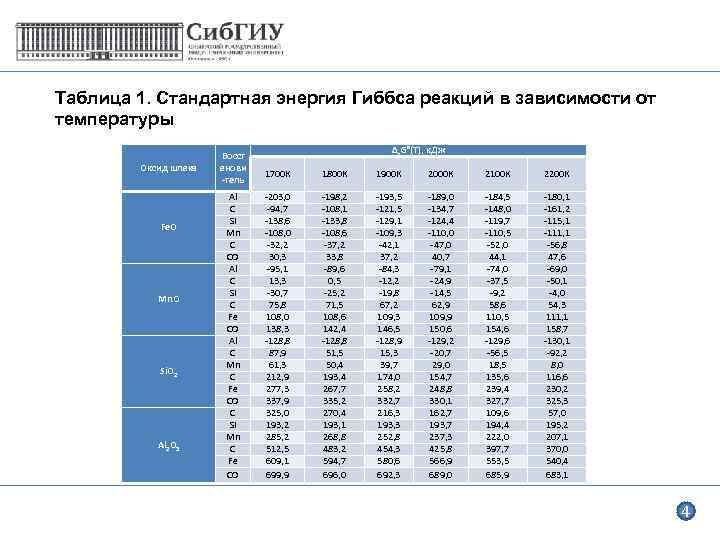 Таблица 1. Стандартная энергия Гиббса реакций в зависимости от температуры Оксид шлака Fe. O Mn. O Si. O 2 Al 2 O 3 Восст анови -тель Al C Si Mn C CO Al C Si C Fe CO Al C Mn C Fe CO C Si Mn C Fe CO ∆r. G°(Т), к. Дж 1700 К 1800 К 1900 К 2000 К 2100 К 2200 К -203, 0 -94, 7 -138, 6 -108, 0 -32, 2 30, 3 -95, 1 13, 3 -30, 7 75, 8 108, 0 138, 3 -128, 8 87, 9 61, 3 212, 9 277, 3 337, 9 325, 0 193, 2 285, 2 512, 5 609, 1 699, 9 -198, 2 -108, 1 -133, 8 -108, 6 -37, 2 33, 8 -89, 6 0, 5 -25, 2 71, 5 108, 6 142, 4 -128, 8 51, 5 50, 4 193, 4 267, 7 335, 2 270, 4 193, 1 268, 8 483, 2 594, 7 696, 0 -193, 5 -121, 5 -129, 1 -109, 3 -42, 1 37, 2 -84, 3 -12, 2 -19, 8 67, 2 109, 3 146, 5 -128, 9 15, 3 39, 7 174, 0 258, 2 332, 7 216, 3 193, 3 252, 8 454, 3 580, 6 692, 3 -189, 0 -134, 7 -124, 4 -110, 0 -47, 0 40, 7 -79, 1 -24, 9 -14, 5 62, 9 109, 9 150, 6 -129, 2 -20, 7 29, 0 154, 7 248, 8 330, 1 162, 7 193, 7 237, 3 425, 8 566, 9 689, 0 -184, 5 -148, 0 -119, 7 -110, 5 -52, 0 44, 1 -74, 0 -37, 5 -9, 2 58, 6 110, 5 154, 6 -129, 6 -56, 5 18, 5 135, 6 239, 4 327, 7 109, 6 194, 4 222, 0 397, 7 553, 5 685, 9 -180, 1 -161, 2 -115, 1 -111, 1 -56, 8 47, 6 -69, 0 -50, 1 -4, 0 54, 3 111, 1 158, 7 -130, 1 -92, 2 8, 0 116, 6 230, 2 325, 3 57, 0 195, 2 207, 1 370, 0 540, 4 683, 1 4
Таблица 1. Стандартная энергия Гиббса реакций в зависимости от температуры Оксид шлака Fe. O Mn. O Si. O 2 Al 2 O 3 Восст анови -тель Al C Si Mn C CO Al C Si C Fe CO Al C Mn C Fe CO C Si Mn C Fe CO ∆r. G°(Т), к. Дж 1700 К 1800 К 1900 К 2000 К 2100 К 2200 К -203, 0 -94, 7 -138, 6 -108, 0 -32, 2 30, 3 -95, 1 13, 3 -30, 7 75, 8 108, 0 138, 3 -128, 8 87, 9 61, 3 212, 9 277, 3 337, 9 325, 0 193, 2 285, 2 512, 5 609, 1 699, 9 -198, 2 -108, 1 -133, 8 -108, 6 -37, 2 33, 8 -89, 6 0, 5 -25, 2 71, 5 108, 6 142, 4 -128, 8 51, 5 50, 4 193, 4 267, 7 335, 2 270, 4 193, 1 268, 8 483, 2 594, 7 696, 0 -193, 5 -121, 5 -129, 1 -109, 3 -42, 1 37, 2 -84, 3 -12, 2 -19, 8 67, 2 109, 3 146, 5 -128, 9 15, 3 39, 7 174, 0 258, 2 332, 7 216, 3 193, 3 252, 8 454, 3 580, 6 692, 3 -189, 0 -134, 7 -124, 4 -110, 0 -47, 0 40, 7 -79, 1 -24, 9 -14, 5 62, 9 109, 9 150, 6 -129, 2 -20, 7 29, 0 154, 7 248, 8 330, 1 162, 7 193, 7 237, 3 425, 8 566, 9 689, 0 -184, 5 -148, 0 -119, 7 -110, 5 -52, 0 44, 1 -74, 0 -37, 5 -9, 2 58, 6 110, 5 154, 6 -129, 6 -56, 5 18, 5 135, 6 239, 4 327, 7 109, 6 194, 4 222, 0 397, 7 553, 5 685, 9 -180, 1 -161, 2 -115, 1 -111, 1 -56, 8 47, 6 -69, 0 -50, 1 -4, 0 54, 3 111, 1 158, 7 -130, 1 -92, 2 8, 0 116, 6 230, 2 325, 3 57, 0 195, 2 207, 1 370, 0 540, 4 683, 1 4
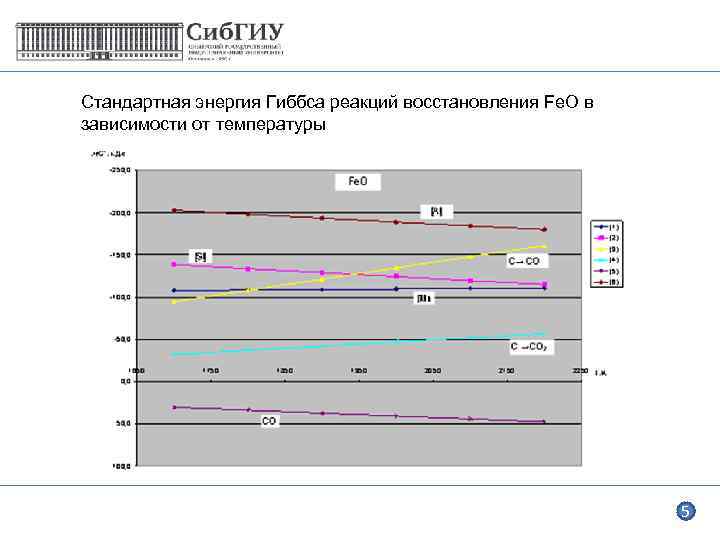 Стандартная энергия Гиббса реакций восстановления Fe. O в зависимости от температуры 5
Стандартная энергия Гиббса реакций восстановления Fe. O в зависимости от температуры 5
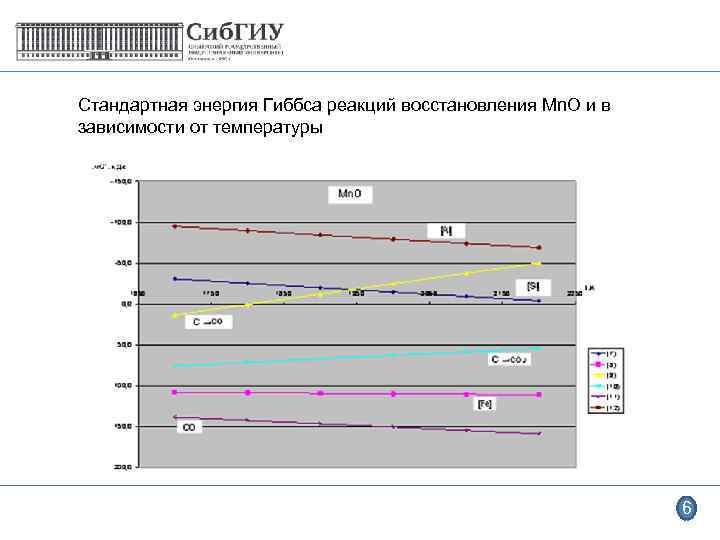 Стандартная энергия Гиббса реакций восстановления Mn. O и в зависимости от температуры 6
Стандартная энергия Гиббса реакций восстановления Mn. O и в зависимости от температуры 6
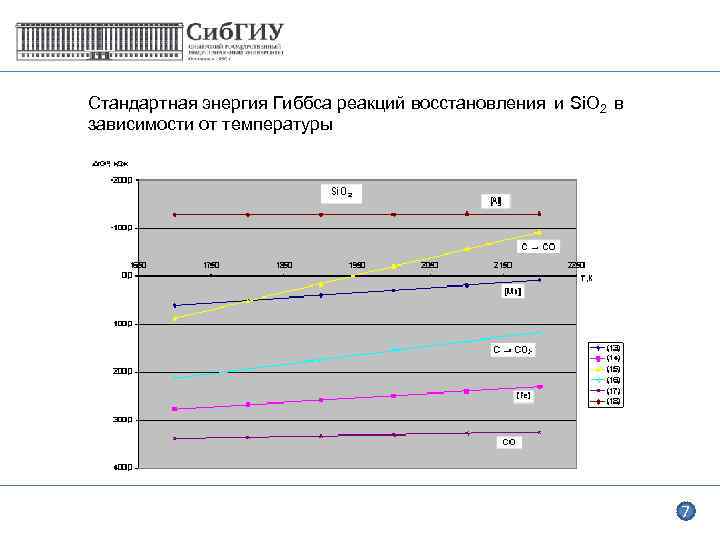 Стандартная энергия Гиббса реакций восстановления и Si. O 2 в зависимости от температуры 7
Стандартная энергия Гиббса реакций восстановления и Si. O 2 в зависимости от температуры 7
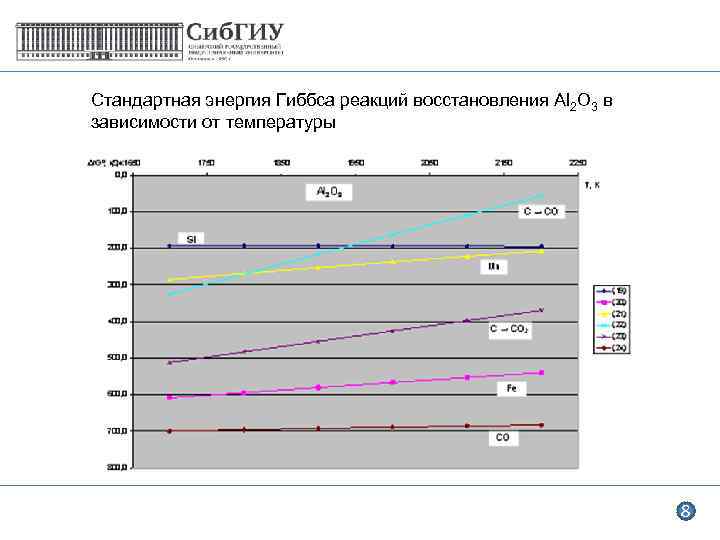 Стандартная энергия Гиббса реакций восстановления Al 2 O 3 в зависимости от температуры 8
Стандартная энергия Гиббса реакций восстановления Al 2 O 3 в зависимости от температуры 8
 Вывод: Таким образом, проведенный термодинамический анализ реакций в системе жидкий металл шва – оксидный расплав – газ показывает, что введенный в систему углерод способен за счет высоких восстановительных свойств при Т = 1950 – 2200 К существенным образом повлиять на содержание неметаллических включений в металле шва в сторону уменьшения. 9
Вывод: Таким образом, проведенный термодинамический анализ реакций в системе жидкий металл шва – оксидный расплав – газ показывает, что введенный в систему углерод способен за счет высоких восстановительных свойств при Т = 1950 – 2200 К существенным образом повлиять на содержание неметаллических включений в металле шва в сторону уменьшения. 9
 Благодарим за внимание!
Благодарим за внимание!


