OV_protsessy.ppt
- Количество слайдов: 31
 Окислительно-восстановительные процессы Механизмы возникновения потенциалов
Окислительно-восстановительные процессы Механизмы возникновения потенциалов
 Процессы, при которых происходит процесс переноса ē от одних атомов к другим и изменение их степеней окисления (с. о. ) называются О-В реакциями.
Процессы, при которых происходит процесс переноса ē от одних атомов к другим и изменение их степеней окисления (с. о. ) называются О-В реакциями.
 Окислители (ох) – акцепторы ē. Содержат атомы с высокой с. о. и э. о>3 Восстановители (red) – доноры ē. Содержат атомы с низкой с. о. и э. о<1, 5 ОВ двойственность проявляют атомы с промежуточной с. о. (Примеры: уч. Ершова «Общая химия» стр. 133)
Окислители (ох) – акцепторы ē. Содержат атомы с высокой с. о. и э. о>3 Восстановители (red) – доноры ē. Содержат атомы с низкой с. о. и э. о<1, 5 ОВ двойственность проявляют атомы с промежуточной с. о. (Примеры: уч. Ершова «Общая химия» стр. 133)
 ОВ реакции состоят из 2 х сопряженных полуреакций: • окисление – процесс отдачи ē • восстановление – процесс присоединения ē S-2 - 2ē → S 0 - окисление red ox Cl 02 + 2ē → 2 Cl- - восстановление ox red Полуреакции содержат две сопряженные ОВ–пары
ОВ реакции состоят из 2 х сопряженных полуреакций: • окисление – процесс отдачи ē • восстановление – процесс присоединения ē S-2 - 2ē → S 0 - окисление red ox Cl 02 + 2ē → 2 Cl- - восстановление ox red Полуреакции содержат две сопряженные ОВ–пары
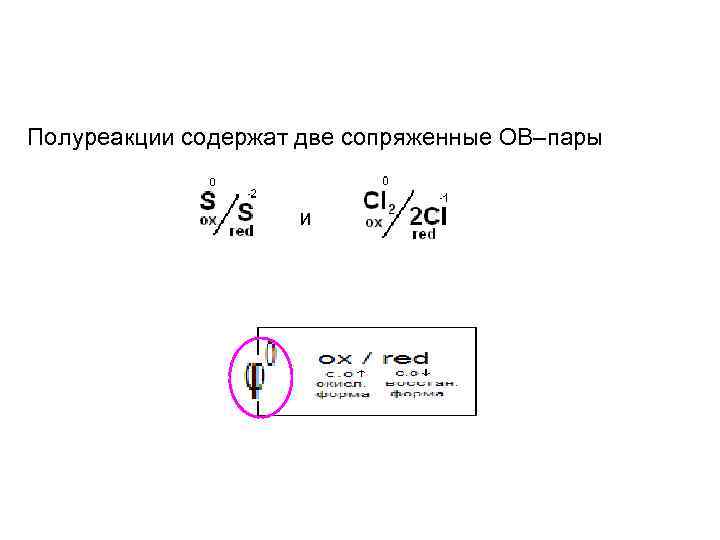 Полуреакции содержат две сопряженные ОВ–пары и
Полуреакции содержат две сопряженные ОВ–пары и
 ОВ способности пары характеризует стандартный ОВ-потенциал –φ0 охred (В) (Т=298 К, аох= аred= 1 мольл): Чем φо, тем сильней окислитель, Чем φо, тем сильней восстановитель. В таблице ОВ-потенциалов даны полуреакции и их φо: ох + nē red φо
ОВ способности пары характеризует стандартный ОВ-потенциал –φ0 охred (В) (Т=298 К, аох= аred= 1 мольл): Чем φо, тем сильней окислитель, Чем φо, тем сильней восстановитель. В таблице ОВ-потенциалов даны полуреакции и их φо: ох + nē red φо
 По потенциалам пар составляют ионные ОВ φо φо = 0, 77 В уравнения: = 0, 54 В. Более сильный ох одной пары реагирует с red другой пары: Fe+3 + 2 I-→Fe+2 + I 02 ox red
По потенциалам пар составляют ионные ОВ φо φо = 0, 77 В уравнения: = 0, 54 В. Более сильный ох одной пары реагирует с red другой пары: Fe+3 + 2 I-→Fe+2 + I 02 ox red
 По потенциалам пар прогнозируют направление самопроизвольного протекания реакций: а) реакция идет в направлении от сильного ох к слабому ох б) реакция идет в прямом направлении, если ЭДС=Еор реакции будет положительной Е ор > 0
По потенциалам пар прогнозируют направление самопроизвольного протекания реакций: а) реакция идет в направлении от сильного ох к слабому ох б) реакция идет в прямом направлении, если ЭДС=Еор реакции будет положительной Е ор > 0
 ЭДС реакции – это стандартная электродвижущая сила реакции, равная разности стандартных потенциалов сопряженных ОВ пар веществ реагентов. Еор = φоох - φоred Чем выше ЭДС реакции, тем интенсивнее она протекает.
ЭДС реакции – это стандартная электродвижущая сила реакции, равная разности стандартных потенциалов сопряженных ОВ пар веществ реагентов. Еор = φоох - φоred Чем выше ЭДС реакции, тем интенсивнее она протекает.
 Виды потенциалов и механизмы их возникновения I Электродный потенциал φ MZ+/M Возникает на границе металла с раствором его соли в результате перехода катионов Ме через границу: Мz+Т Мz+р-р Величина потенциала зависит от природы Ме.
Виды потенциалов и механизмы их возникновения I Электродный потенциал φ MZ+/M Возникает на границе металла с раствором его соли в результате перехода катионов Ме через границу: Мz+Т Мz+р-р Величина потенциала зависит от природы Ме.
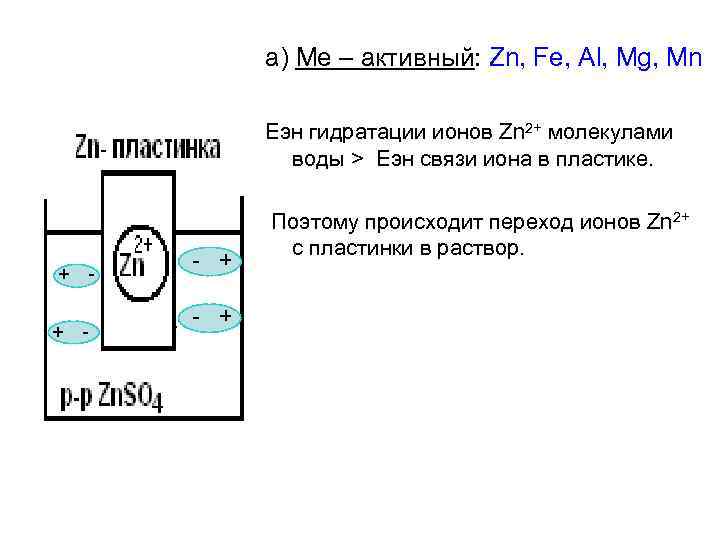 а) Ме – активный: Zn, Fe, Al, Mg, Mn Eэн гидратации ионов Zn 2+ молекулами воды > Еэн связи иона в пластике. + + - - + Поэтому происходит переход ионов Zn 2+ с пластинки в раствор.
а) Ме – активный: Zn, Fe, Al, Mg, Mn Eэн гидратации ионов Zn 2+ молекулами воды > Еэн связи иона в пластике. + + - - + Поэтому происходит переход ионов Zn 2+ с пластинки в раствор.
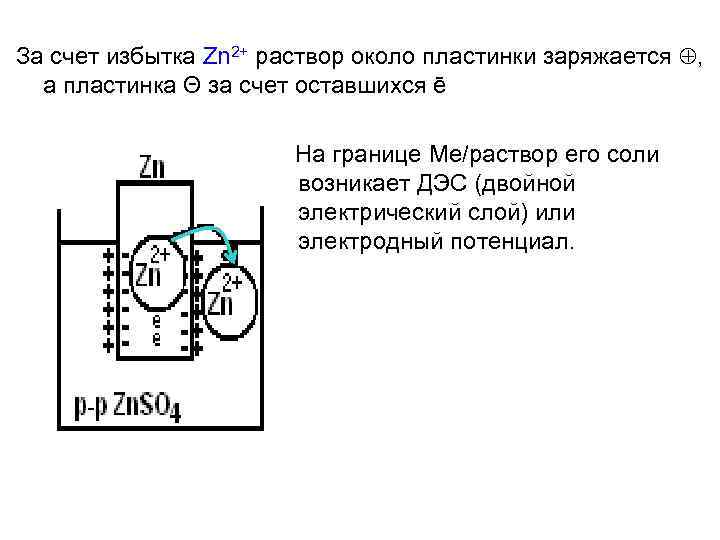 За счет избытка Zn 2+ раствор около пластинки заряжается , а пластинка Θ за счет оставшихся ē На границе Ме/раствор его соли возникает ДЭС (двойной электрический слой) или электродный потенциал.
За счет избытка Zn 2+ раствор около пластинки заряжается , а пластинка Θ за счет оставшихся ē На границе Ме/раствор его соли возникает ДЭС (двойной электрический слой) или электродный потенциал.
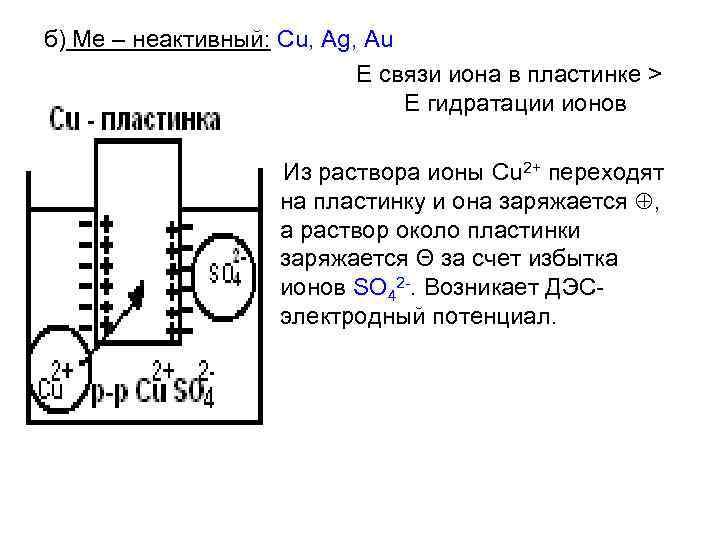 б) Ме – неактивный: Cu, Ag, Au Е связи иона в пластинке > Е гидратации ионов Из раствора ионы Cu 2+ переходят на пластинку и она заряжается , а раствор около пластинки заряжается Θ за счет избытка ионов SO 42 -. Возникает ДЭСэлектродный потенциал.
б) Ме – неактивный: Cu, Ag, Au Е связи иона в пластинке > Е гидратации ионов Из раствора ионы Cu 2+ переходят на пластинку и она заряжается , а раствор около пластинки заряжается Θ за счет избытка ионов SO 42 -. Возникает ДЭСэлектродный потенциал.
 Стандартный электродный потенциал φ0 мz+/м – это скачок потенциала на границе Ме/раствор его соли при а. Ме. Z+ = 1 мольл и Т= 298 К. Его измеряют относительно стандартного водородного электрода, потенциал которого принят за 0: φо 2 Н+Н 2 о = 0
Стандартный электродный потенциал φ0 мz+/м – это скачок потенциала на границе Ме/раствор его соли при а. Ме. Z+ = 1 мольл и Т= 298 К. Его измеряют относительно стандартного водородного электрода, потенциал которого принят за 0: φо 2 Н+Н 2 о = 0
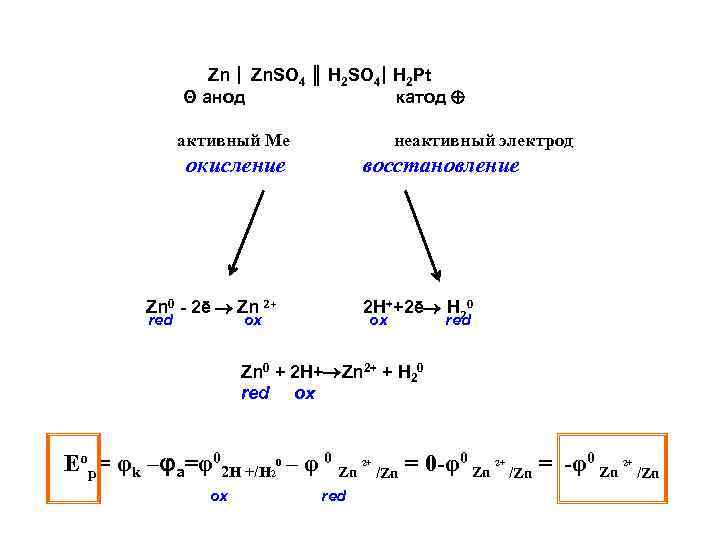 Zn | Zn. SO 4 ║ H 2 SO 4| H 2 Pt Θ анод катод активный Ме неактивный электрод окисление восстановление Zn 0 - 2ē Zn 2+ red 2 H++2ē H 20 ox оx red Zn 0 + 2 H+ Zn 2+ + H 20 red ox Еор= φk –φa=φ02 H +/H 20 – φ 0 Zn ox red 2+ = 0 -φ0 Zn /Zn 2+ = -φ0 Zn /Zn 2+ /Zn
Zn | Zn. SO 4 ║ H 2 SO 4| H 2 Pt Θ анод катод активный Ме неактивный электрод окисление восстановление Zn 0 - 2ē Zn 2+ red 2 H++2ē H 20 ox оx red Zn 0 + 2 H+ Zn 2+ + H 20 red ox Еор= φk –φa=φ02 H +/H 20 – φ 0 Zn ox red 2+ = 0 -φ0 Zn /Zn 2+ = -φ0 Zn /Zn 2+ /Zn
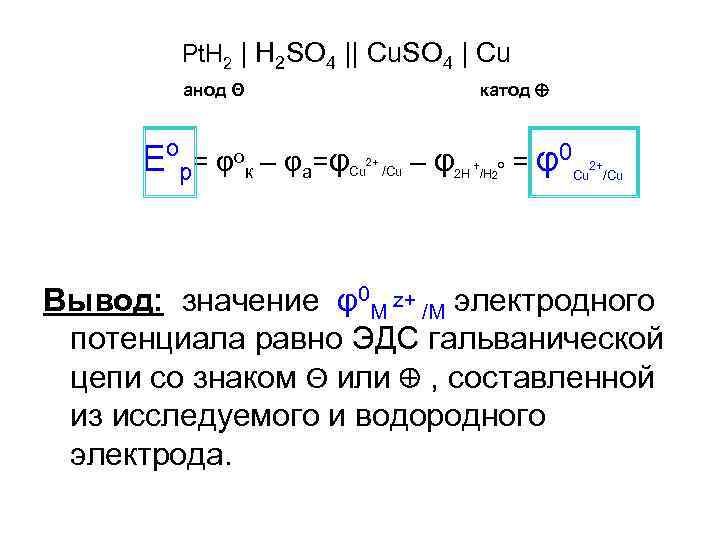 Pt. H 2 | H 2 SO 4 || Cu. SO 4 | Cu катод анод Θ Е о = φок – φа=φCu р 2+ /Cu – φ2 H +/H o = φ0 Cu 2+/Cu 2 Вывод: значение φ0 М z+ /М электродного потенциала равно ЭДС гальванической цепи со знаком Θ или , cоставленной из исследуемого и водородного электрода.
Pt. H 2 | H 2 SO 4 || Cu. SO 4 | Cu катод анод Θ Е о = φок – φа=φCu р 2+ /Cu – φ2 H +/H o = φ0 Cu 2+/Cu 2 Вывод: значение φ0 М z+ /М электродного потенциала равно ЭДС гальванической цепи со знаком Θ или , cоставленной из исследуемого и водородного электрода.
 Ряд напряжений металлов – это расположение металлов в порядке возрастания их φ0 Mz+/ M . В стоматологии протезировании с помощью металлов следует учитывать ОВ процессы. Если применять различные Ме, то в ротовой полости в электролитной слюне возникает ЭДС и происходит коррозия: Аu Me неакт. катод восстановление Fe Ме акт. анод Θ окисление Au+1 + 1ē Au 0 Fe 0 - 2ē Fe+2 ox red Fe 0 + 2 Au+1 Fe+2 + 2 Au 0 red ox E 0 p= φк - φа = 2, 14 > 0 Ме разрушаются, даже не контактируя друг с другом в электролитной среде.
Ряд напряжений металлов – это расположение металлов в порядке возрастания их φ0 Mz+/ M . В стоматологии протезировании с помощью металлов следует учитывать ОВ процессы. Если применять различные Ме, то в ротовой полости в электролитной слюне возникает ЭДС и происходит коррозия: Аu Me неакт. катод восстановление Fe Ме акт. анод Θ окисление Au+1 + 1ē Au 0 Fe 0 - 2ē Fe+2 ox red Fe 0 + 2 Au+1 Fe+2 + 2 Au 0 red ox E 0 p= φк - φа = 2, 14 > 0 Ме разрушаются, даже не контактируя друг с другом в электролитной среде.
 Для расчета φ M z+ /M в нестандартных условиях используют уравнение Нернста: φM z+/ M= φ 0 Mz+/ M + 0, 059 lg a Z Me z+
Для расчета φ M z+ /M в нестандартных условиях используют уравнение Нернста: φM z+/ M= φ 0 Mz+/ M + 0, 059 lg a Z Me z+
 Окислительно-восстановительный, 0 или редокс-потенциал – φ r Инертный Ме (Pt, Au) в сочетании с ОВ системой называется редокс-электродом, а возникающий на нем потенциал – редокс-потенциалом φr 0
Окислительно-восстановительный, 0 или редокс-потенциал – φ r Инертный Ме (Pt, Au) в сочетании с ОВ системой называется редокс-электродом, а возникающий на нем потенциал – редокс-потенциалом φr 0
 ОВ-системы содержат окислительную и восстановительную формы одного вещества и бывают 2 х типов: I тип – участвуют только ē оx + Zē red Fe 3+ +1ē Fe 2+ (цитохромы) in vivo II тип – участвуют ē и H+ + оx + Zē + m. H red + H 2 O Mn. O 4 - + 5ē + 8 H+ или Mn 2+ + 4 H 2 O НАД + / НАД*H + H+ in vivo
ОВ-системы содержат окислительную и восстановительную формы одного вещества и бывают 2 х типов: I тип – участвуют только ē оx + Zē red Fe 3+ +1ē Fe 2+ (цитохромы) in vivo II тип – участвуют ē и H+ + оx + Zē + m. H red + H 2 O Mn. O 4 - + 5ē + 8 H+ или Mn 2+ + 4 H 2 O НАД + / НАД*H + H+ in vivo
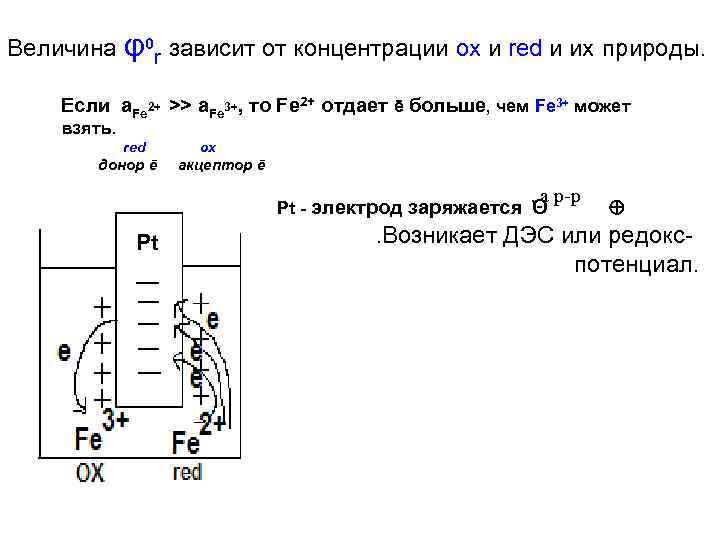 Величина φ0 r зависит от концентрации ox и red и их природы. Если a. Fe 2+ >> a. Fe 3+, то Fe 2+ отдает ē больше, чем Fe 3+ может взять. red донор ē ox акцептор ē , а Pt - электрод заряжается Θ Pt . Возникает p-p ДЭС или редокспотенциал.
Величина φ0 r зависит от концентрации ox и red и их природы. Если a. Fe 2+ >> a. Fe 3+, то Fe 2+ отдает ē больше, чем Fe 3+ может взять. red донор ē ox акцептор ē , а Pt - электрод заряжается Θ Pt . Возникает p-p ДЭС или редокспотенциал.
 φ0 r определяют относительно водородного электрода. При нестандартных условиях φr рассчитывают по уравнениям Петерса: φ= φ 0 r r 0, 059 + Z аох lg а ; red число ē φr =φr 0 0, 059 * m + Z аох* ан+ lg аred число H+
φ0 r определяют относительно водородного электрода. При нестандартных условиях φr рассчитывают по уравнениям Петерса: φ= φ 0 r r 0, 059 + Z аох lg а ; red число ē φr =φr 0 0, 059 * m + Z аох* ан+ lg аred число H+
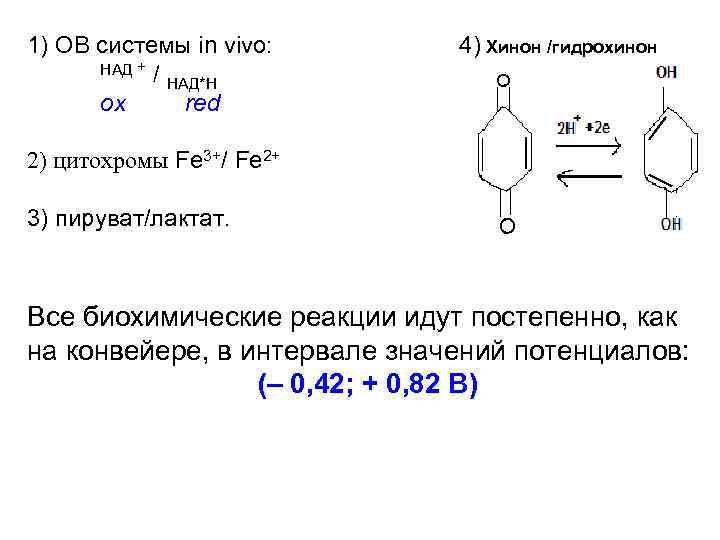 1) ОВ системы in vivo: НАД + / НАД*H ox red 4) Хинон /гидрохинон 2) цитохромы Fe 3+/ Fe 2+ 3) пируват/лактат. Все биохимические реакции идут постепенно, как на конвейере, в интервале значений потенциалов: (– 0, 42; + 0, 82 В)
1) ОВ системы in vivo: НАД + / НАД*H ox red 4) Хинон /гидрохинон 2) цитохромы Fe 3+/ Fe 2+ 3) пируват/лактат. Все биохимические реакции идут постепенно, как на конвейере, в интервале значений потенциалов: (– 0, 42; + 0, 82 В)
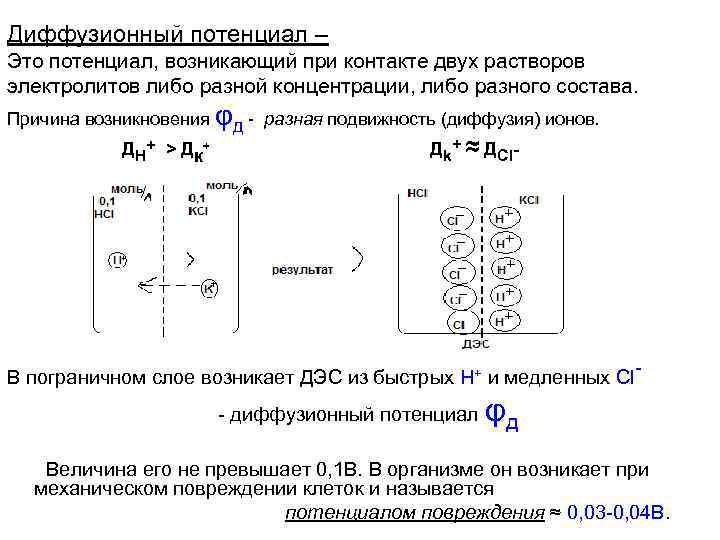 Диффузионный потенциал – Это потенциал, возникающий при контакте двух растворов электролитов либо разной концентрации, либо разного состава. Причина возникновения φд - разная подвижность (диффузия) ионов. Д H+ > Д к + Дk+ ≈ ДCl- В пограничном слое возникает ДЭС из быстрых Н+ и медленных Cl- диффузионный потенциал φд Величина его не превышает 0, 1 В. В организме он возникает при механическом повреждении клеток и называется потенциалом повреждения ≈ 0, 03 -0, 04 В.
Диффузионный потенциал – Это потенциал, возникающий при контакте двух растворов электролитов либо разной концентрации, либо разного состава. Причина возникновения φд - разная подвижность (диффузия) ионов. Д H+ > Д к + Дk+ ≈ ДCl- В пограничном слое возникает ДЭС из быстрых Н+ и медленных Cl- диффузионный потенциал φд Величина его не превышает 0, 1 В. В организме он возникает при механическом повреждении клеток и называется потенциалом повреждения ≈ 0, 03 -0, 04 В.
 Мембранный потенциал φM , или биопотенциал Это потенциал, возникающий между сторонами избирательно проницаемой мембраны, разделяющей два раствора разного состава.
Мембранный потенциал φM , или биопотенциал Это потенциал, возникающий между сторонами избирательно проницаемой мембраны, разделяющей два раствора разного состава.

 Разность концентраций K+ и Na+ поддерживается работой К-Na – насоса. Он переносит в клетку 2 K+ и из клетки 3 Na+ за счет энергии гидролиза АТФ. В результате дисбаланса зарядов внутренняя поверхность мембраны заряжается Θ, а наружная . Возникает мембранный потенциал ≈80 м. В.
Разность концентраций K+ и Na+ поддерживается работой К-Na – насоса. Он переносит в клетку 2 K+ и из клетки 3 Na+ за счет энергии гидролиза АТФ. В результате дисбаланса зарядов внутренняя поверхность мембраны заряжается Θ, а наружная . Возникает мембранный потенциал ≈80 м. В.
 С мембранным потенциалом связано: 1. сокращение мышц, 2. передача нервных импульсов, 3. снятие ЭКГ, электромиограмм, энцефалограмм, электрогастрограмм. 4. Увеличение K+ во внеклеточной жидкости ведет к изменению φM , сбою сердечного ритма, смерти (эвтаназия ). Под действием ядов прекращаются потоки Na+ , наступает паралич (строение мембраны нарушается).
С мембранным потенциалом связано: 1. сокращение мышц, 2. передача нервных импульсов, 3. снятие ЭКГ, электромиограмм, энцефалограмм, электрогастрограмм. 4. Увеличение K+ во внеклеточной жидкости ведет к изменению φM , сбою сердечного ритма, смерти (эвтаназия ). Под действием ядов прекращаются потоки Na+ , наступает паралич (строение мембраны нарушается).
 Значение ОВ – процессов. Биологическое окисление 1. За счет ОВ – реакций организм получает 99% энергии. Биологическое окисление идет в митохондриях с участием ОВ-ферментов. Они переносят H+ и ē от субстрата на О 2 , образуется Н 2 О, выделяется энергия. 0 φ =+0, 82 H-St-H НАД+х1 ФАД+ х2 ЦХ 1, 2, 3 φ0” =-0, 32 2 Н+ +2 е +1/2 O 2 St+H 2 O -220 к. Дж 50% энергии идет на синтез АТФ.
Значение ОВ – процессов. Биологическое окисление 1. За счет ОВ – реакций организм получает 99% энергии. Биологическое окисление идет в митохондриях с участием ОВ-ферментов. Они переносят H+ и ē от субстрата на О 2 , образуется Н 2 О, выделяется энергия. 0 φ =+0, 82 H-St-H НАД+х1 ФАД+ х2 ЦХ 1, 2, 3 φ0” =-0, 32 2 Н+ +2 е +1/2 O 2 St+H 2 O -220 к. Дж 50% энергии идет на синтез АТФ.
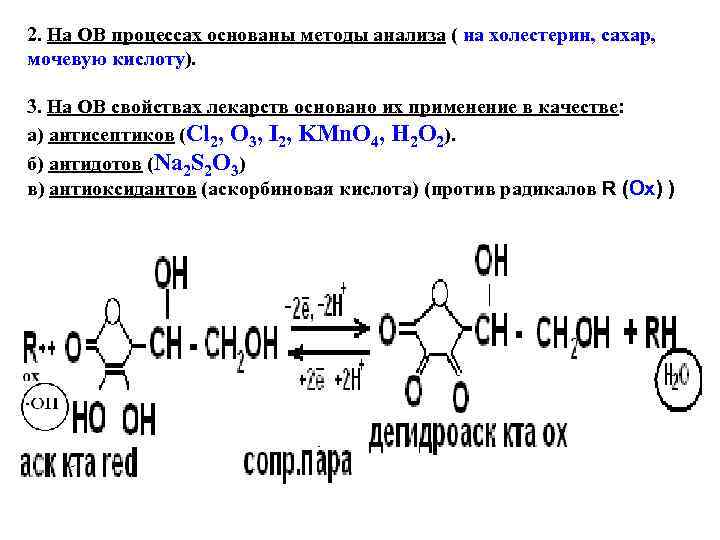 2. На ОВ процессах основаны методы анализа ( на холестерин, сахар, мочевую кислоту). 3. На ОВ свойствах лекарств основано их применение в качестве: а) антисептиков (Cl 2, O 3, I 2, KMn. O 4, H 2 O 2). б) антидотов (Na 2 S 2 O 3) в) антиоксидантов (аскорбиновая кислота) (против радикалов R (Ox) )
2. На ОВ процессах основаны методы анализа ( на холестерин, сахар, мочевую кислоту). 3. На ОВ свойствах лекарств основано их применение в качестве: а) антисептиков (Cl 2, O 3, I 2, KMn. O 4, H 2 O 2). б) антидотов (Na 2 S 2 O 3) в) антиоксидантов (аскорбиновая кислота) (против радикалов R (Ox) )
 Спасибо за внимание!
Спасибо за внимание!


