тема_13 лекция_12 Окисление белков, жиров.ppt
- Количество слайдов: 60

Окисление органических соединений (белки, жиры, нуклеиновые кислоты) «Если бы все происшедшее при жизни не разрушалось бы после смерти и не поступало вновь в оборотный капитал природы, то Земля превратилась бы в огромное кладбище. » Омелянский

Белки составляют большую долю живой биомассы, не менее 50%. служат важным источником питательных субстратов (более чем 20 различных L-аминокислот). пептидные связи разрушают протеолитические ферменты – протеазы (гидролазы).

при разложении белков микроорганизмами азот освобождается в виде аммиака. этот процесс называется АММОНИФИКАЦИЕЙ или минерализацией азота. он протекает в природе постоянно (гниение белковых веществ)

белки распадаются на более простые соединения, доступные для использования различными организмами. интенсивность процесса гниения зависит как от химической структуры белка, так и от вида микроорганизма.

казеин молока, гемоглобин крови, белки роговых и слизистых веществ разлагаются труднее, чем яичный или сывороточный альбумин, белки мяса

микроорганизмы большинство аэробных и анаэробных бактерий, актиномицеты, грибы особенно активны представители семейств Pseudomonodaceae, p. Pseudomonas; Bacillaceae, p. Bacillus, p. Clostridium; Enterobacteriaceae, p. Proteus и др.

для определения протеолитической активности используют способность бактерий гидролизовать желатин

начальные стадии гидролиза белка протекают с участием экзоферментов с образованием продуктов гидролиза – аминокислот и олигопептидов. продукты гидролиза транспортируются в клетку специальными транспортными системами. структурные белки, нерастворимые в воде, устойчивы к протеолизу – это кератин, элластин, коллаген.

устойчивость белков повышается в результате связывания белков с полифенолами. чувствительность к протеолитическим ферментам повышается после денатурации белка (под действием высокой температуры, кислот, щелочей).

микроорганизмы синтезируют множество различных протеаз тип и количество зависит от вида микроорганизма и условий роста. протеазы синтезируются в неактивной форме (в виде проферментов) и активируются в результате посттрансляционной модификации, в процессе транспорта или аутокаталитической активации.
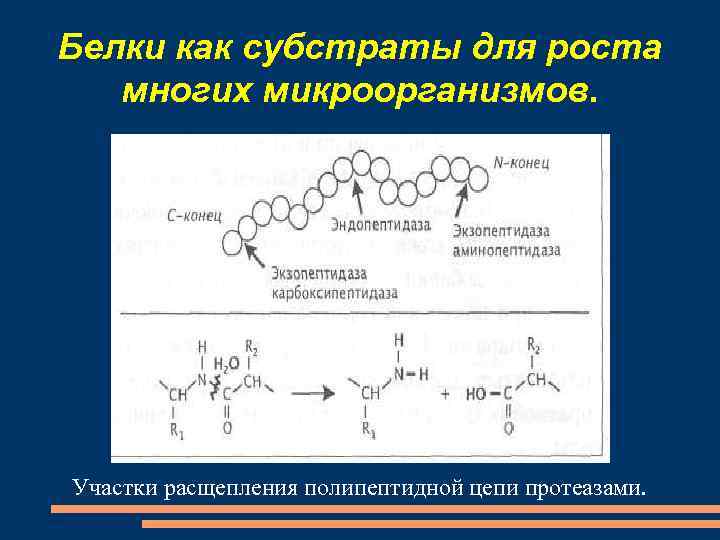
Белки как субстраты для роста многих микроорганизмов. Участки расщепления полипептидной цепи протеазами.

протеазы классифицируют в соответствии с природой активного центра сериновые, цистеиновые, аспарагиновые, металлсодержащие. различаются по чувствительности к определенным ингибиторам. сериновые: чувствительны к диизопропилфторфосфату и его фосфороорганическим производным

цистеиновые: к действию ионов металлов, алкилирующих агентов и окислителей. внутри четырех классов протеазы подразделяются по специфичности к тем или иным боковым цепям (т. е. аминокислотным остаткам в сайте расщепления).

протеазы, выделяемые клетками микроорганизмов в окружающую среду, осуществляют гидролиз ряда пептидных связей в молекулах белков. образующиеся при этом полипептиды и олигопептиды могут использоваться клетками бактерий, в которых они разрушаются внутриклеточными пептидазами до свободных аминокислот.
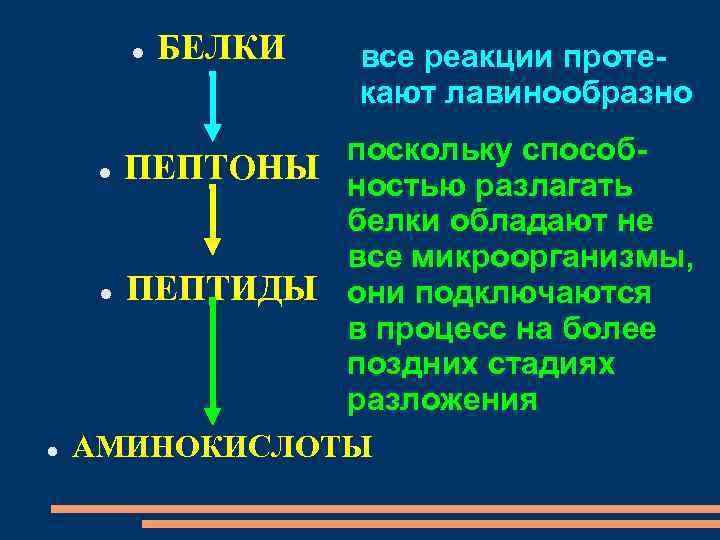
БЕЛКИ все реакции протекают лавинообразно поскольку способ ПЕПТОНЫ ностью разлагать белки обладают не все микроорганизмы, ПЕПТИДЫ они подключаются в процесс на более поздних стадиях разложения АМИНОКИСЛОТЫ

клеточные протеазы локализованы в цитоплазме, плазматической или наружной мембране, либо в периплазме. выполняют ключевую роль в регуляции клеточных процессов (а не в расщеплении питательных субстратов).

ограниченное протеолитическое расщепление имеет важное значение в посттрансляционном процессинге белков (при «созревании» белков), в транспорте, в инактивации регуляторных белков и при дифференцировке (образовании спор).

протеазы представляют собой важные факторы вирулентности бактерий, многие из которых питаются белками организма-хозяина. это субтилизин, стрептокиназа, гемолизины, эластаза.

Разложение нуклеиновых кислот Внеклеточные фосфодиэстеразы, неспецифичные к последовательности оснований Продукты распада: мононуклеотиды, низкомолекулярные олигонуклеотиды. Нуклеотиды дефосфорилируются периплазматическими фосфатазами. Рибоза, дезоксирибоза, нуклеотиды, нуклеозиды, азотистые основания

Внутриклеточные нуклеазы Сайт-специфичные - рибонуклеазы (РНКазы) - дезоксирибонуклеазы (ДНКазы) Основные типы 1. Расщепляют ДНК, РНК и ДНК-РНК-гибриды; 2. расщепляют одноцепочечные и двуцепочечные субстраты; 3. экзонуклеазы - отщепляют нуклеотиды от 3 и 5 концов цепи; 4. эндонуклеазы — расщепляют фосфодиэфирную связь; 5. нуклеазы, распознающие определенную последовательность нуклеотидов; 6. неспецифические нуклеазы

липиды не относятся к полимерам в строгом смысле. разложение этих труднорастворимых соединений основано на ряде принципов разложения полимеров

у всех организмов липиды служат основными структурными компонентами клеточных мембран, отлагаются как запасные вещества. основные компоненты: > 95% триацилглицеролы, < 5% фосфолипиды или гликолипиды, стероиды и каротиноиды. липиды мембран не являются триацилглицеролами.

каротиноиды и стероиды относятся к неомыляемым липидам. омыление других компонентов липидов (щелочной гидролиз) происходит с высвобождением жирных кислот, глицерола и полярных групп (головок). жирные кислоты окисляются через образование ацетил Со. А

многие микроорганизмы образуют поверхностно-активные вещества, гликолипиды, эмульгирующие липиды в среде. липазы (ацилгидролазы) – ферменты, катализирующие разложение триглицеридов до ди- и моноглицеридов, глицерола и жирных кислот. В системах с низкой активностью воды катализируют обратную реакцию — этерификацию глицерола жирными кислотами.

липазы ряд липаз обладает фосфолипазной активностью. по локализации они делятся на внеклеточные, периплазматические связанные с клеточной поверхностью.

липазы они воздействуют на водорастворимые и водонерастворимые субстраты. для их активности требуется наличие фазы раздела липид – вода. условием разложения липидов является их эмульгирование.

липазы различаются по субстратной специфичности 1. наиболее распространенные – неспецифические липазы – осуществляют необратимый гидролиз триацилглицеролов, преимущественно содержащих длинноцепочечные жирные кислоты. В спиртовых растворах проявляют эстеразную активность

2. липазы, специфично отщепляющие жирные кислоты в позициях у первого и третьего атомов углерода в остатке глицерола. 3. специфичные в отношении жк в составе липидов; у некоторых микроорганизмов липазы синтезируются конститутивно, у большинства индуцированно.

Реакции, катализируемые липазами (А), и механизмы гидролиза (Б). Rl, R 2 — алкильные цепи.

фосфолипазы это внутриклеточные у многих бактерий мембраносвязанные ферменты, гидролизующие фосфолипиды по различным участкам их молекул. продукты фосфолипазной активности - лизофосфолипиды

фосфолипазы относятся к важным факторам вирулентности патогенных бактерий на коже, клеточных поверхностях в организме-хозяине. разрушение фосфолипидов вызывает патологический эффект с образованием лизофосфатидовых кислот – высокоактивных внутриклеточных сигнальных молекул.

Микроорганизмы: Липазами обладают бактерии большинства родов; наиболее изучены в отношении их образования представители родов Staphylococcus, Pseudomonas, Bacillus, Streptomyces, Aeromonas, Xenorhabdus, Moraxella, Propionibacterium, Chromobacterium и Serratia.

фосфодиэстеразы катализируют разложение нуклеиновых кислот. неспецифичны к последовательности оснований. в результате расщепления образуются мононуклеотиды и разнообразные низкомолекулярные олигонулеотиды, способные проникать в клетки.

компоненты нуклеиновых кислот – рибоза, дезоксирибоза, нуклеотиды, нуклеозиды и азотистые основания – способны использовать различные микроорганизмы

пути расщепления олигосахаридов и превращения мономерных сахаров в интермедиаты катаболических путей

Для того, чтобы разнообразные низкомолекулярные углеводы могли включиться в центральные катаболические пути, они должны быть преобразованы в типовые субстраты синтез ферментов периферического метаболизма гексоз индуцируется.

периферический метаболизм сахаров реакции: фосфорилирования, фосфоролиза гликозидов, кетоенолизомеризации, окисления/ восстановления, альдольного расщепления, удаление заместителей -NH , 2 OCH 3 и -OOC-CH 3

Многие бактерии способны поглощать распространенные дисахариды: сахароза, целлобиоза или мальтоза, с участием пермеаз. фосфоролитическое расщепление гликозидной связи приводит к образованию глюкозо-1 -фосфата и второго сахара.

D-глюкозиды (трегалоза) проникают в клетку с помощью фосфотрансферазной транспортной системы (ФТС), фосфорилирующей молекулу дисахарида в процессе транспорта по С 6 атому остатка глюкозы. образующийся дисахарид-6 -фосфат гидролизуется в клетке с образованием глюкозо-6 -фосфата и второго сахара.
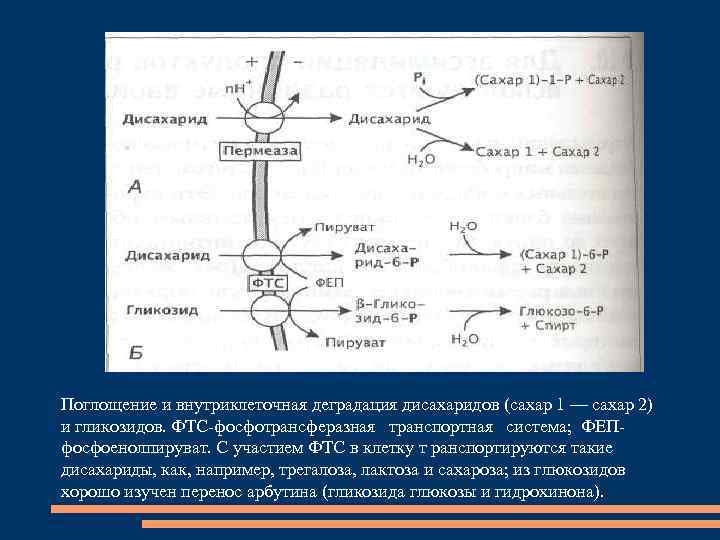
Поглощение и внутриклеточная деградация дисахаридов (сахар 1 — сахар 2) и гликозидов. ФТС-фосфотрансферазная транспортная система; ФЕПфосфоенолпируват. С участием ФТС в клетку т ранспортируются такие дисахариды, как, например, трегалоза, лактоза и сахароза; из глюкозидов хорошо изучен перенос арбутина (гликозида глюкозы и гидрохинона).

Некоторые наиболее распространенные дисахариды и трисахариды
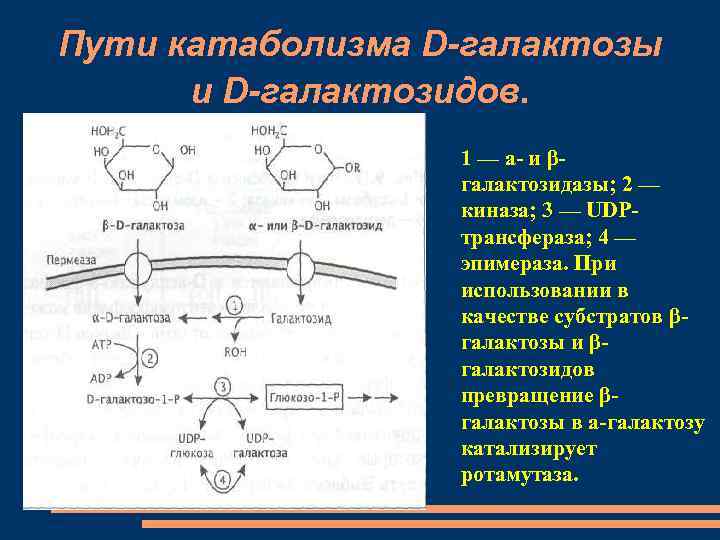
Пути катаболизма D-галактозы и D-галактозидов. 1 — а- и βгалактозидазы; 2 — киназа; 3 — UDPтрансфераза; 4 — эпимераза. При использовании в качестве субстратов βгалактозы и βгалактозидов превращение βгалактозы в а-галактозу катализирует ротамутаза.
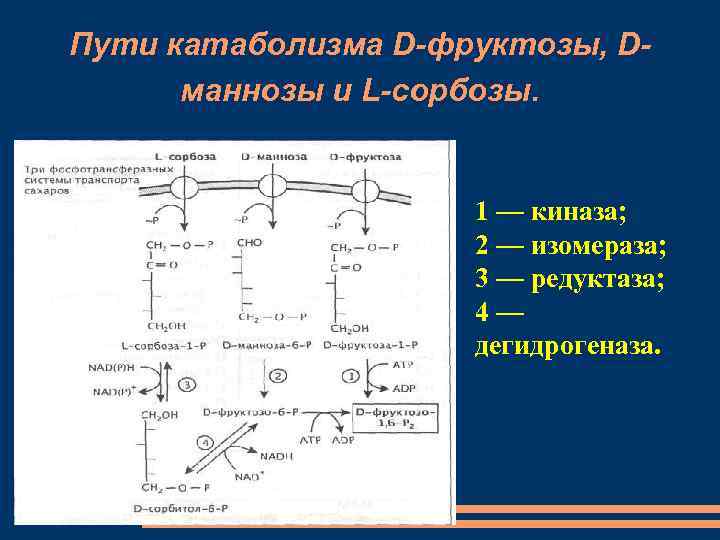
Пути катаболизма D-фруктозы, Dманнозы и L-сорбозы. 1 — киназа; 2 — изомераза; 3 — редуктаза; 4— дегидрогеназа.

Пути катаболизма пентоз и (дезокси)нуклеозидов 1— фосфорилазы; 2 —мутаза; 3 —дезоксирибоальдолаза.

Общая схема энергетических процессов у прокариот Э Н Е Р Г Е Т И Ч Е С К И Е р е с у р с ы п е н т о з ы г е к с о з ы пентозо-фосфатный путь брожения гликолиз пируват путь НАD H 2 ЦТК дыхательная цепь Этнера-Дудорова безкислородная часть с участием кислорода О 2


Модификация гликолитического пути у анаэробных архей на примере Pyrococcus furiosus. Фд— ферредоксин; W — вольфрам.
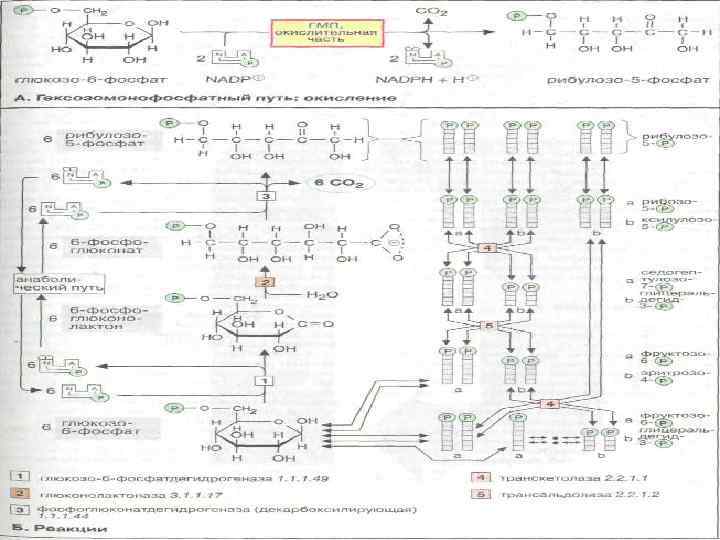

Окислительный пентозофосфатный цикл. A. Реакции превращения пентозофосфата в гексозофосфат. Rul — рибулоза; Rbs—рибоза; Xul — ксилулоза; Fru — фруктоза; ТК — транскетолаза, ТА — трансальдолаза. Б. Окисление одной молекулы глюкозы приводит к образованию трех молекул СО 2 и одной молекулы триозофосфата, а также шести молекул NADPH.
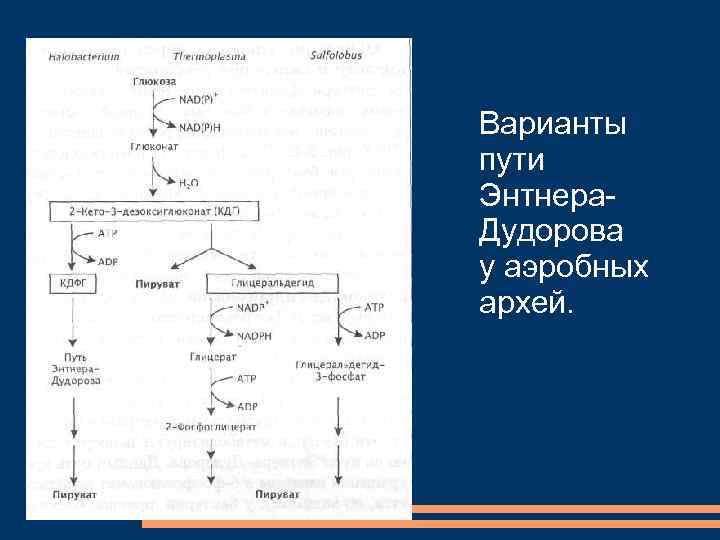
Варианты пути Энтнера. Дудорова у аэробных архей.

Взаимосвязь гликолитического пути, пентозофосфатного пути и пути Энтнера. Дудорова в метаболизме углеводов у бактерий.
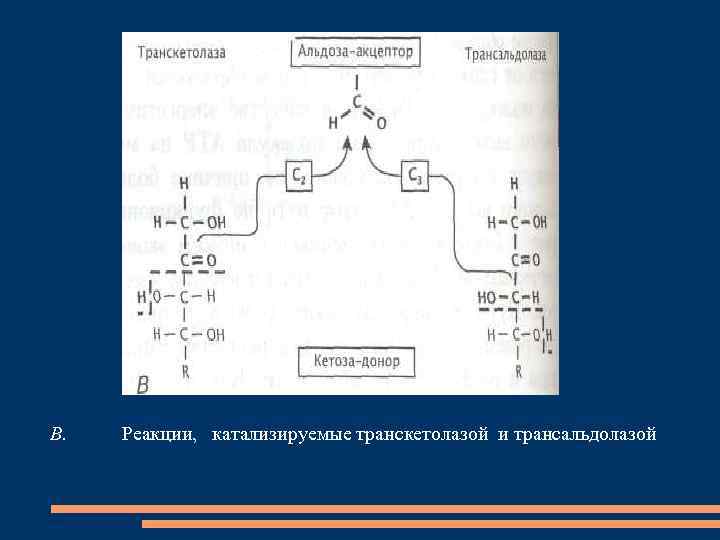
B. Реакции, катализируемые транскетолазой и трансальдолазой

Метилглиоксалевый шунт. 1 — метилглиоксальсинтаза; 2 — глиоксилазы I и II; 3 — D-лактатоксидаза (флавинзависимая).


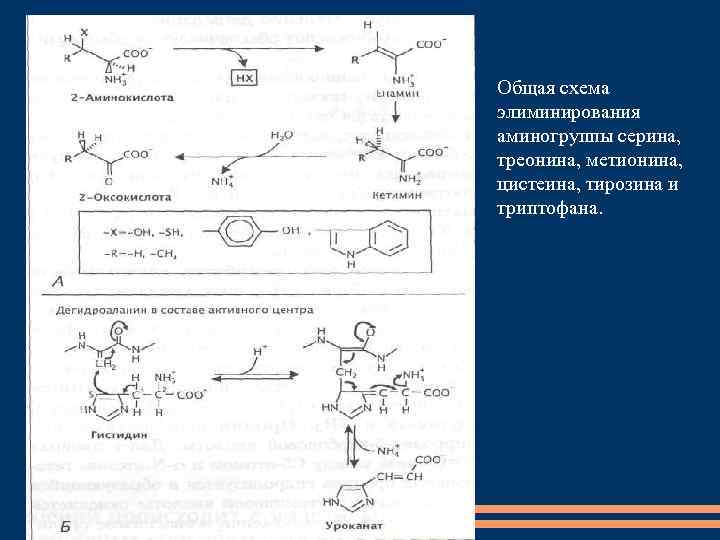
Общая схема элиминирования аминогруппы серина, треонина, метионина, цистеина, тирозина и триптофана.

Разложение аминокислот с разветвленной цепью (на примере L-лейцина).
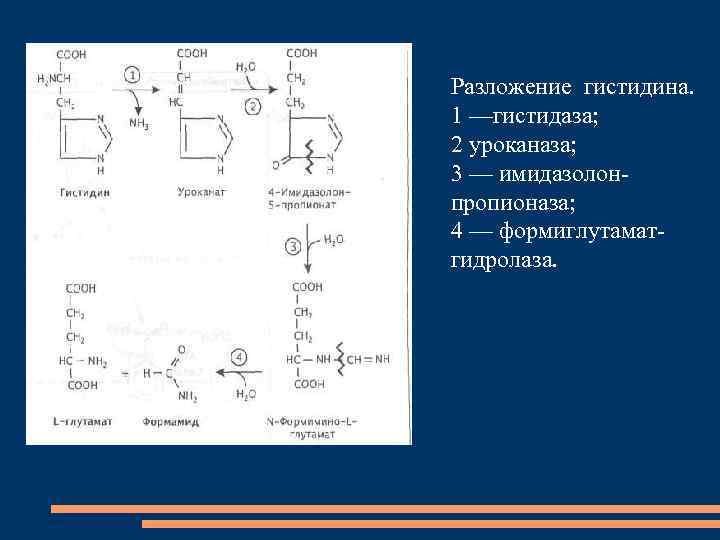
Разложение гистидина. 1 —гистидаза; 2 уроканаза; 3 — имидазолонпропионаза; 4 — формиглутаматгидролаза.
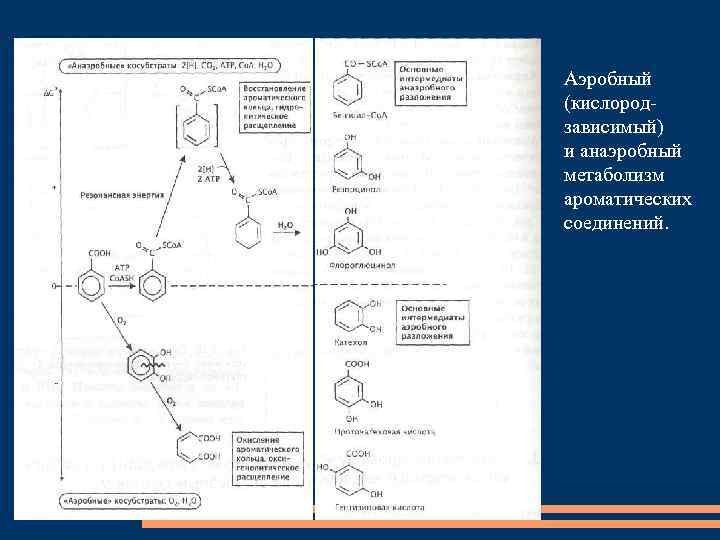
Аэробный (кислородзависимый) и анаэробный метаболизм ароматических соединений.
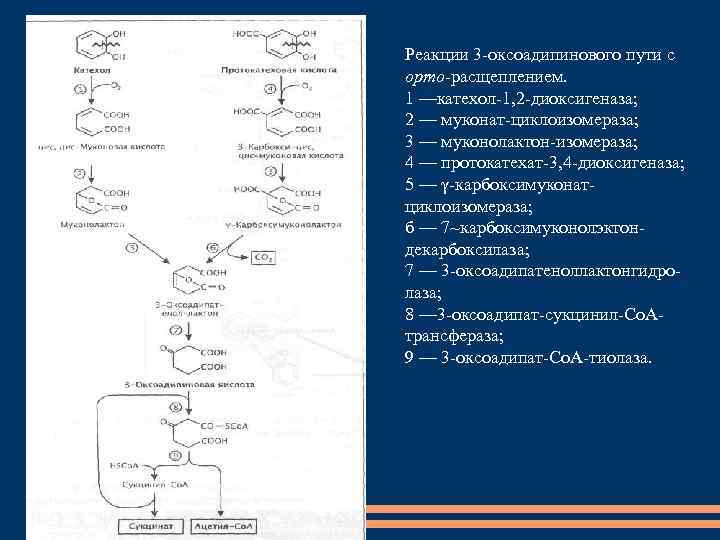
Реакции 3 -оксоадипинового пути с орто-расщеплением. 1 —катехол-1, 2 -диоксигеназа; 2 — муконат-циклоизомераза; 3 — муконолактон-изомераза; 4 — протокатехат-3, 4 -диоксигеназа; 5 — γ-карбоксимуконатциклоизомераза; б — 7~карбоксимуконолэктондекарбоксилаза; 7 — 3 -оксоадипатеноллактонгидролаза; 8 — 3 -оксоадипат-сукцинил-Со. Атрансфераза; 9 — 3 -оксоадипат-Со. А-тиолаза.
тема_13 лекция_12 Окисление белков, жиров.ppt