Первинна культура.ppt
- Количество слайдов: 42
 Одержання первинних культур клітин Первинна культура – культура, джерелом якої є органи й тканини, їх фрагменти або клітини, взяті безпосередньо з організму (культура клітин до першого пасажування) • Адгезія клітин in vivo та in vitro • Загальні принципи одержання первинних культур • Приклади окремих первинних культур – гепатоцити дорослого щура, ембріональні нейрони миші, тимоцити щура (суспензійна культура), фібробласти людини (метод експлантатів)
Одержання первинних культур клітин Первинна культура – культура, джерелом якої є органи й тканини, їх фрагменти або клітини, взяті безпосередньо з організму (культура клітин до першого пасажування) • Адгезія клітин in vivo та in vitro • Загальні принципи одержання первинних культур • Приклади окремих первинних культур – гепатоцити дорослого щура, ембріональні нейрони миші, тимоцити щура (суспензійна культура), фібробласти людини (метод експлантатів)
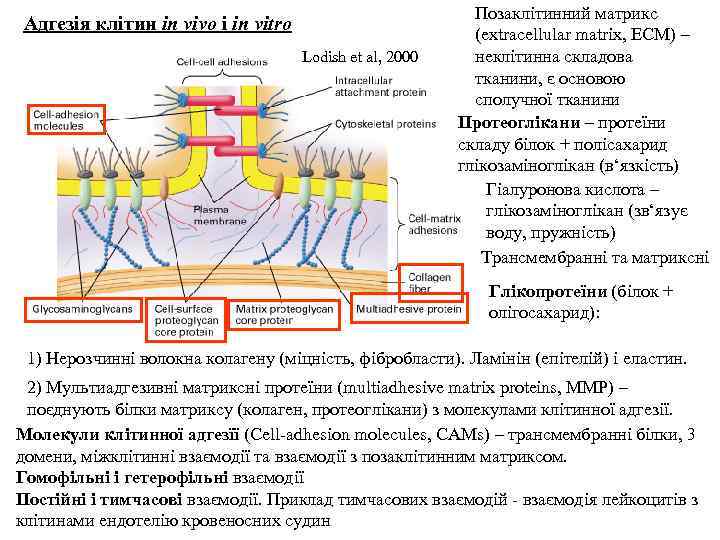 Адгезія клітин in vivo i in vitro Lodish et al, 2000 Позаклітинний матрикс (extracellular matrix, ECM) – неклітинна складова тканини, є основою сполучної тканини Протеоглікани – протеїни складу білок + полісахарид глікозаміноглікан (в‘язкість) Гіалуронова кислота – глікозаміноглікан (зв‘язує воду, пружність) Трансмембранні та матриксні Глікопротеїни (білок + олігосахарид): 1) Нерозчинні волокна колагену (міцність, фібробласти). Ламінін (епітелій) і eластин. 2) Мультиадгезивні матриксні протеїни (multiadhesive matrix proteins, ММР) – поєднують білки матриксу (колаген, протеоглікани) з молекулами клітинної адгезії. Молекули клітинної адгезїї (Cell-adhesion molecules, CAMs) – трансмембранні білки, 3 домени, міжклітинні взаємодії та взаємодії з позаклітинним матриксом. Гомофільні і гетерофільні взаємодії Постійні і тимчасові взаємодії. Приклад тимчасових взаємодій - взаємодія лейкоцитів з клітинами ендотелію кровеносних судин
Адгезія клітин in vivo i in vitro Lodish et al, 2000 Позаклітинний матрикс (extracellular matrix, ECM) – неклітинна складова тканини, є основою сполучної тканини Протеоглікани – протеїни складу білок + полісахарид глікозаміноглікан (в‘язкість) Гіалуронова кислота – глікозаміноглікан (зв‘язує воду, пружність) Трансмембранні та матриксні Глікопротеїни (білок + олігосахарид): 1) Нерозчинні волокна колагену (міцність, фібробласти). Ламінін (епітелій) і eластин. 2) Мультиадгезивні матриксні протеїни (multiadhesive matrix proteins, ММР) – поєднують білки матриксу (колаген, протеоглікани) з молекулами клітинної адгезії. Молекули клітинної адгезїї (Cell-adhesion molecules, CAMs) – трансмембранні білки, 3 домени, міжклітинні взаємодії та взаємодії з позаклітинним матриксом. Гомофільні і гетерофільні взаємодії Постійні і тимчасові взаємодії. Приклад тимчасових взаємодій - взаємодія лейкоцитів з клітинами ендотелію кровеносних судин
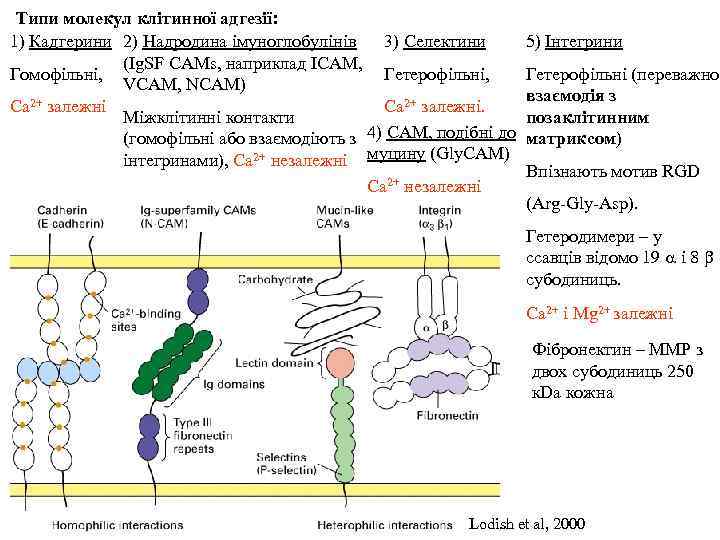 Типи молекул клітинної адгезії: 1) Кадгерини 2) Надродина імуноглобулінів 3) Селектини (Ig. SF CAMs, наприклад ICAM, Гомофільні, Гетерофільні, VCAM, NCAM) Ca 2+ залежні. Міжклітинні контакти (гомофільні або взаємодіють з 4) CAM, подібні до інтегринами), Ca 2+ незалежні муцину (Gly. CAM) Ca 2+ незалежні 5) Інтегрини Гетерофільні (переважно взаємодія з позаклітинним матриксом) Впізнають мотив RGD (Arg-Gly-Asp). Гетеродимери – у ссавців відомо 19 a і 8 b субодиниць. Ca 2+ i Mg 2+ залежні Фібронектин – ММР з двох субодиниць 250 к. Da кожна Lodish et al, 2000
Типи молекул клітинної адгезії: 1) Кадгерини 2) Надродина імуноглобулінів 3) Селектини (Ig. SF CAMs, наприклад ICAM, Гомофільні, Гетерофільні, VCAM, NCAM) Ca 2+ залежні. Міжклітинні контакти (гомофільні або взаємодіють з 4) CAM, подібні до інтегринами), Ca 2+ незалежні муцину (Gly. CAM) Ca 2+ незалежні 5) Інтегрини Гетерофільні (переважно взаємодія з позаклітинним матриксом) Впізнають мотив RGD (Arg-Gly-Asp). Гетеродимери – у ссавців відомо 19 a і 8 b субодиниць. Ca 2+ i Mg 2+ залежні Фібронектин – ММР з двох субодиниць 250 к. Da кожна Lodish et al, 2000
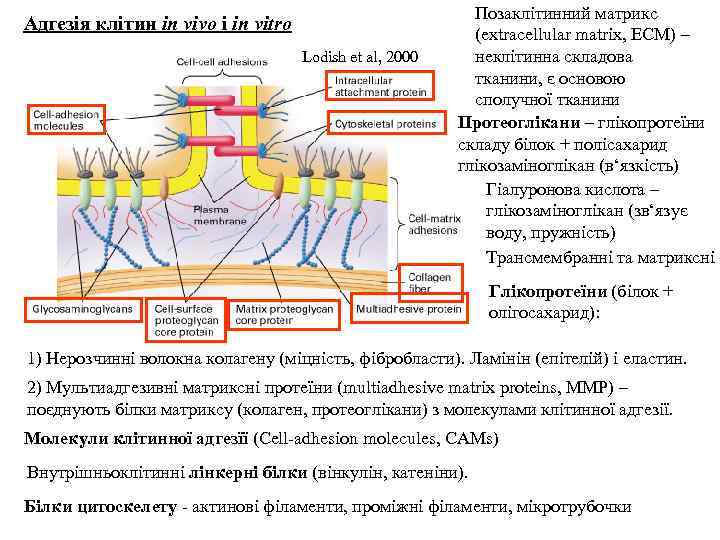 Адгезія клітин in vivo i in vitro Lodish et al, 2000 Позаклітинний матрикс (extracellular matrix, ECM) – неклітинна складова тканини, є основою сполучної тканини Протеоглікани – глікопротеїни складу білок + полісахарид глікозаміноглікан (в‘язкість) Гіалуронова кислота – глікозаміноглікан (зв‘язує воду, пружність) Трансмембранні та матриксні Глікопротеїни (білок + олігосахарид): 1) Нерозчинні волокна колагену (міцність, фібробласти). Ламінін (епітелій) і eластин. 2) Мультиадгезивні матриксні протеїни (multiadhesive matrix proteins, ММР) – поєднують білки матриксу (колаген, протеоглікани) з молекулами клітинної адгезії. Молекули клітинної адгезїї (Cell-adhesion molecules, CAMs) Внутрішньоклітинні лінкерні білки (вінкулін, катеніни). Білки цитоскелету - aктинові філаменти, проміжні філаменти, мікротрубочки
Адгезія клітин in vivo i in vitro Lodish et al, 2000 Позаклітинний матрикс (extracellular matrix, ECM) – неклітинна складова тканини, є основою сполучної тканини Протеоглікани – глікопротеїни складу білок + полісахарид глікозаміноглікан (в‘язкість) Гіалуронова кислота – глікозаміноглікан (зв‘язує воду, пружність) Трансмембранні та матриксні Глікопротеїни (білок + олігосахарид): 1) Нерозчинні волокна колагену (міцність, фібробласти). Ламінін (епітелій) і eластин. 2) Мультиадгезивні матриксні протеїни (multiadhesive matrix proteins, ММР) – поєднують білки матриксу (колаген, протеоглікани) з молекулами клітинної адгезії. Молекули клітинної адгезїї (Cell-adhesion molecules, CAMs) Внутрішньоклітинні лінкерні білки (вінкулін, катеніни). Білки цитоскелету - aктинові філаменти, проміжні філаменти, мікротрубочки
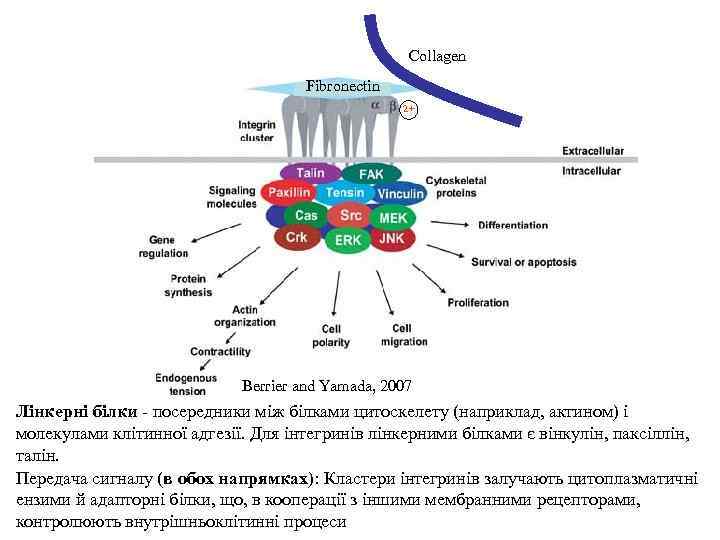 Collagen Fibronectin 2+ Berrier and Yamada, 2007 Лінкерні білки - посередники між білками цитоскелету (наприклад, актином) і молекулами клітинної адгезії. Для інтегринів лінкерними білками є вінкулін, паксіллін, талін. Передача сигналу (в обох напрямках): Кластери інтегринів залучають цитоплазматичні ензими й адапторні білки, що, в кооперації з іншими мембранними рецепторами, контролюють внутрішньоклітинні процеси
Collagen Fibronectin 2+ Berrier and Yamada, 2007 Лінкерні білки - посередники між білками цитоскелету (наприклад, актином) і молекулами клітинної адгезії. Для інтегринів лінкерними білками є вінкулін, паксіллін, талін. Передача сигналу (в обох напрямках): Кластери інтегринів залучають цитоплазматичні ензими й адапторні білки, що, в кооперації з іншими мембранними рецепторами, контролюють внутрішньоклітинні процеси
 Адгезія in vitro Поверхні для прикріплення клітин – скло, пластик, рідше метали. Вимоги до поверхонь: 1) Наявність заряду 2) Гідрофільність (забезпечує розпластаність клітин) Скло – протягом десятиліть найпоширеніший матеріал для виготовлення культурального посуду (in vitro – „на склі“). Особливо хороше прикріплення клітин до боросилікатного скла (висока термостабільність). Вимагає миття з використанням нетоксичних детергентів з наступною стерилізацією. Зараз найчастіше використовують скляні покривні скельця для вирощування клітин. Пластик – найчастіше полістирол (завдяки прозорості, міцності). Зараз – найпоширеніший матеріал для вирощування клітин in vitro. Одноразове використання. Немодифікований полістирол доволі гідрофобний (багато типів клітин не прикріплюються взагалі, інші – погано розпластуються).
Адгезія in vitro Поверхні для прикріплення клітин – скло, пластик, рідше метали. Вимоги до поверхонь: 1) Наявність заряду 2) Гідрофільність (забезпечує розпластаність клітин) Скло – протягом десятиліть найпоширеніший матеріал для виготовлення культурального посуду (in vitro – „на склі“). Особливо хороше прикріплення клітин до боросилікатного скла (висока термостабільність). Вимагає миття з використанням нетоксичних детергентів з наступною стерилізацією. Зараз найчастіше використовують скляні покривні скельця для вирощування клітин. Пластик – найчастіше полістирол (завдяки прозорості, міцності). Зараз – найпоширеніший матеріал для вирощування клітин in vitro. Одноразове використання. Немодифікований полістирол доволі гідрофобний (багато типів клітин не прикріплюються взагалі, інші – погано розпластуються).
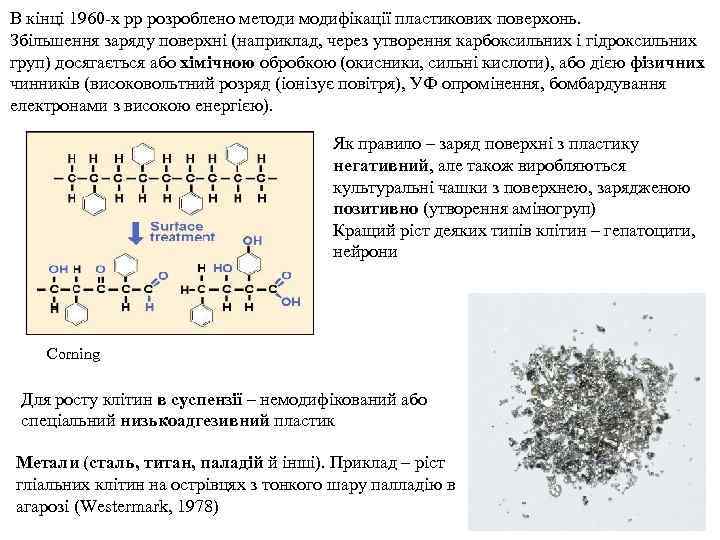 В кінці 1960 -х рр розроблено методи модифікації пластикових поверхонь. Збільшення заряду поверхні (наприклад, через утворення карбоксильних і гідроксильних груп) досягається або хімічною обробкою (окисники, сильні кислоти), або дією фізичних чинників (високовольтний розряд (іонізує повітря), УФ опромінення, бомбардування електронами з високою енергією). Як правило – заряд поверхні з пластику негативний, але також виробляються культуральні чашки з поверхнею, зарядженою позитивно (утворення аміногруп) Кращий ріст деяких типів клітин – гепатоцити, нейрони Corning Для росту клітин в суспензії – немодифікований або спеціальний низькоадгезивний пластик Mетали (сталь, титан, паладій й інші). Приклад – ріст гліальних клітин на острівцях з тонкого шару палладію в агарозі (Westermark, 1978)
В кінці 1960 -х рр розроблено методи модифікації пластикових поверхонь. Збільшення заряду поверхні (наприклад, через утворення карбоксильних і гідроксильних груп) досягається або хімічною обробкою (окисники, сильні кислоти), або дією фізичних чинників (високовольтний розряд (іонізує повітря), УФ опромінення, бомбардування електронами з високою енергією). Як правило – заряд поверхні з пластику негативний, але також виробляються культуральні чашки з поверхнею, зарядженою позитивно (утворення аміногруп) Кращий ріст деяких типів клітин – гепатоцити, нейрони Corning Для росту клітин в суспензії – немодифікований або спеціальний низькоадгезивний пластик Mетали (сталь, титан, паладій й інші). Приклад – ріст гліальних клітин на острівцях з тонкого шару палладію в агарозі (Westermark, 1978)
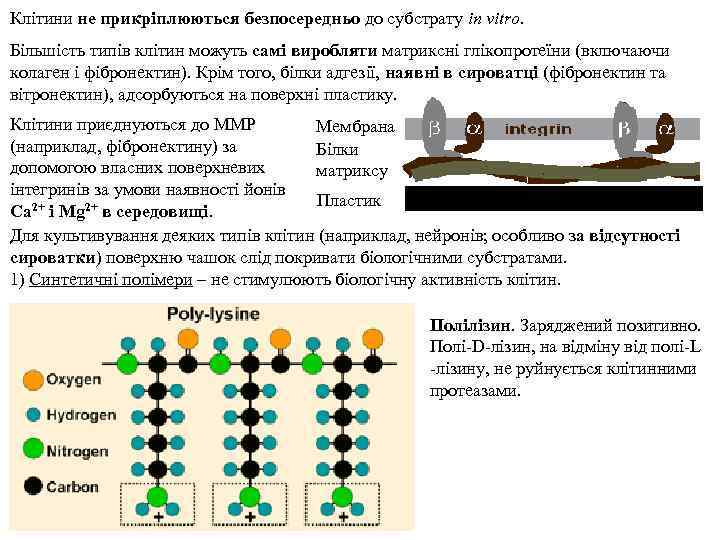 Клітини не прикріплюються безпосередньо до субстрату in vitro. Більшість типів клітин можуть самі виробляти матриксні глікопротеїни (включаючи колаген i фібронектин). Крім того, білки адгезії, наявні в сироватці (фібронектин та вітронектин), адсорбуються на поверхні пластику. Клітини приєднуються до ММР Мембрана (наприклад, фібронектину) за Білки допомогою власних поверхневих матриксу інтегринів за умови наявності йонів Пластик Ca 2+ i Mg 2+ в середовищі. Для культивування деяких типів клітин (наприклад, нейронів; особливо за відсутності сироватки) поверхню чашок слід покривати біологічними субстратами. 1) Синтетичні полімери – не стимулюють біологічну активність клітин. Полілізин. Заряджений позитивно. Полі-D-лізин, на відміну від полі-L -лізину, не руйнується клітинними протеазами.
Клітини не прикріплюються безпосередньо до субстрату in vitro. Більшість типів клітин можуть самі виробляти матриксні глікопротеїни (включаючи колаген i фібронектин). Крім того, білки адгезії, наявні в сироватці (фібронектин та вітронектин), адсорбуються на поверхні пластику. Клітини приєднуються до ММР Мембрана (наприклад, фібронектину) за Білки допомогою власних поверхневих матриксу інтегринів за умови наявності йонів Пластик Ca 2+ i Mg 2+ в середовищі. Для культивування деяких типів клітин (наприклад, нейронів; особливо за відсутності сироватки) поверхню чашок слід покривати біологічними субстратами. 1) Синтетичні полімери – не стимулюють біологічну активність клітин. Полілізин. Заряджений позитивно. Полі-D-лізин, на відміну від полі-L -лізину, не руйнується клітинними протеазами.
 2) Біологічні полімери: колаген (з хвостів щура) желатин (з шкіри свині; продукт часткового гідролізу колагену) ламінін (з саркоми миші EHS (Engelbreth-Holm-Swarm)) вітронектин, фібронектин (з плазми крові) фібриноген (з плазми крові) Іноді – ріст на матриксі, що лишився після видалення (з допомогою Triton X 100) моношару клітин іншого типу, або ріст в умовах кокультури. Колаген I типу з сухожиль, що приєднані до хребців хвоста щура (Strom et al. , 1982). 1. Розрізати свіжовідрізані або заморожені (після відтаювання) хвости щурів поздовжно від основи до кінця. 2. Видалити з хвостів шкіру, кровоносні судини та рештки м‘язевої тканини. 3. Взяти білі колагенові волокна і простерилізувати їх з допомогою УФ. 4. Додати до 1 г колагенових волокон (звичайно з 3 — 4 хвостів) 300 мл 0, 1 М оцтової кислоти і залишити перемішуватись при 4 °С протягом 48 годин. 5. Профільтрувати розчин через 2 — 3 шари стерильної марлі. 6. Розбавити отриманий розчин в 20 разів бідистильованою водою. 7. Покрити розчином дно культурального посуду і висушути на повітрі (1 — 2 дні при температурі, не вищiй за 37 °С). Інші субстрати, як правило – інкубувати ніч при кімнатній температурі або 4°С (1 -3 години при 37 °С), потім видалити розчин і ретельно висушити.
2) Біологічні полімери: колаген (з хвостів щура) желатин (з шкіри свині; продукт часткового гідролізу колагену) ламінін (з саркоми миші EHS (Engelbreth-Holm-Swarm)) вітронектин, фібронектин (з плазми крові) фібриноген (з плазми крові) Іноді – ріст на матриксі, що лишився після видалення (з допомогою Triton X 100) моношару клітин іншого типу, або ріст в умовах кокультури. Колаген I типу з сухожиль, що приєднані до хребців хвоста щура (Strom et al. , 1982). 1. Розрізати свіжовідрізані або заморожені (після відтаювання) хвости щурів поздовжно від основи до кінця. 2. Видалити з хвостів шкіру, кровоносні судини та рештки м‘язевої тканини. 3. Взяти білі колагенові волокна і простерилізувати їх з допомогою УФ. 4. Додати до 1 г колагенових волокон (звичайно з 3 — 4 хвостів) 300 мл 0, 1 М оцтової кислоти і залишити перемішуватись при 4 °С протягом 48 годин. 5. Профільтрувати розчин через 2 — 3 шари стерильної марлі. 6. Розбавити отриманий розчин в 20 разів бідистильованою водою. 7. Покрити розчином дно культурального посуду і висушути на повітрі (1 — 2 дні при температурі, не вищiй за 37 °С). Інші субстрати, як правило – інкубувати ніч при кімнатній температурі або 4°С (1 -3 години при 37 °С), потім видалити розчин і ретельно висушити.
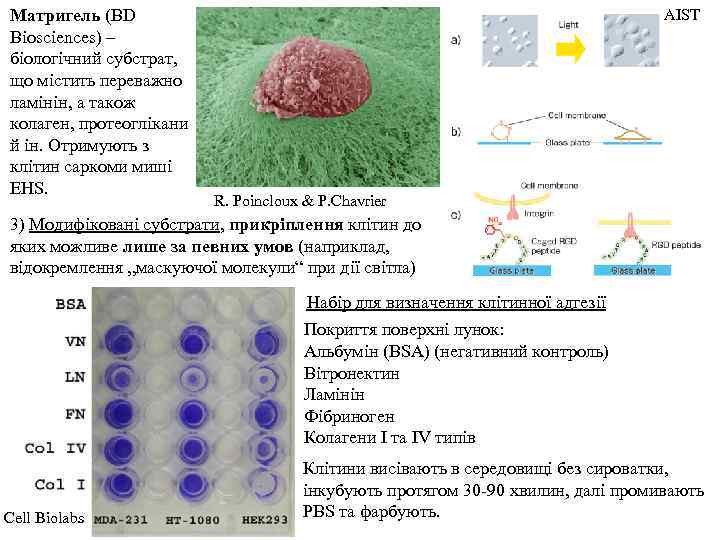 Матригель (BD Biosciences) – біологічний субстрат, що містить переважно ламінін, а також колаген, протеоглікани й ін. Отримують з клітин саркоми миші EHS. AIST R. Poincloux & P. Chavrier 3) Модифіковані субстрати, прикріплення клітин до яких можливе лише за певних умов (наприклад, відокремлення „маскуючої молекули“ при дії світла) Набір для визначення клітинної адгезії Покриття поверхні лунок: Альбумін (BSA) (негативний контроль) Вітронектин Ламінін Фібриноген Колагени І та ІV типів Cell Biolabs Клітини висівають в середовищі без сироватки, інкубують протягом 30 -90 хвилин, далі промивають PBS та фарбують.
Матригель (BD Biosciences) – біологічний субстрат, що містить переважно ламінін, а також колаген, протеоглікани й ін. Отримують з клітин саркоми миші EHS. AIST R. Poincloux & P. Chavrier 3) Модифіковані субстрати, прикріплення клітин до яких можливе лише за певних умов (наприклад, відокремлення „маскуючої молекули“ при дії світла) Набір для визначення клітинної адгезії Покриття поверхні лунок: Альбумін (BSA) (негативний контроль) Вітронектин Ламінін Фібриноген Колагени І та ІV типів Cell Biolabs Клітини висівають в середовищі без сироватки, інкубують протягом 30 -90 хвилин, далі промивають PBS та фарбують.
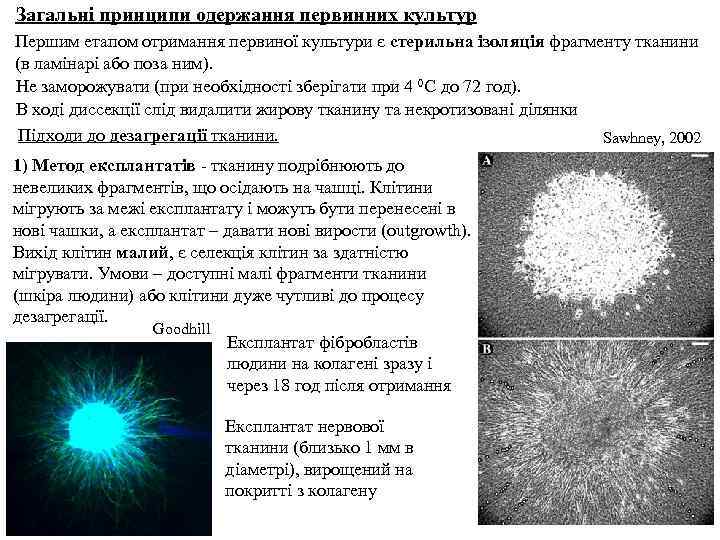 Загальні принципи одержання первинних культур Першим етапом отримання первиної культури є стерильна ізоляція фрагменту тканини (в ламінарі або поза ним). Не заморожувати (при необхідності зберігати при 4 0 С до 72 год). В ході диссекції слід видалити жирову тканину та некротизовані ділянки Підходи до дезагрегації тканини. Sawhney, 2002 1) Метод експлантатів - тканину подрібнюють до невеликих фрагментів, що осідають на чашці. Клітини мігрують за межі експлантату і можуть бути перенесені в нові чашки, а експлантат – давати нові вирости (outgrowth). Вихід клітин малий, є селекція клітин за здатністю мігрувати. Умови – доступні малі фрагменти тканини (шкіра людини) або клітини дуже чутливі до процесу дезагрегації. Goodhill Експлантат фібробластів людини на колагені зразу і через 18 год після отримання Експлантат нервової тканини (близько 1 мм в діаметрі), вирощений на покритті з колагену
Загальні принципи одержання первинних культур Першим етапом отримання первиної культури є стерильна ізоляція фрагменту тканини (в ламінарі або поза ним). Не заморожувати (при необхідності зберігати при 4 0 С до 72 год). В ході диссекції слід видалити жирову тканину та некротизовані ділянки Підходи до дезагрегації тканини. Sawhney, 2002 1) Метод експлантатів - тканину подрібнюють до невеликих фрагментів, що осідають на чашці. Клітини мігрують за межі експлантату і можуть бути перенесені в нові чашки, а експлантат – давати нові вирости (outgrowth). Вихід клітин малий, є селекція клітин за здатністю мігрувати. Умови – доступні малі фрагменти тканини (шкіра людини) або клітини дуже чутливі до процесу дезагрегації. Goodhill Експлантат фібробластів людини на колагені зразу і через 18 год після отримання Експлантат нервової тканини (близько 1 мм в діаметрі), вирощений на покритті з колагену
 2) Механічна дезагрегація м‘яких тканин (тимус, селезінка, деякі ембріональні органи та деякі пухлини) – фільтрація через нейлонову сітку, шприци. Швидке отримання культури, проте значне пошкодження клітин. Подрібнення до окремих клітин не обов‘язкове.
2) Механічна дезагрегація м‘яких тканин (тимус, селезінка, деякі ембріональні органи та деякі пухлини) – фільтрація через нейлонову сітку, шприци. Швидке отримання культури, проте значне пошкодження клітин. Подрібнення до окремих клітин не обов‘язкове.
 3) Для ферментативної дезагрегації може використовуватися ціла низка ферментів, окремо або в комбінаціях (трипсин, бактерійні протеази - коллагеназа, проназа, диспаза та ін. ). Неочищені („crude“) препарати часто ефективніші (домішки протеаз), проте можуть бути токсичними. Завжди потребують попереднього тестування. Найчастіше використовують трипсин (0, 25% неочищений чи 0, 01 -0, 05 % очищений). Часто в присутності хелаторів Ca 2+ (EDTA). „Тепла трипсинізація“ – швидка дезагрегація великих фрагментів тканини (цілі ембріони миші). Інкубація 3 -4 год 37 0 С в середовищі, що містить трипсин, зі струшуванням. Збирати середовище з клітинами і додавати нове кожні 30 хвилин. „Холодна трипсинізація“ – клітини краще виживають, тому зразки меншого розміру. Інкубація 6 -18 год. 4 0 С в середовищі, що містить трипсин (без струшування), потім 30 хв. 37 0 С, далі суспендувати в культуральному середовищі. Трипсин може пошкоджувати клітини (епітеліальні) або бути малоефективним (сполучна тканина). Тоді - колагеназа (200 -2000 U/мл) (екзотоксин Clostridium histolyticum, потребує Ca 2+). Гірша дезагрегація клітин, порівняно з трипсином, проте краще виживання 4 -48 год. при 37 0 С без струшування, далі суспендувати в культуральному середовищі. Іноді в поєднанні з протеазами використовують також гiалуронiдазаи (існують бактерійні, тестикулярнi, слини п‘явок), ДНКазу та ін. Після дезагрегації ензим слід видалити шляхом м‘якого центрифугування
3) Для ферментативної дезагрегації може використовуватися ціла низка ферментів, окремо або в комбінаціях (трипсин, бактерійні протеази - коллагеназа, проназа, диспаза та ін. ). Неочищені („crude“) препарати часто ефективніші (домішки протеаз), проте можуть бути токсичними. Завжди потребують попереднього тестування. Найчастіше використовують трипсин (0, 25% неочищений чи 0, 01 -0, 05 % очищений). Часто в присутності хелаторів Ca 2+ (EDTA). „Тепла трипсинізація“ – швидка дезагрегація великих фрагментів тканини (цілі ембріони миші). Інкубація 3 -4 год 37 0 С в середовищі, що містить трипсин, зі струшуванням. Збирати середовище з клітинами і додавати нове кожні 30 хвилин. „Холодна трипсинізація“ – клітини краще виживають, тому зразки меншого розміру. Інкубація 6 -18 год. 4 0 С в середовищі, що містить трипсин (без струшування), потім 30 хв. 37 0 С, далі суспендувати в культуральному середовищі. Трипсин може пошкоджувати клітини (епітеліальні) або бути малоефективним (сполучна тканина). Тоді - колагеназа (200 -2000 U/мл) (екзотоксин Clostridium histolyticum, потребує Ca 2+). Гірша дезагрегація клітин, порівняно з трипсином, проте краще виживання 4 -48 год. при 37 0 С без струшування, далі суспендувати в культуральному середовищі. Іноді в поєднанні з протеазами використовують також гiалуронiдазаи (існують бактерійні, тестикулярнi, слини п‘явок), ДНКазу та ін. Після дезагрегації ензим слід видалити шляхом м‘якого центрифугування
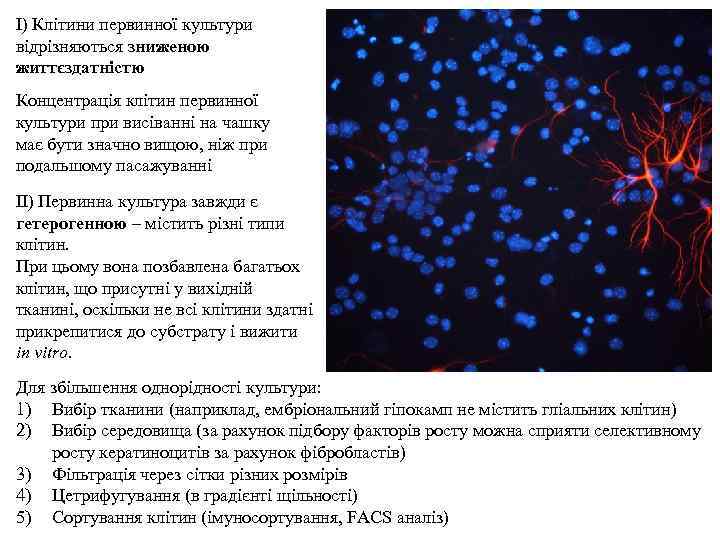 І) Клітини первинної культури відрізняються зниженою життєздатністю Концентрація клітин первинної культури при висіванні на чашку має бути значно вищою, ніж при подальшому пасажуванні ІІ) Первинна культура завжди є гетерогенною – містить різні типи клітин. При цьому вона позбавлена багатьох клітин, що присутні у вихідній тканині, оскільки не всі клітини здатні прикрепитися до субстрату і вижити in vitro. Для збільшення однорідності культури: 1) Вибір тканини (наприклад, ембріональний гіпокамп не містить гліальних клітин) 2) Вибір середовища (за рахунок підбору факторів росту можна сприяти селективному росту кератиноцитів за рахунок фібробластів) 3) Фільтрація через сітки різних розмірів 4) Цетрифугування (в градієнті щільності) 5) Сортування клітин (імуносортування, FACS аналіз)
І) Клітини первинної культури відрізняються зниженою життєздатністю Концентрація клітин первинної культури при висіванні на чашку має бути значно вищою, ніж при подальшому пасажуванні ІІ) Первинна культура завжди є гетерогенною – містить різні типи клітин. При цьому вона позбавлена багатьох клітин, що присутні у вихідній тканині, оскільки не всі клітини здатні прикрепитися до субстрату і вижити in vitro. Для збільшення однорідності культури: 1) Вибір тканини (наприклад, ембріональний гіпокамп не містить гліальних клітин) 2) Вибір середовища (за рахунок підбору факторів росту можна сприяти селективному росту кератиноцитів за рахунок фібробластів) 3) Фільтрація через сітки різних розмірів 4) Цетрифугування (в градієнті щільності) 5) Сортування клітин (імуносортування, FACS аналіз)
 ІІІ) Клітини первинних культур для оптимальної життєдіяльності потребують середовищ, багатих на поживні речовини Середовище М 199 (1950 р) – широкий спектр поживних речовин у невисокій концентрації Крім компонентів, наявних в МЕМ, також містить 1) Замінимі амінокислоти й похідні амінокислот (глутатіон й ін. ) 2) Додаткові вітаміни й коферменти (біотин, аскорбат, жиророзчинні А, Е, К, D й ін. ) 3) Додаткові вуглеводи (рибоза, дезоксирибоза) 4) Попередники нуклеїнових кислот 5) Мікроелементи (Fe) 6) Холестерин IV) Клітини в первинних культурах часто не здатні до проліферації. Наприклад, первинні лімфоцити (при дії мутагенів – лише кілька поділів), первинні нейрони, первинні гепатоцити. Якщо клітини в первинній культурі проліферують (наприклад, фібробласти), відбувається селекція одних клітинних популяцій (менш диференційованих) за рахунок інших. Підтримуючі середовища – для підтримання життєздатності і функціональної активності клітин (до кількох тижднів), а не розмноження (відсутність або низький вміст сироватки) М 199 за відсутності сироватки – підтримуюче. За наявності сироватки або замінюючих її білків М 199 може бути використана як ростове середовище для клітин, що швидко розмножуються. При відсутності сироватки, для кожного типу клітин в первинній культурі свої додаткові компоненти: гормони (інсулін, стероїдні гормони, трийодтиронін), фактори росту (нервів, епідермісу, фібробластів), транспортні білки (трансферрин, альбумін), фактори прикріплення (фетуїн, фібронектин) й ін.
ІІІ) Клітини первинних культур для оптимальної життєдіяльності потребують середовищ, багатих на поживні речовини Середовище М 199 (1950 р) – широкий спектр поживних речовин у невисокій концентрації Крім компонентів, наявних в МЕМ, також містить 1) Замінимі амінокислоти й похідні амінокислот (глутатіон й ін. ) 2) Додаткові вітаміни й коферменти (біотин, аскорбат, жиророзчинні А, Е, К, D й ін. ) 3) Додаткові вуглеводи (рибоза, дезоксирибоза) 4) Попередники нуклеїнових кислот 5) Мікроелементи (Fe) 6) Холестерин IV) Клітини в первинних культурах часто не здатні до проліферації. Наприклад, первинні лімфоцити (при дії мутагенів – лише кілька поділів), первинні нейрони, первинні гепатоцити. Якщо клітини в первинній культурі проліферують (наприклад, фібробласти), відбувається селекція одних клітинних популяцій (менш диференційованих) за рахунок інших. Підтримуючі середовища – для підтримання життєздатності і функціональної активності клітин (до кількох тижднів), а не розмноження (відсутність або низький вміст сироватки) М 199 за відсутності сироватки – підтримуюче. За наявності сироватки або замінюючих її білків М 199 може бути використана як ростове середовище для клітин, що швидко розмножуються. При відсутності сироватки, для кожного типу клітин в первинній культурі свої додаткові компоненти: гормони (інсулін, стероїдні гормони, трийодтиронін), фактори росту (нервів, епідермісу, фібробластів), транспортні білки (трансферрин, альбумін), фактори прикріплення (фетуїн, фібронектин) й ін.
 Первинна культура гепатоцитів дорослого щура 1953 - Anderson N G. The mass isolation of whole cells from rat liver. Science Клітини практично були позбавлені нормальних метаболічних властивостей через перфузію печінки, що проводилася під великим тиском (проблема - пошкодження клітинних мембран) Х. Кребс (Нобелівська премія 1953) вважав: „якщо навіть ізольовані фрагменти печінки не можуть функціонувати in vitro подібно до цілої перфузованої печінки, малоймовірно, що суспензія окремих клітин здатна на це“. Проте саме в лабораторії Кребса були розроблені м‘які методи перфузії печінки 1967 - Howard R B et al. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J. Cell Biol. Обробка шматочків печінки колагеназою давала можливість отримати ізольовані інтактні гепатоцити (проблема - низький вихід клітин) 1969 - Berry M N & Friend D S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J. Cell Biol. Культура інтактних гепатоцитів з печінки щура методом перфузії середовищем, вільним від Ca 2+, що містить колагеназу. М. Беррі: „Це був один з дуже небагатьох випадків в моїй науковій кар‘єрі, коли логіка себе виправдала!“ В більшості випадків ізольовані гепатоцити мали ті ж метаболічні властивості, що й клітини печінки in vivo.
Первинна культура гепатоцитів дорослого щура 1953 - Anderson N G. The mass isolation of whole cells from rat liver. Science Клітини практично були позбавлені нормальних метаболічних властивостей через перфузію печінки, що проводилася під великим тиском (проблема - пошкодження клітинних мембран) Х. Кребс (Нобелівська премія 1953) вважав: „якщо навіть ізольовані фрагменти печінки не можуть функціонувати in vitro подібно до цілої перфузованої печінки, малоймовірно, що суспензія окремих клітин здатна на це“. Проте саме в лабораторії Кребса були розроблені м‘які методи перфузії печінки 1967 - Howard R B et al. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J. Cell Biol. Обробка шматочків печінки колагеназою давала можливість отримати ізольовані інтактні гепатоцити (проблема - низький вихід клітин) 1969 - Berry M N & Friend D S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J. Cell Biol. Культура інтактних гепатоцитів з печінки щура методом перфузії середовищем, вільним від Ca 2+, що містить колагеназу. М. Беррі: „Це був один з дуже небагатьох випадків в моїй науковій кар‘єрі, коли логіка себе виправдала!“ В більшості випадків ізольовані гепатоцити мали ті ж метаболічні властивості, що й клітини печінки in vivo.
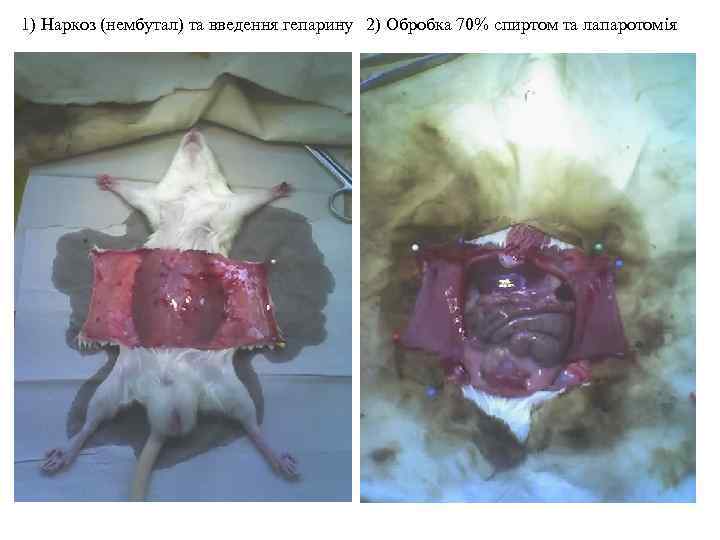 1) Наркоз (нембутал) та введення гепарину 2) Обробка 70% спиртом та лапаротомія
1) Наркоз (нембутал) та введення гепарину 2) Обробка 70% спиртом та лапаротомія
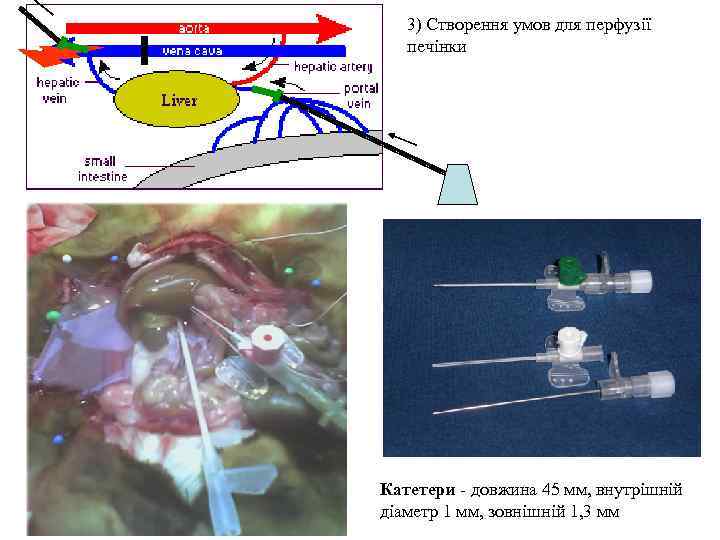 3) Створення умов для перфузії печінки Катетери - довжина 45 мм, внутрішній діаметр 1 мм, зовнішній 1, 3 мм
3) Створення умов для перфузії печінки Катетери - довжина 45 мм, внутрішній діаметр 1 мм, зовнішній 1, 3 мм
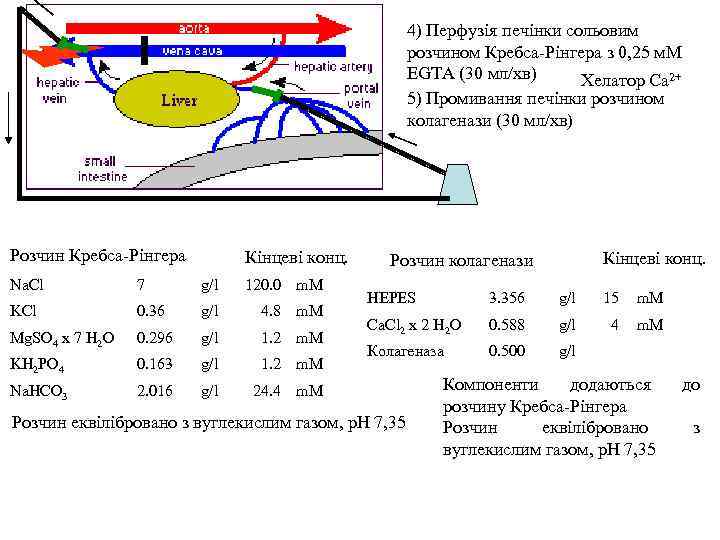 4) Перфузія печінки сольовим розчином Кребса-Рінгера з 0, 25 м. М EGTA (30 мл/хв) Хелатор Ca 2+ 5) Промивання печінки розчином колагенази (30 мл/хв) Розчин Кребса-Рінгера Кінцеві конц. Na. Cl 7 g/l 120. 0 m. M KCl 0. 36 g/l 4. 8 m. M Mg. SO 4 x 7 H 2 O 0. 296 g/l 1. 2 m. M KH 2 PO 4 0. 163 g/l 1. 2 m. M Na. HCO 3 2. 016 g/l Кінцеві конц. Розчин колагенази 24. 4 m. M HEPES 3. 356 g/l 15 m. M Ca. Cl 2 x 2 H 2 O 0. 588 g/l 4 m. M Колагеназа 0. 500 g/l Розчин еквілібровано з вуглекислим газом, p. H 7, 35 Компоненти додаються розчину Кребса-Рінгера Розчин еквілібровано вуглекислим газом, p. H 7, 35 до з
4) Перфузія печінки сольовим розчином Кребса-Рінгера з 0, 25 м. М EGTA (30 мл/хв) Хелатор Ca 2+ 5) Промивання печінки розчином колагенази (30 мл/хв) Розчин Кребса-Рінгера Кінцеві конц. Na. Cl 7 g/l 120. 0 m. M KCl 0. 36 g/l 4. 8 m. M Mg. SO 4 x 7 H 2 O 0. 296 g/l 1. 2 m. M KH 2 PO 4 0. 163 g/l 1. 2 m. M Na. HCO 3 2. 016 g/l Кінцеві конц. Розчин колагенази 24. 4 m. M HEPES 3. 356 g/l 15 m. M Ca. Cl 2 x 2 H 2 O 0. 588 g/l 4 m. M Колагеназа 0. 500 g/l Розчин еквілібровано з вуглекислим газом, p. H 7, 35 Компоненти додаються розчину Кребса-Рінгера Розчин еквілібровано вуглекислим газом, p. H 7, 35 до з
 6) Перенесення печінки в середовище Середовище М 199 і механічна дезагрегація з видаленням сполучної тканини Порошок M 199 7) Видалення фрагментів печінкової капсули, Глюкоза агрегатів клітин і сполучної тканини фільтрацією через нейлонову сітку (пори 79 µm) HEPES 8) Видалення непаренхимних клітин і клітинного Na. HCO 3 дебрису послідовним центрифугуванням (20 g) 9) Підрахунок кількості клітин і висівання на чашку (1 -2 x 106/60 мм чашку) 10) До середовища додають eмбріональну сироватку теляти (4%), 10 -7 M дексаметазон, 10 -9 M інсулін i пеніцилін (100 U/ml)/ стрептоміцин сульфат (50 µg/ ml) Альбумін сироватки теляти Кінцеві конц. 9. 8 g/l 1. 1 g/l 5. 5 м. М 3. 6 g/l 15 м. М 1. 5 g/l 18 м. М 4. 0 g/l 0. 4 м. М Kietzmann et al, 2007 Через 4 год. після ізоляції повне середовище замінюють на середовище без сироватки За таких умов клітини виживають кілька днів. Якщо гепатоцити вирощують на поверхні, покритій матриксними білками, вони можуть виживати кілька тижднів, проте втрачають властивості диференційованих клітин. В присутності EGF та пірувату (або нікотинаміду) можуть відбутися 1 -3 поділи
6) Перенесення печінки в середовище Середовище М 199 і механічна дезагрегація з видаленням сполучної тканини Порошок M 199 7) Видалення фрагментів печінкової капсули, Глюкоза агрегатів клітин і сполучної тканини фільтрацією через нейлонову сітку (пори 79 µm) HEPES 8) Видалення непаренхимних клітин і клітинного Na. HCO 3 дебрису послідовним центрифугуванням (20 g) 9) Підрахунок кількості клітин і висівання на чашку (1 -2 x 106/60 мм чашку) 10) До середовища додають eмбріональну сироватку теляти (4%), 10 -7 M дексаметазон, 10 -9 M інсулін i пеніцилін (100 U/ml)/ стрептоміцин сульфат (50 µg/ ml) Альбумін сироватки теляти Кінцеві конц. 9. 8 g/l 1. 1 g/l 5. 5 м. М 3. 6 g/l 15 м. М 1. 5 g/l 18 м. М 4. 0 g/l 0. 4 м. М Kietzmann et al, 2007 Через 4 год. після ізоляції повне середовище замінюють на середовище без сироватки За таких умов клітини виживають кілька днів. Якщо гепатоцити вирощують на поверхні, покритій матриксними білками, вони можуть виживати кілька тижднів, проте втрачають властивості диференційованих клітин. В присутності EGF та пірувату (або нікотинаміду) можуть відбутися 1 -3 поділи
 Первинна культура ембріональних нейронів миші з гіпокампу Первинні культури, отримані з ембріонів – тканина легше дезагрегує, клітини більш життєздатні, часто краще проліферують (наприклад, фібробласти). Оптимальний термін для одержання клітинних культур з ембріона мишi становить 13 діб, коли ембріон є вже достатньо великим за розмірами, але все ще містить значну кількість недиференційованої мезенхіми Вагітність у миші - 19 -21 доба
Первинна культура ембріональних нейронів миші з гіпокампу Первинні культури, отримані з ембріонів – тканина легше дезагрегує, клітини більш життєздатні, часто краще проліферують (наприклад, фібробласти). Оптимальний термін для одержання клітинних культур з ембріона мишi становить 13 діб, коли ембріон є вже достатньо великим за розмірами, але все ще містить значну кількість недиференційованої мезенхіми Вагітність у миші - 19 -21 доба
 Цервікальна дислокація
Цервікальна дислокація
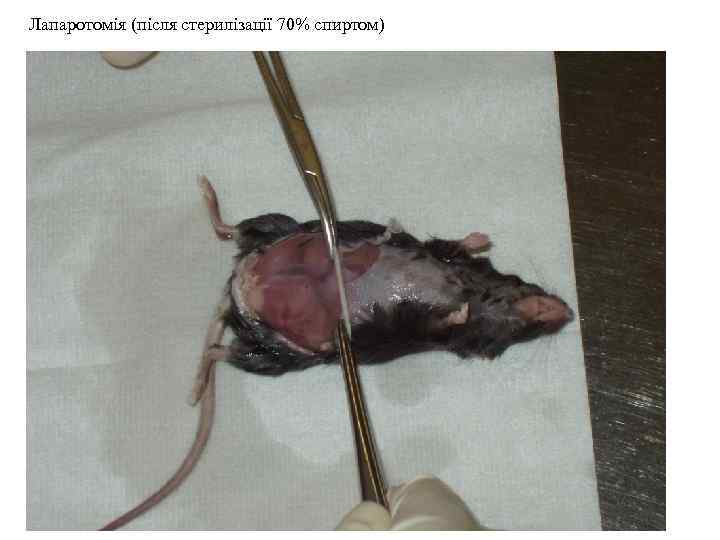 Лапаротомія (після стерилізації 70% спиртом)
Лапаротомія (після стерилізації 70% спиртом)
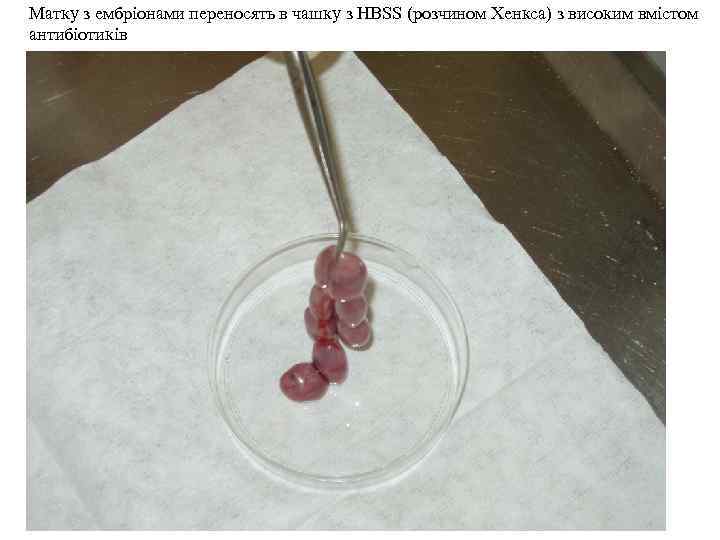 Матку з ембріонами переносять в чашку з HBSS (розчином Хенкса) з високим вмістом антибіотиків
Матку з ембріонами переносять в чашку з HBSS (розчином Хенкса) з високим вмістом антибіотиків
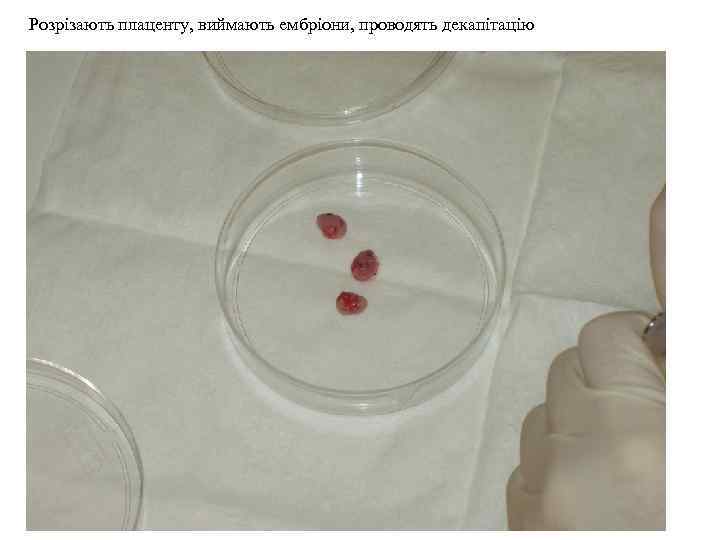 Розрізають плаценту, виймають ембріони, проводять декапітацію
Розрізають плаценту, виймають ембріони, проводять декапітацію
 Відрізані голови переносять в новій чашці з HBSS під ламінарний бокс
Відрізані голови переносять в новій чашці з HBSS під ламінарний бокс
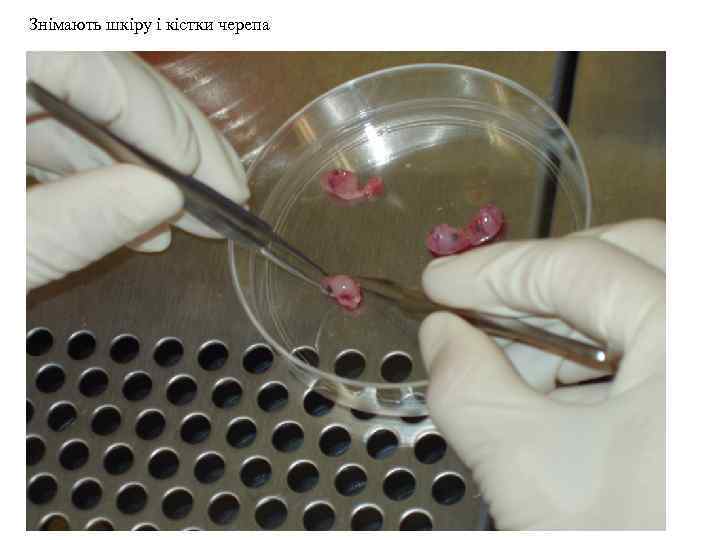 Знімають шкіру і кістки черепа
Знімають шкіру і кістки черепа
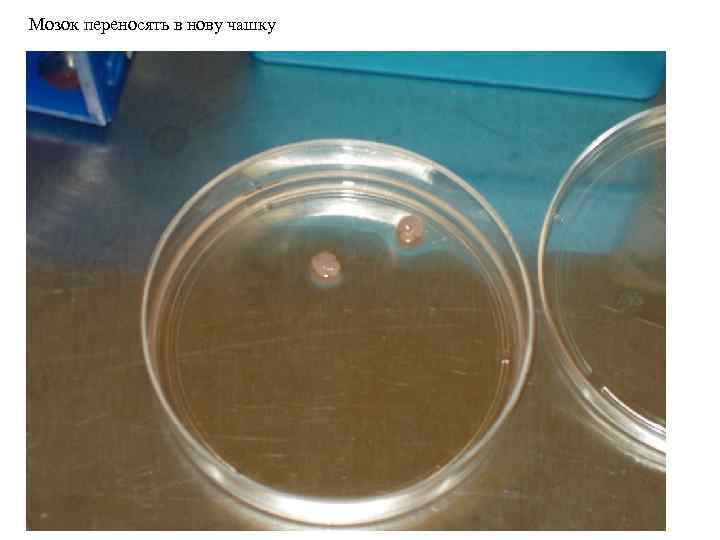 Мозок переносять в нову чашку
Мозок переносять в нову чашку
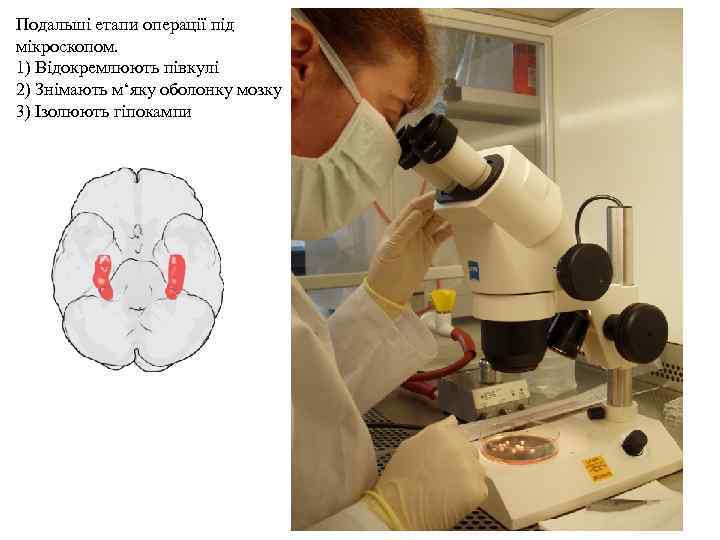 Подальші етапи операції під мікроскопом. 1) Відокремлюють півкулі 2) Знімають м‘яку оболонку мозку 3) Ізолюють гіпокампи
Подальші етапи операції під мікроскопом. 1) Відокремлюють півкулі 2) Знімають м‘яку оболонку мозку 3) Ізолюють гіпокампи
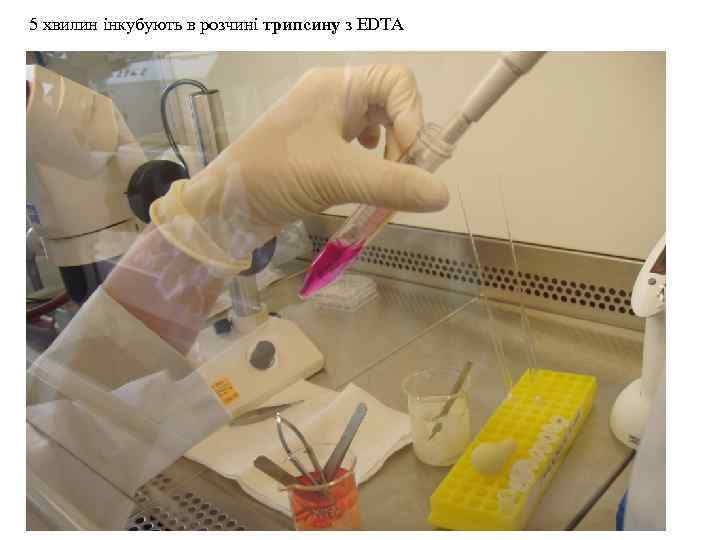 5 хвилин інкубують в розчині трипсину з EDTA
5 хвилин інкубують в розчині трипсину з EDTA
 Гіпокампи двічі промивають в розчині HBSS
Гіпокампи двічі промивають в розчині HBSS
 Суспендують в середовищі МЕМ з допомогою пастерівської піпетки
Суспендують в середовищі МЕМ з допомогою пастерівської піпетки
 Культивують 25 x 103/0, 5 мл (спочатку в краплі, через 1 годину додають середовище)
Культивують 25 x 103/0, 5 мл (спочатку в краплі, через 1 годину додають середовище)
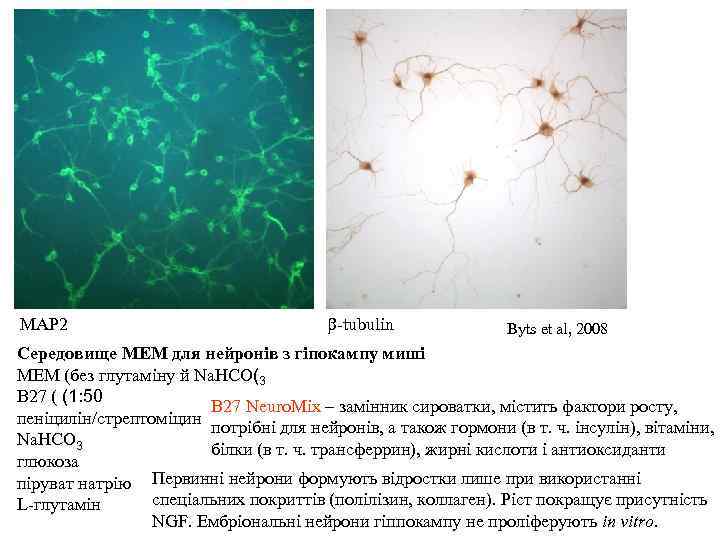 MAP 2 b-tubulin Byts et al, 2008 Середовище MEM для нейронів з гіпокампу миші MEM (без глутаміну й Na. HCO(3 B 27 ( (1: 50 B 27 Neuro. Mix – замінник сироватки, містить фактори росту, пеніцилін/стрептоміцин потрібні для нейронів, а також гормони (в т. ч. інсулін), вітаміни, Na. HCO 3 білки (в т. ч. трансферрин), жирні кислоти і антиоксиданти глюкоза піруват натрію Первинні нейрони формують відростки лише при використанні спеціальних покриттів (полілізин, коллаген). Ріст покращує присутність L-глутамін NGF. Ембріональні нейрони гіппокампу не проліферують in vitro.
MAP 2 b-tubulin Byts et al, 2008 Середовище MEM для нейронів з гіпокампу миші MEM (без глутаміну й Na. HCO(3 B 27 ( (1: 50 B 27 Neuro. Mix – замінник сироватки, містить фактори росту, пеніцилін/стрептоміцин потрібні для нейронів, а також гормони (в т. ч. інсулін), вітаміни, Na. HCO 3 білки (в т. ч. трансферрин), жирні кислоти і антиоксиданти глюкоза піруват натрію Первинні нейрони формують відростки лише при використанні спеціальних покриттів (полілізин, коллаген). Ріст покращує присутність L-глутамін NGF. Ембріональні нейрони гіппокампу не проліферують in vitro.
 Первинна культура тимоцитів щура (суспензійна культура): 1) Декапітація щура
Первинна культура тимоцитів щура (суспензійна культура): 1) Декапітація щура
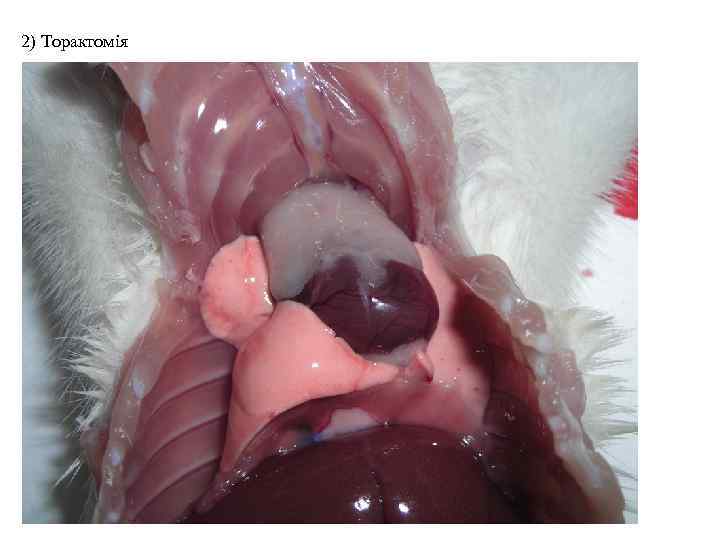 2) Торактомія
2) Торактомія
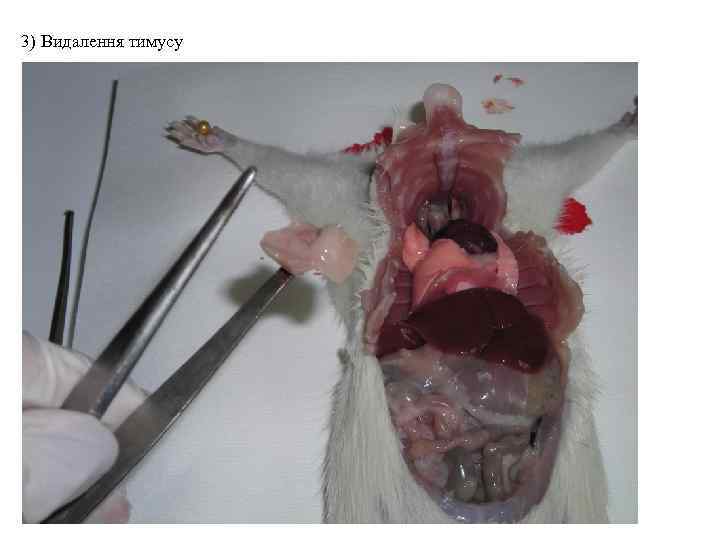 3) Видалення тимусу
3) Видалення тимусу
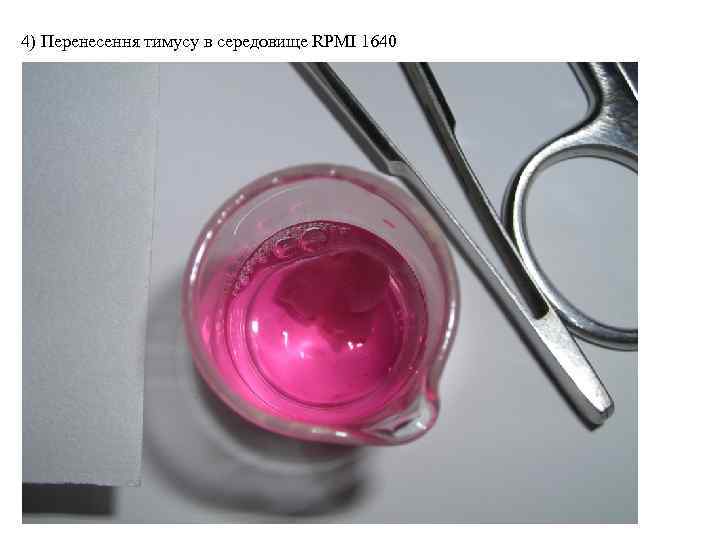 4) Перенесення тимусу в середовище RPMI 1640
4) Перенесення тимусу в середовище RPMI 1640
 4) Перенесення тимусу в середовище RPMI 1640 Середовище RPMI 1640 Низький вміст Ca 2+ і Mg 2+ При культивуванні тимоцитів перед використанням додаються: 10% ембріональна сироватка теляти 4 m. M глутамін 100 U/ml пеніцилін 75 µg/ml стрептоміцин сульфат
4) Перенесення тимусу в середовище RPMI 1640 Середовище RPMI 1640 Низький вміст Ca 2+ і Mg 2+ При культивуванні тимоцитів перед використанням додаються: 10% ембріональна сироватка теляти 4 m. M глутамін 100 U/ml пеніцилін 75 µg/ml стрептоміцин сульфат
 5) Механічна гомогенізація. Видалення фрагментів капсули, клітин епітелію і сполучної тканини фільтрацією через нейлонову сітку
5) Механічна гомогенізація. Видалення фрагментів капсули, клітин епітелію і сполучної тканини фільтрацією через нейлонову сітку
 6) Центрифугація двічі (1000 - 1500 rpm, 100 - 200 g, 5 хв. ) 7) Підрахунок кількості клітин і висівання в лунку (1 -5 x 106/мл)
6) Центрифугація двічі (1000 - 1500 rpm, 100 - 200 g, 5 хв. ) 7) Підрахунок кількості клітин і висівання в лунку (1 -5 x 106/мл)
 Первинна культура фібробластів людини Отримання первинної культури фібробластів людини методом експлантатів. 1. Вирізати шматочок шкіри (без волосся, мінімально кератинізований) 2. Перенести на культуральну чашку, подрібнити ножицями (до бл. 1 мм 3), промити в забуференому фізіологічному розчині, розповсюдити по поверхні чашки, 3. Кожний шматок покрити краплею середовища DMEM з сироваткою (40 -50%) і антибіотиками та iнкубувати ніч для повного прикріплення 4. Додати більшу кількість середовища (3 мл на 6 см чашку) 5. Культивувати до формування моношару (приблизно тиждень). Фібробласти шкіри Scien. Cell Research Laboratories Фібробласти cерця людини Розроблені методи отримання первинних культур людини для більшості типів клітин. Проте найпоширеніші два типи - лімфоцити і фібробласти шкіри.
Первинна культура фібробластів людини Отримання первинної культури фібробластів людини методом експлантатів. 1. Вирізати шматочок шкіри (без волосся, мінімально кератинізований) 2. Перенести на культуральну чашку, подрібнити ножицями (до бл. 1 мм 3), промити в забуференому фізіологічному розчині, розповсюдити по поверхні чашки, 3. Кожний шматок покрити краплею середовища DMEM з сироваткою (40 -50%) і антибіотиками та iнкубувати ніч для повного прикріплення 4. Додати більшу кількість середовища (3 мл на 6 см чашку) 5. Культивувати до формування моношару (приблизно тиждень). Фібробласти шкіри Scien. Cell Research Laboratories Фібробласти cерця людини Розроблені методи отримання первинних культур людини для більшості типів клітин. Проте найпоширеніші два типи - лімфоцити і фібробласти шкіри.


