11. Очистка сточных вод адсорбцией.pptx
- Количество слайдов: 39

Очистка сточных вод адсорбцией. Ионный обмен в растворах сточных вод

Сорбция – это поглощение одного вещества из окр. среды др. в-вом: тв. телом или жидкостью. Сорбент – поглощающее в-во (тело), а поглощаемое – сорбат. По механизму сорбции различают адсорбцию, абсорбцию, хемосорбцию и капилл. конденсацию. Абсорбция – поглощение всей массой сорбента. Адсорбция − поглощение пов-стью сорбента. Хемосорбция − сорбция с хим. взаим-вием.
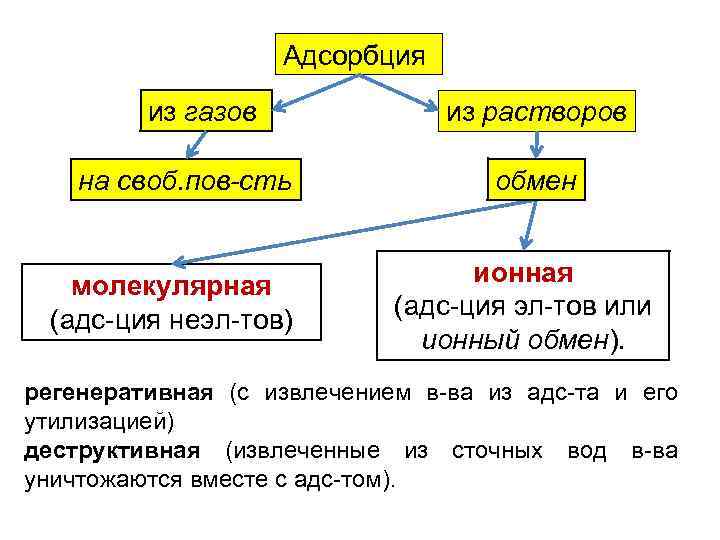
Адсорбция из газов на своб. пов-сть молекулярная (адс-ция неэл-тов) из растворов обмен ионная (адс-ция эл-тов или ионный обмен). регенеративная (с извлечением в-ва из адс-та и его утилизацией) деструктивная (извлеченные из сточных вод в-ва уничтожаются вместе с адс-том).

Адсорбция используется для глубокой очистки сточных вод от растворенных орг. веществ при их отн. невысокой конц-ции. Адсорбция эффективна для извлечения ценных в-в с целью их регенерации, для удаления токсичных в-в, препятствующих биологической очистке, для глубокой очистки сточных вод в системах оборотного водоснабжения. Её применяют для обезвреживания сточных вод от соед-ний ароматических (фенолы) и непред. алиф. или гидрофобных (ех, содержащих хлор или нитрогруппы), гербицидов, пестицидов, ПАВ, красителей, неэл-тов или слабых эл-тов.

Эфф-сть адс-ной очистки (до 80 - 95 %) зависит от хим. природы адсорбента, доступности и величины адс-ной пов-сти, от хим. строения и состояния в-ва в водном р-ре. Преимущество метода – возможность сорбции в-в из многокомпонентных смесей, в т. ч. из малоконцентрированных сточных вод, высокая эффективность очистки. При наличии в сточных водах только неорган. соедний, а также низших одноатомных спиртов метод молек. адс-ции не применим. Удаление неорг. в-в произв-ся с помощью ионного обмена. Ионообменная очистка применяется для извлечения из сточных вод тяжелых металлов (Zn, Cu, Cr, Ni, Pb, Hg, Cd, V, Mn), а также соед-ний As, фосфора, цианистых соед-ний и р/а в-в. Ионный обмен широко распространен при обессоливании в процессе водоподготовки.

Адсорбенты. В кач-ве сорбентов используют разл. искусств. и природные пористые мат-лы: активированные угли, силикагели, зола, шлак, торф и др. Минер. сорбенты – глины, силикагели, алюмогели, гидроксиды исп-ся мало, т. к. энергия взаим-вия их с молми воды велика и нередко превышает энергию адсорбции. Наиболее универс. сорбентами являются активные угли. Акт. угли при очистке сточных вод должны быть отн. крупнопористыми (улавливать большие орг. мол-лы; не подвергаться истиранию; не катализировать возможны рции в водной среде; легко смачиваться водой; иметь способность к регенерации и низкую стоимость.
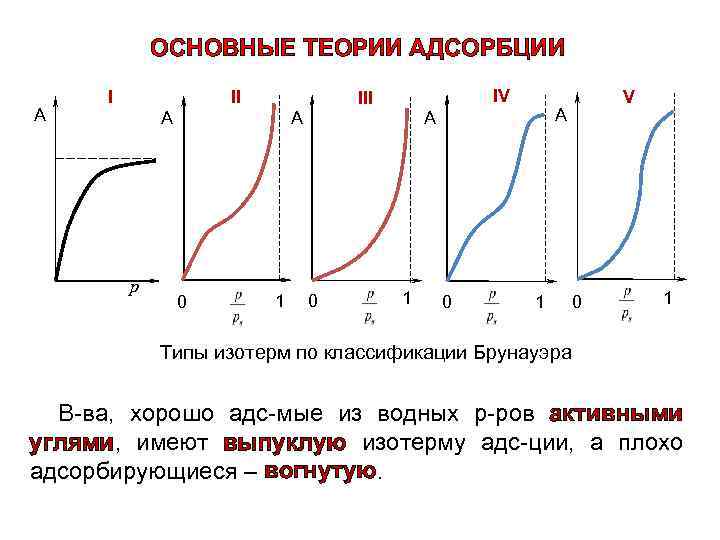
ОСНОВНЫЕ ТЕОРИИ АДСОРБЦИИ А I II А р А 0 1 IV III 0 А А 1 0 V 1 0 1 Типы изотерм по классификации Брунауэра В-ва, хорошо адс-мые из водных р-ров активными углями, имеют выпуклую изотерму адс-ции, а плохо адсорбирующиеся – вогнутую.

Ур-ние Генри Ур-ние Ленгмюра Ур-ние БЭТ А = КГ·с Ур-ние Фрейндлиха Ур-ние Кельвина Ур-ние Поляни Ур-ния ТОЗМ а = kадс⋅Сравн

ТЕОРЕТИЧЕСКИЕ ОСНОВЫ АДСОРБЦИОННОЙ ОЧИСТКИ СТОЧНЫХ ВОД Адсорбция растворенных в-в – рез-тат перехода мол-л раств. вва из р-ра на пов-сть тв. адс-нта под действием силового поля пов-сти. При этом наблюдаются два вида сил межмол. взаимодействия: – молекул раств. в-ва с мол-ми (или атомами) поверхности сорбента; – молекул раств. в-ва с мол-ми воды в растворе (гидратация). Разность этих двух сил определяет силу удержания на пов-сти сорбента. Чем больше энергия гидратации мол-л растворенного в-ва, тем слабее адсорбируется вещество из раствора. Правило выравнивания полярностей Ребиндера: преимущественно адсорбируется тот компонент, полярность к-рого промежуточна между полярностями адсорбента и др. компонента рра. Ех. , полярный адс-нт (силикагель) хорошо адсорбирует менее полярные в-ва (ех, дифильные н. м. жирные к-ты) из неполярного р-ля (толуол, гептан), а неполярный адс-нт (уголь) хорошо сорбирует более полярные по сравнению с ним в-ва (те же дифильные в-ва) из полярного р-ля (воды). Чем больше разница полярностей адсорбента и р-ля, тем меньше роль р-ля в конкуренции за адсорбционные места. Увеличение разности полярности (ум-ние взаимной растворимости) рля и раств. в-ва способствует адсорбции.

Адсорбция − процесс обратимый и равновесный. Скорости сорбции и десорбции пропорц-ны концентрации в-ва в р-ре и на пов-сти сорбента. В начале сорбции при максим. конц-ции в-ва в р-ре скорость адсорбции также максимальна. По мере ув-ния конц-ции адс-го в-ва на повсти адсорбента скорость десорбции ув-ся. Когда обе скорости выравниваются наступает равновесие. Конц-ция в-ва в таком р-ре наз-ся равновесной. Если повысить конц-цию, то равновесие нарушится, но только до достижения адсорбционной ёмкости. На практике адс-цию проводят в статических и динамических условиях. При статической сорбции поглощаемое в-во нах-ся в непрерывном контакте с сорбентом, перемещаясь вместе с ним (аппараты с перемешиванием). При динам. сорбции поглощаемое в-во фильтруется через слой сорбента, контакт прерывается (аппараты с псевдоожиженным слоем, фильтры).

Статическая активность (ёмкость) сорбента – кол-во поглощённого в-ва на единицу массы сорбента к моменту достижения равновесия в опр. условиях (постоянных т-ре жидкости и начальной конц-ции в-ва). Динамическая акт-сть (ёмкость) сорбента – время от начала пропускания сорбата до его проскока (до появления за слоем сорбента), или макс. кол-во в-ва, поглощённого единицей массы сорбента до момента появления сорбируемого вещества за слоем сорбента. Динам. ёмкость промыш. адсорберов = 45 − 90%. На практике сорбц. процессы ведут в динам. условиях, т. к. это обеспечивает непрерывность и автоматизацию технол. процесса. Между кол-вом адс-ного в-ва и оставшегося в р-ре в разбавленных р-рах наступает равновесие, подчиняющееся закону распределения.
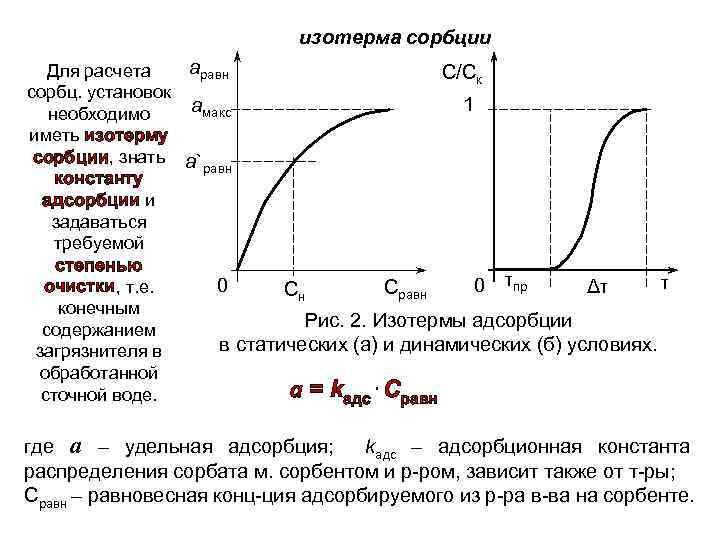
изотерма сорбции аравн Для расчета С/Ск сорбц. установок 1 амакс необходимо иметь изотерму сорбции, знать а` равн константу адсорбции и задаваться требуемой степенью τ 0 τпр 0 Δτ очистки, т. е. Сравн Сн конечным Рис. 2. Изотермы адсорбции содержанием в статических (а) и динамических (б) условиях. загрязнителя в обработанной а = kадс⋅Сравн сточной воде. где а – удельная адсорбция; kадс – адсорбционная константа распределения сорбата м. сорбентом и р-ром, зависит также от т-ры; Сравн – равновесная конц-ция адсорбируемого из р-ра в-ва на сорбенте.

Кинетика адсорбции. Скорость процесса адсорбции зависит от конц-ции, физ. -хим. природы и структуры растворенных в-в, т-ры воды, вида и св-в адсорбента. В общем случае процесс адсорбции складывается из 3 -х стадий: 1) перенос в-ва из сточной воды к пов-сти зерен адсорбента (внешнедиффузионная область), 2) собственно адсорбционный процесс, 3) перенос в-ва внутри зерен адсорбента (внутридиффузионная область). Лимитирующими стадиями процесса может быть внешняя или внутренняя диффузия, либо обе эти стадии. Во внешнедиффузионной области скорость массопереноса опр-ся турбулентностью потока жидкости, к-рая зависит от скорости жидк. Во внутридиффузионной области интенсивность массопереноса зависит от вида и размеров пор адсорбента, от формы и размера его зерен, от размера молекул адсорб. в-в, от коэф-та массопроводности. Оптим. процесс адсорбции целесообразно проводить при интенсивных гидродинамических режимах, чтобы он лимитировался во внутридиффузионной области, сопротивление к-рой можно снизить, изменяя структуру адсорбента, уменьшая размеры зерна.

Адсорбционные установки. Процесс адсорбционной очистки сточной воды ведут • при интенсивном перемешивании адсорбента с водой, • при фильтровании воды через слой адсорбента или • в псевдоожиженном слое на установках периодического и непрерывного действия. Процесс проводят в одну или несколько ступеней. Статическая одноступенчатая адсорбция применяется, когда адсорбент очень дешев или явл-ся отходом производства. Расход адсорбента для одноступенчатого процесса определяют из уравнения материального баланса: где m - расход адсорбента; Q - объемный расход сточных вод; Сн и Сравн – начальная и равновесная концентрации загрязненной сточной воды; a – коэффициент адсорбции. Конечная концентрация сорбата в сточной воде:

При использовании многоступенчатой установки процесс протекает при меньшем расходе адсорбента. При этом в первую ступень вводят столько адсорбента сколько необходимо для снижения концентрации загрязнений от Сн до С 1, затем адсорбент отделяют отстаиванием или фильтрованием, а сточную воду направляют во вторую ступень, куда вводят свежий адсорбент. По окончании процесса адсорбции во второй ступени концентрация загрязнений в воде уменьшается от C 1 до C 2 и т. д. Конечная концентрация загрязнений в сточной воде после очистки в установке с n ступенями равна: Сn = [Q /(Q + km)]n. Сн, где k – коэффициент распределения, равный k = aτ/a = (Сн – Ск)/(Сн – Ср) ≈ 0. 7 ÷ 0. 8, где aτ – значение удельной адсорбции за время τ; Ср – равновесная концентрация вещества. Расход адсорбента на каждую ступень : Необходимое число ступеней п = lg. Сн – lg. Сn/[lg(Q + km) – lg. Q].

В динамических условиях процесс очистки проводят при фильтровании сточной воды через слой адсорбента. Скорость фильтрования зависит от конц-ции растворенных в-в и колеблется от 2 – 4 до 5 – 6 м 3/(м 2*ч). Адсорбент применяют в виде ч-ц размером 1, 5 - 5 мм. Вода в колонне движется снизу вверх, заполняя все сечение. В одной колонне при неподвижном слое угля процесс очистки ведут периодически до проскока, а затем адсорбент выгружают и регенерируют. При непрерывном процессе используют несколько колонн. По такой схеме две колонны работают последовательно, а третья отключена на регенерацию. При проскоке во второй (средней) колонне на регенерацию отключают первую колонну. При расчете насыпных фильтров время их защитного действия определяют по формуле t зд = k зд H − τ, (3. 2) где kзд – коэффициент защитного действия, определяемый экспериментально; H – высота слоя сорбента; τ – время потери защитного действия. Коэффициент защитного действия равен: В момент проскока в колонне появляется слой адсорбента L 0, который не работает. Этот слой называют "мертвым" слоем. Если одновременно выводить из колонны "мертвый" слой и вводить в нее такой же слой свежего адсорбента, то колонна будет работать непрерывно.

Скорость перемещения работающего слоя равна U = Сн wср/ao∂, (6. 69) где wср – средн. скорость воды в колонне; ao∂ - динам. емкость адсорбента. Длина (высота) работающего слоя: Lp = М/(S βΔСср), где M – кол-во поглощенного в-ва; S – площадь поперечного сечения слоя; β – коэффициент массопередачи; ΔСср – средняя движущая сила адсорбции. При небольших концентрациях загрязнений в сточной воде средняя движущая сила процесса может быть вычислена как средняя логарифмическая из движущих сил на концах адсорбера. Регенерация адсорбента. Адсорбированные вещества из угля извлекают десорбцией насыщенным или перегретым водяным паром, либо нагретым инертным газом. Температура перегретого пара при избыточном давлении 0, 3 – 0, 6 МПа равна 200 – 3000 С, а температура инертных газов 120 – 1400 С. Расход пара при отгонке легколетучих веществ равен 2, 5 – 3 кг на 1 кг отгоняемого вещества, для высококипящих – в 5 – 10 раз больше. После десорбции пары конденсируют и вещество извлекают из конденсата.

Ионный обмен в растворах сточных вод Ионообменная очистка применяется для извлечения из сточных вод тяжелых металлов (Zn, Cu, Cr, Ni, Pb, Hg, Cd, V, Mn), а также соединений As, P, CN-соед-ний и р/а в-в. Метод позволяет рекуперировать ценные в-ва при высокой степени очистки воды. Ионный обмен широко прим-ся при обессоливании в процессе водоподготовки. Сущность ионного обмена. Ионный обмен – это процесс взаим-я р-ра с твердой фазой, обладающей сввами обменивать ионы, содержащиеся в ней, на другие ионы, присутствующие в р-ре. В-ва, составляющие эту твердую фазу, наз-ся ионитами. Они практически не растворимы в воде. Те из них, к-рые поглощают из р-ров катионы, - катиониты, анионы - аниониты. Катиониты обладают кислотными св-вами, а аниониты - основными. Если иониты обменивают и катионы, и анионы, их называют амфотерными.

Основы процесса ионного обмена. Ионный обмен происходит в эквивалентных отношениях и обычно обратим. Движ. сила реакций ионного обмена – разность хим. потенциалов обменивающихся ионов. В общ. виде эти р-ции можно представить как: m. A + Rm. B m. RA + B Na 2 O – Al 2 O 3 – n. Si. O 2 – m. H 2 O [R] – Me n+ + + Na [R] – + n+ Na + Me [R] –

Реакция ионного обмена: - при контакте с катионитом RSO 4 H+Na. Cl RSO 4 Na+HCl - при контакте с анионитом ROH+Na. Cl RСl+Na. OH. Реакция идет до установления ионообменного равновесия. Скорость установления равновесия зависит от внешних и внутренних факторов: гидродинамического режима жидкости; конц-ции обменивающихся ионов; структуры зерен ионита; его проницаемости для ионов.

Иониты бывают неорганические (минеральные) и органические. Это природные или синтетические в-ва. К неорганическим природным ионитам относятся цеолиты, глинистые минералы, полевые шпаты, различные слюды. Их катионообменные свойства обусловлены содержанием алюмосиликатов типа Na 2 OAl 2 O 3 -n. Si. O 2 -m. H 2 O. Ионообменными свойствами обладает также фторапатит [Ca 5(PO 4)3]F и гидроксидапатит. Неорганические синтетические иониты - силикагели, пермутиты, труднораств. оксиды и гидроксиды алюминия, хрома, циркония и др. Катионообменные св-ва, ех силикагеля, обусловлены обменом ионов водорода гидроксидных групп на катионы металлов, проявляющиеся в щелочной среде. Катионообменными свойствами обладают и пермутиты, получаемые сплавлением соединений, содержащих алюминий и кремний.

Органические природные иониты – это гуминовые кислоты почв и углей. Они проявляют слабокислотные свойства. Для усиления кислотных свойств и обменной емкости угли измельчают и сульфируют в избытке олеума. Сульфоугли – дешевые полиэл-ты, содержат сильно- и слабокислотные группы. К их недостаткам относится малая хим. стойкость и низкая мех. прочность зерен, а также небольшая обменная емкость, особенно в нейтральных средах. К орг. искусств. ионитам отн-ся ионообменные смолы с развитой пов-стью. Они имеют наиб. практ. значение для очистки сточных вод. Синт. ионообм. смолы представляют собой ВМС, углеводородные радикалы к-рых образуют пространственную сетку с фиксированными на ней ионообменными функциональными группами. Простр. СН-сетка (каркас) называется матрицей, а обменивающиеся ионы – противоионами.

Каждый противоион соединен с анкерными ионами. Полимерные СН-цепи, явл-щиеся основой матрицы, связаны (сшиты) м. собой поперечными связями, что придает прочность каркасу. Матрицу обозначают в общем виде (R), а активную группу указывают полностью. ех, сульфокатиониты записывают как RSO 3 H, где R - матрица, H - противоион, SO 3 - анкерный ион. Иониты с одинаковыми активными группами наз-ся монофункциональными, с разными – полифункциональными. Они могут обладать смешанными сильно- и слабоосновными свойствами. Катиониты и аниониты могут находиться в солевой форме. Вместо Н+ Ме n+, и вместо ОН– анионы кислот.
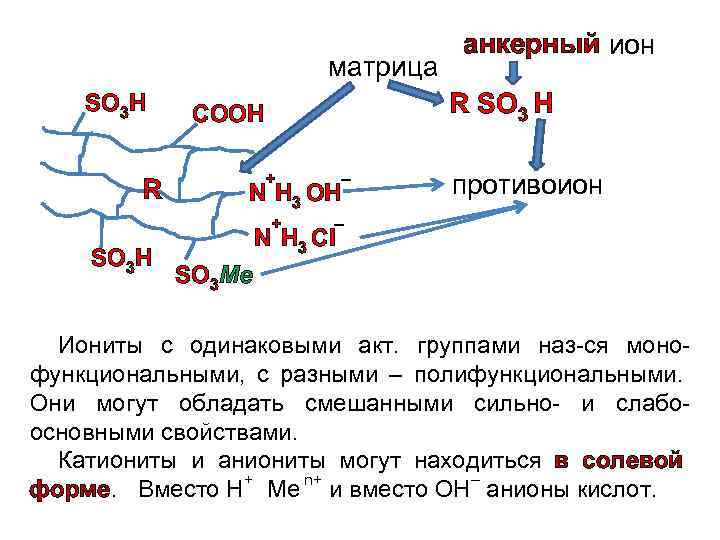
матрица SO 3 H R R SO 3 H COOH + N H 3 OH + SO 3 H анкерный ион N H 3 Cl – противоион – SO 3 Ме Иониты с одинаковыми акт. группами наз-ся монофункциональными, с разными – полифункциональными. Они могут обладать смешанными сильно- и слабоосновными свойствами. Катиониты и аниониты могут находиться в солевой форме. Вместо Н+ Ме n+ и вместо ОН– анионы кислот.

Свойства ионитов. При нагревании ионитов в воде и на воздухе возможно разрушение их зерен, отщепление активных групп, что приводит к уменьшению их емкости. Для каждой смолы имеется т-рный предел, выше к-рого ее использовать нельзя. Терм. устойчивость анионитов ниже, чем катионитов. Величина р. Н сточной воды, при к-рой происходит обмен ионами, зависит от константы диссоциации ионообменных групп смолы. Сильнокислотные катиониты позволяют проводить процесс в любых средах, а слабокислотные – в щелочных и нейтральных средах. Иониты не растворяются в воде, но набухают, являясь гелями с ограниченной набухаемостью. Размер микропор возрастает, объем ионитов увеличивается в 1, 5 - 3 раза. Степень набухания зависит от строения смолы, природы противоионов, от состава раствора.

Набухание ионитов влияет на скорость, полноту обмена ионов и селективность ионита. Оно прекращается, когда разность осмотических давлений до и после обмена уравновесится силами растяжения и сжатия ионита. Синтетические иониты набухают в воде больше и имеют большую обменную емкость, чем природные. Срок службы синтетических катионитов значительно больше, чем анионитов. Сильно набухающие (гелеобразные) смолы имеют низкую обменную поверхность. Макропористые иониты обладают развитой обменной поверхностью, равной 60 - 80 м 2/г. Селективность ионного обмена зависит от давления набухания в порах смолы и от размера пор ионита. Малые поры не впускают большие ионы. Для повышения селективности ионитов к опр. металлам в состав смолы вводят в-ва, способные образовывать хелаты.

Поглотительная способность ионитов хар-ся обменной емкостью, к-рая опр-ся числом эквивалентов ионов, поглощаемых единицей массы или объема ионита. Различают полную, статическую и динамическую обменные емкости. Полная емкость – это количество поглощаемого вещества при полном насыщении единицы объема или массы ионита. Статическая емкость – это обменная емкость ионита при равновесии в данных рабочих условиях. Статическая обменная емкость обычно меньше полной. Динамическая обменная емкость – это емкость ионита до "проскока" ионов в фильтрат, определяемая в условиях фильтрации. Динамическая емкость меньше статической.

Ионообменное равновесие. Если ионит привести в контакт с р-ром эл-та, то по истечении некоторого времени установится равновесие между конц-циями ионов в ионите и в р-ре. Это. Р-р при этом остаётся электронейтральным. Адсорбция электролитов имеет ионообменный механизм. . Ионообменную р-цию с участием ионов одинаковых по знаку заряда, но разных по его величине, можно представить : где z 1 и z 2 – заряды обменивающихся ионов М 1 и М 2. коэффициент ионного обмена уравнение Никольского

Функц-ная зав-сть противоионного состава ионита от противоионного состава внешнего раствора при p, T=const наз-ся изотермой ионного обмена. Изотермы изображаются в безразмерных координатах: где – эквивалентные доли i - го иона в фазе ионита и в р-ре; – конц-ции i - го иона в ионите и в р-ре в условиях равновесия, моль ионов /1 г ионита; zi – заряд i - го иона.

Величины изменяются в интервале от 0 до 1, след- но, изотермы обмена изображаются в квадра- те, со стороной равной единице. 1 K>1 K=1 K<1 0 1 – коэффициент распределения i-го иона при сорбции Kрi, служит мерой обогащения или обеднения ионита данным в-вом. При Kрi < 1 ионит обеднен, а при Kрi >1 обогащен компонентом по сравнению с равновесным р-ром.

Если в р-ре содержится не один, а несколько ионов, ех. А и В, то селективность ионита оценивается коэф-нтом селективности (избирательности) KАВ, равным отношению коэффициентов распределения конкурирующих ионов: При КАВ > 1 ионит селективен к иону А; при КАВ < 1 избирательно сорбируется ион В; при КАВ = 1 ионит не проявляет селективности ни к одному из ионов.

1 Форма изотермы ионного обмена зависит от величины коэф-та селективности КАВ: КАВ > 1 изотерма выпуклая; КАВ < 1 – вогнутая; КАВ = 1 – линейная и совпадает с диагональю. K>1 K=1 K<1 0 1

Если обменная р-ция описывается ур-нием в общ. виде, то равновесие ионообменных процессов выражается как: где КАВ – константа равновесия; – концентрация ионов в твердой фазе; с – концентрация ионов в жидкой фазе; x = с/с0 – безразмерная концентрация в жидкой фазе; с0 – общая "эквивалентная" конц-ция ионов в жидкости; θ – обменная ёмкость смолы (значение в находится в пределах п и 1).

Процесс переноса ионов состоит из нескольких стадий: 1. перенос ионов А из ядра потока жидкости до внешней поверхности плёнки жидкости, окружающей зерно ионита; 2. диффузия ионов через пограничную плёнку жидкости; 3. переход иона через границу раздела фаз в зерно смолы; 4. диффузия ионов А в зерне ионита к ионообменным функциональным группам; 5. химическая реакция двойного обмена ионов А и В; 6. диффузия ионов В внутри зерна ионита к границе раздела фаз; 7. переход ионов В через границу раздела фаз на внутреннюю поверхность пленки жидкости; 8. диффузия ионов В через пленку жидкости; 9. диффузия ионов В в ядро потока жидкости.

Скорость всего процесса опр-ся самой медленной из этих стадий – диффузией в плёнке жидкости либо диффузией в зерне ионита. Хим. р-ция ионного обмена происходит быстро и не явл-ся лимитирующей. При конц-ции в-ва в сточных водах менее 0, 003 моль/л, или при значении числа Био Bi << 1 скорость обмена опрся диффузией ионов через пленку жидкости (пленочная кинетика). Вi = βro/(kг·D), где β – коэф-нт массоотдачи; r 0 – радиус зерна ионита; kг – константа Генри; D – коэф-нт массопроводности (диффузии). При конц-ции 0, 1 моль/л (или Вi >>1) скорость опр-ся диффузией ионов внутри зерна (гелевая кинетика). В области конц-ций 0, 003 – 0, 1 моль/л определяющими явл-ся оба вида диффузии.

Коэф-ты диффузии ионов D в смоле ≈ 10 -6 – 10 -9 см 2/с, а в воде 10 -4 – 10 -5 см 2/с. D ум-ся при ув-нии размера гидратированных ионов в рре и росте заряда обмениваемых противоионов смолы. Для расчета коэффициента массоотдачи во внешнедиффузионной области при Re от 2 до 30 исп-ся зав-сть: Nu = 0, 725 • Re 0, 47 • Pr. D 1/3, где Nu = β·dэ/D – число Нуссельта; Re = w·dэ/ρ – число Рейнольдса; Prd = v/D – число Прандтля.

Регенерация ионитов. Катиониты регенерируют 2 – 8%ми р-рами кислот. Регенерац-е р-ры – элюаты содержат катионы. Затем после рыхления и промывки катиониты заряжаются пропусканием р-ра Na. Cl. Аниониты регенерируют 2 – 6%-ми р-рами щелочи. Они переходят в ОН-форму. Элюаты содержат все извлеченные из сточных вод анионы. Элюаты – это р-ры кислот и щелочей, их нейтрализуют или обр-ют с целью рекуперации ценных продуктов. Нейтрализацию проводят смешением кислых и щелочных элюатов, а также доп. введением кислоты или щелочи. Степень регенерации ионитов (в %) опр-ют по формуле: а = 100 θв/θп, где θв – восст-ная обм. емкость; θп - полная обм. емкость. На степень регенерации влияет тип ионита, состав насыщенного слоя, природа, конц-ция и расход регенер щего в-ва, т-ра, время контакта и расход реагентов.

Сорбция - один из наиболее эффективных методов глубокой очистки от растворённых органических и неорганических веществ сточных вод предприятий различных отраслей пром-сти. Сорбционная очистка применяется и самостоятельно и совместно с биологической, как метод предварительной и глубокой очистки. Сорбц. методы также эффективны для извлечения из сточных вод ценных раств. в-в с их последующей утилизацией и использования очищенных сточных вод в системе оборотного водоснабжения промышленных предприятий. Ионообменная очистка применяется для извлечения из сточных вод тяжелых металлов (цинка, меди, хрома, никеля, свинца, ртути, кадмия, ванадия, марганца), а также соединений мышьяка, фосфора, цианистых соед-ний и р/а в-в. Ионный обмен широко распространен при обессоливании в процессе водоподготовки. Преимуществами метода молек. адсорбции являются возможность поглощения веществ из многокомпонентных смесей и высокая степень очистки, особенно слабо концентрированных сточных вод. Адсорбционная очистка сточных вод наиболее рациональна, если в них содержатся преимущественно ароматические соединения, неэлектролиты или слабые электролиты, красители, непредельные соединения или гидрофобные (например, содержащие хлор или нитрогруппы) алифатические соединения. При содержании в сточных водах только неорганических соединений, а также низких одноатомных спиртов метод молек. адс-ции не применим. Удаление неорг. в-в произв-ся с помощью ионного обмена.

Адс. очистка вод может быть регенеративной, т. е. с извлечением вещества из адсорбента и его утилизацией, и деструктивной, при которой извлеченные из сточных вод вещества уничтожаются вместе с адсорбентом. Эффективность адсорбционной очистки достигает 80 – 95 % и зависит от хим. природы адсорбента, величины адсорбционной поверхности, от хим. строения извлекаемого вещества и его состояния в растворе. Адсорбенты. В кач-ве сорбентов используют активные угли, синтетические сорбенты и некоторые отходы про-ва (золу, шлаки, опилки). Мин. сорбенты используют мало, т. к. сорбируют гл. обр. молекулы воды. Наиболее универсальными явл-ся акт. угли, но они должны слабо взаимодействовать с мол-ми воды и хорошо – с орг. в-вами, быть отн. крупнопористыми, чтобы их пов-сть была доступна для орг. молекул. Их пористость составляет 60 − 75 %, а уд. площадь пов-сти 400 − 900 м 2/г. Адс. св-ва акт. углей зависят от структуры пор, их величины, распределения по размерам. Акт. угли делятся на крупно- и мелкопористые, и смешанные. Поры по размеру подразделяются на три вида: - макро: 0, 1 – 2 мкм; -мезо: 0, 004 – 0, 1 мкм; и -микропоры: < 0, 004 мкм. При малом времени контакта с водой они должны иметь высокую адс. емкость, высокую селективность и малую удерживающую способность при регенерации. Угли должны быть прочными, быстро смачиваться водой, иметь опр. гранулометрический состав (use мелкозернистые адсорбенты с ч-цами размером 0, 25 – 0, 5 мм и высокодисп. угли с размером ч-ц менее 40 мкм).
11. Очистка сточных вод адсорбцией.pptx