Оксиды азота.ppt
- Количество слайдов: 19
 Очистка газов от оксидов азота
Очистка газов от оксидов азота
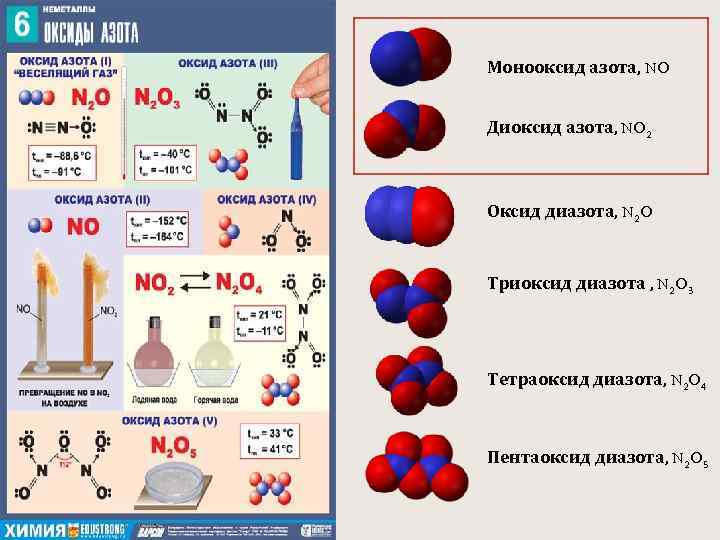 Монооксид азота, NO Диоксид азота, NO 2 Оксид диазота, N 2 O Триоксид диазота , N 2 O 3 Тетраоксид диазота, N 2 O 4 Пентаоксид диазота, N 2 O 5
Монооксид азота, NO Диоксид азота, NO 2 Оксид диазота, N 2 O Триоксид диазота , N 2 O 3 Тетраоксид диазота, N 2 O 4 Пентаоксид диазота, N 2 O 5
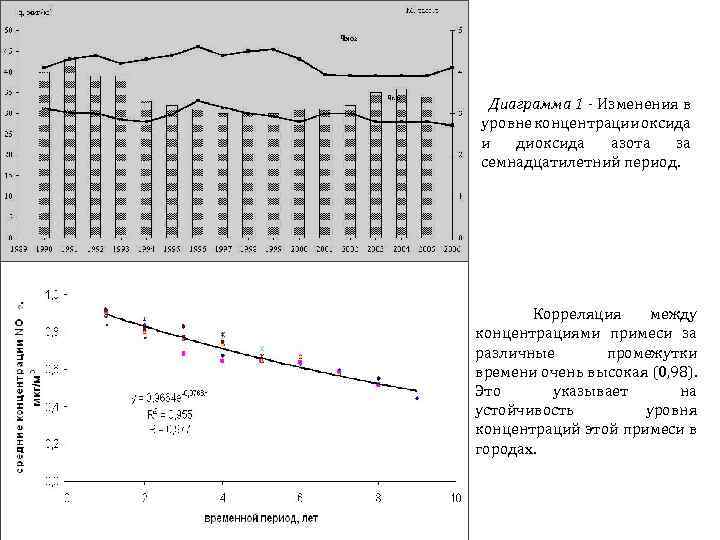 Диаграмма 1 - Изменения в уровне концентрации оксида и диоксида азота за семнадцатилетний период. Корреляция между концентрациями примеси за различные промежутки времени очень высокая (0, 98). Это указывает на устойчивость уровня концентраций этой примеси в городах.
Диаграмма 1 - Изменения в уровне концентрации оксида и диоксида азота за семнадцатилетний период. Корреляция между концентрациями примеси за различные промежутки времени очень высокая (0, 98). Это указывает на устойчивость уровня концентраций этой примеси в городах.
 Предельно-допустимая концентрация, мг/м 3 Наименование вещества Диоксид азота Максимально разовая, ПДКмр Среднесуточная, ПДКсс Класс опасности 0, 085 0, 04 2 Источники выбросов: • Теплоэлектростанции - 72, 5% • Автотранспорт - 17, 3% • Черная металлургия - 6, 1% • Промышленность строительных материалов - 1, 8% • Химическая промышленность - 1, 7% • Нефтеперерабатывающая промышленность - 0, 6%
Предельно-допустимая концентрация, мг/м 3 Наименование вещества Диоксид азота Максимально разовая, ПДКмр Среднесуточная, ПДКсс Класс опасности 0, 085 0, 04 2 Источники выбросов: • Теплоэлектростанции - 72, 5% • Автотранспорт - 17, 3% • Черная металлургия - 6, 1% • Промышленность строительных материалов - 1, 8% • Химическая промышленность - 1, 7% • Нефтеперерабатывающая промышленность - 0, 6%
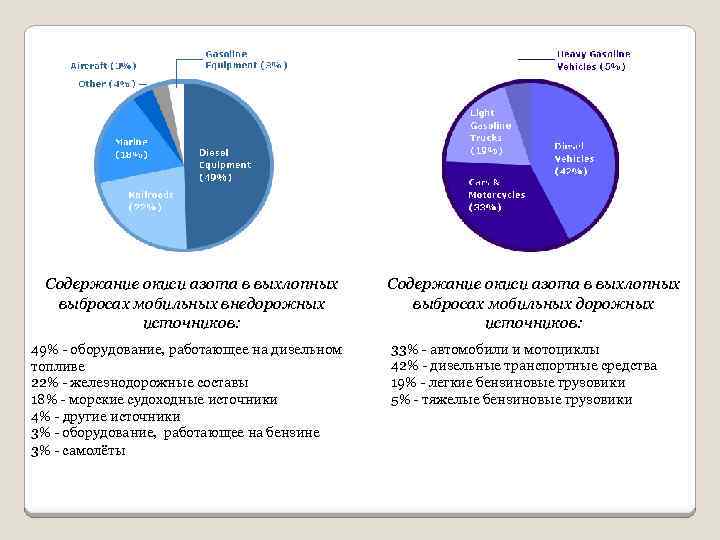 Содержание окиси азота в выхлопных выбросах мобильных внедорожных источников: 49% - оборудование, работающее на дизельном топливе 22% - железнодорожные составы 18% - морские судоходные источники 4% - другие источники 3% - оборудование, работающее на бензине 3% - самолёты Содержание окиси азота в выхлопных выбросах мобильных дорожных источников: 33% - автомобили и мотоциклы 42% - дизельные транспортные средства 19% - легкие бензиновые грузовики 5% - тяжелые бензиновые грузовики
Содержание окиси азота в выхлопных выбросах мобильных внедорожных источников: 49% - оборудование, работающее на дизельном топливе 22% - железнодорожные составы 18% - морские судоходные источники 4% - другие источники 3% - оборудование, работающее на бензине 3% - самолёты Содержание окиси азота в выхлопных выбросах мобильных дорожных источников: 33% - автомобили и мотоциклы 42% - дизельные транспортные средства 19% - легкие бензиновые грузовики 5% - тяжелые бензиновые грузовики
 Образование NO из топлива Происходит в 2 этапа: - газификация капель мазута с выделением азотсодержащих органических соединений в виде паров и газов; - реакции окисления паров и газов с образованием NO. Изучено влияние азотсодержащих добавок к метану, на основании чего предложен механизм образования NO по схеме: NH • + O 2 ↔ NO + ОН • ; NO + HO 2 • ↔ NO 2 +ОН •
Образование NO из топлива Происходит в 2 этапа: - газификация капель мазута с выделением азотсодержащих органических соединений в виде паров и газов; - реакции окисления паров и газов с образованием NO. Изучено влияние азотсодержащих добавок к метану, на основании чего предложен механизм образования NO по схеме: NH • + O 2 ↔ NO + ОН • ; NO + HO 2 • ↔ NO 2 +ОН •
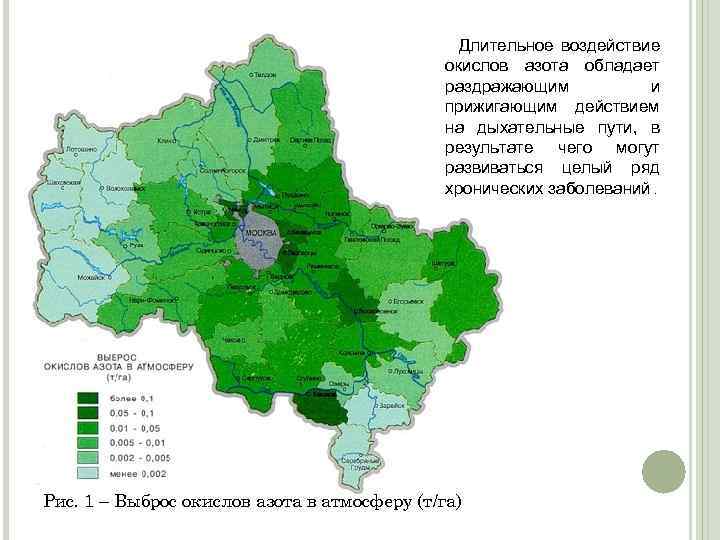 Длительное воздействие окислов азота обладает раздражающим и прижигающим действием на дыхательные пути, в результате чего могут развиваться целый ряд хронических заболеваний. Рис. 1 – Выброс окислов азота в атмосферу (т/га)
Длительное воздействие окислов азота обладает раздражающим и прижигающим действием на дыхательные пути, в результате чего могут развиваться целый ряд хронических заболеваний. Рис. 1 – Выброс окислов азота в атмосферу (т/га)
 МЕТОДЫ ОЧИСТКИ ГАЗОВ ОТ ОКСИДОВ АЗОТА: Поглощение окислов азота жидкими сорбентами Поглощение окислов азота твердыми сорбентами Восстановление окислов азота до элементарного азота на катализаторе
МЕТОДЫ ОЧИСТКИ ГАЗОВ ОТ ОКСИДОВ АЗОТА: Поглощение окислов азота жидкими сорбентами Поглощение окислов азота твердыми сорбентами Восстановление окислов азота до элементарного азота на катализаторе
 МЕТОДЫ ОЧИСТКИ ГАЗОВ ОТ ОКСИДОВ АЗОТА: Адсорбционные Каталитическое восстановление Карбамидный Регулирование процесса горения Окислительные методы Восстановительные методы
МЕТОДЫ ОЧИСТКИ ГАЗОВ ОТ ОКСИДОВ АЗОТА: Адсорбционные Каталитическое восстановление Карбамидный Регулирование процесса горения Окислительные методы Восстановительные методы
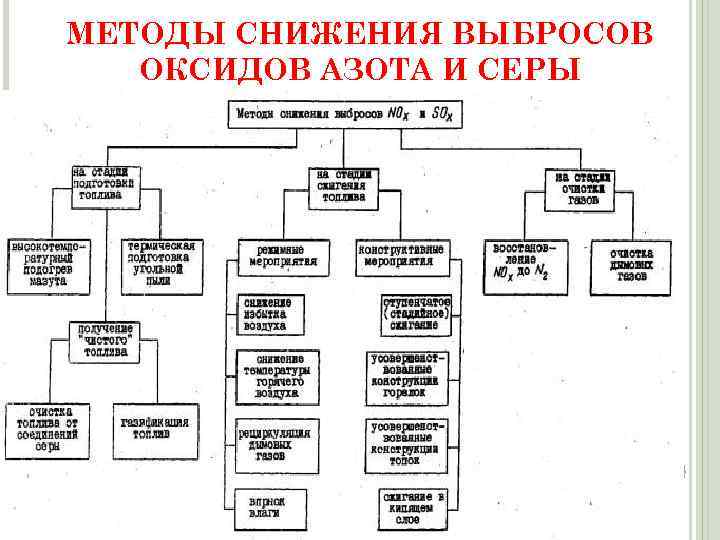 МЕТОДЫ СНИЖЕНИЯ ВЫБРОСОВ ОКСИДОВ АЗОТА И СЕРЫ
МЕТОДЫ СНИЖЕНИЯ ВЫБРОСОВ ОКСИДОВ АЗОТА И СЕРЫ
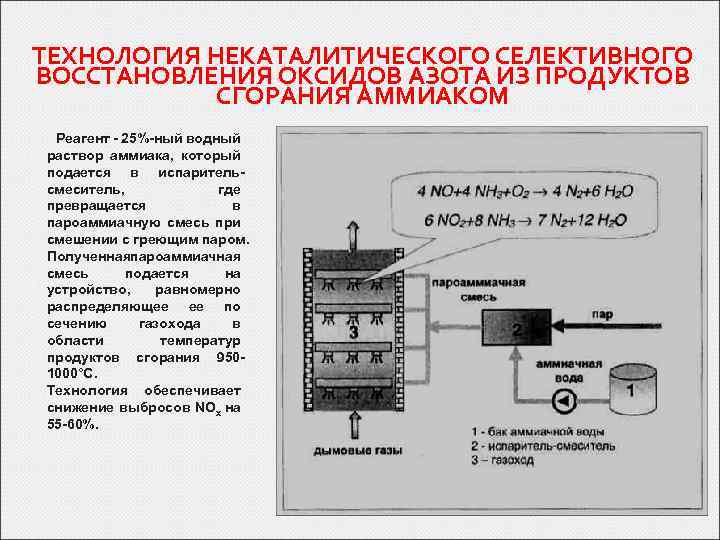 ТЕХНОЛОГИЯ НЕКАТАЛИТИЧЕСКОГО СЕЛЕКТИВНОГО ВОССТАНОВЛЕНИЯ ОКСИДОВ АЗОТА ИЗ ПРОДУКТОВ СГОРАНИЯ АММИАКОМ Реагент - 25%-ный водный раствор аммиака, который подается в испарительсмеситель, где превращается в пароаммиачную смесь при смешении с греющим паром. Полученнаяпароаммиачная смесь подается на устройство, равномерно распределяющее ее по сечению газохода в области температур продуктов сгорания 9501000°С. Технология обеспечивает снижение выбросов NOx на 55 -60%.
ТЕХНОЛОГИЯ НЕКАТАЛИТИЧЕСКОГО СЕЛЕКТИВНОГО ВОССТАНОВЛЕНИЯ ОКСИДОВ АЗОТА ИЗ ПРОДУКТОВ СГОРАНИЯ АММИАКОМ Реагент - 25%-ный водный раствор аммиака, который подается в испарительсмеситель, где превращается в пароаммиачную смесь при смешении с греющим паром. Полученнаяпароаммиачная смесь подается на устройство, равномерно распределяющее ее по сечению газохода в области температур продуктов сгорания 9501000°С. Технология обеспечивает снижение выбросов NOx на 55 -60%.
 ТЕХНОЛОГИЯ ОДНОВРЕМЕННОЙ ОЧИСТКИ ДЫМОВЫХ ГАЗОВ ОТ ОКСИДОВ АЗОТА И СЕРЫ В качестве реагента может использоваться раствор в технической воде сернокислого железа (Fe. SO 4 -7 H 2 O), трилона Б (Na 2 C 10 H 14 N 2 O 8), сульфита натрия (Na 2 SO 3) и гидроксида натрия (Na. OH) в определенных пропорциях. Na. OH Разработаны также другие варианты абсорбции, например с использованием озонированного воздуха. Оборудование отличается простотой конструкции, малыми габаритами, требует минимальных капитальных и эксплуатационных затрат. Технология обеспечивает: • очистку дымовых газов от NOx и SO 2 до уровня ПДВ; • регенерацию поглотительного раствора; • утилизацию продуктов газоочистки; • получение сульфатных удобрений или товарного гипса.
ТЕХНОЛОГИЯ ОДНОВРЕМЕННОЙ ОЧИСТКИ ДЫМОВЫХ ГАЗОВ ОТ ОКСИДОВ АЗОТА И СЕРЫ В качестве реагента может использоваться раствор в технической воде сернокислого железа (Fe. SO 4 -7 H 2 O), трилона Б (Na 2 C 10 H 14 N 2 O 8), сульфита натрия (Na 2 SO 3) и гидроксида натрия (Na. OH) в определенных пропорциях. Na. OH Разработаны также другие варианты абсорбции, например с использованием озонированного воздуха. Оборудование отличается простотой конструкции, малыми габаритами, требует минимальных капитальных и эксплуатационных затрат. Технология обеспечивает: • очистку дымовых газов от NOx и SO 2 до уровня ПДВ; • регенерацию поглотительного раствора; • утилизацию продуктов газоочистки; • получение сульфатных удобрений или товарного гипса.
 Гомогенногетерогенный процесс основан на сочетании высокотемпературного некаталитического и низкотемпературного каталитического восстановления NOx аминосодержащими восстановителями. Он реализован в установке по очистке промышленных газовых выбросов от оксидов азота.
Гомогенногетерогенный процесс основан на сочетании высокотемпературного некаталитического и низкотемпературного каталитического восстановления NOx аминосодержащими восстановителями. Он реализован в установке по очистке промышленных газовых выбросов от оксидов азота.
 Каталитический метод При каталитическом методе используются реакции восстановления газами СО, СН 4, Н 2 в присутствии катализаторов. Удаление NOx происходит по реакции: А) при действии восстановителя СО: CO + 2 NO → N 2 + 2 CO 2, 4 CO + 2 NO 2 → N 2 + 4 CO 2, Б) при действии восстановителя Н 2: 2 H 2 + 2 NO → N 2 + H 2 O, 2 H 2 + 2 NO 2 → N 2 + 2 H 2 O, В) при действии восстановителя – метана: CH 4 + O 2 → CO 2 + H 2 O, CH 4 + 4 NO → CO 2 + 2 H 2 O + 2 N 2, CH 4 + 2 NO 2 → CO 2 + 2 H 2 O + N 2. Для удаления СО используют восстановитель - водород по реакциям: СО + 3 Н 2 → СH 4 + Н 2 O, СO 2 + 4 Н 2 → СН 4 + 2 Н 2 O, 1/2 O 2 + Н 2 → Н 2 O. Оксиды азота можно удалить при взаимодействии их с Na. OH, Na 2 CO 3, КОН, Са(ОН)2, NH 4 OH : N 2 O 3 + Na 2 CO 3 → Na. NO 2 + СO 2, NO 2 + Na 2 CO 3 → Na. NO 2 + Na. NO 3 + CO 2.
Каталитический метод При каталитическом методе используются реакции восстановления газами СО, СН 4, Н 2 в присутствии катализаторов. Удаление NOx происходит по реакции: А) при действии восстановителя СО: CO + 2 NO → N 2 + 2 CO 2, 4 CO + 2 NO 2 → N 2 + 4 CO 2, Б) при действии восстановителя Н 2: 2 H 2 + 2 NO → N 2 + H 2 O, 2 H 2 + 2 NO 2 → N 2 + 2 H 2 O, В) при действии восстановителя – метана: CH 4 + O 2 → CO 2 + H 2 O, CH 4 + 4 NO → CO 2 + 2 H 2 O + 2 N 2, CH 4 + 2 NO 2 → CO 2 + 2 H 2 O + N 2. Для удаления СО используют восстановитель - водород по реакциям: СО + 3 Н 2 → СH 4 + Н 2 O, СO 2 + 4 Н 2 → СН 4 + 2 Н 2 O, 1/2 O 2 + Н 2 → Н 2 O. Оксиды азота можно удалить при взаимодействии их с Na. OH, Na 2 CO 3, КОН, Са(ОН)2, NH 4 OH : N 2 O 3 + Na 2 CO 3 → Na. NO 2 + СO 2, NO 2 + Na 2 CO 3 → Na. NO 2 + Na. NO 3 + CO 2.
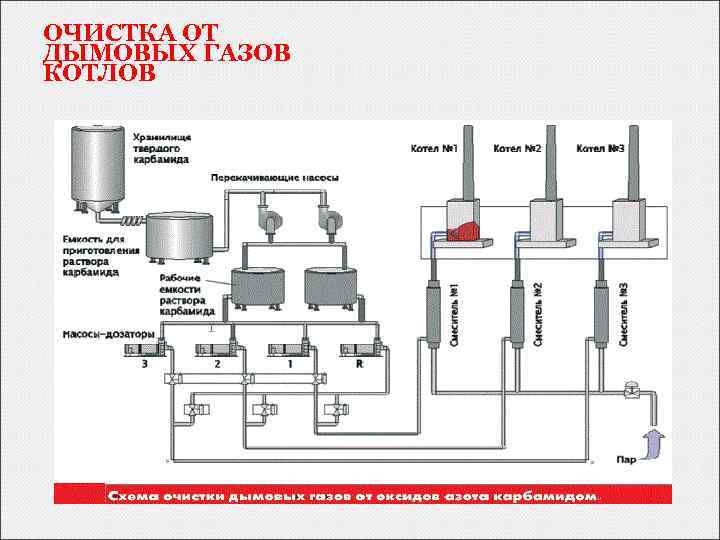 ОЧИСТКА ОТ ДЫМОВЫХ ГАЗОВ КОТЛОВ
ОЧИСТКА ОТ ДЫМОВЫХ ГАЗОВ КОТЛОВ
 Метод восстановления с помощью аммиака (взаимодействие аммиака с оксидами азота при определенных температурах): 4 NO+4 NH 3+O 2 → 4 N 2+6 H 2 O; 6 NO+8 NH 3 → 7 N 2+12 H 2 O. При высоких температурах (900. . . 1100 ОС) реакции протекают без катализаторов. Дозирование аммиака осуществляется в зависимости от режимов работы котла, чтобы исключить его проскок в атмосферу (на практике полностью исключить проскок аммиака не удается и он может составлять 3, 8 мг/м 3 ). При более низких температурах (573. . . 723 К) реакция разложения оксидов азота протекает только в присутствии катализатора. В качестве катализаторов используются оксиды различных металлов (титан, хром, ванадий). Они наносятся на элементы с развитой поверхностью, выполненные в виде сот, гранул или пластин.
Метод восстановления с помощью аммиака (взаимодействие аммиака с оксидами азота при определенных температурах): 4 NO+4 NH 3+O 2 → 4 N 2+6 H 2 O; 6 NO+8 NH 3 → 7 N 2+12 H 2 O. При высоких температурах (900. . . 1100 ОС) реакции протекают без катализаторов. Дозирование аммиака осуществляется в зависимости от режимов работы котла, чтобы исключить его проскок в атмосферу (на практике полностью исключить проскок аммиака не удается и он может составлять 3, 8 мг/м 3 ). При более низких температурах (573. . . 723 К) реакция разложения оксидов азота протекает только в присутствии катализатора. В качестве катализаторов используются оксиды различных металлов (титан, хром, ванадий). Они наносятся на элементы с развитой поверхностью, выполненные в виде сот, гранул или пластин.
 МЕТОДЫ ОЧИСТКИ ГАЗОВ ОТ СЛАБООКИСЛЕННЫХ ОКСИДОВ АЗОТА Поглощение окиси азота растворами сернокислой закиси железа. Поглощение окиси азота растворами сульфита аммония: (NH 4)2 SO 3 + 2 NО (NH 4)2 SO 4 + N 2; ( NH 4)2 SO 3 + NO 2 (NН 4)2 SO 4 + NО. Окисление и абсорбция окислов азота водными растворами окислителей. Очистка газов от окислов азота водными растворами перекиси водорода: Н 2 O 2 + NО 2 + H 2 O 3 NO 2 +H 2 O 2 HNO 3 +NO. Абсорбция слабоокисленных окислов азота водными растворами перманганата калия: KMn. О 4 + NО + H 2 O КNО 3 + Мn. О 2 + H 2 O.
МЕТОДЫ ОЧИСТКИ ГАЗОВ ОТ СЛАБООКИСЛЕННЫХ ОКСИДОВ АЗОТА Поглощение окиси азота растворами сернокислой закиси железа. Поглощение окиси азота растворами сульфита аммония: (NH 4)2 SO 3 + 2 NО (NH 4)2 SO 4 + N 2; ( NH 4)2 SO 3 + NO 2 (NН 4)2 SO 4 + NО. Окисление и абсорбция окислов азота водными растворами окислителей. Очистка газов от окислов азота водными растворами перекиси водорода: Н 2 O 2 + NО 2 + H 2 O 3 NO 2 +H 2 O 2 HNO 3 +NO. Абсорбция слабоокисленных окислов азота водными растворами перманганата калия: KMn. О 4 + NО + H 2 O КNО 3 + Мn. О 2 + H 2 O.
 ВЫБРОСЫ ОКСИДОВ АЗОТА ИЗ ЗАВОДСКИХ ТРУБ ПОЛУЧИЛИ НАЗВАНИЕ "ЛИСИЙ ХВОСТ"
ВЫБРОСЫ ОКСИДОВ АЗОТА ИЗ ЗАВОДСКИХ ТРУБ ПОЛУЧИЛИ НАЗВАНИЕ "ЛИСИЙ ХВОСТ"



