Оценка Т звена иммунной системы Гаськова М.ppt
- Количество слайдов: 38
 Оценка Т звена иммунной системы Выполнила студентка 481 а группы Гаськова Марина
Оценка Т звена иммунной системы Выполнила студентка 481 а группы Гаськова Марина
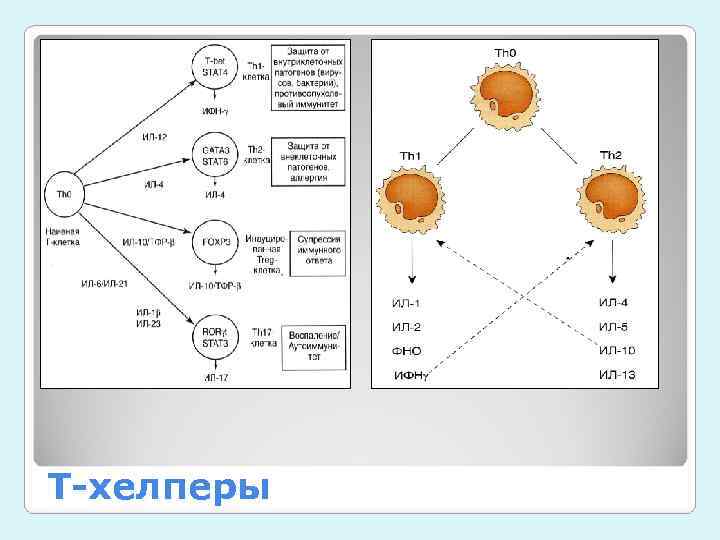
 Субпопуляции: • Т-клетки хелперы (Th 0, Th 1, Th 2, Th 17), CD 4+ • регуляторные Т- клетки (Treg, Tr 1, Th 3), CD 4+ CD 25+ Fox. P 3+ • цитотоксические Т-клетки (ЦТЛ), CD 8+
Субпопуляции: • Т-клетки хелперы (Th 0, Th 1, Th 2, Th 17), CD 4+ • регуляторные Т- клетки (Treg, Tr 1, Th 3), CD 4+ CD 25+ Fox. P 3+ • цитотоксические Т-клетки (ЦТЛ), CD 8+
 Недостатки биологических методов: ◦ Трудоемкие и сложные в исполнении; ◦ Требуют значительно больше времени до получения конечного результата, а также особых стерильных условий и оборудования для постановки; ◦ Менее специфичные, чем иммунохимические методы. Преимущества: Отличаются достаточно высокой чувствительностью; С биологической точки зрения являются более правильными, поскольку измеряют только биологически активные формы цитокинов. Все методы оценки биологической активности цитокинов in vitro могут быть объединены в 5 основных групп: Биологические методы
Недостатки биологических методов: ◦ Трудоемкие и сложные в исполнении; ◦ Требуют значительно больше времени до получения конечного результата, а также особых стерильных условий и оборудования для постановки; ◦ Менее специфичные, чем иммунохимические методы. Преимущества: Отличаются достаточно высокой чувствительностью; С биологической точки зрения являются более правильными, поскольку измеряют только биологически активные формы цитокинов. Все методы оценки биологической активности цитокинов in vitro могут быть объединены в 5 основных групп: Биологические методы
 Т-хелперы
Т-хелперы
 Методы оценки биологической активности цитокинов; Иммунохимические методы; Молекулярно-биологические методы. Изучение системы цитокинов проводится на различных уровнях в зависимости от конкретных задач и включает следующие основные подходы: Генетический анализ на предмет отсутствия мутаций в генах цитокинов, их рецепторов и белков внутриклеточных сигнальных систем запуска синтеза и передачи сигнала; Анализ полиморфизма генов цитокинов; Изучение экспрессии генов цитокинов; Изучение уровня продукции цитокинов клетками в культуре; Определение концентраций цитокинов в биологических жидкостях; Изучение синтеза цитокинов на уровне отдельных клеток; Изучение синтеза цитокинов в тканях. Методы оценки функционирования системы цитокинов
Методы оценки биологической активности цитокинов; Иммунохимические методы; Молекулярно-биологические методы. Изучение системы цитокинов проводится на различных уровнях в зависимости от конкретных задач и включает следующие основные подходы: Генетический анализ на предмет отсутствия мутаций в генах цитокинов, их рецепторов и белков внутриклеточных сигнальных систем запуска синтеза и передачи сигнала; Анализ полиморфизма генов цитокинов; Изучение экспрессии генов цитокинов; Изучение уровня продукции цитокинов клетками в культуре; Определение концентраций цитокинов в биологических жидкостях; Изучение синтеза цитокинов на уровне отдельных клеток; Изучение синтеза цитокинов в тканях. Методы оценки функционирования системы цитокинов
 • Анализ на уровне клеток-продуцентов (мононуклеарные клетки, лимфоциты, лейкоциты, макрофаги, ДК и др. ) Генный уровень - Исследование генов, которые ответственны за синтез цитокинов и их полиморфизмов, методами, основанными на ПЦР. - Идентификация адаптерных и других молекул, которые проводят сигнал, запускающий транскрипцию цитокиновых генов (ПЦР, иммуноблоттинг и др. ). Клеточный уровень - Выявление и определение количества клеток (Тh 1, Th 2, регуляторные Т- лимфоциты), содержащих цитокины (методом внутриклеточного окрашивания цитокинов). - Подсчет количества клеток, секретирующих анализируемые цитокины (методом ELISPOT). • Анализ растворимых цитокинов и их антагонистов в биологических средах организма - Количественное определение цитокинов с помощью ИФА. - Тестирование биологической активности цитокинов на различных моделях (клеточные линии, клетки-мишени и др. ). - Иммуногистохимическое окрашивание цитокинов в тканях. - Определение соотношения оппозитных цитокинов (например, про- и противовоспалительных), а также цитокинов и их антагонистов. • Определение действия цитокинов на клетки-мишени - Выявление экспрессии рецепторов цитокинов и их генов (проточная цитофлюориметрия, ПЦР). - Анализ молекул, участвующих в передаче сигнала с рецепторов цитокинов в клетках-мишенях (ПЦР, иммуноблоттинг). - Анализ фенотипа и функциональной активности клеток-мишеней после действия на них конкретного цитокина (проточная цитофлюорометрия, методы биологического тестирования) Комплексный анализ системы цитокинов включает несколько последовательных этапов
• Анализ на уровне клеток-продуцентов (мононуклеарные клетки, лимфоциты, лейкоциты, макрофаги, ДК и др. ) Генный уровень - Исследование генов, которые ответственны за синтез цитокинов и их полиморфизмов, методами, основанными на ПЦР. - Идентификация адаптерных и других молекул, которые проводят сигнал, запускающий транскрипцию цитокиновых генов (ПЦР, иммуноблоттинг и др. ). Клеточный уровень - Выявление и определение количества клеток (Тh 1, Th 2, регуляторные Т- лимфоциты), содержащих цитокины (методом внутриклеточного окрашивания цитокинов). - Подсчет количества клеток, секретирующих анализируемые цитокины (методом ELISPOT). • Анализ растворимых цитокинов и их антагонистов в биологических средах организма - Количественное определение цитокинов с помощью ИФА. - Тестирование биологической активности цитокинов на различных моделях (клеточные линии, клетки-мишени и др. ). - Иммуногистохимическое окрашивание цитокинов в тканях. - Определение соотношения оппозитных цитокинов (например, про- и противовоспалительных), а также цитокинов и их антагонистов. • Определение действия цитокинов на клетки-мишени - Выявление экспрессии рецепторов цитокинов и их генов (проточная цитофлюориметрия, ПЦР). - Анализ молекул, участвующих в передаче сигнала с рецепторов цитокинов в клетках-мишенях (ПЦР, иммуноблоттинг). - Анализ фенотипа и функциональной активности клеток-мишеней после действия на них конкретного цитокина (проточная цитофлюорометрия, методы биологического тестирования) Комплексный анализ системы цитокинов включает несколько последовательных этапов
 ◦ Оценка пролиферативной активности клеток (стимуляция или подавление); ◦ Оценка цитотоксичности; ◦ Определение экспрессии мембранных рецепторов, синтеза других цитокинов и т. п. ◦ Оценка влияния на функциональную активность клеток (что всегда зависит от типа клеток и от изучаемого цитокина, например оценка хемотаксиса либо оценка завершенности фагоцитоза); ◦ Оценка противоинфекционного действия, как в случае интерферона. 1. Биологические методы
◦ Оценка пролиферативной активности клеток (стимуляция или подавление); ◦ Оценка цитотоксичности; ◦ Определение экспрессии мембранных рецепторов, синтеза других цитокинов и т. п. ◦ Оценка влияния на функциональную активность клеток (что всегда зависит от типа клеток и от изучаемого цитокина, например оценка хемотаксиса либо оценка завершенности фагоцитоза); ◦ Оценка противоинфекционного действия, как в случае интерферона. 1. Биологические методы
 ИЛ 1 определяется в культуре моноцитов, стимулированных ЛПС Используются мыши инбредной линии C 3 H/He. J Тимоциты этих мышей стимулированы митогенами (конканавалин А=Кон. А, фитогемагглютинин=ФГА) и отвечают на ИЛ 2 и митогены Метод: последовательные 2 Х разведения суспензии тимоцитов в специальной среде и контрольных образцов; разведения переносят в 96 -луночные планшеты и инкубируют; затем вносят метку в культуру клеток и счетчиком определяют включение метки КС = M ср(образец)/Мср(контроль), Мср – среднее число имульсов в трех лунках Если КС 3, ИЛ 1 активен (с большой достоверностью) Определение биологической активности ИЛ 1
ИЛ 1 определяется в культуре моноцитов, стимулированных ЛПС Используются мыши инбредной линии C 3 H/He. J Тимоциты этих мышей стимулированы митогенами (конканавалин А=Кон. А, фитогемагглютинин=ФГА) и отвечают на ИЛ 2 и митогены Метод: последовательные 2 Х разведения суспензии тимоцитов в специальной среде и контрольных образцов; разведения переносят в 96 -луночные планшеты и инкубируют; затем вносят метку в культуру клеток и счетчиком определяют включение метки КС = M ср(образец)/Мср(контроль), Мср – среднее число имульсов в трех лунках Если КС 3, ИЛ 1 активен (с большой достоверностью) Определение биологической активности ИЛ 1
 Используемые клетки: клетки-фибробласты эмбрионов кур и человека, перевиваемые клетки диплоидных фибробластов человека, культура клеток L-929 Используемые вирусы: вирус энцефаломиелита мышей (ВЭМ), вирус везикулярного стоматита мыши Методика: культуру клеток в среде вносят в 96 - луночные планшеты и инкубируют для образования монослоя; далее проводят титрование исследуемых образцов путем 2 Х разведений на монослое; к образцам + ВЭМ и инкубируют их Уровень активности ИФН определяется по обратному значению максимального разведения образца Определение биологической активности ИФН
Используемые клетки: клетки-фибробласты эмбрионов кур и человека, перевиваемые клетки диплоидных фибробластов человека, культура клеток L-929 Используемые вирусы: вирус энцефаломиелита мышей (ВЭМ), вирус везикулярного стоматита мыши Методика: культуру клеток в среде вносят в 96 - луночные планшеты и инкубируют для образования монослоя; далее проводят титрование исследуемых образцов путем 2 Х разведений на монослое; к образцам + ВЭМ и инкубируют их Уровень активности ИФН определяется по обратному значению максимального разведения образца Определение биологической активности ИФН
 Для ИЛ-2 используют мышиную клеточную линия HT 2. ИЛ-2 определяют по способности : 1) поддерживать рост Т-лимфобластов, стимулированных митогеном 2) поддерживать длительный рост зависимой линии Т-клеток в культуре CTLL (линия цитотоксических Т-лимфоцитов) ИЛ-4 может усиливать синтез ДНК в В-клетках, стимулированных к пролиферации антителами к Ig. M. Биоанализ для определения И-2 и ИЛ-4.
Для ИЛ-2 используют мышиную клеточную линия HT 2. ИЛ-2 определяют по способности : 1) поддерживать рост Т-лимфобластов, стимулированных митогеном 2) поддерживать длительный рост зависимой линии Т-клеток в культуре CTLL (линия цитотоксических Т-лимфоцитов) ИЛ-4 может усиливать синтез ДНК в В-клетках, стимулированных к пролиферации антителами к Ig. M. Биоанализ для определения И-2 и ИЛ-4.
 Цитотоксический индекс: ЦИ = {(a b) a} 100% (a – количество живых клеток в контроле , b - количество живых клеток в опыте) В данном методе используются 2 контроля: ØПоложительный – рекомбинантный ФНО ØОтрицательный – клетки в культуральной среде Условная активность ФНО – значение обратного разведения образца, необходимого для получения 50% клеточной цитотоксичности Определение биологической активности ФНО
Цитотоксический индекс: ЦИ = {(a b) a} 100% (a – количество живых клеток в контроле , b - количество живых клеток в опыте) В данном методе используются 2 контроля: ØПоложительный – рекомбинантный ФНО ØОтрицательный – клетки в культуральной среде Условная активность ФНО – значение обратного разведения образца, необходимого для получения 50% клеточной цитотоксичности Определение биологической активности ФНО
 Методики количественного определения концентрации растворимых цитокинов в различных биологических жидкостях: Иммуноферментный анализ в различных модификациях (ИФА) Радиоиммунный анализ (РИА) Мультифакторный анализ Для анализа экспрессии цитокинов и их рецепторов на мембранах клеток, а также продукции цитокинов клетками в культуре и в тканях: 1. Цитофлюориметрические методы – для анализа экспрессии поверхностных молекул клеток (мембранных форм цитокинов и рецепторов цитокинов) и определения цитокинов в цитоплазме клеток. 2. Метод оценки продукции цитокинов – единичными клетками в культуре (ELISPOT). 3. Иммуноцитохимия и иммуногистохимия – для оценки содержания цитокинов в цитоплазме клеток на мазках и на срезах тканей. 2. Иммунохимические методы
Методики количественного определения концентрации растворимых цитокинов в различных биологических жидкостях: Иммуноферментный анализ в различных модификациях (ИФА) Радиоиммунный анализ (РИА) Мультифакторный анализ Для анализа экспрессии цитокинов и их рецепторов на мембранах клеток, а также продукции цитокинов клетками в культуре и в тканях: 1. Цитофлюориметрические методы – для анализа экспрессии поверхностных молекул клеток (мембранных форм цитокинов и рецепторов цитокинов) и определения цитокинов в цитоплазме клеток. 2. Метод оценки продукции цитокинов – единичными клетками в культуре (ELISPOT). 3. Иммуноцитохимия и иммуногистохимия – для оценки содержания цитокинов в цитоплазме клеток на мазках и на срезах тканей. 2. Иммунохимические методы
 Большинство иммуноферментных тест-систем адаптированы для работы с любыми биологическими жидкостями. Для измерения уровней цитокинов на системном уровне используют сыворотку или плазму крови. сыворотку крови Обычно их концентрации находятся на пределе чувствительности иммуноферментного метода; более целесообразно измерять их уровни в интересующих исследователя тканях или в биологических жидкостях (слезная жидкость, жидкость десневых карманов, смывы из полостей, моча, спинно-мозговая жидкость). жидкость Иммунохимические методы
Большинство иммуноферментных тест-систем адаптированы для работы с любыми биологическими жидкостями. Для измерения уровней цитокинов на системном уровне используют сыворотку или плазму крови. сыворотку крови Обычно их концентрации находятся на пределе чувствительности иммуноферментного метода; более целесообразно измерять их уровни в интересующих исследователя тканях или в биологических жидкостях (слезная жидкость, жидкость десневых карманов, смывы из полостей, моча, спинно-мозговая жидкость). жидкость Иммунохимические методы
 Уровень жидкости Тетраметилбензидин Стрептавидин-пероксидаза Вторые антитела, конъюгированные с биотином Цитокин Лунка планшета Оценка секреции ИФН г методом ELISPOT
Уровень жидкости Тетраметилбензидин Стрептавидин-пероксидаза Вторые антитела, конъюгированные с биотином Цитокин Лунка планшета Оценка секреции ИФН г методом ELISPOT
 Принцип работы большинства современных тест-систем заключатся в использовании «сэндвич» -варианта твердофазного иммуноферментного анализа. • Высоко специфичны; • Быстры (время постановки ИФА составляет менее 5 ч) • Относительно просты в исполнении; • Порог чувствительности достигает 0, 5 пкг/мл.
Принцип работы большинства современных тест-систем заключатся в использовании «сэндвич» -варианта твердофазного иммуноферментного анализа. • Высоко специфичны; • Быстры (время постановки ИФА составляет менее 5 ч) • Относительно просты в исполнении; • Порог чувствительности достигает 0, 5 пкг/мл.
 Метод РИА сходен с ИФА , но используются меченные радиоактивные изотопы. Чувствительность РИА достаточно высока, но в последнее время метод применяется редко. Для оценки уровня цитокинов используется также другая модификация стандартного ИФА с применением флюоресценции. Вместо цветного субстрата берется субстрат фермента пероксидазы, меняющий под действием фермента флюоресценцию(например, люминол). Радиоиммунный анализ.
Метод РИА сходен с ИФА , но используются меченные радиоактивные изотопы. Чувствительность РИА достаточно высока, но в последнее время метод применяется редко. Для оценки уровня цитокинов используется также другая модификация стандартного ИФА с применением флюоресценции. Вместо цветного субстрата берется субстрат фермента пероксидазы, меняющий под действием фермента флюоресценцию(например, люминол). Радиоиммунный анализ.
 Преимущества метода: Одновременный анализ до 100 цитокинов в одном образце Многократное уменьшение объема исследуемого образца Увеличение воспроизводимости результатов Экономия времени, снижение стоимости исследования и трудозатрат Мультифакторный анализ
Преимущества метода: Одновременный анализ до 100 цитокинов в одном образце Многократное уменьшение объема исследуемого образца Увеличение воспроизводимости результатов Экономия времени, снижение стоимости исследования и трудозатрат Мультифакторный анализ
 Мультифакторный анализ Иммуноанализ типа «сэндвич» , в котором антитело связанно с поверхностью микрочастицы (микрошарики, микрочипы) Сходный принцип с ИФА Микрочастицы различного размера (диаметр 4, 4 и 5, 5 мкм) Отдельные виды микрочастиц можно идентифицировать по отличающейся интенсивности флюоресценции и размеру
Мультифакторный анализ Иммуноанализ типа «сэндвич» , в котором антитело связанно с поверхностью микрочастицы (микрошарики, микрочипы) Сходный принцип с ИФА Микрочастицы различного размера (диаметр 4, 4 и 5, 5 мкм) Отдельные виды микрочастиц можно идентифицировать по отличающейся интенсивности флюоресценции и размеру
 Принцип метода: ◦ Первые антитела сорбированы на микрошариках; вторые антитела могут быть помечены разными флюорохромами или другими метками, что позволяет проводить измерение уровней сразу нескольких цитокинов; ◦ Далее принцип реакции похож на стандартный ИФА в планшетах Вторые антитела, меченные флюоресцеином цитокин Первые антитела микрошарик Мультифакторный анализ
Принцип метода: ◦ Первые антитела сорбированы на микрошариках; вторые антитела могут быть помечены разными флюорохромами или другими метками, что позволяет проводить измерение уровней сразу нескольких цитокинов; ◦ Далее принцип реакции похож на стандартный ИФА в планшетах Вторые антитела, меченные флюоресцеином цитокин Первые антитела микрошарик Мультифакторный анализ

 Методика определения синтеза цитокинов изолированными клетками: (0, 6 мл) Свежая венозная кровь, взятая в емкость с гепарином – тщательно перемешивают и разводят в 5 раз средой RPMI 1640 (2, 4 мл) – добавляют 2 м. М глутамина и 80 мкг/мл гентамицина. В качестве индуктора синтеза группы провоспалительных цитокинов (IL-1, IL-6, TNF), IL-10, IFN- и хемокинов могут быть использованы препараты ЛПС в концентрации 1 -10 мкг/мл. В качестве индукторов синтеза IL-2, IL-4, IFN-γ и других Т- клеточных цитокинов может служить ФГА (50 мкг/мл). 1. индуктор 2. разведенная кровь 37 о. С, 5%СО 2 исследование содержания отбор супернатанта цитокинов в биологическом 24 ч или иммуноферментном тесте У больных подсчитывают количество лейкоцитов и формулу крови по стандартным методикам. Полученные данные пересчитывают на 1 млн лейкоцитов либо мононуклеаров, лимфоцитов или других интересующих клеток в 1 мл крови(с учетом разведений). 3. Определение продукции цитокинов клетками
Методика определения синтеза цитокинов изолированными клетками: (0, 6 мл) Свежая венозная кровь, взятая в емкость с гепарином – тщательно перемешивают и разводят в 5 раз средой RPMI 1640 (2, 4 мл) – добавляют 2 м. М глутамина и 80 мкг/мл гентамицина. В качестве индуктора синтеза группы провоспалительных цитокинов (IL-1, IL-6, TNF), IL-10, IFN- и хемокинов могут быть использованы препараты ЛПС в концентрации 1 -10 мкг/мл. В качестве индукторов синтеза IL-2, IL-4, IFN-γ и других Т- клеточных цитокинов может служить ФГА (50 мкг/мл). 1. индуктор 2. разведенная кровь 37 о. С, 5%СО 2 исследование содержания отбор супернатанта цитокинов в биологическом 24 ч или иммуноферментном тесте У больных подсчитывают количество лейкоцитов и формулу крови по стандартным методикам. Полученные данные пересчитывают на 1 млн лейкоцитов либо мононуклеаров, лимфоцитов или других интересующих клеток в 1 мл крови(с учетом разведений). 3. Определение продукции цитокинов клетками
 Определение рецепторов и мембранных форм цитокинов Определение внутриклеточных цитокинов ◦ Блокирование клеточного метаболизма ◦ Фиксация клеток ◦ Пермебиализация клеточной мембраны (используется сапонин в сочетании с блокаторами обратного транспорта (брефелдин А или монензин) для предотвращения экскреции антител из цитоплазмы клеток). Изучение продукции цитокинов клетками методом проточной цитометрии
Определение рецепторов и мембранных форм цитокинов Определение внутриклеточных цитокинов ◦ Блокирование клеточного метаболизма ◦ Фиксация клеток ◦ Пермебиализация клеточной мембраны (используется сапонин в сочетании с блокаторами обратного транспорта (брефелдин А или монензин) для предотвращения экскреции антител из цитоплазмы клеток). Изучение продукции цитокинов клетками методом проточной цитометрии
 Может дать дополнительную информацию о состоянии местного иммунитета Иммуногистохимические методы с использованием специфических поликлональных или моноклональных антител к цитокинам Цитокины могут быть обнаружены в цитоплазме клеток в мазках клеточных суспензий; кусочки тканей обычно глубоко замораживают, а затем готовят срезы толщиной 4 -6 мкм в криостате(- 20 о. С) 4. Определение уровней цитокинов в тканях
Может дать дополнительную информацию о состоянии местного иммунитета Иммуногистохимические методы с использованием специфических поликлональных или моноклональных антител к цитокинам Цитокины могут быть обнаружены в цитоплазме клеток в мазках клеточных суспензий; кусочки тканей обычно глубоко замораживают, а затем готовят срезы толщиной 4 -6 мкм в криостате(- 20 о. С) 4. Определение уровней цитокинов в тканях
 Метод непрямой иммуногистохимии: ◦ Изучение локализации цитокинов в клетках; с использованием специфических антител к цитокинам ◦ На втором этапе используют антивидовые антитела, меченные флюорохромами (для люминесцентной микроскопии), (возможно выявление как цитоплазматических цитокинов, так и их мембранных форм) или ферментами (для световой микроскопии) В случае ферментов используют биотинилированные антивидовые АТ, а на последнем этапе – стрептавидин-пероксидаза либо стрептавидин-щелочная фосфатаза. Определение уровней цитокинов в тканях
Метод непрямой иммуногистохимии: ◦ Изучение локализации цитокинов в клетках; с использованием специфических антител к цитокинам ◦ На втором этапе используют антивидовые антитела, меченные флюорохромами (для люминесцентной микроскопии), (возможно выявление как цитоплазматических цитокинов, так и их мембранных форм) или ферментами (для световой микроскопии) В случае ферментов используют биотинилированные антивидовые АТ, а на последнем этапе – стрептавидин-пероксидаза либо стрептавидин-щелочная фосфатаза. Определение уровней цитокинов в тканях
 Иммуноцитохимический метод выявления клеток, синтезирующих ИЛ-1β, среди изолированных мононуклеаров крови человека после стимуляции ЛПС
Иммуноцитохимический метод выявления клеток, синтезирующих ИЛ-1β, среди изолированных мононуклеаров крови человека после стимуляции ЛПС

 Определение экспрессии генов цитокинов по накоплению м. РНК; Специфические олигонуклеотидные зонды (от нескольких нуклеотидов до целой к. ДНК, соответствующей гену искомого цитокина) При использовании метода гибридизации in situ на свежих криосрезах тканей или мазках клеток для выявления локализации м. РНК цитокинов могут использоваться комплементарные РНК-зонды для РНК- гибридизации. 5. Молекулярно-биологические методы изучения цитокинов
Определение экспрессии генов цитокинов по накоплению м. РНК; Специфические олигонуклеотидные зонды (от нескольких нуклеотидов до целой к. ДНК, соответствующей гену искомого цитокина) При использовании метода гибридизации in situ на свежих криосрезах тканей или мазках клеток для выявления локализации м. РНК цитокинов могут использоваться комплементарные РНК-зонды для РНК- гибридизации. 5. Молекулярно-биологические методы изучения цитокинов
 • При использовании метода гибридизации in situ на свежих криосрезах тканей или мазках клеток для выявления локализации м. РНК цитокинов могут использоваться комплементарные РНК-зонды для РНК-гибридизаци. • метод позволяет определять количество и тип клеток • наличие м. РНК необязательно отражает присутствие цитокина в клетке, необходима комбинация методов, позволяющих оценитьи эксперссию м. РНК и синтез данного цитокина Гибридизация in situ для выявления клеток, содержащих м. РНК ИЛ-1β, среди мононуклеаров крови человека
• При использовании метода гибридизации in situ на свежих криосрезах тканей или мазках клеток для выявления локализации м. РНК цитокинов могут использоваться комплементарные РНК-зонды для РНК-гибридизаци. • метод позволяет определять количество и тип клеток • наличие м. РНК необязательно отражает присутствие цитокина в клетке, необходима комбинация методов, позволяющих оценитьи эксперссию м. РНК и синтез данного цитокина Гибридизация in situ для выявления клеток, содержащих м. РНК ИЛ-1β, среди мононуклеаров крови человека
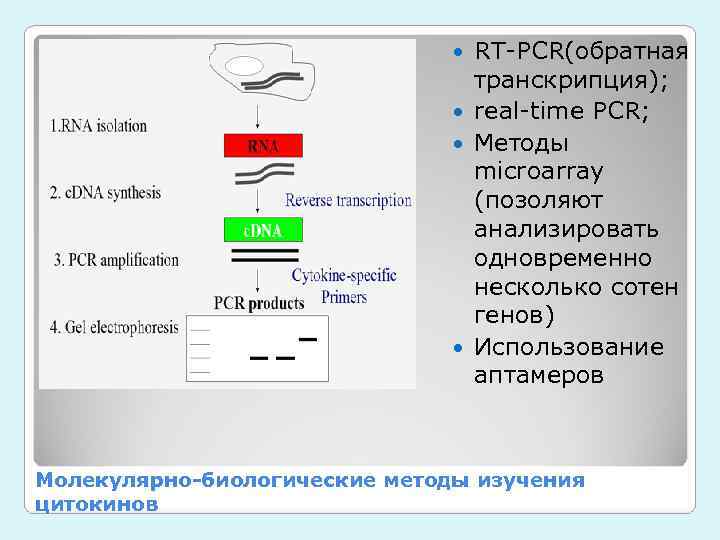 RT-PCR(обратная транскрипция); real-time PCR; Методы microarray (позоляют анализировать одновременно несколько сотен генов) Использование аптамеров Молекулярно-биологические методы изучения цитокинов
RT-PCR(обратная транскрипция); real-time PCR; Методы microarray (позоляют анализировать одновременно несколько сотен генов) Использование аптамеров Молекулярно-биологические методы изучения цитокинов
 Аптамеры - олигонуклеотиды, полученные по технологии SELEX. Используют для количественной оценки уровня цитокинов, в том числе в модификации ИФА, где вместо антител в качестве распознающих цитокины молекул используются аптамеры
Аптамеры - олигонуклеотиды, полученные по технологии SELEX. Используют для количественной оценки уровня цитокинов, в том числе в модификации ИФА, где вместо антител в качестве распознающих цитокины молекул используются аптамеры
 Изменение соотношения клеток, продуцирующих различные цитокины, может отражать патогенез заболевания и служить критерием прогноза заболевания и оценки проводимой терапии. Методом внутриклеточного окрашивания определяют экспрессию цитокина на уровне одной клетки. Проточная цитофлуориметрия позволяет подсчитать количество клеток, экспрессирующих тот или иной цитокин. 6. Внутриклеточное окрашивание
Изменение соотношения клеток, продуцирующих различные цитокины, может отражать патогенез заболевания и служить критерием прогноза заболевания и оценки проводимой терапии. Методом внутриклеточного окрашивания определяют экспрессию цитокина на уровне одной клетки. Проточная цитофлуориметрия позволяет подсчитать количество клеток, экспрессирующих тот или иной цитокин. 6. Внутриклеточное окрашивание
 Имеются некоторые ограничения: ü с их помощью невозможно анализировать синтез цитокинов единичной клеткой, üневозможно определить количество цитокинпродуцирующих клеток в субпопуляции, üневозможно определить, экспрессируют ли цитокинпродуцирующие клетки уникальные маркеры, üсинтезируются ли различные цитокины разными клетками или одними и теми же.
Имеются некоторые ограничения: ü с их помощью невозможно анализировать синтез цитокинов единичной клеткой, üневозможно определить количество цитокинпродуцирующих клеток в субпопуляции, üневозможно определить, экспрессируют ли цитокинпродуцирующие клетки уникальные маркеры, üсинтезируются ли различные цитокины разными клетками или одними и теми же.
 Врожденные нарушения регуляции Цитокин-зависимый ПИД: наследственный дефект гена гамма цепи рецептора ИЛ-2(делеция АКО 62, 81) Х- сцепленный ТКИД (характеризуется отсутствиемпадением содержания Тлф и резким снижением показателей клеточного и гуморального иммунитета) Дефицит альфа субъединицы ИЛ-7 ТКИД(снижение кол-ва Тлф, но нормальные показатели Влф, НК) Нарушения в системе ИЛ-12, 23, ИФНг и их R повышенная восприимчивость к инфекциям, вызываемых микобактериями и сальмонеллами, Listeria monocytogenes. 7. Роль цитокинов в патогенезе заболеваний
Врожденные нарушения регуляции Цитокин-зависимый ПИД: наследственный дефект гена гамма цепи рецептора ИЛ-2(делеция АКО 62, 81) Х- сцепленный ТКИД (характеризуется отсутствиемпадением содержания Тлф и резким снижением показателей клеточного и гуморального иммунитета) Дефицит альфа субъединицы ИЛ-7 ТКИД(снижение кол-ва Тлф, но нормальные показатели Влф, НК) Нарушения в системе ИЛ-12, 23, ИФНг и их R повышенная восприимчивость к инфекциям, вызываемых микобактериями и сальмонеллами, Listeria monocytogenes. 7. Роль цитокинов в патогенезе заболеваний
 SNP(single nucleotide polymorphism)-важный диагностический маркер, который определяется МБМ, т. к. не удаляется ЕО и сохраняется в популяции. Ген ФНО: замены -308(Г А) и -238(Г А) в нетранслируемой области в зоне промоторных участков. Приводит к увеличению продукции ФНО в 2 -5 раз. В 4 раза чаще встречается у больных с тяжело протекающей церебральной формой малярии, в 7 -8 раз у больных с развившимися тяжелыми нарушениями НС Функциональный полиморфизм генов цтк
SNP(single nucleotide polymorphism)-важный диагностический маркер, который определяется МБМ, т. к. не удаляется ЕО и сохраняется в популяции. Ген ФНО: замены -308(Г А) и -238(Г А) в нетранслируемой области в зоне промоторных участков. Приводит к увеличению продукции ФНО в 2 -5 раз. В 4 раза чаще встречается у больных с тяжело протекающей церебральной формой малярии, в 7 -8 раз у больных с развившимися тяжелыми нарушениями НС Функциональный полиморфизм генов цтк
 Ревматоидный артрит-поражение синовиальной оболочки, хрящевой и костной ткани суставов. У больных с РА в синовиальной оболочке обнаружены плазмоцитоидные и миелоидные ДК, МФ, которые синтезируют широкий спектр цтк, способных индуцировать дифференцировку наивных Тлф. Ключевой медиатор- ФНО и ИЛ 1. ФНО вызывает функциональную активацию синовиальных фибробластов, эндотелаильных клеток и привлечение Лц, синтез цтк, воспаление и ремоделирование ткани сустава. Вмешивается в метаболизм липидов, вызывая кахексию. Ил-6 стимулирует синтез острофазных белков в печени. Роль в развитии аутоиммунной патологии
Ревматоидный артрит-поражение синовиальной оболочки, хрящевой и костной ткани суставов. У больных с РА в синовиальной оболочке обнаружены плазмоцитоидные и миелоидные ДК, МФ, которые синтезируют широкий спектр цтк, способных индуцировать дифференцировку наивных Тлф. Ключевой медиатор- ФНО и ИЛ 1. ФНО вызывает функциональную активацию синовиальных фибробластов, эндотелаильных клеток и привлечение Лц, синтез цтк, воспаление и ремоделирование ткани сустава. Вмешивается в метаболизм липидов, вызывая кахексию. Ил-6 стимулирует синтез острофазных белков в печени. Роль в развитии аутоиммунной патологии

 У больных в ПК выше число клонов Тлф, синтезирующих ИЛ-3, 4, 5, 6, ФНО. Бронхиальная астма- ИЛ 4, 5, 13(Тх2) Обнаружение в пуповинной крови ИФНг, связано с низким риском развития БА. Определение уровня и продукции цтк у детей раннего возраста может быть важным эдементом диагностики для выявления предрасположенности к аллергии. Цтк и аллергия
У больных в ПК выше число клонов Тлф, синтезирующих ИЛ-3, 4, 5, 6, ФНО. Бронхиальная астма- ИЛ 4, 5, 13(Тх2) Обнаружение в пуповинной крови ИФНг, связано с низким риском развития БА. Определение уровня и продукции цтк у детей раннего возраста может быть важным эдементом диагностики для выявления предрасположенности к аллергии. Цтк и аллергия
 Цтк служат важными мишенями иммунодиагностики многих заболеваний. Изучение уровня цтк позволяет получить информацию о функциональной активности различных иммунокомпетентных клеток, тяжести воспаления, его переходе на системный уровень и прогнозе, соотношении процессов активации Тх. Оценка функционирования цтк позволяет по- новому подойти к изучению состояния ИС организма в клинической практике. Заключение
Цтк служат важными мишенями иммунодиагностики многих заболеваний. Изучение уровня цтк позволяет получить информацию о функциональной активности различных иммунокомпетентных клеток, тяжести воспаления, его переходе на системный уровень и прогнозе, соотношении процессов активации Тх. Оценка функционирования цтк позволяет по- новому подойти к изучению состояния ИС организма в клинической практике. Заключение


