
Обзор КИМов ЕГЭ 2009 год часть С

Используя метод электронного баланса, составьте уравнение реакции… Определите окислитель и восстановитель.

Задания первой волны KMn. O 4 + Mn. SO 4 + H 2 O = Mn. O 2 + … KNO 2 + … + H 2 O = Mn. O 2 + … + KOH I 2 + K 2 SO 3 + … = K 2 SO 4 + … + H 2 O Cr 2 O 3 + … + KOH = KNO 2 + K 2 Cr. O 4 + … Zn + KNO 3 + … = NH 3 + K 2 Zn. O 2 + … SO 2 + KMn. O 4 + … = Mn. SO 4 + … + H 2 SO 4

Задания первой волны KMn. O 4 + Mn. SO 4 + H 2 O = Mn. O 2 + … 3 KNO 2 +2 KMn. O 4 + H 2 O = 2 Mn. O 2 +3 KNO 3 + 2 KOH +3 +5 N -2ē→N × 3 +7 +4 Mn +3ē→Mn × 2

Задания первой волны I 2 + K 2 SO 3 +2 KOH = K 2 SO 4 + 2 KI + H 2 O Cr 2 O 3 + 3 HNO 3 + 7 KOH = 3 KNO 2 + 2 K 2 Cr. O 4 + +5 H 2 O +3 +6 Cr -3ē→Cr × 2 N+5 +8ē→ N-3 × 3

Задания первой волны Zn + KNO 3 + … = NH 3 + K 2 Zn. O 2 + … 5 SO 2 + 2 KMn. O 4 + 3 H 2 SO 4 = 2 Mn. SO 4 + + K 2 SO 4 +5 SO 3+ 3 H 2 O +4 +6 S -2ē→S × 5 +7 +2 Mn +5ē→Mn × 2

Задания второй волны Na 2 SO 3 + KIO 3 + … = … + K 2 SO 4 + … + H 2 O Cr 2(SO 4)3 + KMn. O 4 + … = K 2 Cr. O 4 + … + +K 2 SO 4 + H 2 O Fe. SO 4 + KCl. O 3 + … = K 2 Fe. O 4 + … + K 2 SO 4 + … K 2 Cr 2 O 7 + … + H 2 O = Cr(OH)3 + Na 2 SO 4 + …

Задания второй волны 5 Na 2 SO 3 + 2 KIO 3 + H 2 SO 4 = 5 Na 2 SO 4 + K 2 SO 4 + I 2+ H 2 O +4 +6 S -2ē→S +5 0 2 I +10ē→I 2 × 5 × 1

Задания второй волны Cr 2(SO 4)3 +6 KMn. O 4 +16 KOH= 2 K 2 Cr. O 4 + 6 K 2 Mn. O 4 +3 K 2 SO 4 + 8 H 2 O +3 +6 2 Cr -6ē→ 2 Cr +7 +6 Mn + ē→Mn × 1 × 6

Задания второй волны Na 2 SO 3 + KIO 3 + … = … + K 2 SO 4 + … + H 2 O Cr 2(SO 4)3 + KMn. O 4 + … = K 2 Cr. O 4 + … + +K 2 SO 4 + H 2 O Fe. SO 4 + KCl. O 3 + … = K 2 Fe. O 4 + … + K 2 SO 4 + … K 2 Cr 2 O 7 + … + H 2 O = Cr(OH)3 + Na 2 SO 4 + …

Задания второй волны Na 2 SO 3 + KIO 3 + … = … + K 2 SO 4 + … + H 2 O Cr 2(SO 4)3 + KMn. O 4 + … = K 2 Cr. O 4 + … + +K 2 SO 4 + H 2 O Fe. SO 4 + KCl. O 3 + … = K 2 Fe. O 4 + … + K 2 SO 4 + … K 2 Cr 2 O 7 + … + H 2 O = Cr(OH)3 + Na 2 SO 4 + …


Даны вещества… Напишите уравнения четырех возможных реакций между этими веществами.

Задания первой волны • • • Cu. S, O 2, Cl 2, HNO 3 конц. , H 2 SO 4 конц. Cu. Cl 2, O 2, H 2 SO 4 конц. , HI Mn. SO 4, Na. Mn. O 4, Na. OH, P 2 O 5 HCl конц. , HNO 3 конц. , S, Fe(OH)2 Водные растворы KMn. O 4, Na 2 SO 3, Ba. Cl 2, HNO 3 конц. , Cu • HBr, Na. Mn. O 4, Na. OH, Br 2

Задания второй волны • • Na. NO 2, NH 4 Cl, Na. OH, Fe. Cl 2, Si Cu. SO 4, KI, Mg, H 2 SO 4 конц. Al 2 S 3, HNO 3 конц. , HCl, C HNO 3 конц. , растворы: Na 2 CO 3, Fe. Cl 3, Na 2 S • Br 2, Zn, растворы: Na 2 Cr 2 O 7, KOH • K 2 Cr 2 O 7, H 2 SO 4 конц. , Na. F, Rb. OH

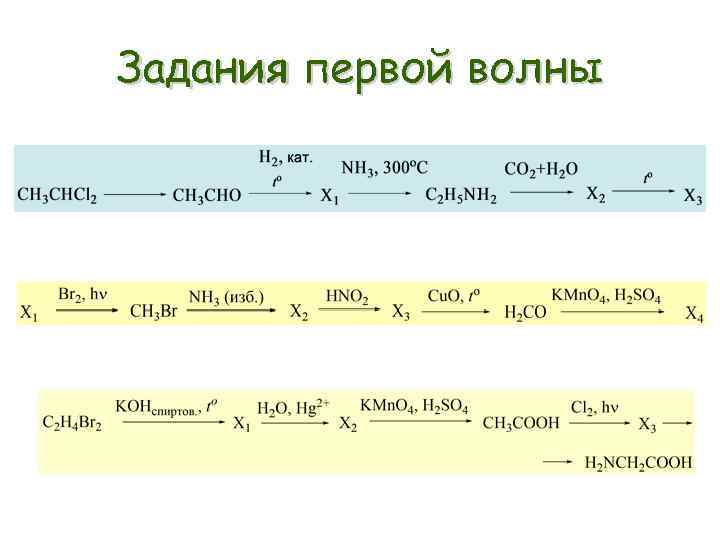
Задания первой волны
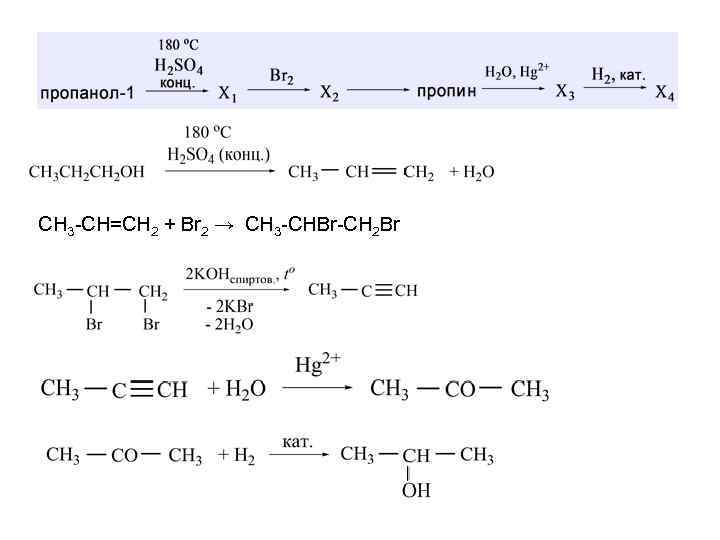
1 CH 3 -CH=CH 2 + Br 2 → CH 3 -CHBr-CH 2 Br
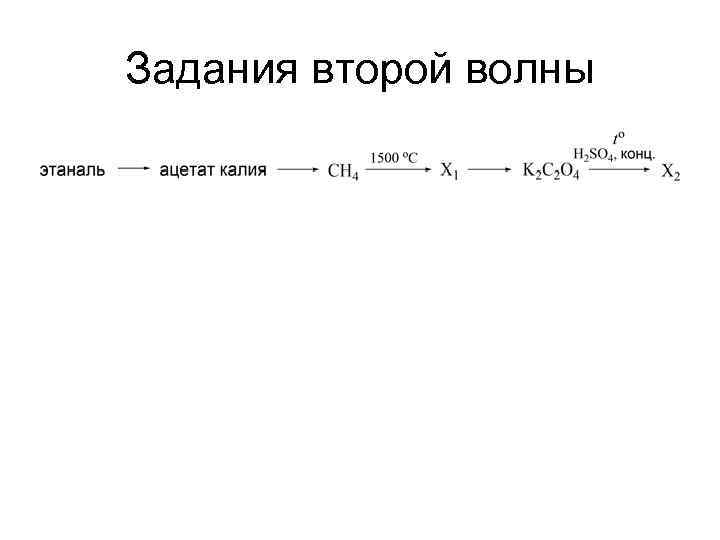
Задания второй волны


1 • Нитрит натрия массой 13, 8 г внесли при нагревании в 220 г раствора хлорида аммония с массовой долей 10%. Какой объем (н. у. ) азота выделится при этом и какова массовая доля хлорида аммония в образовавшемся растворе? Ответ: w(NH 4 Cl) = 4, 9%

2 • Нитрит калия массой 8, 5 г внесли при нагревании в 270 г раствора бромида аммония с массовой долей 12%. Какой объем (н. у. ) азота выделится при этом и какова массовая доля бромида аммония в получившемся растворе? Ответ: V(N 2) = 2, 24 л, w(NH 4 Br) = 8, 2%

3 • Смешали 300 мл раствора серной кислоты с массовой долей 10% (плотностью 1, 05 г/мл) и 200 мл раствора гидроксида калия с массовой долей 20% (плотностью 1, 10 г/мл). Какой объем воды следует добавить к полученной смеси, чтобы массовая доля соли в ней составила 7%? Ответ: V = 262, 9 л

4 • В 120 мл раствора азотной кислоты с массовой долей 7% (плотностью 1, 03 г/мл) внесли 12, 8 г карбида кальция. Какой объем 20%-ной соляной кислоты (плотностью 1, 10 г/мл) следует добавить к полученной смеси для её полной нейтрализации? Ответ: V = 43, 1 мл

5 • При взаимодействии в сернокислой среде 8, 7 г диоксида марганца с 22, 4 г бромида калия выделился бром, практический выход которого составил 88%. Какой объем (н. у. ) этилена может прореагировать с полученным количеством брома? Ответ: V = 1, 86 л

6 • При сливании 160 г раствора нитрата бария с массовой долей 10% и 50 г раствора хромата калия с массовой долей 11% выпал осадок. Рассчитайте массовую долю нитрата калия в образовавшемся растворе. Ответ: w = 2, 8%

7 • Рассчитайте, какую массу карбида алюминия следует добавить к 150 г 21% -ного раствора азотной кислоты, чтобы массовая доля кислоты уменьшилась в 3 раза. Ответ: m(Al 4 C 3) = 3, 96 г

8 • Карбид алюминия массой 1, 44 г растворили в 150 г 21%-ного раствора азотной кислоты. Рассчитайте массовую долю кислоты в получившемся растворе. Ответ: w(HNO 3) = 15, 9 %

9 • Смешали 300 мл 7%-ного раствора карбоната натрия (плотностью 1, 03 г/мл) и 200 мл 15%-ного раствора хлорида бария (плотностью 1, 07 г/мл). Определите массовую долю хлорида натрия в образовавшемся растворе. Ответ: w(Na. Cl) = 3, 66%

10 • Смешали 300 мл раствора карбоната натрия с массовой долей 7% (плотностью 1, 03 г/мл) и 200 мл раствора хлорида бария с массовой долей 15% (плотностью 1, 07 г/мл). Определите массовую долю карбоната натрия в образовавшемся растворе. Ответ: w = 1, 1%.


1 • Ацетиленовый углеводород может максимально присоединить 80 г брома с образованием продукта реакции массой 97 г. Установите молекулярную формулу этого углеводорода. Ответ: C 5 H 8

2 Установите молекулярную формулу предельного трехатомного спирта, массовая доля водорода в котором равна 10%. Ответ: C 5 H 9(OH)3

3 • Предельный одноатомный спирт сожгли. В результате реакции получили 22, 4 л (н. у. ) углекислого газа и 22, 5 г водяных паров. Определите молекулярную формулу исходного спирта. Ответ: C 4 H 9 OH

4 • При окислении предельного одноатомного спирта оксидом меди(II) получили 9, 73 г альдегида, 8, 65 г меди и воду. Определите молекулярную формулу исходного спирта. Ответ: С 4 H 9 OH

5 При взаимодействии 18, 5 г предельной одноосновной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5, 6 л (н. у. ) газа. Определите молекулярную формулу кислоты. Ответ: С 2 H 5 COOH

6 • При дегидратации предельного одноатомного спирта получили простой эфир с массовой долей водорода 13, 73%. Определите молекулярную формулу исходного спирта. Ответ: С 3 H 7 OH

7 • Установите молекулярную формулу исходного диена, относительная плотность паров которого по воздуху равна 1, 862. Ответ: С 4 H 6

8 • Установите молекулярную формулу исходного диена, относительная плотность паров которого по воздуху равна 1, 38. Ответ: С 3 H 4

9 • При полном сгорании углеводорода образовалось 27 г воды и 33, 6 г углекислого газа (н. у. ). Относительная плотность углеводорода по аргону равна 1, 05. Установите его молекулярную формулу. Ответ: С 3 Н 6

10

Спасибо за внимание!