b46be8097cce5a89d1279573ed581ffb.ppt
- Количество слайдов: 37

ОБЯЗАННОСТИ СПОНСОРА. МОНИТОРИНГ. АУДИТ. Распутняк Сергей Сергеевич

СПОНСОР: • физическое лицо / компания / организация, • инициатор начала КИ, • отвечает за организацию, контроль и/или финансирование КИ КОНТРАКТНАЯ ИССЛЕДОВАТЕЛЬСКАЯ ОРГАНИЗАЦИЯ (КИО): • физическое лицо / организация • в рамках договора со Спонсором • выполняет одну или несколько его обязанностей или функций, связанных с проведением КИ

ОБЯЗАННОСТИ СПОНСОРА. - внедрение системы мер по обеспечению и контролю качества КИ ICH GCP, 5. 1. 1 ОБЕСПЕЧЕНИЕ (ГАРАНТИЯ) КАЧЕСТВА КИ – комплекс мероприятий для обеспечения соблюдения правил GCP и действующих нормативных требований в процессе КИ, сбора данных, документального оформления и представления результатов КИ ICH GCP, 1. 46
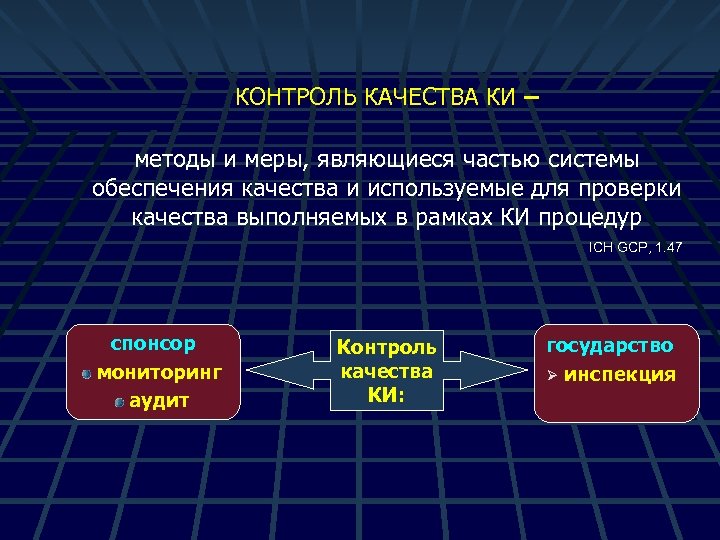
КОНТРОЛЬ КАЧЕСТВА КИ – методы и меры, являющиеся частью системы обеспечения качества и используемые для проверки качества выполняемых в рамках КИ процедур ICH GCP, 1. 47 спонсор мониторинг аудит Контроль качества КИ: государство Ø инспекция

ОБЯЗАННОСТИ СПОНСОРА. - получение письменного согласия на предоставление прямого доступа: ü на всех клинических базах, участвующих в КИ ü ко всем первичным документам - для мониторинга, аудита - инспекции ICH GCP, 5. 1. 2 ПРЯМОЙ ДОСТУП – разрешение на изучение, анализ, проверку и копирование каких-либо записей и отчетов, необходимых для оценки КИ. ICH GCP, 1. 2. 1 соблюдение нормативных требований по сохранению анонимности испытуемых и конфиденциальности информации, принадлежащей спонсору

ОБЯЗАННОСТИ СПОНСОРА. ДО НАЧАЛА ИССЛЕДОВАНИЯ ð Выбор исследователей (5. 6. 1. ) ð Протокол и Брошюра исследователя (5. 6. 2. ) ð Письменные соглашения (5. 6. 3. ): Ö выполнять нормативные требования и GCP Ö соблюдать процедуры сбора/предоставления данных Ö согласие на мониторинг, аудит, инспекцию Ö хранить документацию до уведомления об истечении срока хранения не менее 2 лет после утверждения последней заявки на лицензирование ЛС в стране участнице ICH, или не менее 2 лет после официального прекращения клинической разработки ИЛС

ОБЯЗАННОСТИ СПОНСОРА. ДО НАЧАЛА ИССЛЕДОВАНИЯ ð Распределение функций и обязанностей (5. 7. ) ð Выплаты испытуемым и исследователям (5. 8. ) ð Финансирование (5. 9. ) ð Подача заявки в уполномоченный регуляторный орган (5. 10. ) ð Решение Этического комитета (5. 10. ) Ö название и адрес ЭК Ö заявление о приверженности GCP Ö одобрение ЭК

ОБЯЗАННОСТИ СПОНСОРА. В ХОДЕ ИССЛЕДОВАНИЯ ð Обеспечение исследователя исследуемым ЛП (5. 13. , 5. 14. ) ð Обновления Брошюры исследователя (5. 12. 2. ) ð Информация по безопасности (5. 16. ) ð Своевременно направлять отчеты обо всех серьезных и непредвиденных ПР на ИЛП всем участвующим в КИ исследователям, ГФЦ МЗ Украины, ЭК (5. 17. )

ОБЯЗАННОСТИ СПОНСОРА. ОБРАЩЕНИЕ С ИССЛЕДУЕМЫМ ПРЕПАРАТОМ СПОНСОР ОБЕСПЕЧИВАЕТ: Изготовление, упаковка и маркировка (в соответствии с GMP и нормативными требованиями) Сертификат качества Брошюра исследователя Инструкция по применению и хранению Система регистрации данных об ИЛП Своевременная поставка ИЛП

ОБЯЗАННОСТИ СПОНСОРА. ОБРАЩЕНИЕ С ИССЛЕДУЕМЫМ ПРЕПАРАТОМ ОБЯЗАННОСТИ СПОНСОРА: - Спонсор должен указать температуру, срок и условия хранения ИЛП…довести эти требования до всех участников исследования… ICH GCP 5. 13. 2 - Упаковка ИЛП должна защищать его от загрязнения или порчи при транспортировке и хранении ICH GCP 5. 13. 3 - В рамках слепых исследований…возможность идентифицировать препарат в случае неотложных состояний… ICH GCP 5. 13. 4

ОБЯЗАННОСТИ СПОНСОРА. ПОСЛЕ ИССЛЕДОВАНИЯ ð Прекращение или приостановка (5. 21. ). Сообщить: ü исследователю, ü ГФЦ МЗ Украины, ü ЭК ð Заключительный отчет о КИ (5. 22. ) ð Уведомления об истечении срока хранения документации

ОБЯЗАННОСТИ СПОНСОРА. В ХОДЕ ИССЛЕДОВАНИЯ ð Мониторинг (5. 18. ) ð Аудит (5. 19)

МОНИТОРИНГ СОП протоко МОНИТОРИНГ (1. 38. ) – ы л процедуры: GC P • контроля за ходом КИ законодательств о • обеспечения выполнения КИ • сбора данных • представления результатов исследования МОНИТОР – Лицо, назначаемое спонсором или КИО, контролирующее проведение КИ в соответствии с протоколом основное связующее звено между спонсором и исследователем

МОНИТОРИНГ ЗАДАЧИ (5. 18. 1. ) убедиться в том, что: ò обеспечена охрана прав и здоровья испытуемых ò полученные данные точные, полные и не противоречат первичной документации ò исследование проводится в соответствии с утвержденным протоколом, GCP и действующими нормативными требованиями

МОНИТОРИНГ Назначение мониторов и их квалификация (5. 18. 2. ) ï назначаются спонсором ï подготовка, медицинские знания (подтверждение в CV) ï ознакомлен с ИЛС, протоколом, формой письменного информированного согласия, СОПами, правилами GCP, действующими нормативными требованиями

МОНИТОРИНГ Объем и особенности мониторинга (5. 18. 3. ) Спонсор обязан обеспечить проведение мониторинга Определяет: l объем зависят от l особенности ï цели ï задачи ï дизайн ï сложность ï «слепоты» ï количества испытуемых ï конечных точек КИ до начала КИ % во время КИ % после окончания КИ %
![МОНИТОРИНГ Специфические требования к проведению мониторинга ] периодические посещения КБ ] проверка комплектации документов, МОНИТОРИНГ Специфические требования к проведению мониторинга ] периодические посещения КБ ] проверка комплектации документов,](https://present5.com/presentation/b46be8097cce5a89d1279573ed581ffb/image-17.jpg)
МОНИТОРИНГ Специфические требования к проведению мониторинга ] периодические посещения КБ ] проверка комплектации документов, согласно нормативным требованиям ] документирование каждого посещения КБ ] составление отчетов о посещении КБ

До начала КИ МОНИТОРИНГ МОНИТОР должен убедиться, что исследователи имеют: квалификацию и навыки проведения КИ; необходимый штат помощников; время и желание проводить КИ; достаточное количество пациентов, подходящих для включения в данное КИ; соответствующее оборудование, включая лабораторное, необходимое для выполнения требований протокола КИ.

МОНИТОРИНГ До начала КИ МОНИТОР обсуждает: протокол и процедуры КИ; правила GCP; получение информированного согласия пациентов; особенности заполнения ИРФ; соблюдение условий получения, хранения, учета, возврата исследуемого ЛП; предоставление в регуляторные органы и заказчику своевременной информации о серьезных или непредвиденных ПР; возможность прямого доступа к первичной документации

До начала КИ МОНИТОРИНГ МОНИТОР согласовывает: что относится к первичной документации, согласно GCP; где будет храниться вся документация, особенно после окончания КИ; МОНИТОР должен убедиться, что Исследователи ознакомились с протоколом и всей информацией, относящейся к КИ, имеют всю необходимую документацию для надлежащего проведения КИ и дали согласие проводить исследование при условии соблюдения конфиденциальности.

Во время КИ (текущий мониторинг) МОНИТОРИНГ Периодичность визитов монитора зависит: частоты визитов пациентов в соответствии с планом КИ; длительности КИ (скрининга, этапов лечения и др. ) особенностей отбора испытуемых согласно протоколу; качества выполнения условий протокола исследователями КБ. Частота визитов указывается в СОП по данному испытанию. Обязательным является посещение монитором КБ сразу после включения первых испытуемых.

Во время КИ (текущий мониторинг) МОНИТОРИНГ Обязанности монитора (5. 18. 4): убедиться: Ø исследователь действует в соответствии с протоколом; Ø информированное согласие получено в письменной форме у каждого испытуемого до его включения в КИ; проследить: Ø исследователь получил Брошюру исследователя в текущей редакции, другие документы, препараты и расходные материалы, необходимые для надлежащего проведения КИ Ø исследователи получали всю необходимую информацию о проводимом КИ

Во время КИ (текущий мониторинг) МОНИТОРИНГ Обязанности монитора (5. 18. 4): проследить: Ø исследователи выполняют свои обязанности по КИ и не передают свои функции неуполномоченным лицам Ø соответствие испытуемых критериям отбора Ø темпы набора испытуемых в КИ Ø данные в первичных и других документах точные, исчерпывающие, заносятся своевременно Ø отчеты, уведомления, заявки исследователя – предоставляются своевременно, удобочитаемы, датированы, содержат точную и подробную информацию, идентифицируют исследователя

Во время КИ (текущий мониторинг) МОНИТОРИНГ Обязанности монитора (5. 18. 4): Сверка записей в ИРФ с первичными и другими документами на предмет полноты и точности представленных в них данных тщательно проверить: Ø правильный перенос данных в ИРФ и соответствуют данным первичной документации Ø любые изменения дозы ИЛС/проводимой терапии документально оформлены Ø ПЯ, сопутствующее лечение, интеркуррентные заболевания регистрируются в ИРФ Ø в ИРФ заносятся сведения о пропущенных визитах, обследованиях и осмотрах Ø все случаи исключения и выбывания испытуемых из КИ регистрируются и объясняются в ИРФ

Во время КИ (текущий мониторинг) МОНИТОРИНГ Обязанности монитора (5. 18. 4): Ø сообщать исследователю об ошибочных, пропущенных и неразборчивых записях в ИРФ. Контроль исправлений (датированы, подписаны, объяснены) Ø контроль своевременности и правильности предоставления отчетов о ПЯ согласно требованиям GCP, протокола, ЭК, спонсора и регуляторных требований Ø следить за тем, чтобы исследователь вел необходимую документацию (GCP, раздел 8 «Основные документы клинического исследования» ) Ø указывать исследователю на нарушения протокола, СОП, правил GCP, действующих нормативных требований и обеспечивать принятие надлежащих мер во избежание повторения обнаруженных нарушений

Во время КИ (текущий мониторинг) МОНИТОРИНГ Обязанности монитора (5. 18. 4): в отношении ИЛП проверить: Ø соблюдение условий и сроков хранения ИЛП. Поставка ИЛП в достаточном количестве на протяжении всего КИ Ø ИЛП получают только испытуемые, соответствующие критериям отбора в дозах, определенных протоколом Ø испытуемым предоставлены необходимые инструкции по правильному приему, хранению, учету и возврату ИЛП Ø получение, использование и возврат ИЛП на клинической базе контролируется и документально оформляется Ø утилизация остатков ИЛП – в соответствии с требованиями регуляторных органов и спонсора

Во время КИ (текущий мониторинг) МОНИТОРИНГ По завершению визита: обсуждает с исследователями выполнения КИ и проблемы | | заполняет лист посещения монитора | отчет о визите дата, название клинической базы, монитор, исследователь, описание объектов проверки, результаты, выявленные недостатки и нарушения, меры и рекомендации по их устранению

После завершения КИ МОНИТОР: проверяет окончательную комплектацию файла исследователя | обговаривает с исследователем условия хранения (архивирование) материалов КИ | МОНИТОРИНГ
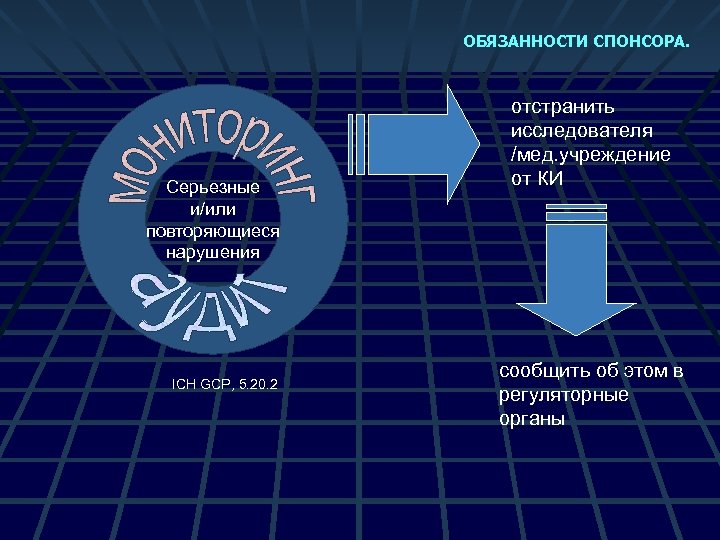
ОБЯЗАННОСТИ СПОНСОРА. Серьезные и/или повторяющиеся нарушения ICH GCP, 5. 20. 2 отстранить исследователя /мед. учреждение от КИ сообщить об этом в регуляторные органы

АУДИТ – Систематическая и независимая проверка документации и деятельности вовлеченных в проведение КИ сторон, которая проводится для подтверждения факта осуществления этой деятельности, а также для оценки соответствия процедур сбора, обработки и представления данных требованиям протокола исследования, СОП, GCP и соответствующих регуляторных требований. ICH GCP, 1. 6.

АУДИТ ЗАДАЧИ: оценка соответствия проведения КИ: ò протоколу, ò СОП, ò правилам GCP, ò действующим нормативным требованиям Аудит – самостоятельная процедура, не связанная с выполнением текущего мониторинга (5. 19. 1. ).

АУДИТ Выбор аудитора и его квалификация (5. 19. 2. ) ï назначаются спонсором ï не участвует в проведении КИ и не зависит от причастных к проведению данного исследования структур ï подготовка, опыт (документальное подтверждение)
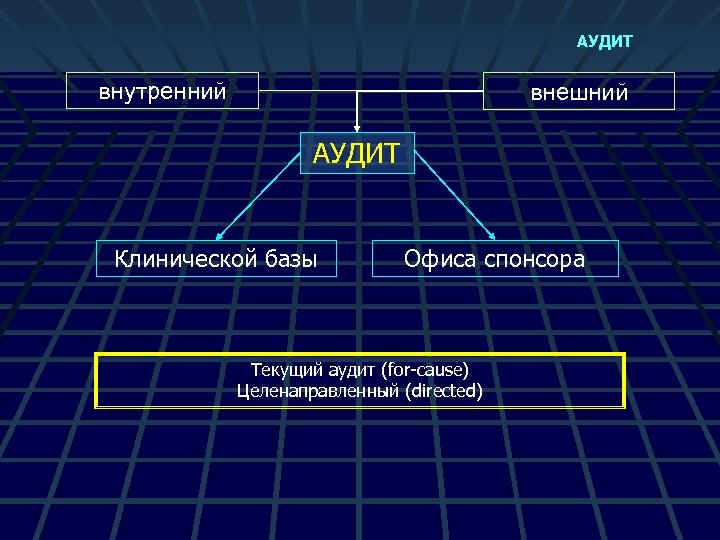
АУДИТ внутренний внешний АУДИТ Клинической базы Офиса спонсора Текущий аудит (for-cause) Целенаправленный (directed)

АУДИТ ð Сверка первичных документов с данными ИРФ ð Проверка файла исследователя ð Учет ИЛС Отчет об аудиторской проверке отсылается спонсору

Классификация замечаний ( «находок» ), выявленных при аудите Значительное несоответствие ICH GCP и существенные ошибки в проведении КИ (major findings) – требуются срочные меры для их разрешения (отсутствие разрешений ЭК, первичной документации, включение пациентов до подписания ими информированного согласия, невалидные результаты и т. д. )

Классификация замечаний ( «находок» ), выявленных при аудите Незначительные ошибки в проведении КИ продолжение (minor finding) - не будут влиять на общий результат КИ – требуются меры для их устранения (отсутствие даты подписания CV, замечания при сверке данных и т. д. ) Рекомендации аудитора (recommendation) – не требуют каких-либо мер со стороны исследователей. Они направлены на улучшение качества проведения КИ в будущем.

АУДИТ е ни е чн ок уто шиб о средство АУДИТ еждение предупр ок ия ошиб повторен пр ед от ош вращ иб ок ение
b46be8097cce5a89d1279573ed581ffb.ppt