лекция 10. 2015 презентация (2).ppt
- Количество слайдов: 62

Общие принципы реакционной способности органических соединений, свойства моно- и полифункциональных соединений

План лекции 1. Кислотно-основные 2. Окислительно-восстановительные реакции (электронный вариант) 3. Общие принципы реакционной способности 4. Характерные реакции органических соединений , реакции SR, SE, AE (электронный вариант) 5. Качественные реакции (лабораторный практикум)

I. Кислотно-основные свойства органических соединений

Органические кислоты и основания Кислоты: R-XH Основания: R-X: -XH – кислотный центр -ОН – кислоты -Х: основный центр (N, O, S, -связь ) n-основания (N, O, S) (спирты, фенолы, карбоновые кислоты) -SH – кислоты (тиолы) -NH – кислоты (амины) -CH – кислоты (углеводороды) (спирты, фенолы, карбоновые кислоты, тиолы, амины) -основания ненасыщенные и ароматические углеводороды

R – XH = кислота R-X- + H+ сопряженное основание (анион) Усиливают кислотность: 1) сопряжение с кислотным центром 2) большой радиус атома в кислотном центре 3) высокая электроотрицательность атома в кислотном центре 4) электроноакцепторные заместители в молекуле кислоты

Сравнительная сила кислот: 1. карбоновые кислоты +Сu. O, Fe. Cl 3, Na. OH, Cu(OH)2, Na 2. фенолы + Fe. Cl 3, Na. OH, Cu(OH)2, Na 3. тиолы + Na. OH, Cu(OH)2, Na 4. многоатомные cпирты +Cu(OH)2, Na 5. одноатомные спирты +Na

Кислотные свойства многоатомных спиртов диол-1, 2 хелатный комплекс
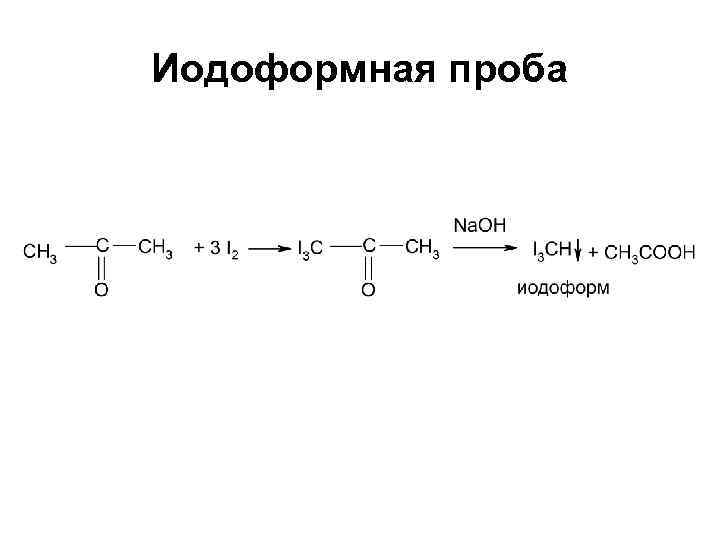
Иодоформная проба

Основания Брёнстеда - акцепторы протона В: + Н+ = В–Н основание сопр. кислота
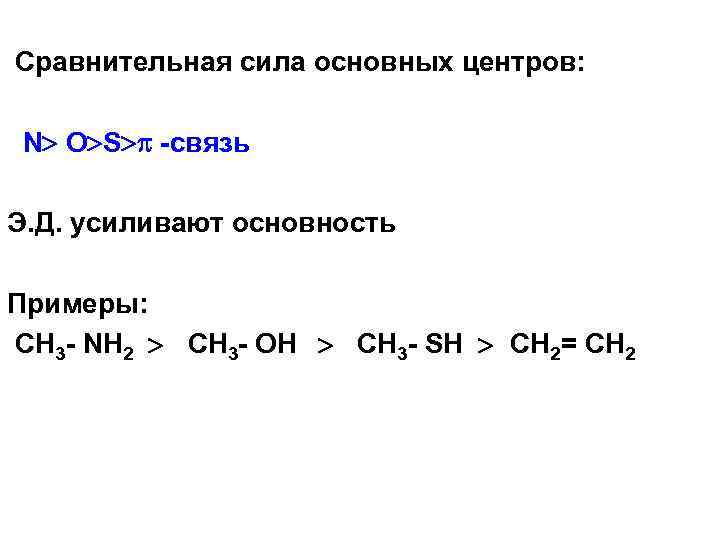
Сравнительная сила основных центров: N O S -связь Э. Д. усиливают основность Примеры: CH 3 - NH 2 CH 3 - OH CH 3 - SH CH 2= CH 2
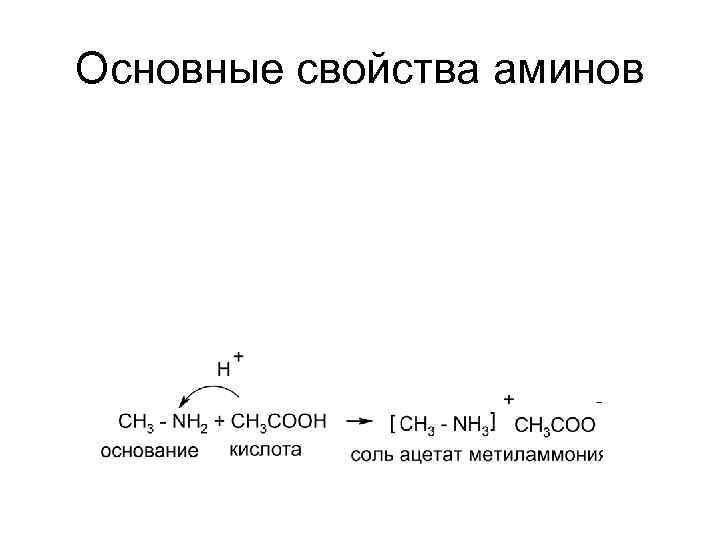
Основные свойства аминов
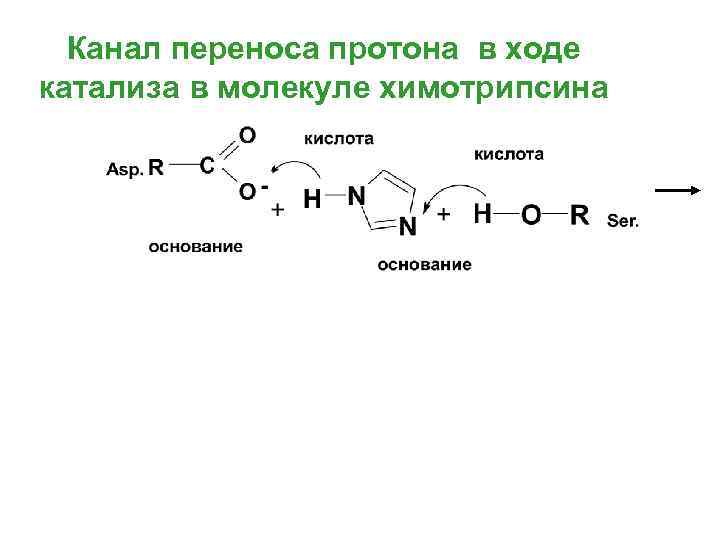
Канал переноса протона в ходе катализа в молекуле химотрипсина

2. ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ

Окислительно-восстановительные реакции (ОВР), идут с изменением степени окисления атомов вследствие переноса электрона от одной частицы к другой.

Стандартный восстановительный потенциал 0 2 Н+/Н 2 0 = 0 В Нормальный восстановительный потенциал 0 2 Н+/Н 2 0 = -0, 42 В

Виды биохимических окислительновосстановительных процессов 1. Дегидрогеназные изменение содержания атомов водорода в молекуле 2. Оксигеназные изменение содержания атомов кислорода в молекуле 3. Свободнорадикальные ОВР
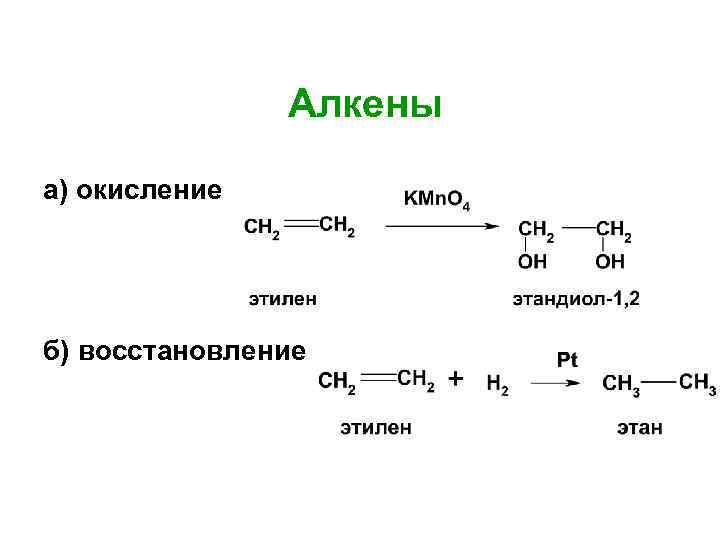
Алкены а) окисление б) восстановление

Спирты Метанол и первичные спирты
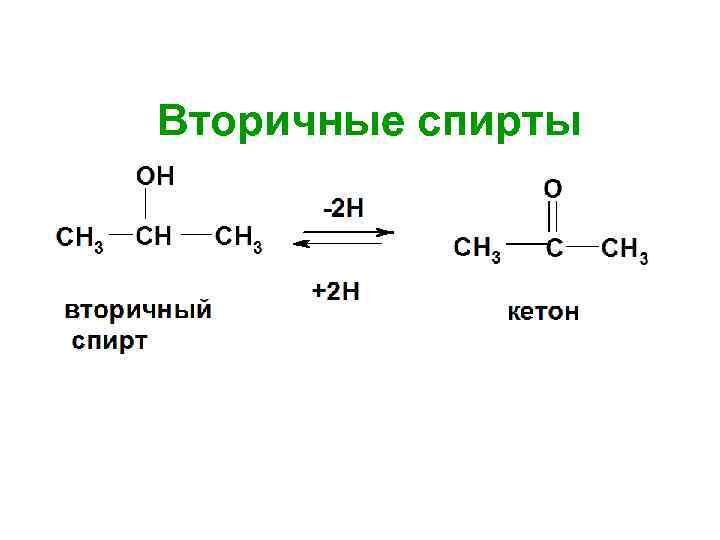
Вторичные спирты
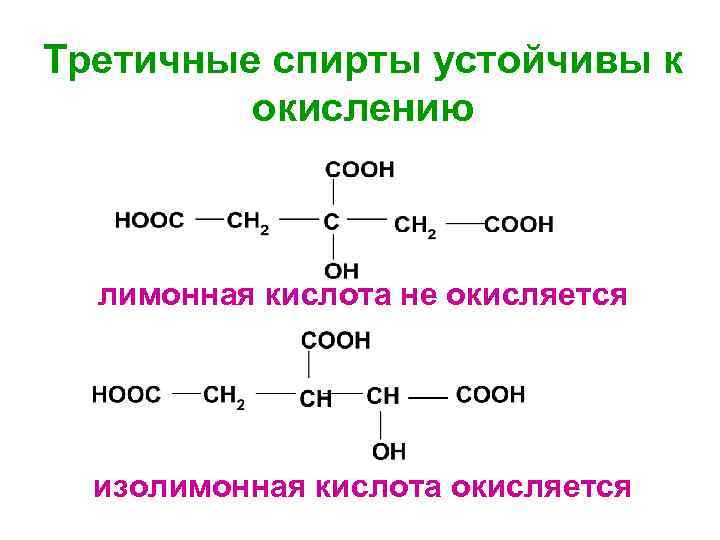
Третичные спирты устойчивы к окислению лимонная кислота не окисляется изолимонная кислота окисляется
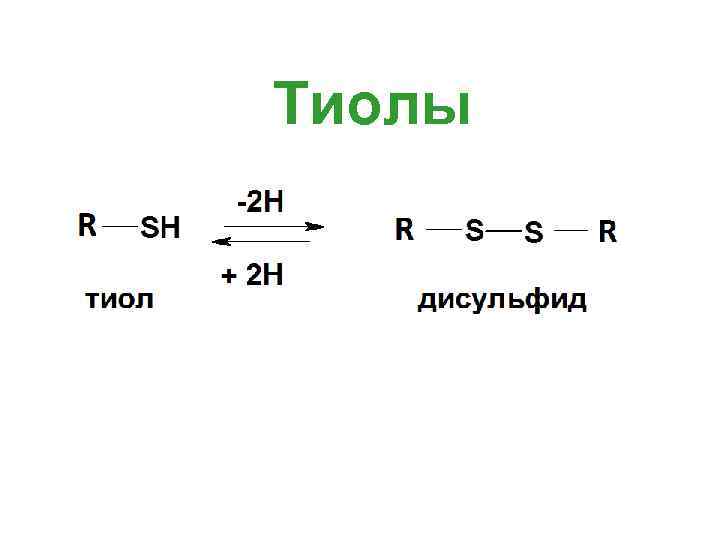
Тиолы

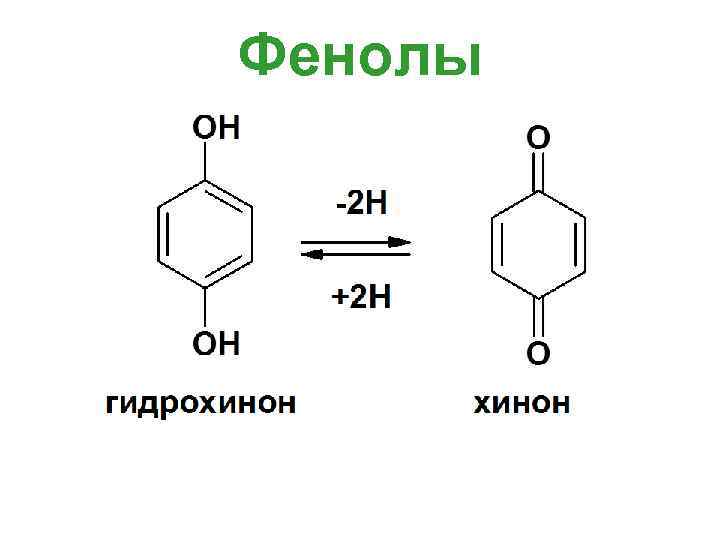
Фенолы
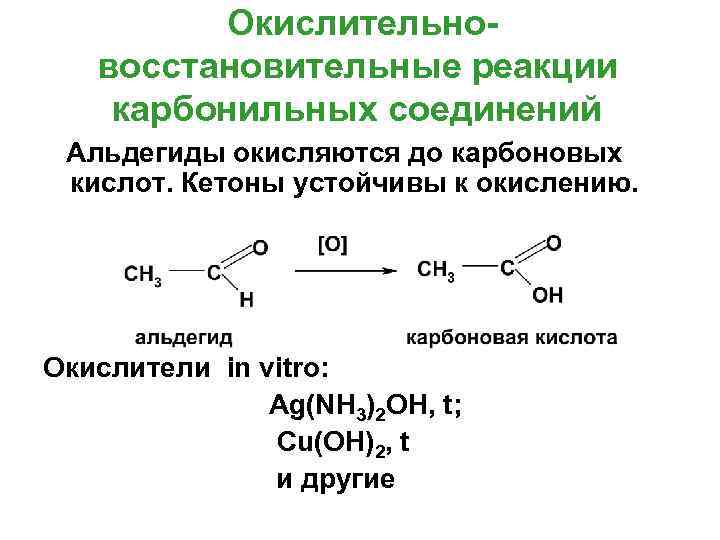
Окислительновосстановительные реакции карбонильных соединений Альдегиды окисляются до карбоновых кислот. Кетоны устойчивы к окислению. Окислители in vitro: Ag(NH 3)2 OH, t; Cu(OH)2, t и другие

Альдегиды и кетоны восстанавливаются в спирты. Альдегиды в первичные, кетоны во вторичные спирты In vivo фермент дегидрогеназа кофермент НАДН

3. Общие принципы реакционной способности органических соединений

Основные понятия • Субстрат – вещество, у которого происходит разрыв связи у атома углерода. Определяет тип реакции • Реагент – вещество (частица), атакующая субстрат (радикал, электрофил, нуклеофил). Определяет механизм реакции.

Образование реагентов нуклеофилы и электрофилы
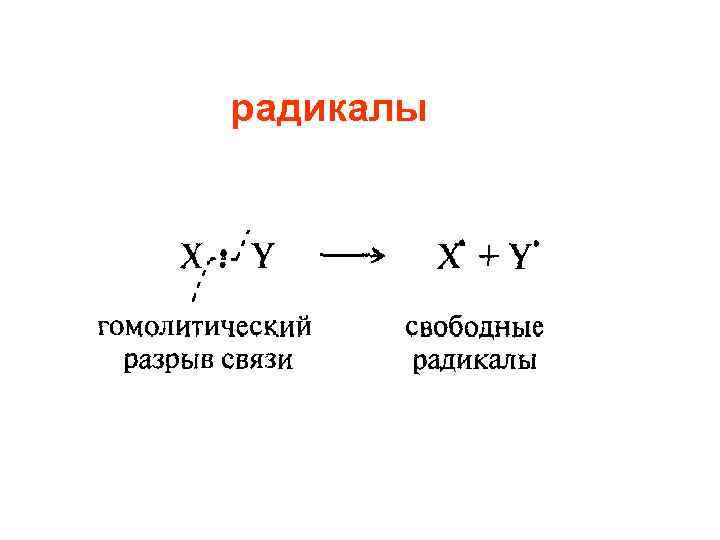
радикалы
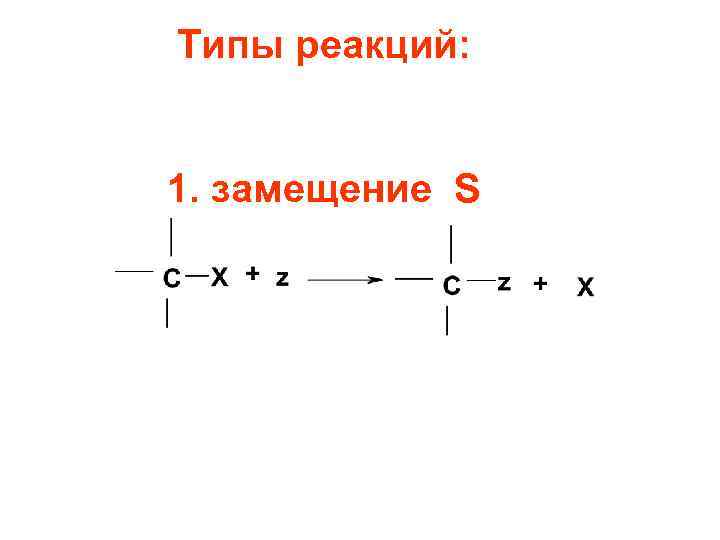
Типы реакций: 1. замещение S
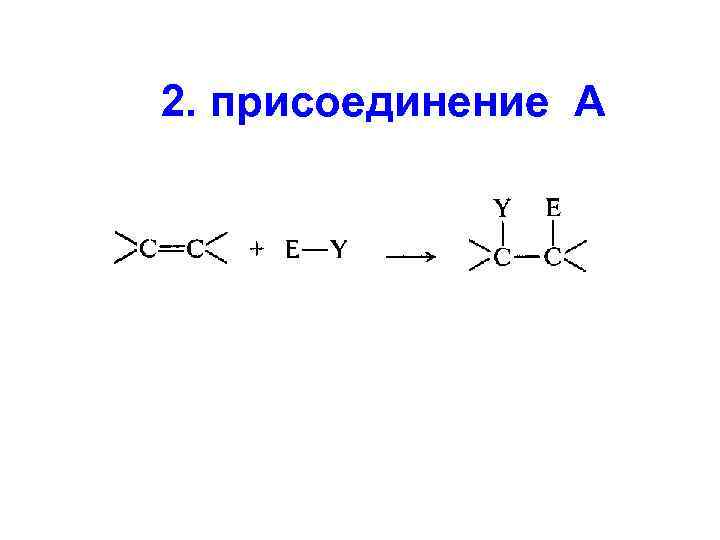
2. присоединение А
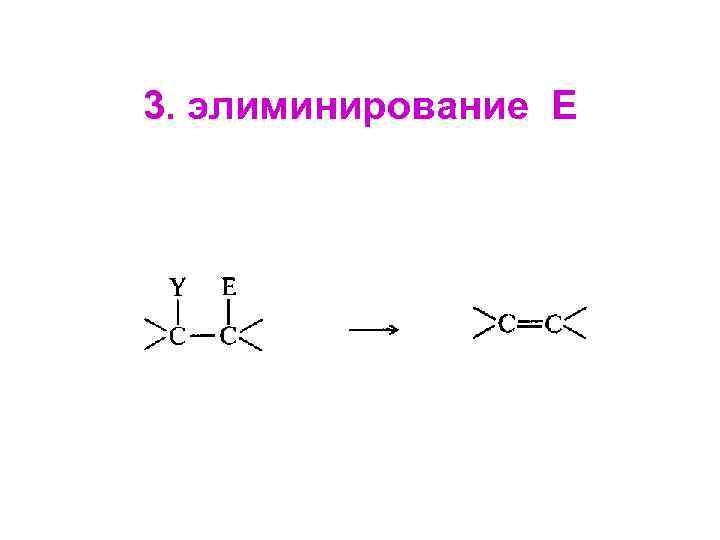
3. элиминирование Е
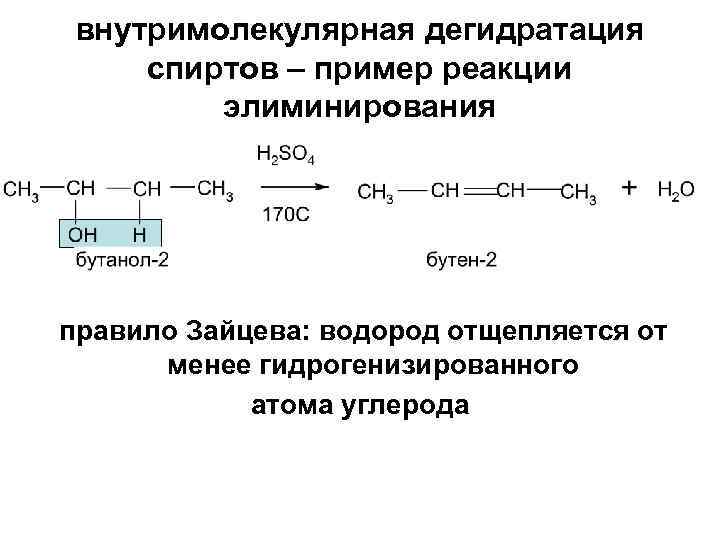
внутримолекулярная дегидратация спиртов – пример реакции элиминирования правило Зайцева: водород отщепляется от менее гидрогенизированного атома углерода
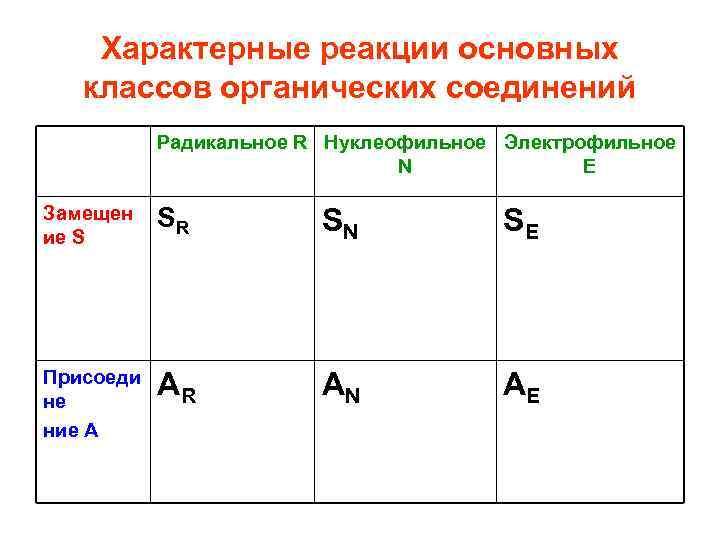
Характерные реакции основных классов органических соединений Радикальное R Нуклеофильное Электрофильное N Е Замещен ие S SR SN SE Присоеди не ние А AR AN AE
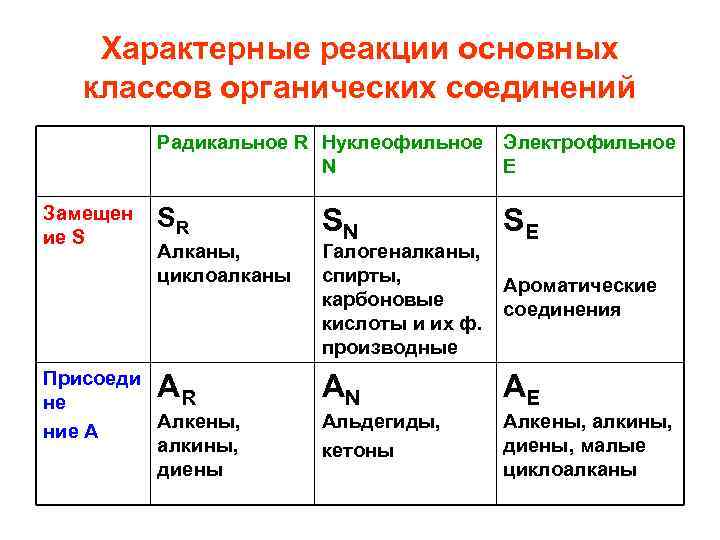
Характерные реакции основных классов органических соединений Радикальное R Нуклеофильное Электрофильное N Е Замещен ие S SR Алканы, циклоалканы Присоеди R не Алкены, ние А алкины, диены A SN Галогеналканы, спирты, карбоновые кислоты и их ф. производные SE Ароматические соединения AN AE Альдегиды, кетоны Алкены, алкины, диены, малые циклоалканы

4. Характерные реакции органических соединений
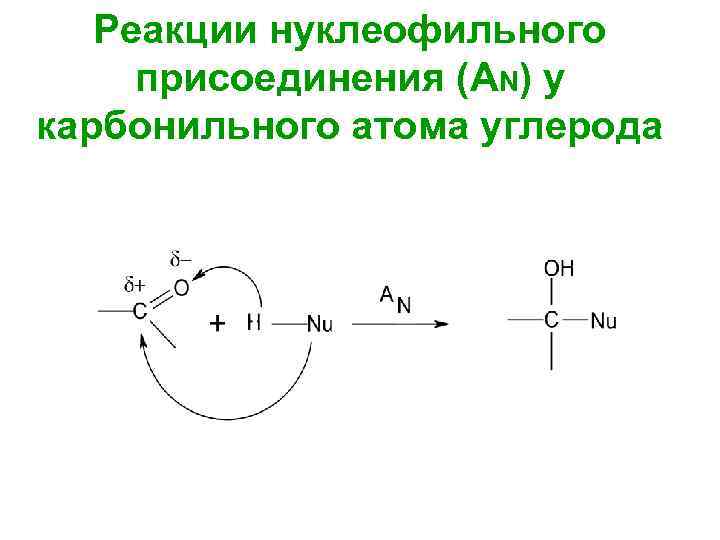
Реакции нуклеофильного присоединения (AN) у карбонильного атома углерода
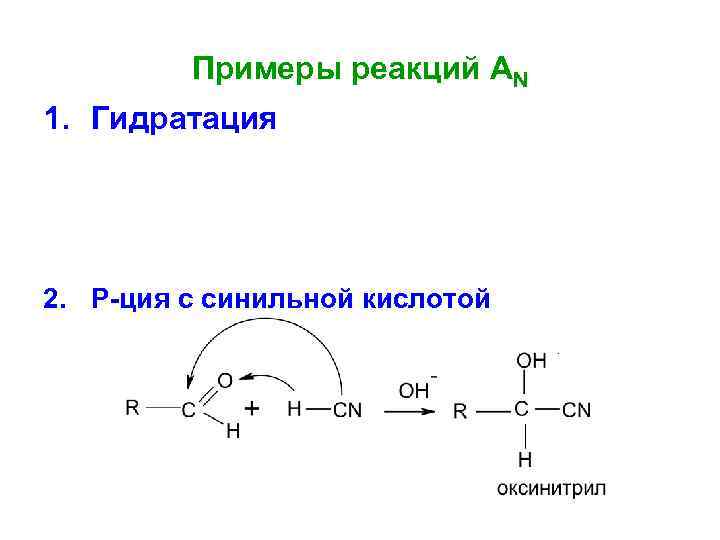
Примеры реакций АN 1. Гидратация 2. Р-ция с синильной кислотой
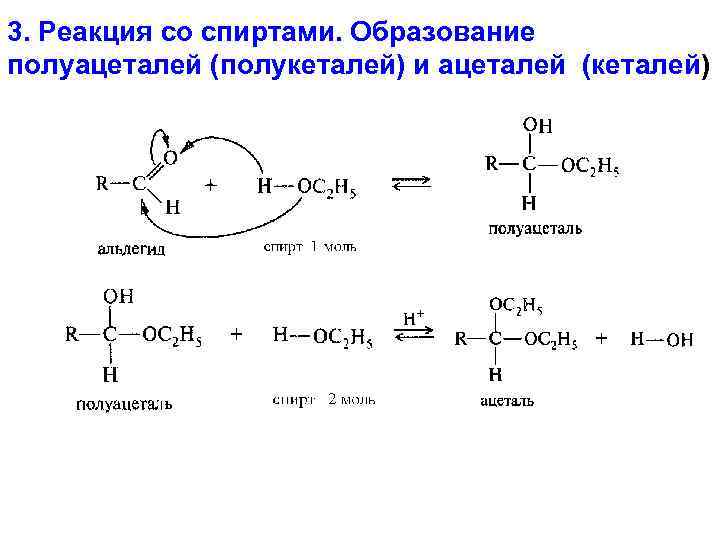
3. Реакция со спиртами. Образование полуацеталей (полукеталей) и ацеталей (кеталей)

4. Альдольная конденсация В результате углеродный скелет удлиняется на два атома углерода

Дисмутация альдегидов

5. Реакции присоединения – отщепления (AN-E) с аминами и их производными А. реакция с аминами
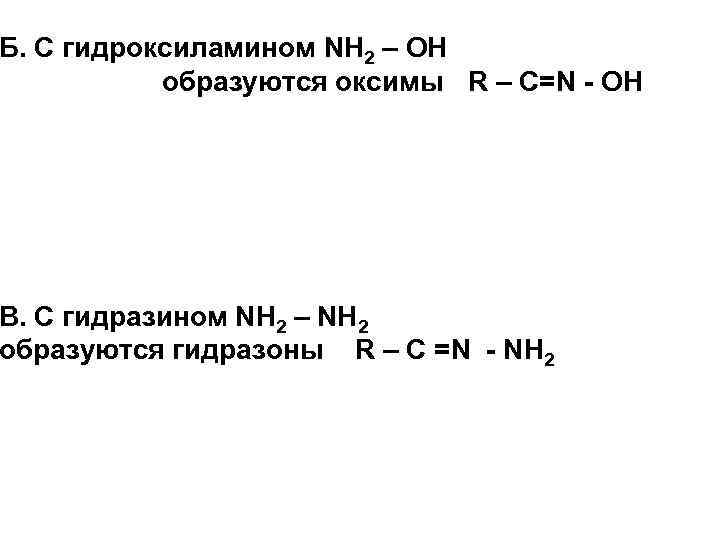
Б. С гидроксиламином NH 2 – OH образуются оксимы R – С=N - OH В. С гидразином NH 2 – NH 2 образуются гидразоны R – С =N - NH 2

Реакции нуклеофильного замещения SN
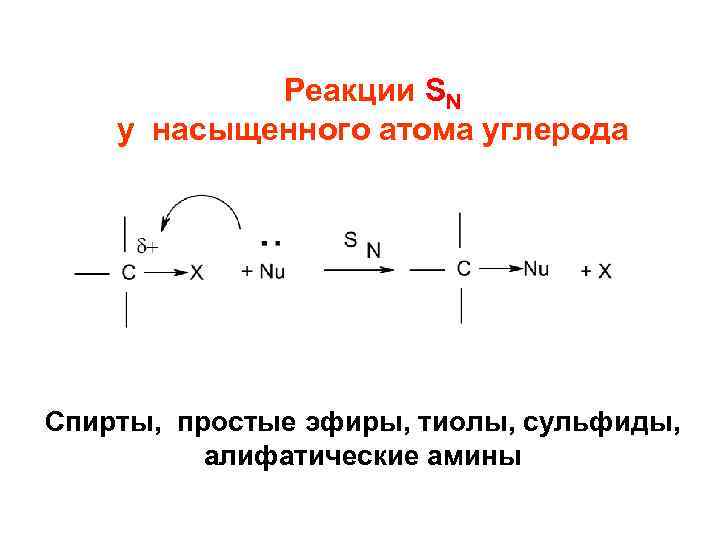
Реакции SN у насыщенного атома углерода Спирты, простые эфиры, тиолы, сульфиды, алифатические амины
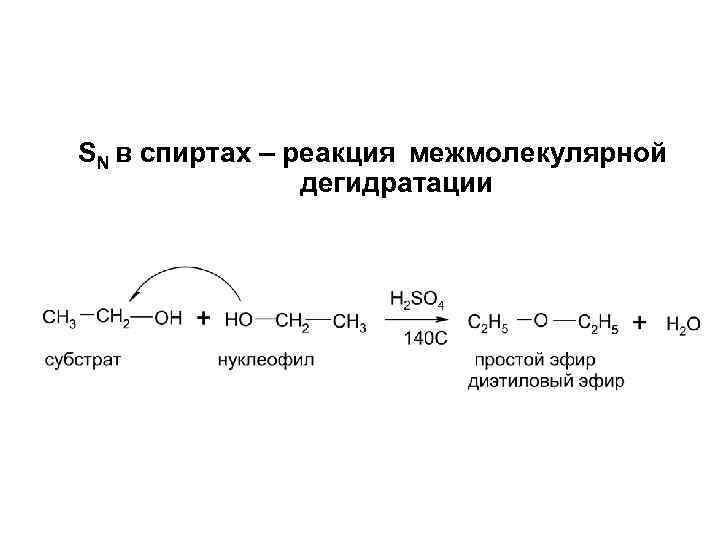
SN в спиртах – реакция межмолекулярной дегидратации
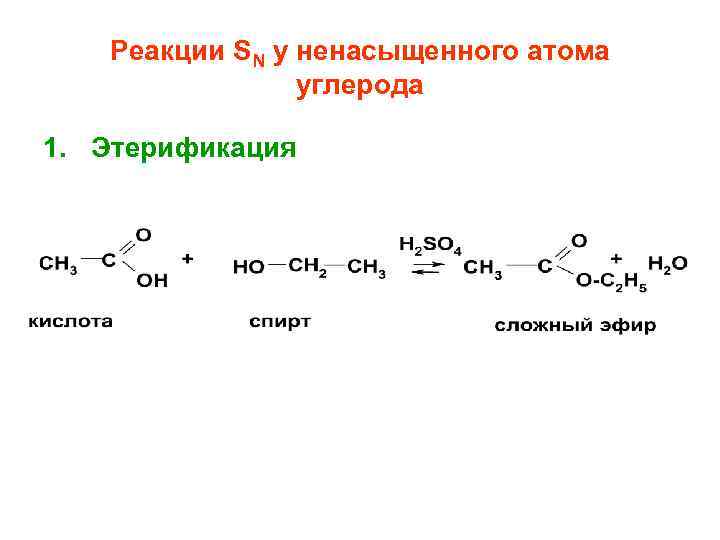
Реакции SN у ненасыщенного атома углерода 1. Этерификация

Фосфорилирование – реакция этерификации с фосфорной кислотой, SN

Образование тиоэфиров (s-ацилирование)
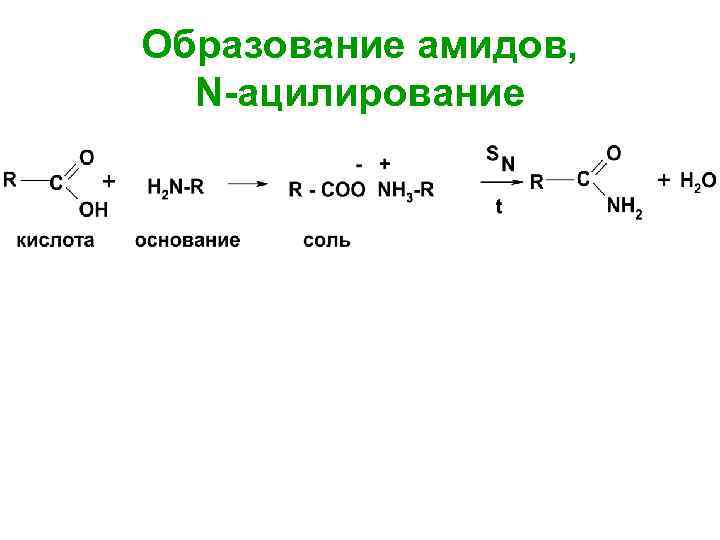
Образование амидов, N-ацилирование
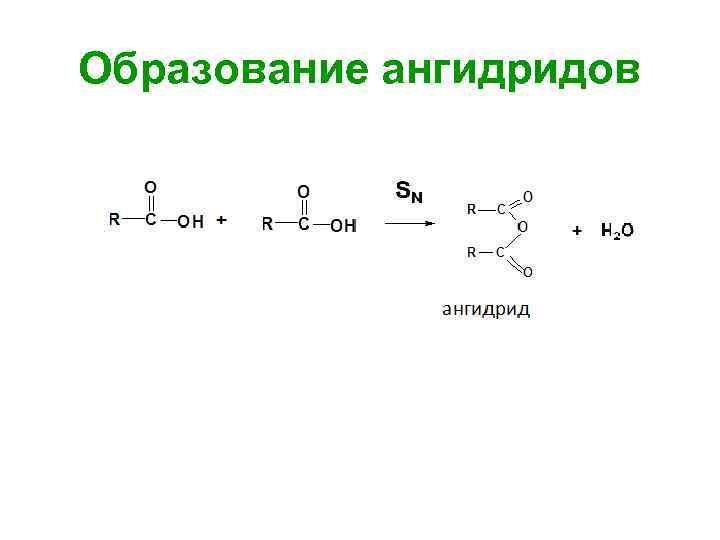
Образование ангидридов
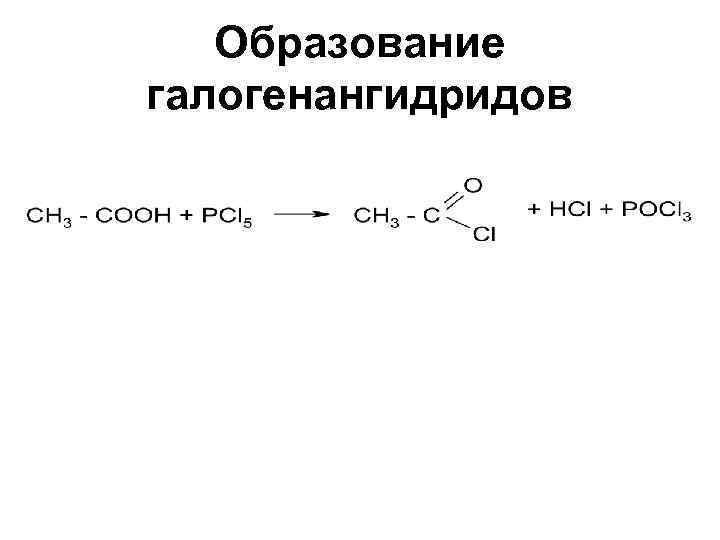
Образование галогенангидридов
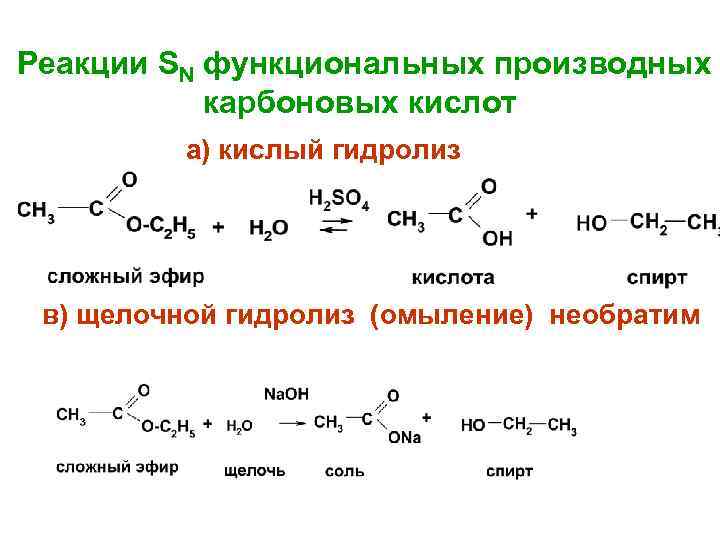
Реакции SN функциональных производных карбоновых кислот а) кислый гидролиз в) щелочной гидролиз (омыление) необратим
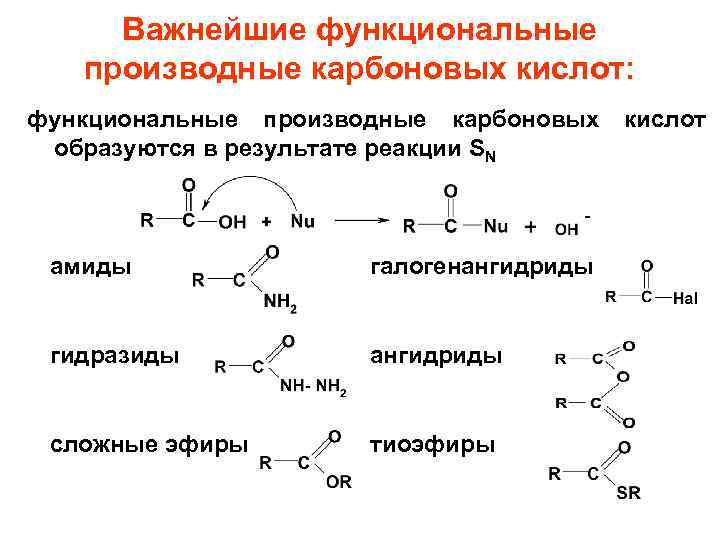
Важнейшие функциональные производные карбоновых кислот: функциональные производные карбоновых образуются в результате реакции SN амиды галогенангидриды гидразиды ангидриды сложные эфиры тиоэфиры кислот

Специфические реакции дикарбоновых кислот 1. Реакция декарбоксилирования идет при нагревании щавелевой и малоновой кислот

2. При нагревании янтарной, глутаровой малеиновой кислот образуется циклический ангидрид
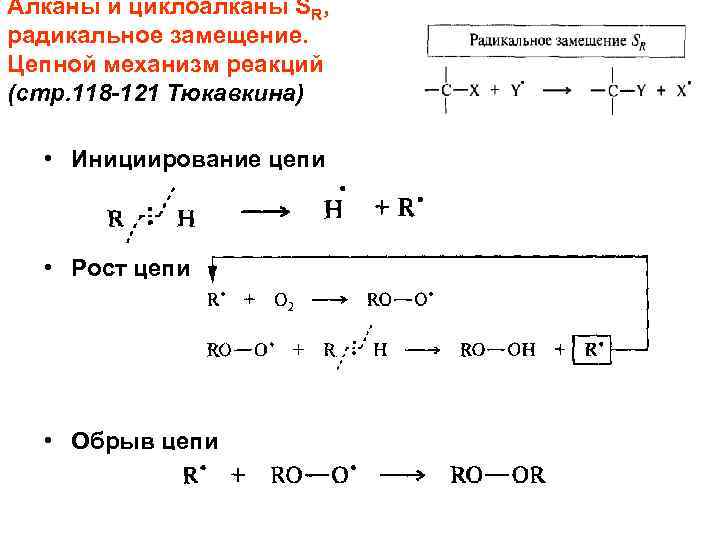
Алканы и циклоалканы SR, радикальное замещение. Цепной механизм реакций (стр. 118 -121 Тюкавкина) • Инициирование цепи • Рост цепи • Обрыв цепи
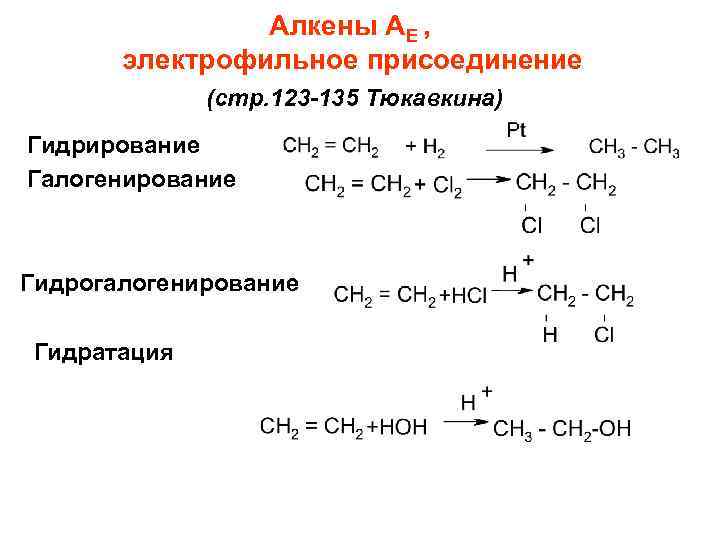
Алкены АЕ , электрофильное присоединение (стр. 123 -135 Тюкавкина) Гидрирование Галогенирование Гидрогалогенирование Гидратация
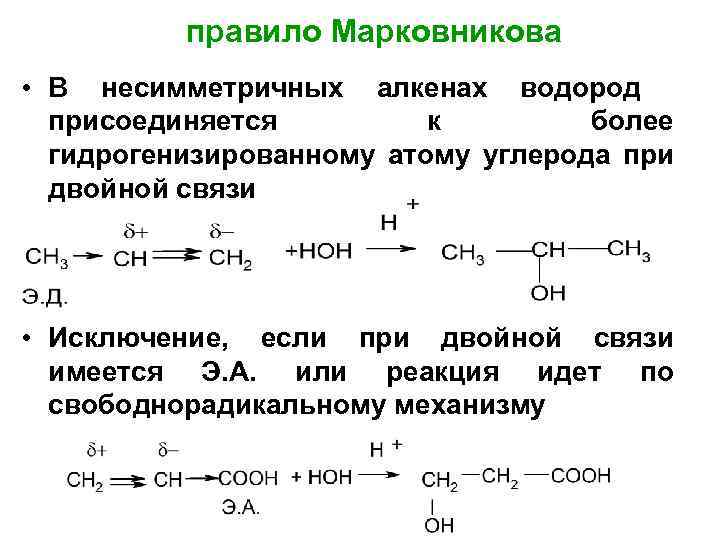
правило Марковникова • В несимметричных алкенах водород присоединяется к более гидрогенизированному атому углерода при двойной связи • Исключение, если при двойной связи имеется Э. А. или реакция идет по свободнорадикальному механизму
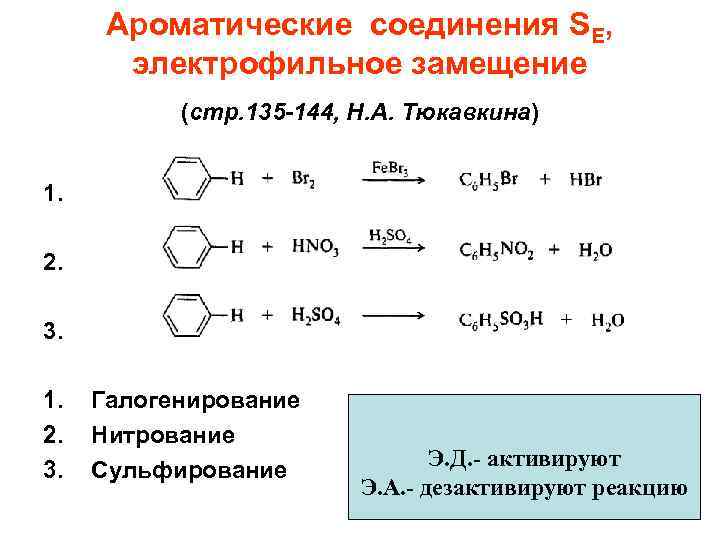
Ароматические соединения SE, электрофильное замещение (стр. 135 -144, Н. А. Тюкавкина) 1. 2. 3. Галогенирование Нитрование Сульфирование Э. Д. - активируют Э. А. - дезактивируют реакцию
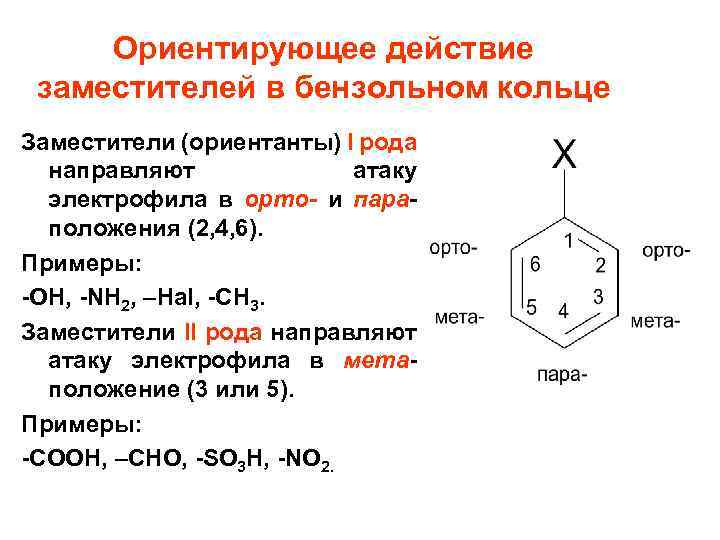
Ориентирующее действие заместителей в бензольном кольце Заместители (ориентанты) I рода направляют атаку электрофила в орто- и параположения (2, 4, 6). Примеры: -OH, -NH 2, –Hal, -CH 3. Заместители II рода направляют атаку электрофила в метаположение (3 или 5). Примеры: -COOH, –CHO, -SO 3 H, -NO 2.

Пример: галогенирование фенола идет очень активно в несколько положений, гидроксил- сильный Э. Д. Образуется 2, 4, 6 -трииодфенол, гидроксил – ориентант I рода.
лекция 10. 2015 презентация (2).ppt