8 аттестация_самоинспекции.ppt
- Количество слайдов: 127

Общие принципы проведения работ по аттестации на фармацевтическом предприятии

Понятие «валидации» (1) документированное подтверждение соответствия оборудования, условий производства, технологического процесса, качества полупродукта и готового продукта действующим регламентам и/или требованиям нормативной документации ОСТ 42 -510 -98 раздел 7 п. 7. 1 МУ 64 -04 -001 -2002 «Производство лекарственных средств. Валидация. Основные положения» получение объективных доказательств, обеспечивающее высокую степень уверенности в том, что планируемый процесс будет постоянно выполняться в соответствии с желаемыми установленными результатами A WHO guide to good manufacturing practice (GMP) requirements: Validation

Понятие «валидации» (2) подтверждение посредством представления объективных доказательств того, что требования, предназначенные для конкретного предполагаемого использования или применения, выполнены. ISO 9000 -2000 Системы менеджмента качества. Основные положения и словарь

Понятие «квалификация» • Оценка и документированное подтверждение того, что проектная документация, оборудование, инженерные системы и другие условия производства способны обеспечить достижение ожидаемых и воспроизводимых результатов МУ 64 -04 -001 -2002 «Производство лекарственных средств. Валидация. Основные положения»

Валидация - «целое» - Понятие используется при оценке методик и процессов относительно продукции Квалификация(аттестация) - этап валидации - понятие используется для оценки соответствия проектов, оборудования, процесса эксплуатации оборудования безотносительно к конкретному продукту

Понятие «аттестации» документальное подтверждение того, что методика, процесс, оборудование, материал или система соответствуют заданным требованиям и их использование дает ожидаемые результаты. ГОСТ Р 52249 -2009 Правила производства и контроля качества лекарственных средств.

Политика проведения аттестации Общая политика предприятия, цели и подход к процессам аттестации, в т. ч. К аттестации • • • технологических процессов, методов очистки, аналитических методов, методов проведения внутрипроизводственного контроля, систем с компьютерным управлением и контролем и лиц, ответственных за разработку, рассмотрение, согласование и оформление каждой стадии аттестации (испытаний), должны быть оформлены в письменном виде.

Политика проведения аттестации Как правило, в ходе разработки процесса (или по имеющимся данным) должны быть определены критические параметры (характеристики) и пределы их изменений, необходимые для обеспечения надежной работы. К таким параметрам относятся: - критические характеристики, которые должны быть указаны для данного продукта (АФС); - технологические параметры, которые могут повлиять на критические характеристики качества АФС; - предельные изменения каждого критического параметра процесса, которые будут использоваться в ходе текущего производственного контроля. Операции, которые считаются критическими для качества и чистоты АФС, подлежат аттестации.

Аттестации подлежат 1. Технологические процессы. 2. Аналитические методики 3. Процессы очистки. 4. Процессы санитарной обработки помещений и др. 5. Технологическое и лабораторное оборудование. 6. Инженерные системы, непосредственно влияющие на качество полупродукта и готового продукта (обеспечение чистым воздухом, водой, паром, инертным газом, сжатым воздухом и др. ). 7. "Чистые" помещения и зоны, "холодные" комнаты и др. 8. Компьютерные системы, связанные с процессом и контролем производства.

Аттестации не подлежат: • Оборудование, не влияющее на качество полупродукта и/или готового продукта. • Инженерные системы, непосредственно не влияющие на качество продукта, но обеспечивающие устойчивость процесса производства (системы энергообеспечения, паро - и водоснабжения и др. ). • Общие конструктивные элементы зданий и помещений. • Вспомогательные компьютерные системы, непосредственно не связанные с процессом производства.

Виды аттестации • • Перспективная Текущая Ретроспективная Повторная (ревалидация)

Перспективная аттестация • проводится на вновь вводимом или реконструируемом производстве перед его пуском; • при введении на фармацевтическом производстве новых процессов и нового оборудования; • перспективная аттестация, используемая для процесса производства АФС, должна быть завершена до выпуска на рынок готового лекарственного средства, произведенного из этой АФС.

Текущая аттестация • Текущая аттестация может проводиться при отсутствии данных о повторных технологических циклах. Это может быть обусловлено производством только ограниченного числа серий АФС, нерегулярным производством серий АФС или производством АФС с использованием аттестованного процесса, в который были внесены изменения. До завершения текущей аттестации серии АФС могут быть выпущены и использованы для производства готовых лекарственных средств для их реализации на рынке на основании тщательного непрерывного контроля и проведения испытаний этих серий АФС.

Повторная аттестация проводится • изменения нормативной документации на готовое лекарственное средство, сырье, вспомогательные, упаковочные или маркировочные материалы; • изменения технологической документации; • замены или ремонта оборудования; • переоборудования производственных помещений и/или вспомогательных систем (отопительной, вентиляционной, кондиционирования и др. ); • выявления нерегламентированных отклонений при проведении технологического процесса; • плановой валидации с учетом соответствующих графиков п. 7. 4. ОСТ 42 -510 -98

Ретроспективная аттестация Ретроспективную аттестацию применяют как исключение для хорошо отлаженных процессов, которые не претерпевали значительных изменений для качества АФС из-за изменений сырья, оборудования, систем, устройств или применяемого технологического процесса. Этот вид аттестации может использоваться в том случае, если: 1) определены критические характеристики качества и критические параметры процесса; 2) установлены соответствующие внутрипроизводственные критерии приемлемости и контроля; 3) отсутствовали существенные сбои в ходе процесса (качестве продукции) по причинам, не связанным с ошибками оператора или отказами оборудования; 4) установлен состав примесей для существующих АФС. При ретроспективных испытаниях для подтверждения стабильности процесса исследуют данные 10 -30 последовательных серий продукции.
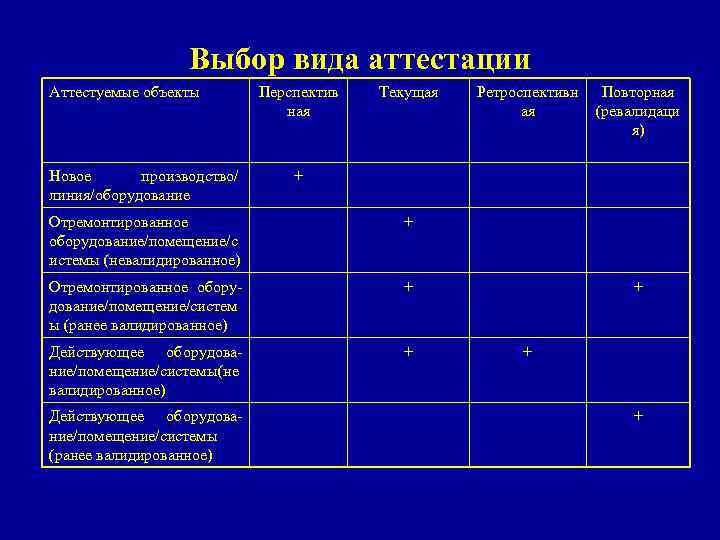
Выбор вида аттестации Перспектив ная Текущая Ретроспективн ая Повторная (ревалидаци я) Новое производство/ линия/оборудование + Отремонтированное оборудование/помещение/с истемы (невалидированное) + Отремонтированное оборудование/помещение/систем ы (ранее валидированное) + + Действующее оборудование/помещение/системы не ( валидированное) + + Действующее оборудование/помещение/системы (ранее валидированное) + Аттестуемые объекты

Организация работ по аттестации • Планирование – Создание планов – Создание документов и графиков – Подготовительные работы ( выбор субконтрактных организаций, обучение персонала, разработка тестов и т. д. ) • Проведение тестов • Координация • Контроль

Группа по аттестации (общезаводская) • Функции: – Планирование – Координация • Состав группы: – Сотрудник инженерной службы – Сотрудник отдела обеспечения качества (контроль) – Сотрудник производственного департамента (технолог) – Сотрудник администрации – Сотрудник отдела аттестации – Сотрудник службы главного технолога (разработчик)

Требования к персоналу, принимающему участие в аттестации • Проведено обучение работе на приборе (оборудовании и т. д. ) • Проведено обучение выполнению производственных операций • Проведено обучение выполнению валидационного протокола • Условия проведения максимально приближены к производственным

Основные документы: • Аттестационный (валидационный) мастер-план (VMP) • Спецификации (потребительские) • СОП по аттестации/Аттестационные протоколы • Отчет об аттестации • СОП по контролю за изменениями

Основные разделы аттестационного плана (1) • Обобщающая часть (введение): – Объемы аттестационных работ – Общий порядок проведения аттестации на предприятии ( со ссылками на графики и таблицы) • Цели аттестации: задачи по аттестации на предприятии • Порядок проведения работ ( общая организационная схема, порядок контроля за проведением работ и внесением изменений в документацию) • Сводная таблица с объемами работ (перечень объектов, параметров)

Основные разделы аттестационного плана (2) • Критерии приемлемости ( указываются в общем виде) • Подготовительные программы : обучение, калибровка и контроль за изменениями, выполняемые до начала определенной стадии работ • Организационная структура : • -Матрица ответственности • -Состав группы по аттестации • График проведения работ

Структура аттестационного протокола 1. Общая информация 2. Цель 3. Описание ранее проведенных работ (ранее проведенная аттестация и др. ) 4. Перечень оборудования и их статус 5. Аттестация помещений ( при необходимости) 6. Диаграмма процесса ( при необходимости) 7. Описание производственного процесса ( при необходимости) 8. Перечень критических параметров (критических продуктов) 9. Отбор проб, тесты и спецификации 10. Критерии приемлемости

Структура отчета об аттестации • Обобщающая часть • Краткое описание работ • Полученные результаты и их анализ – Статистический анализ данных, графиков – Диапазон значений критических параметров – Анализ данных, вне установленного диапазона – Научное обоснование • Отклонения : оценка влияния на результаты аттестации • Заключения • Рекомендации, приложения • Проверка и согласование теми же сотрудниками, которые согласовывали протокол

Этапы аттестации - аттестация проекта (design qualification; DQ) - документальное подтверждение того, что проект производства (в т. ч. помещения, оборудование или вспомогательные системы) соответствует заданию на проектирование и действующим нормам; - аттестация установленного оборудования (Installation Qualification; IQ) - документальное подтверждение того, что установленное или измененное оборудование, помещения или вспомогательные системы соответствуют утвержденному проекту, заданию на проектирование и действующим нормам; - аттестация функционирующего оборудования (Operational Qualification; OQ) - документальное подтверждение того, что установленное или измененное оборудование, помещения или вспомогательные системы функционируют надлежащим образом в требуемом режиме; - аттестация в эксплуатации (Performance Qualification; PQ) - документальное подтверждение того, что оборудование, помещения и вспомогательные системы могут работать совместно с нужной эффективностью и воспроизводимостью в соответствии с утвержденными требованиями и характеристиками технологического процесса.
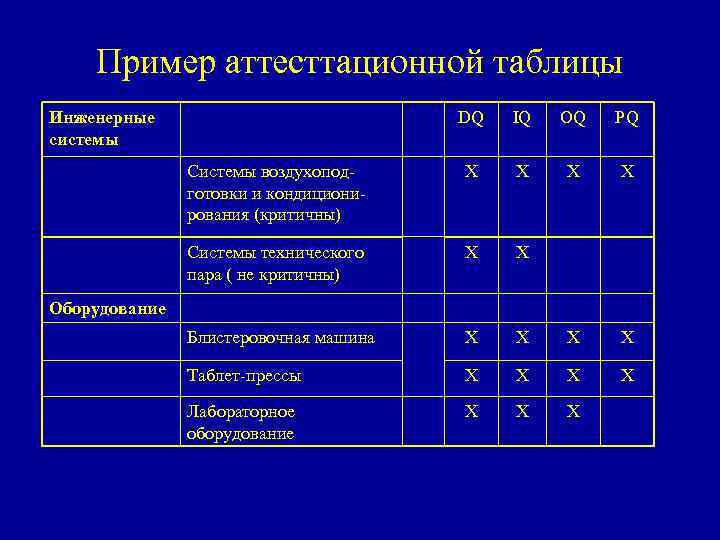
Пример аттесттационной таблицы Инженерные системы DQ IQ OQ PQ Системы воздухоподготовки и кондиционирования (критичны) Х Х Системы технического пара ( не критичны) Х Х Блистеровочная машина Х Х Таблет-прессы Х Х Лабораторное оборудование Х Х Х Оборудование
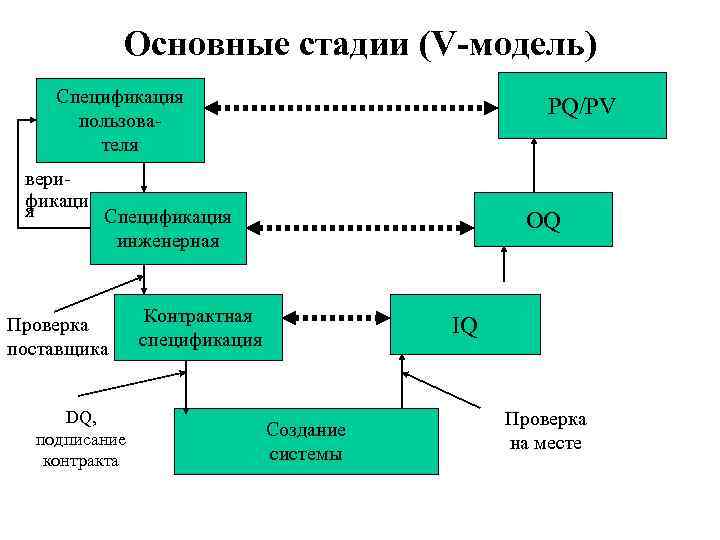
Основные стадии (V-модель) Спецификация пользователя верификаци я PQ/PV Спецификация инженерная Проверка поставщика DQ, подписание контракта OQ Контрактная спецификация IQ Создание системы Проверка на месте

Аттестация проекта (DQ) Проверка соответствия конструкции (планировки, дизайна) помещений, оборудования и процессов требованиям GMP Что проверяется: -чертежи и схемы -предлагаемые функциональные характеристики -спецификации на материалы контактирующих с продуктом поверхностей - потоки движения персонала и материалов - спецификации на помещения - характеристики отдельных критических элементов (фильтры) и т. д. Кем проводится: - рабочая группа (совместно с поставщиком)

Аттестация установленного оборудования (IQ) Проверка того, что помещения, инженерные системы, оборудование и процессы сконструированы и смонтированы в соответствии с заданными спецификацией требованиями Что проверяется: -материал и комплектность -схемы и чертежи -подключение к системам - возможность работа Кто проводит: - персонал, осуществляющий дальнейшую эксплуатацию и обслуживание

Работы по IQ включают: • Проверку наличия общей и специальной документации • Проверку наличия СОП по эксплуатации, очистке и журналов учета работ/ремонта • Проверку протоколов обучения • Тестирование работоспособности ( по принципу работает/не работает)

Аттестация функционирующего оборудования (OQ) Проверка работы оборудования, инженерных систем, помещений на соответствие заданным параметрам (контрактным спецификациям) Что проверяется: -динамические характеристики ( например: скорость воздухопотока или скорость воды, химические и микробиологические характеристики, физические характеристики и др. ) Кто проводит: персонал, осуществляющий дальнейшую эксплуатацию и обслуживание

Аттестация в эксплуатации (PQ) Проверка стабильности получения продукта, соответствующего спецификации и параметрам качества. Часто заменяется термином – валидация процесса. Что проверяется: -параметры стабильной работы -параметры качества продукта Кто проводит: Персонал, участвующий в технологическом процессе
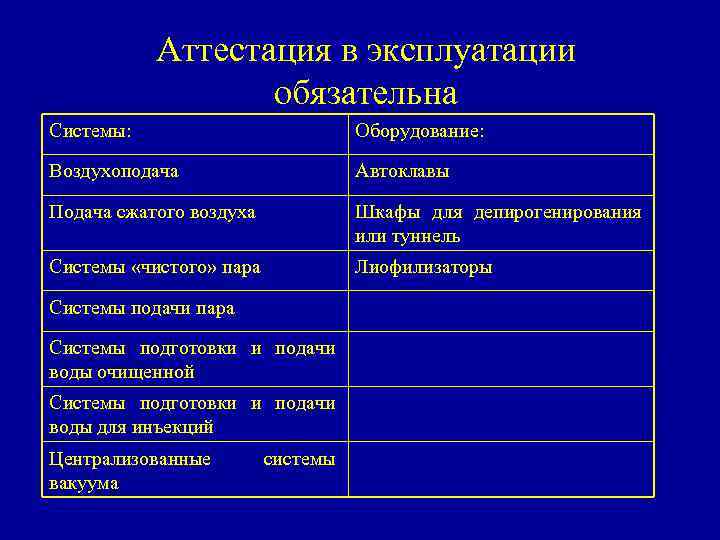
Аттестация в эксплуатации обязательна Системы: Оборудование: Воздухоподача Автоклавы Подача сжатого воздуха Шкафы для депирогенирования или туннель Системы «чистого» пара Лиофилизаторы Системы подачи пара Системы подготовки и подачи воды очищенной Системы подготовки и подачи воды для инъекций Централизованные вакуума системы

Особенности PQ (PV) • Проводится ТОЛЬКО после IQ/OQ • Длительность ( первичной фазы для систем – не менее 20 дней, для оборудования – 3 «прогона» ) • Последующий мониторинг • Персонал прошел обучение • Все СОП по эксплуатации утверждены • Контроль за изменениями функционирует эффективно

Аттестация процесса Валидируемые процессы: Очистка Смешивание ( грануляция и др. ) Санитарная обработка Производство нерасфасованной продукции ( таблетирование, лиофилизация и др. ) Дезинфекция Фасовка (асептический розлив, укупоривание, запаивание и др. ) Депирогенизация Стерилизация

Аттестация технологического процесса • Цель : демонстрация стабильности и робастности ( устойчивости) процесса – Использование разных серий – Проведение в разные дни – Статистическая обработка данных

Стратегии аттестации • Матрицирование (matrixing) – т. е. включение в одну процедуру разные дозировки одного и того же препарата или одинакового оборудования с различными размерами. • Семейства (family) – объединение разных, но близких продуктов ( например, по лекарственной форме: растворы для применения внутрь, или безрецептурные препараты и др. ) • Группирование экстремов (bracketing) – оцениваются только крайние по характеристикам процессы ( самая большая и самая маленькая загрузки, самая высокая и самая низкая скорость операций).

Параметры, аттестуемые при производстве таблеток • Размер частиц субстанции • Насыпная плотность субстанции/вспомогательного вещества • Загрузка в грануляторе • Количество и концентрации в смесителе • Скорость смешения и время смешивания • Влажность гранулята • Условия помола • Время опудривания • Прочность таблеток • Скорость подачи покрывающего слоя и др.

Вопросы, связанные с аттестацией процесса • • Научный подход Наличие СОП Калибровка Мониторинг внутренней среды Обучение Программа отбора проб сырья и его оценки Контроль изменений – Производственные помещения/системы – Технология/операции упаковки – Состав – Исходное сырье и поставщики – Процедуры очистки – Компьютерные системы и системы контроля

Основные проблемы (по FDA) • Не соблюдение утвержденных аттестационных протоколов • Неадекватные данные ( недостаточное тестирование, отсутствие спецификаций и т. д. ) • Ретроспективная аттестация – изменения происходили без очередности • Неадекватный контроль изменений, неадекватная программа ревалидации

Области, на которые обращает внимание FDA при проверке • Взаимосвязь между аттестационными сериями и серией, использовавшейся в клинических исследованиях (biobatch) • Контроль исходных материалов • Технологический процесс и оборудование • Внутрипроизводственный процесс, включая анализ гранулята • Использование аттестованных методик • Исследование забракованной продукции

Аттестация аналитических методик Процесс подтверждения, что методика подходит для поставленной цели, т. е. для решения определенной аналитической задачи Проводится: - для методов и методик, не включенных в фармакопею - для фармакопейных методик, воспроизводимых на предприятии (ограниченная) - при передаче технологий

Принципы валидации хроматографических методик

Категория I — аналитические методы для определения содержания основных компонентов в лекарственных веществах или в готовых лекарственных формах. Категория II — для определения примесей и продуктов разложения. Категория III — для определения растворения, высвобождения лекарственного вещества и т. п. Категория IV — тесты идентификации.
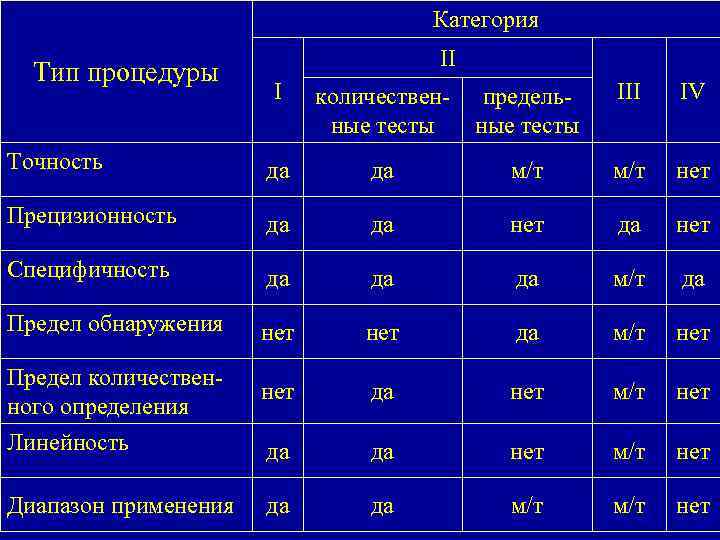
Категория Тип процедуры II I количественные тесты предельные тесты III IV Точность да да м/т нет Прецизионность да да нет Специфичность да да да м/т да Предел обнаружения нет да м/т нет Предел количественного определения нет да нет м/т нет Линейность да да нет м/т нет Диапазон применения да да м/т нет

Тестирование методики как единой аналитической системы при условиях, указанных в методике.
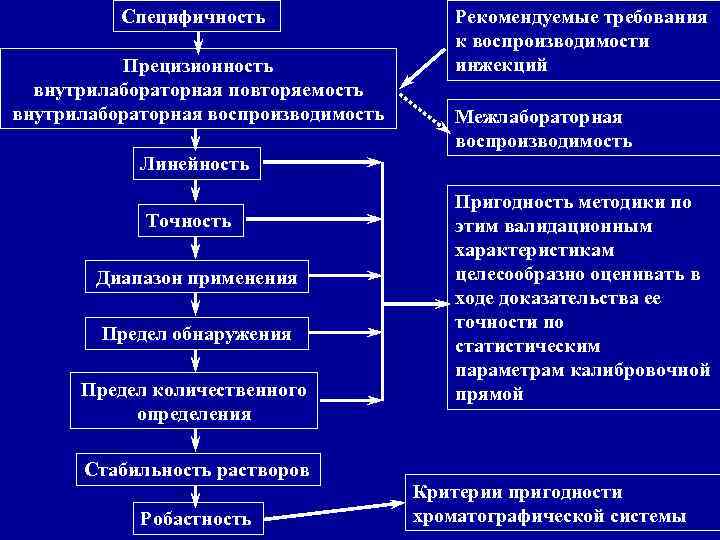
Специфичность Прецизионность внутрилабораторная повторяемость внутрилабораторная воспроизводимость Рекомендуемые требования к воспроизводимости инжекций Межлабораторная воспроизводимость Линейность Точность Диапазон применения Предел обнаружения Предел количественного определения Стабильность растворов Робастность Пригодность методики по этим валидационным характеристикам целесообразно оценивать в ходе доказательства ее точности по статистическим параметрам калибровочной прямой Критерии пригодности хроматографической системы

Специфичность методики.

Специфичность методик определения содержания основного вещества, растворения, однородности дозирования.

Специфичность (speciticity) - способность однозначно определять анализируемое вещество в присутствии всех других компонентов, включая примеси, которые потенциально могут присутствовать в анализируемом веществе. Специфичность подтверждается набором хроматограмм а) испытуемого раствора, б) раствора субстанции определяемого вещества, в) растворителя образца (blank), г) плацебо — для лекарственных форм, д) раствора для определения пригодности хроматографической системы. В качестве критерия полноты разделения пиков обычно используют коэффициент разделения пиков Rs.

Определение «чистоты» пика 1. с определением угла спектрального контраста θ, 2. с использованием хромато-массспектроскопии.

Специфичность методик определения содержания примесей

1. Примеси известны и имеются в наличии.

Необходимо показать, что 1. методика дает возможность обнаруживать пики основных продуктов деструкции лекарственного вещества, 2. пики примесей достаточно хорошо разделены между собой и отделены от пика лекарственного вещества и системных пиков, 3. методика дает возможность определять пики основных примесей из технологического процесса, 4. идентифицированы все примеси, содержание которых ≥ 0, 1%.

Специфичность подтверждается набором хроматограмм: 1. раствора смеси определяемого вещества и основных примесей, 2. растворителя образца, 3. испытуемого раствора, 4. раствора для определения пригодности хроматографической системы.

2. Основные примеси неизвестны или отсутствуют.

Для доказательства специфичности методик можно использовать следующие процессы химической модификации лекарственных веществ (ЛВ): 1. гидролиз с помощью 0, 1 N HCl и/или 0, 1 N Na. OH, 2. окисление 3 %-ным раствором Н 2 О 2, 0, 05 М раствором йода, 3. термическое разложение вещества при 60 – 100 °С, 4. фотохимическое разложение.

Длительность разрушающего воздействия на ЛВ выбирают учитывая следующие факторы: 1. продукты химической модификации должны быть отчетливо видны на хроматограмме – площадь пика ЛВ должна уменьшиться не менее, чем на 10%, 2. продукты химической модификации ЛВ должны быть хорошо отделены от пика ЛВ, площадь пика ЛВ должна быть близкой к таковой в испытуемом растворе, т. е. должна уменьшиться не более, чем на 30%, 3. желательно, чтобы содержание продукта химической модификации находилось вблизи уровня допустимого максимального содержания единичной примеси.

Прецизионность методики.

Прецизионность (воспроизводимость, precision) характеризует случайное рассеяние результатов (вариант) относительно среднего значения. Прецизионность аналитической методики характеризуют стандартным отклонением SD или относительным стандартным отклонением RSD в %, для серии измерений: SD = √ Σ (Xi - X)2 / (m – 1) 100 • SD RSD = ------ X

Внутрилабораторная повторяемость (сходимость) результатов определения определяется по величине стандартного отклонения относительного

Внутрилабораторная воспроизводимость 1. стандартные отклонения результатов анализа, полученные различными аналитиками статистически эквивалентны (с помощью Fкритерия Фишера), 2. средние результаты не отличаются друг от друга (с помощью t-критерия Стьюдента).

В одной лаборатории в один день один аналитик готовит в одинаковых условиях из модельной смеси или из одной серии исследуемого вещества 1. не менее 9 испытуемых растворов, охватывающих нормируемую по методике область концентраций, 2. Не менее 6 испытуемых растворов определяемого вещества при концентрации, близкой к номинальной. Каждый из растворов готовится независимо от других растворов и хроматографируется 3 раза.

Для определения основных лекарственных формах RSD ≤ 2%. веществ Для определения примесей при их содержании ≥ 1% - RSD ≤ 10%, при их содержании 0, 1 < х < 1% - RSD ≤ 25%, при их содержании ≤ 0, 1 - RSD ≤ 50%. в

Межлабораторная воспроизводимость

Линейность (linearity)— это способность методики в диапазоне применения давать величины сигнала Y (площади или высоты пика) прямо пропорциональные концентрации (количеству) С определяемого вещества: Y= a + b. C. В качестве критерия линейности для методик определения содержания основных веществ следует рассматривать значение коэффициента корреляции r.

Согласно рекомендациям FDA значение коэффициента корреляции r для методик определения содержания основных примесей должно быть не менее 0, 999. Для определения содержания примесей r должно быть не менее 0, 98.

Точность (accuracy) — это близость экспериментальных результатов, получаемых с использованием аналитической методики, к истинному значению во всей области действия аналитической методики. Точность может выражаться как в виде разности между средним экспериментальным Х и истинным μ значениями (Х – μ) ± ΔХ, или в виде открываемости R = (найдено аналита) х 100%/ (взято аналита).

Для субстанций точность определяют методом сравнения со стандартом. Для лекарственных форм точность определяют методом открытия введенного в матрицу аналита или методом стандартных добавок. Для примесей точность определяют методом внутренней нормализации.

Диапазон применения методики — это интервал между наименьшей и наибольшей концентрациями (количествами) определяемого вещества, включая эти концентрации (количества), в котором 1) соблюдается линейность методики, 2) воспроизводимость не выходит за пределы допустимых (заданных) значений и 3) методика является достаточной. Диапазон применения методики должен охватывать все значения концентраций (количеств), которые могут быть получены в ходе выполнения рутинных анализов.

В соответствии с требованиями ICH и USP диапазон применения методики должен быть не менее, чем 80 – 120% для количественного определения веществ в субстанциях и лекарственных формах, 70 – 130% для однородности дозирования, ± 20% для испытания на растворение, 50 – 120 % для определения примесей.

Предел обнаружения (LOD) определяют как наименьшую концентрацию анализируемого вещества в образце, которую можно детектировать (обнаружить отклик) при заданных условиях теста.

Расчет предела обнаружения по стандартному отклонению (SD) сигнала и наклону калибровочной прямой по формуле: LOD = 3, 3(SDa/b), где SDa – стандартное отклонение свободного члена калибровочной прямой «площадь пика S» - «концентрация определяемого вещества C» S = a + b. C.

Расчет предела обнаружения с использованием значений свободного члена и координат средней точки калибровочной прямой 2Ĉ • t(P, f) • SD 0 / √nj LOD=----------------, Ŷ – a + t(P, f) • SD 0 / √nj где Ĉ, Ŷ – координаты средней точки, a – свободный член, SD 0 – стандартное отклонение между экспериментальными и рассчетными значениями, nj – количество параллельных определений для каждой экспериментальной точки, t(P, f) – критерий Стьюдента (Р = 99%).

Метод оценки предела обнаружения по соотношению "Сигнал/Шум" S / N’ ≈ 3, где S – величина сигнала, N’ – величина шума.

Предел количественного определения (LOQ) — наименьшая концентрация аналита, которая может быть определена с приемлемой прецизионностью (воспроизводимостью) и точностью при регламентированных условиях метода.

Оценка предела количественного определения LOQ по соотношению "Сигнал/Шум" S / N' = 10

Расчет предела количественного определения с использованием калибровочной прямой. Способ 1. LOQ= 10(SD / b), где b — наклон калибровочной прямой, SD — стандартное отклонение сигнала.

Расчет предела количественного определения с использованием калибровочной прямой. Способ 2. Для этого рассчитывают 1) теоретические значения результатов анализа C = (Y - a) / b, 2) стандартные отклонения результатов анализа √ [ ][ ] SD 0 1 1 SDb 2 Ys-Ŷ 2 SDc= ------ + ------ • ------- , b N m b SD 0 где SD 0 – стандартное отклонение калибровочной прямой, N – количество экспериментальных точек калибровочной прямой, Ys – величина отклика, m – количество параллельных определений, b – коэффициент калибровочной прямой, SDb – его стандартное отклонение, Ŷ – среднее значение откликов всех экспериментальных точек.

Стабильность растворов. Необходимо построить зависимость St = S 0 + bt, где St, S 0 – площади пиков, t – время. и сравнить величину tb = |b| / SDb и сравнить его с критическим значением t-критерия Стьюдента.

Оценка устойчивости аналитической системы к небольшим изменениям основных параметров проводится по RSD. Оценивается влияние таких параметров, как например: 1. содержание органического растворителя, солей, модификаторов подвижной фазы, 2. р. Н буферного раствора, 3. температура колонки, 4. скорость потока подвижной фазы.

Критерии пригодности хроматографической системы
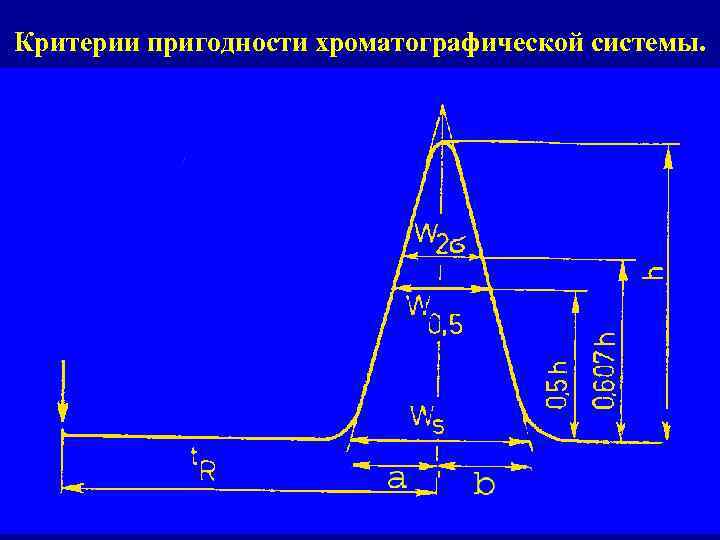
Критерии пригодности хроматографической системы.

Критерии пригодности хроматографической системы. Селективность (критерий разделения) Rs = 2 x (Tr 1 – Tr 2) / (W 1 + W 2) Ассиметрия пика (хвостовой фактор) Т 0, 05 = a / b Эффективность N = 5, 54 x (Tr / W 0, 5)2 = 16 x (Tr / W)2 = 4 x (Tr / W 2σ) Критерий воспроизводимости результатов измерений RSD.

Минимально допустимые значения коэффициентов разделения 1. Если пики не сильно отличаются по высоте Rs ≥ 1, 5. 2. Если пики значительно отличаются по высоте Rs ≥ 1, 5. 3. Если пики имеют большой хвостовой фактор Т 0, 05 > 2, 5 Rs ≥ 2, 5

Критерий, связанный с надежностью определения начала и конца пика ВР 0, 8 ≤ T 0, 05 ≤ 1, 5, USP 0, 75 ≤ T 0, 05 ≤ 2, 5,

Аттестация очистки Как правило, следует проводить аттестацию методов очистки. Обычно аттестацию методов очистки проводят в случаях, когда загрязнение или перенос материалов представляют наибольший риск для качества АФС. Например, на ранних стадиях производства может оказаться ненужной аттестация методов очистки оборудования, если все остатки удаляются последующими операциями очистки. Аттестация методов очистки должна отражать фактический характер использования оборудования. Если на одном и том же оборудовании производятся различные АФС или промежуточные продукты, и очистка этого оборудования проводится одним и тем же способом, то для аттестации очистки может быть выбран репрезентативный образец промежуточного продукта или АФС. Этот выбор должен быть основан на свойствах растворимости вещества и трудности его очистки, а также на расчете допустимых предельных значений остатков на основе его активности, токсичности и стабильности.

Аттестация очистки Методика аттестации очистки должна содержать характеристику оборудования, подлежащего очистке, порядок очистки, перечень материалов, допустимые предельные значения чистоты, параметры, которые следует контролировать, и применяемые аналитические методы. В методике также следует указать вид отбираемых проб, методы их отбора и маркировки. Для процессов, в которых существует ограничение на общее микробное загрязнение или уровень эндотоксинов в АФС, или других процессов, для которых такое загрязнение может представлять опасность (например, при производстве нестерильных АФС, используемых в производстве стерильных препаратов), аттестация очистки (дезинфекции) оборудования должна включать в себя определение уровня загрязнения по микроорганизмам и эндотоксинам. После проведения аттестации методы очистки должны контролироваться с определенной периодичностью для подтверждения того, что они сохраняют эффективность при использовании в текущем производстве. Чистоту оборудования можно контролировать аналитическими методами, а если это допускается, - путем визуального осмотра. Визуальный осмотр позволяет определить большие скопления загрязнений на малых площадях, которые могут оставаться необнаруженными при отборе проб и/или проведении анализов.

Принципы аттестации процесса очистки • Процедура документирована • Оценка эффективности процедуры: – Визуальная – Инструментальная ( микробиологическая, остаточное содержание препарата, остаточное содержание чистящих веществ)

Методология проведения аттестации очистки • Разработать протокол валидации очистки (метод очистки, аналитические методики, критерии эффективности) для различных продуктов ( продукты можно объединять) • Верифицировать метод и валидировать методики • Выполнить весь цикл очистки ( по проекту СОП) 3 раза. Отступление от цикла не допускается. • При неудовлетворительных результатах внести изменения в процесс и начать все сначала.

Разработка протокола (1) • Методология разработки протокола: – Специфические процедуры для каждого продукта – Группировка по родственным продуктам и выбор наихудшего случая – Группировка по степени риска ( хорошо растворимые продукты, одинаковая активность, высокотоксичные продукты или сложные для определения) – Установление параметров для предельного содержания не более 1 -ой фракции смеси – Различные факторы безопасности для различных лекарственных форм

Разработка протокола (2) Установление критериев (1) • На основании терапевтической дозы с учетом фактора безопасности: – Не более 0, 1% рутинной терапевтической дозы минимальной дневной дозы постороннего агента в максимальной суточной дозе последующего препарата ( дневная доза препарата А х фактор безопасности) – Не более 10 ppm в другом продукте – Для аллергогенных продуктов пределы содержания должны находиться ниже предела обнаружения наиболее чувствительными аналитическими методами

Разработка протокола (3) Установление критериев (2) • На основании токсичной дозы – Не более LD 50 субстанции или чистящего агента • По степени микробиологической контаминации – Для субстанций ( не более 100 -200 КОЕ на 100 см 2 или 10 -20) – Для чистящих веществ ( не более 200 -400 КОЕ на см 2 или 100 -200)

Разработка протокола (4) Методы отбора проб • Метод «мазка» (наиболее предпочтителен) – Техника отбора мазка (не менее 5 на участке 10 х10 см) – Количество точек отбора • Метод «промывных вод»

Разработка протокола (5) • «наихудший случай» – Проверка метода очистки при наибольшей загрязненности – Использование «жестких» параметров: пересохшие поверхности, минимальная концентрация чистящих средств и/или минимальное время воздействия

Разработка протокола (6) • Определить время между окончанием производства и началом очистки • Определить время между окончанием очистки и началом следующего производственного цикла

Самоинспекция

Самоинспекция 1. Важный элемент системы обеспечения качества 2. Система проведения внутренних проверок (соответствующая организационная структура, соответствующие процедуры, соответствующая документация) 3. Система корректирующих мероприятий и последующих проверок

Самоинспекция (внутренний аудит) проводится с целью проверки выполнения предприятием требований настоящего стандарта (GMP) и принятия необходимых мер по устранению недостатков. ГОСТ 52249 -2009

Аудит (проверка): Систематический, независимый и документированный процесс получения свидетельств аудита (проверки) и объективного их оценивания с целью установления степени выполнения согласованных критериев аудита (проверки) ГОСТ Р ИСО 9000 -2001

Типы аудитов: Внутренние проверки или аудиты первой стороной – проводятся самой организацией Внешние проверки: • Аудиты (проверки) второй стороной – проводятся сторонами, заинтересован-ными в деятельности организации • Аудиты (проверки) третьей стороны – проводятся внешними независимыми организациями

Самоинспекция - Проводится самим предприятием - Проводится группой, могут привлекаться независимые эксперты Аудит -Может проводится другими сторонами - Проводится аудитором (группой), могут привлекаться технические эксперты

Типы самоинспекций Плановые: • Проводятся в соответствии с графиком • Как правило, не реже 1 раза в год Внеплановые • По указанию руководства • При выявлении нестандартной продукции • При реорганизации • При изменении технологии или организации производства • При постановке на производства новых ЛС

Объекты самоинспекции -персонал; -помещения, включая помещения для подготовки персонала; -эксплуатация зданий и оборудования; -хранение сырья и готовых продуктов; -контроль производства и постадийный контроль; -контроль поступления, хранения и использования упаковочных и маркировочных материалов; -контроль качества; -документация; -санитария и гигиена; -программы по проведению валидации и ревалидации; -калибровка инструментов и измерительных приборов; -процедура отзыва продуктов с рынка; -порядок рассмотрения рекламаций; -результаты проведения предыдущих самоинспекций и принятые меры.

Документация системы самоинспекции • СОП о проведении самоинспекции • Опросники, памятки, методички • Заполняемые формы (регистрация несоответствий, отчет о выполнении корректирующих мероприятий) • Отчеты о самоинспекции • План-график самоинспекции • Планы корректирующих мероприятий • Положение (инструкция) о группе самоинспекции и аудиторе

Стадии самоинспекции • • • Планирование и подготовка Проведение проверки Составление отчета Выработка рекомендаций Разработка плана корректирующих мероприятий • Контроль их выполнения • Анализ результатов
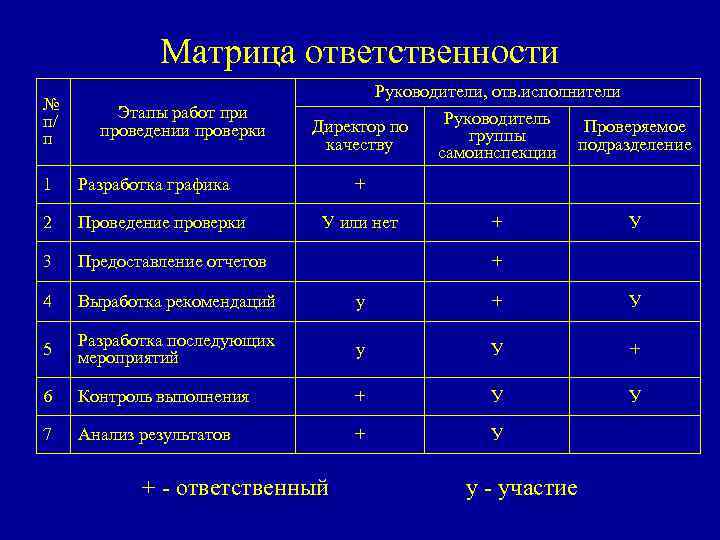
Матрица ответственности № п/ п Этапы работ при проведении проверки Руководители, отв. исполнители Руководитель Директор по Проверяемое группы качеству самоинспекции подразделение 1 Разработка графика + 2 Проведение проверки 3 Предоставление отчетов 4 Выработка рекомендаций у + У 5 Разработка последующих мероприятий у У + 6 Контроль выполнения + У У 7 Анализ результатов + У У или нет + У + + - ответственный у - участие

Планирование • Составление и утверждение годового графика • Рассылка графика по подразделениям • Формирование группы самоинспекции • Определение ресурсов, необходимых для подготовки группы • Подготовка к проверке • Собрание группы Самоинспекция 108

Группа по самоинспекции • • Компетентные специалисты Хорошее знание ГОСТ 52249 Состав группы как минимум 2 человека Специалисты из проверяемого подразделения не включаются в группу • Состав утверждается приказом генерального директора предприятия

Подготовка к проверке (1) • Изучение документации: – Внешняя : ОСТы, МУ, приказы, международные стандарты и руководства – Отчеты о предыдущих самоинспекциях и проверках корректирующих мероприятий – Внутренние документы предприятия: основополагающие СОП, регламенты, досье на препарат, отчеты – Внутренние документы проверяемого подразделения: органиграмма, планы размещения оборудования, инженерных систем, СОП

Подготовка к проверке (2) • Разработка опросных листов, памяток и др. • Определение стратегии проверки и выбор объектов самоинспекции • Уведомление проверяемого подразделения о времени проведения проверки и составе группы аудиторов • Издание приказа или распоряжения • Определение ответственных лиц проверяемого подразделения, отвечающих за взаимодействие с проверяемыми

Опросник для склада этикетировочных материалов ( пример) 1. Хранятся ли этикетки в отдельном и достаточным по площади помещении? 2. Организация склада предупреждает возможность перепутывания этикеток? 3. Приемлема ли существующая система учета этикеток? 4. Проверяется ли перед отпуском со склада правильность этикеток? 5. Уничтожены ли забракованные и устаревшие этикетки?

Опросник для ОКК • СОП по отбору проб предусматривает идентификацию места отбора и лица, проводящего отбор • Осуществляется хранение архивных образцов • Проведена валидация методов контроля, подтвердившая их точность, чувствительность, специфичность и воспроизводимость • Реактивы и другие материалы идентифицируются с указанием срока годности

Опросник лаборатории • Помещения контрольной лаборатории соответствуют установленным требованиям (раздел 4) • Имеется оборудование, позволяющее выполнять установленные методы контроля • Калибровка соответствует установленным требованиям • Выполняемые анализы фиксируются • Утвержден порядок отбора проб готового продукта

Опросники и памятки • • Преимущества Обеспечивают структурность проверки Напоминание о проверяемых объектах Направление проверки Проверки более компактные Недостатки • Отсутствие гибкости • Формализм • Заполнение отнимает время

Стратегии проверки Проверка по продукту Проверка системы • По ходу материальным • Аудит 2 -х и более систем потокам – Система обеспечения • Против хода качества материальных потоков – Система помещений и оборудования • Аудит производства отдельного препарата – Система управления материалами • Проверка документации – Управление производством • «Проблемный» подход (по – Система упаковки и рекламациям, браку и т. д) маркировки – Система контроля качества

Приказ (распоряжение) о проведении проверки • Назначается состав группы и руководитель • Назначаются даты и сроки, включая время • Приказ согласовывается с проверяемым подразделением, то есть согласовывается состав группы и время • Является дополнительным напоминанием о предстоящей проверке

Предварительное совещание • Проводит руководитель группы самоинспекции (ведущий аудитор) • Проверяется готовность к проверке • Распределяются конкретные участки между аудиторами • Согласовывается режим работы группы • Обсуждаются детали предстоящей проверки

Ответственность руководителя проверяемого подразделения • Назначить ответственных лиц, сопровождающих аудиторов • Обеспечить доступ аудиторов к документации подразделения • Обеспечить возможность проведения аудиторами интервью персонала • Подготовить своевременно план корректирующих мероприятий • Выполнить план корректирующих мероприятий

Проведение проверки • опрос по опросникам • работа на месте/интервью • совещания/инструктажи аудиторов (при необходимости) • создание предварительного отчета • обсуждение наблюдений и заключений проверяющих с руководителем проверяемого подразделения

Использующиеся термины: Наблюдение- результат оценки свидетельства аудита в зависимости от критериев аудита Объективное доказательство – информация, в отношении которой можно доказать, что она правдива, основана на фактах и получена путем наблюдений, измерений или с помощью других средств Отклонение – невыполнение установленного требования Несоответствие – выявленное при проверке отклонение, проводящие и могущее привести к выпуску нестандартной продукции.

Принципы проведения интервью • Типы вопросов: с открытым ответом, допускают объяснение • Изучение (дальнейшие объяснения поощряются) • Молчание ( делайте паузы !) • Перефразирование • Ответы фиксируются • Утверждения должны быть проверены

Оформление наблюдения • Указываются пункты нормативного документа, соответствие которого проверялось • Указываются факты, подтверждающие соответствие или несоответствие • Указывается, как были получены эти факты ( при интервью, при проверке документов, при наблюдении) • При несоответствии формулируется степень несоответствия: критическая, значительная или незначительная (замечание) или используется бальная система

Заключительное совещание Цель: – Обсудить полученные результаты – Получить объяснения – Обсудить предлагаемые рекомендации • Время проведения согласовывается заранее • Все полученные в ходе проверки данные должны быть уже структурированы • Культура проведения совещания: все имеют право голоса, нет обвинительного оттенка

Оценка наблюдений с позиции управления рисками 3 типа : 1 – критические ( мероприятия: немедленные, включая остановку процесса) 2 – существенные ( мероприятия: административные взыскания, повторная инспекция) 3 – незначительные ( мероприятия: достаточные длительные, превентивные)

Отчет о проверке Титульный лист содержит : • Наименование предприятия, • наименование проверяемого подразделения, дата и время проверки, состав проверяющих, ответственные лица со стороны проверяемых, основные замечания, предлагаемые меры по исправлению. • Количество листов в отчете • Сроки подачи плана корректирующих мероприятий ( не всегда) • Подписи проверяемых и проверяющих • Утверждающие надписи

Корректирующие мероприятия действия, предпринятые для устранения причин обнаруженного несоответствия, дефекта или другой нежелательной ситуации с тем, чтобы предотвратить их повторное возникновение Предупреждающие действия – действия, предпринятое для устранения причин потенциального несоответствия дефекта или другой нежелательной ситуации с тем, чтобы предотвратить их возникновение
8 аттестация_самоинспекции.ppt