L3.ppt
- Количество слайдов: 38

Общие представления о комплексных соединениях Еще в начале XIX в. была известна группа неорганических веществ, состав и строение которых нельзя было понять, исходя из концепции валентности элементов и представлений о химической связи, существовавших в то время. Например, состав и строение таких веществ как Cu. SO 4, NH 3, Pt. Cl 4 и KCl в то время могли объяснить, используя понятие "обычной" или "главной" валентности, и сами вещества, которые называли «соединения первого порядка» отдельно могли существовать сколь угодно долго. В то же время при их взаимодействии образуются новые соединения [Cu(NH 3)4]SO 4, K 2[Pt. Cl 6], в растворе которых не обнаруживаются ионы Cu • aq и аммиака; Pt 4+ и Cl. Такие соединения называли молекулярными или соединениями высшего порядка, а впоследствии "комплексными" соединениями ("complex" означает «сложный» ). Для объяснения их состава использовали понятие «побочной» валентности. • Термин "комплексные соединения" был предложен нашим соотечественником В. А. Кистяковский в 1890 г. почти одновременно с В. Оствальдом и А. Вернером. • В. А. Кистяковский рассматривал комплексные соединения как продукты соединения двух солей (2 KCl + Cu. Cl 2 → K 2[Cu. Cl 4]), имеющих общие анионы и не разлагающихся на простые ионы даже в разбавленных растворах.

• В 1893 г. Альфред Вернер опубликовал статью "Дополнительные данные о строении неорганических соединений", которая закладывала основы современных представлений о координационных соединениях: 1. Согласно теории Вернера, атомы могут проявлять не только обычную "главную" валентность, но и "дополнительную" или "побочную" валентность. Побочные валентности, по Вернеру, насыщаются при образовании комплексных соединений. Тогда как главные валентности катионов металлов насыщаются только отрицательно заряженными ионами, побочные валентности могут насыщаться и отрицательно заряженными ионами и нейтральными молекулами. 2. В каждом комплексном ионе есть центральный атом (комплексообразователь, акцептор электронов, иногда и донор электронов N, O, галогены и др. ), вокруг которого располагаются координированные им ионы и молекулы. 3. Каждый комплекс характеризуется координационным числом, которое показывает сколько атомов, ионов или молекул размещено вокруг центрального атома (т. е. оно указывает на общее количество σ связей, которые образует центральный атом с лигандами). Координационное число может быть 2 12. Координационное число равно сумме "главной" и "побочной" валентности, определяется природой иона или молекулы. 4. Координированные атомы (как за счет главной, так и за счет побочной валентности) находятся во внутренней сфере координационного соединения. Они называются аддендамы (или по современной номенклатуре лигандами). Координационная емкость лигандов число мест во внутренней сфере комплекса, которые занимает каждый лиганд. Для большинства лигандов координационная емкость равна единице, реже двум. • Анионы галогенов, CN , NH 3, H 2 O занимают в комплексе одно координационное место и называются монодентантнимы лигандами.
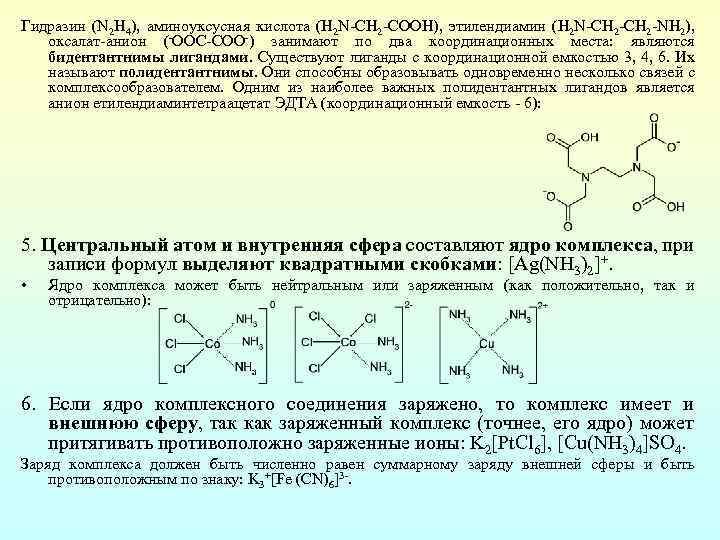
Гидразин (N 2 H 4), аминоуксусная кислота (H 2 N CН 2 COOH), этилендиамин (H 2 N CH 2 NH 2), оксалат анион ( ООС СОО ) занимают по два координационных места: являются бидентантнимы лигандами. Существуют лиганды с координационной емкостью 3, 4, 6. Их называют полидентантнимы. Они способны образовывать одновременно несколько связей с комплексообразователем. Одним из наиболее важных полидентантных лигандов является анион етилендиаминтетраацетат ЭДТА (координационный емкость 6): 5. Центральный атом и внутренняя сфера составляют ядро комплекса, при записи формул выделяют квадратными скобками: [Ag(NH 3)2]+. • Ядро комплекса может быть нейтральным или заряженным (как положительно, так и отрицательно): 6. Если ядро комплексного соединения заряжено, то комплекс имеет и внешнюю сферу, так как заряженный комплекс (точнее, его ядро) может притягивать противоположно заряженные ионы: K 2[Pt. Cl 6], [Cu(NH 3)4]SO 4. Заряд комплекса должен быть численно равен суммарному заряду внешней сферы и быть противоположным по знаку: K 3+[Fe (CN)6]3.

• Комплексные соединения - это соединения в узлах кристаллической решетки которых находятся комплексные ионы, способные к самостоятельному существованию в растворах. Значение теории Вернера: хотя теория и не смогла объяснить природу "побочной" валентности, однако Вернеру удалось • Систематизировать большое количество экспериментальных фактов; • Разработать методы определения строения координационных соединений; • Предсказать и обосновать изомерию комплексных соединений; • Разработать номенклатуру комплексных соединений; • Теория наметила новые пути синтеза комплексных соединений, что побудило к развитию экспериментальной неорганической химии.

Номенклатура комплексов и координационных соединений • • Первые названия координационным соединениям давали исследователи, которые их синтезировали, в зависимости от цвета. Так, желтое соединение [Co(NH 3)6]Cl 3 назвали лутеохлорид (от лат. Lutes желтый), [Co. Cl 2(NH 3)4]Cl празеохлорид (от лат. Prasinos зеленый). По цвету и с учетом способа получения соединения K 4[Fe(CN)6] и K 3[Fe(CN)6] получили названия соответственно желтой и красной кровяной соли. Для некоторых координационных соединений сохраняются названия по имени исследователей, их впервые получивших: K[Pt. Cl 3(Н 2 C=CH 2)] соль Цейзе; K 3[Co(NO 2)6] соль Фишера. Впервые логическую систему названий координационных соединений разработал Вернер, однако она не могла быть распространена на координационные соединения, синтезированные в последнее время (например, Re(CO)6]), а также на те, в которых центральный атом имел нулевую или отрицательную степени окисления. • Учитывая это, международный союз чистой и прикладной химии (IUPAC) предложил новую номенклатуру координационных соединений (правила 1957, 1970, 1990 гг. ) По международной номенклатуре, формулу комплекса записывают в квадратных скобках и ставят символ центрального атома, потом анионные лиганды в алфавитном порядке, потом также в алфавитном порядке катионные и нейтральные лиганды. В конце записывают мостиковые лиганды (если они есть) в порядке возрастания мостиковой емкости (количества соединенных центров). Мостиковые лиганды обозначают греческой буквой μn, где индекс n = 3, 4, . . . показывает количество соединенных центральных атомов, если их больше, чем 2. Если нужно отделить формулы сложных лигандов, то пользуются круглыми скобками, а в более сложных случаях еще и фигурными по такому принципу: [(. . . )], [{(. . . )}], [{[(. . . )]}]. После внешних скобок проставляют (если он есть) заряд комплекса как верхний индекс (при изображении комплексных ионов) или записывают полную формулу соединения по обычным порядком: катионы, затем анионы.
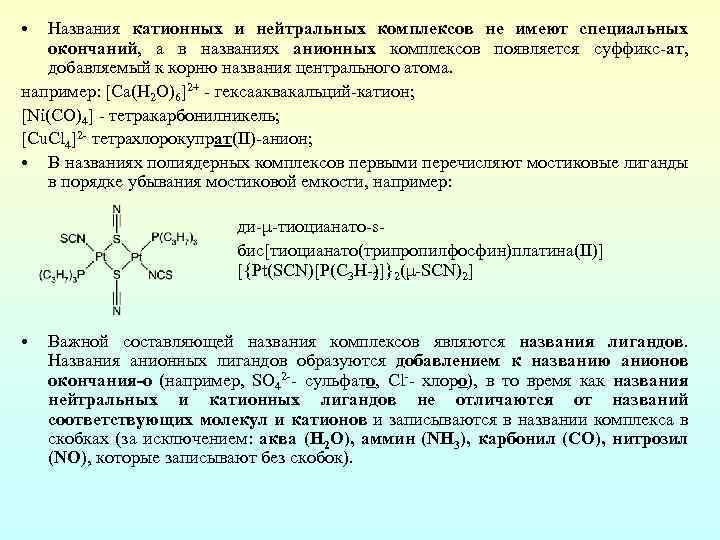
• Названия катионных и нейтральных комплексов не имеют специальных окончаний, а в названиях анионных комплексов появляется суффикс ат, добавляемый к корню названия центрального атома. например: [Ca(H 2 O)6]2+ гексааквакальций катион; [Ni(CO)4] тетракарбонилникель; [Cu. Cl 4]2 тетрахлорокупрат(II) анион; • В названиях полиядерных комплексов первыми перечисляют мостиковые лиганды в порядке убывания мостиковой емкости, например: ди μ тиоцианато s бис[тиоцианато(трипропилфосфин)платина(ІІ)] [{Pt(SCN)[P(C 3 H )]}2(μ SCN)2] 3 • Важной составляющей названия комплексов являются названия лигандов. Названия анионных лигандов образуются добавлением к названию анионов окончания-о (например, SO 42 сульфато, Cl хлоро), в то время как названия нейтральных и катионных лигандов не отличаются от названий соответствующих молекул и катионов и записываются в названии комплекса в скобках (за исключением: аква (H 2 O), аммин (NH 3), карбонил (CO), нитрозил (NO), которые записывают без скобок).

• Количество лигандов в координационной сфере указывают с помощью префиксов: ди-, три-, тетра-, пента-, . . . В случае сложных лигандов, или которые уже содержат префиксы, количество их указывают с помощью префиксов бис-(два), трис-(три), тетракис (четыре), пентакис (пять) и т. д. Например: [Fe(En)3]Cl 3 трис(этилендиаммин)феррум(III) хлорид. • Степень окисления центрального атома указывают с помощью римской цифры или арабской цифры с определенным знаком: [Co(SO 4)(NH 3)5]+ пентаамминсульфатокобальт(III) ион; K[Cr(CN)4(H 2 O)2] калий диакватетрацианохромат(III). • Названия соединений электролитов строят за порядком записи формулы: сначала катион, а затем анион: K 4[Sn. F 8] калий октафторостаннат; [Pt(NO 2)Cl(NH 3)2 En]SO 4 диамминэтилендиамминнитрохлороплатина(IV) сульфат; [Co(NH 3)6][Fe(CN)6] гексаамминкобальт(+3) гексацианоферрат(+3). • Если комплексное соединение является кислотой, то ее название также образуется из двух слов, причем вторым словом всегда есть "кислота". Основной же частью названия является слово, выведено из названия аниона с помощью окончания ная: H 3[Fe(CN)6] гексацианоферратная(II) кислота.

Классификация комплексных соединений • Основные способы классификации комплексных соединений основываются на природе центрального атома и лигандов а также характере связи между ними. I. По классам соединений: • комплексные кислоты: H 2[Si. F 6], H[Au. Cl 4]; • комплексные основания: [Ag(NH 3)2]OH, [Co(En)2](OH)3; • комплексные соли: K 3[Co(CN)6], [Cr(H 2 O)6]Cl 3. II. По природе лигандов: • лиганды: H 2 O аквакомплексы: [Co(H 2 O)6]Cl 3, [Cu(H 2 O)4](NO 3)2; • лиганды: NH 3 аммиакаты: [Ag(NH 3)2]Cl, [Cu(NH 3)4]SO 4; • лиганды анионы кислот: ацидокомплексы: K 4[Fe(CN)6]; • лиганды ОН гидроксокомплексы: K 3[Al(OH)6]. III. По знаку заряда • катионные: [Co(NH 3)6]Cl 3, [Zn(NH 3)4]Cl 2; • анионные: Li[Al. H 4]; K 3[Co(CN)6]; • нейтральные: [Pt. Cl 2(NH 3)2]; [Co. Cl 3(NH 3)3]; [Co(NH 3)6][Fe(CN)6].
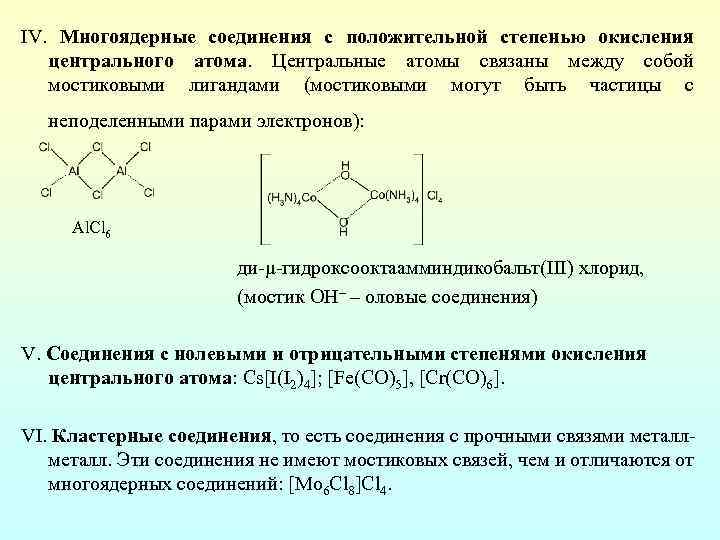
IV. Многоядерные соединения с положительной степенью окисления центрального атома. Центральные атомы связаны между собой мостиковыми лигандами (мостиковыми могут быть частицы с неподеленными парами электронов): Al. Cl 6 ди μ гидроксооктаамминдикобальт(ІІІ) хлорид, (мостик ОН– – оловые соединения) V. Соединения с нолевыми и отрицательными степенями окисления центрального атома: Cs[I(I 2)4]; [Fe(CO)5], [Cr(CO)6]. VI. Кластерные соединения, то есть соединения с прочными связями металл. Эти соединения не имеют мостиковых связей, чем и отличаются от многоядерных соединений: [Mo 6 Cl 8]Cl 4.

VII. Соединения, образование которых обусловлено наличием π-связей (πкомплексы): K[Pt. Cl 3(H 2 C = CH 2)]; Среди этих соединений есть так называемые сэндвичевые соединения: [Cr(C 6 H 6)2]; [Fe(C 5 H 5)2]. VIII. Соединения, содержащие координированные молекулы: Н 2, N 2 и О 2: гемоглобин; [Ru(N 2)2(NH 3)4]Cl 2. IX. Соединения циклические, которые разделяют на подгруппы: 1) хелатные, 2) внутрикомплексные, 3) макроциклические.
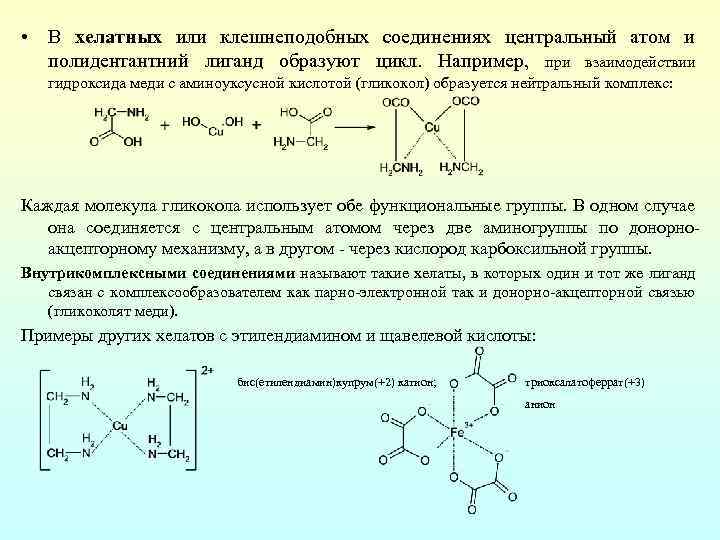
• В хелатных или клешнеподобных соединениях центральный атом и полидентантний лиганд образуют цикл. Например, при взаимодействии гидроксида меди с аминоуксусной кислотой (гликокол) образуется нейтральный комплекс: Каждая молекула гликокола использует обе функциональные группы. В одном случае она соединяется с центральным атомом через две аминогруппы по донорно акцепторному механизму, а в другом через кислород карбоксильной группы. Внутрикомплексными соединениями называют такие хелаты, в которых один и тот же лиганд связан с комплексообразователем как парно электронной так и донорно акцепторной связью (гликоколят меди). Примеры других хелатов с этилендиамином и щавелевой кислоты: бис(етилендиамин)купрум(+2) катион; триоксалатоферрат(+3) анион
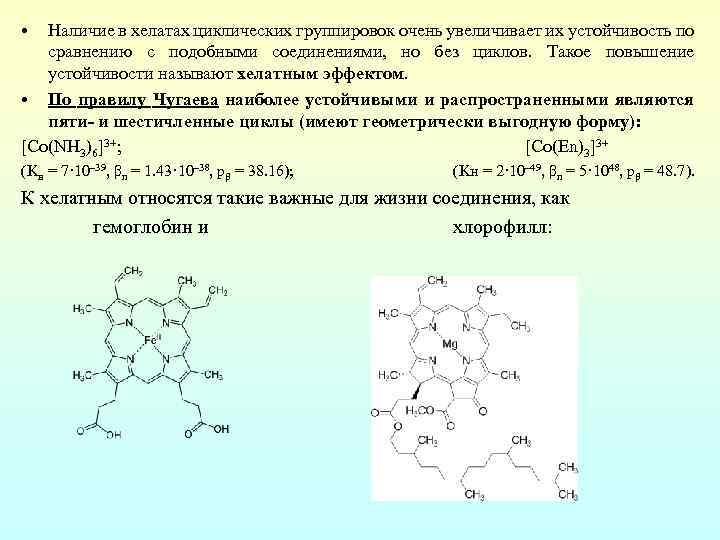
• Наличие в хелатах циклических группировок очень увеличивает их устойчивость по сравнению с подобными соединениями, но без циклов. Такое повышение устойчивости называют хелатным эффектом. • По правилу Чугаева наиболее устойчивыми и распространенными являются пяти- и шестичленные циклы (имеют геометрически выгодную форму): [Co(NH 3)6]3+; [Co(En)3]3+ (Kн = 7· 10– 39, βn = 1. 43· 10– 38, pβ = 38. 16); (Kн = 2· 10– 49, βn = 5· 1048, pβ = 48. 7). К хелатным относятся такие важные для жизни соединения, как гемоглобин и хлорофилл:

Изомерия комплексных соединений Изомеры - это соединения, которые имеют одинаковый состав, но отличаются по строению, химическим и физическим свойствам. Наиболее часто встречаются такие ее виды: 1) Сольватная (гидратная) изомерия наблюдается, когда распределение молекул растворителя (воды) между внутренней и внешней сферами неодинаково, поэтому изомеры имеют различные свойства: [Cr(H 2 O)6]Cl 3; [Cr. Cl(H 2 O)5]Cl 2∙H 2 O; [Cr. Cl 2(H 2 O)4]Cl∙ 2 H 2 O Фиолетовый; светло зеленый; темно зеленый Состав данных комплексов устанавливают по реакции взаимодействия с Ag. NO 3 разное количество осадка Ag. Cl. 2) Ионизационная изомерия связана с легкостью диссоциации ионов внутренней и внешней сфер комплекса: [Pt. Cl 2(NH 3)4]Br 2 и [Pt. Br 2(NH 3)4]Cl 2. 3) Координационная изомерия встречается в бикомплексних соединениях: [Co(NH 3)6][Fe(CN)6] и [Fe(NH 3)6][Co(CN)6]. 4) Координационная полимерия встречается в бикомплексних соединениях: [Pt. Cl(NH 3)3][Pt. Cl 3(NH 3)]; и [Pt(NH 3)4][Pt. Cl 4].

5) Изомерия связи возникает тогда, когда монодентантные лиганды могут координироваться через два разных атома. Например, NO 2 может присоединяться к центральному атому через азот или кислород: [Co(NO 2)(NH 3)5]SO 4; [Co(ONO)(NH 3)5]SO 4 коричнево желтый; красный Изомерия связи может наблюдаться у амбидендантних лигандов, содержащих хотя бы 2 разных атома с неподеленными парами электронов. 6) Пространственная или геометрическая изомерия (цис и транс изомерия) обусловлена тем, что одинаковые лиганды располагаются вокруг комплексообразователя или
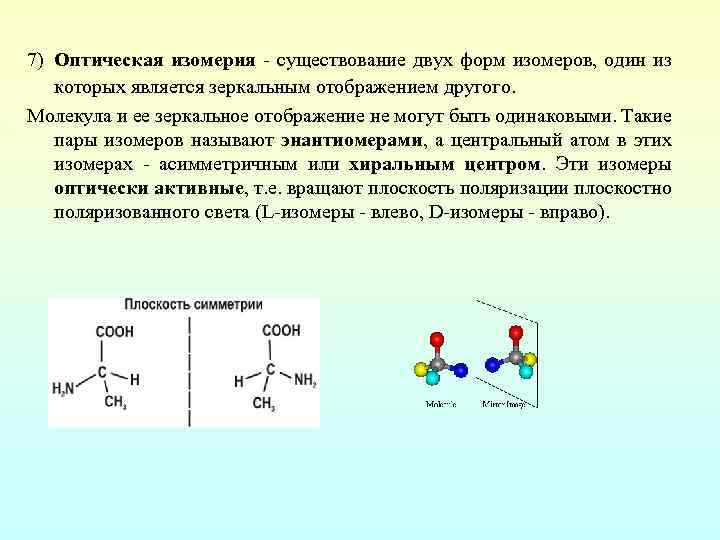
7) Оптическая изомерия существование двух форм изомеров, один из которых является зеркальным отображением другого. Молекула и ее зеркальное отображение не могут быть одинаковыми. Такие пары изомеров называют энантиомерами, а центральный атом в этих изомерах асимметричным или хиральным центром. Эти изомеры оптически активные, т. е. вращают плоскость поляризации плоскостно поляризованного света (L изомеры влево, D изомеры вправо).

• Взаимное влияние координированных групп (трансвлияние). Правило Черняева И. И. Черняев в 1926 г. сформулировал правило транс влияния: В координационной сфере лиганды, находящиеся в транс-положении друг относительно друга, в значительной мере влияют друг на друга. Это влияние приводит к усилению или ослаблению связи лигандов, которые занимают транс-положение с центральным атомом. Трансвлияние является общей закономерностью для неоднородных комплексов квадратной или октаэдрической структурой. Так, по способности проявлять трансвлияние лиганды размещаются в ряд: C 2 H 4 CN- CO > CNS- NO 2 - > I- > Br- > Cl- > OH- > NH 3 > H 2 O • Активность членов этого ряда уменьшается слева направо. Лиганды расположены слева способствуют удалению лигандов, расположенных справа и, наоборот, лиганды конца ряда закрепляют во внутренней сфере лиганды в начале ряда. Например, 1) В комплексе [Pt(NO 2)Cl 3]2 - транс лабилизирующее влияние. Из 3 х Cl ионов легче замещается тот, который находится в транс-положении к NO 2 -. 2) А в комплексе [Pt. Cl 3 NH 3]- транс стабилизирующее влияние. Cl- -ион в транс-положении к NH 3 крепче связан с Pt и наиболее трудно вступает в реакции замещения по сравнению с Cl ионом в цис положении.

Устойчивость комплексных соединений • Образование комплексов в растворе можно в общем случае представить : M + n. L MLn, n Это равновесие характеризуется общей константой образования (устойчивости) комплекса: . Образование комплексов и их диссоциация имеют преимущественно ступенчатый характер. Каждая стадия характеризуется ступенчатой константой образования (устойчивости): Как правило, ступенчатые константы устойчивости уменьшаются в ряду К 1> K 2> K 3>. . . > Kn.

Общая и ступенчатые константы образования связаны между собой простыми уравнениями: Это концентрационные константы. Для получения термодинамических констант используют активности ионов а. Тогда: Их преимущество в связи с изменением свободной энергии: Ранее устойчивость комплексов характеризовали также константами нестойкости (диссоциации), а каждая стадия диссоциации комплекса ступенчатой константой диссоциации:

Общая константа диссоциации комплекса равна произведению ступенчатых констант. Чем устойчивее комплекс, тем меньше его Kd. Константы диссоциации (общая и ступенчатые) обратно пропорциональны соответствующим константам устойчивости (чем больше значение β, тем устойчивее комплекс) Для удобства пользования в справочной литературе приводят не абсолютные значения констант устойчивости, а их логарифмы: рβ = -lg βn. В ряде соединений, которые рассматриваются как комплексные, константы устойчивости настолько невелики, что концентрации составных частей становятся больше, чем концентрация комплексного иона. К таким соединениям относятся двойные соли, которые в твердом состоянии имеют координационную структуру, а в растворе в значительной степени распадаются на составные ионы: В умеренно разбавленных растворах этой соли существуют как комплексные так и простые ионы. Дальнейшее разведение приводит к полному распаду комплексных ионов. Известны соли, которые занимают промежуточное положение между типичными двойными и типичными комплексными солями, например KPb. I 3. В концентрированном растворе существуют ионы K + i [Pb. I 3]. При разбавлении раствора этой соли комплексный ион распадается на I i Pb. I 2, который выпадает в осадок.

Факторы, влияющие на устойчивость комплексных соединений Устойчивость комплексных соединений определяется прочностью связи между комплексообразователем и лигандами. При этом в зависимости от природы комплексообразователя и лигандов прочность связи может изменяться в широких пределах. Например, комплексы двухвалентных металлов с этилендиамином: Из сравнения констант устойчивости комплексных ионов с соответствующими размерами ионов комплексообразователей следует, что уменьшение радиуса комплексообразователя и увеличение заряда приводит к повышению устойчивости комплексов. Таким образом устойчивость высокоспинових комплексов двухвалентных биометаллов с азот и кислородсодержащими лигандами изменяется в следующем порядке: Mg 2+ < Mn 2+ < Fe 2+; Co 2+; Ni 2+; Zn 2+; Cu 2+. Эта закономерность известна под названием ряда устойчивости Ирвинга-Вильямса.

На устойчивость комплексных соединений влияют также некоторые свойства лигандов, например: Чем больше заряд лиганда, его дипольный момент, а также чем меньше радиус лиганда, тем более устойчивым будет комплексное соединение, образованное этим лигандом. Устойчивость комплексных соединений возрастает также с увеличением координационного емкости лигандов: Этилендиамин бидентантний лиганд, а аммиак монодентантний, поэтому комплексное соединение кобальта с этилендиамином намного прочнее, чем комплекс с аммиаком.

Природа химической связи в комплексных соединениях Электростатические представления По простой модели Косселя и Магнуса (1916 1922) взаимодействие между комплексообразователем и ионными (или полярными) лигандами описывается законом Кулона. При этом предполагается, что частицы, которые образуют комплекс являются недеформированными шарами с определенным зарядом и радиусом. Устойчивый комплекс образуется тогда, когда силы протяжения к ядру комплекса уравновешивают силы отталкивания между лигандами. Согласно закону Кулона прочность комплекса возрастает с ростом заряда и уменьшением радиуса комплексообразователя и лигандов: (β 4[Al. F 4] > β 4[Al. I 4] ; β 4[Cu(NH 3)4]2 +> β 4[Cu(NH 3)4]+). • Так как силы отталкивания между ионами больше, чем между нейтральными лигандами, координационное число в комплексе с ионными лигандами меньше, чем с нейтральными: [Co(SCN)4]2 и [Co(H 2 O)6]2+. При увеличении числа лигандов, увеличиваются силы отталкивания между ними, поэтому для однозарядных ионов координационное число равно 2, для двухзарядных – к. ч. =4; для трехзарядных к. ч. =4 или 6.

Преимущества теории: Электростатическая теория • дает правильные расчеты энергии связи, • она достаточно наглядна, и поэтому • используется для качественных выводов. Недостатки теории: не может объяснить ряд фактов: 1) Почему существуют комплексы с неполярными лигандами и комплексообразователем в нулевой степени окисления, например [Fe(CO)5]; 2) Чем обусловлены магнитные и оптические свойства соединений; 3) Не обьясняет почему для некоторых комплексов с к. ч. =4 геометрическая структура квадратная, а не тетраэдрическая, что более вероятно для шаров в пространстве; 4) Считает неизменной электронное строение свободного иона и иона, как комплексообразователя, например, у Со 3+ и у [Co(NH 3)6]3+.

Метод валентных связей • Метод валентных связей (МВЗ) является наглядным способом описания комплексных соединений, предложен и разработан Полингом. • В основе МВЗ лежат следующие положения: 1. Связь между комплексообразователем и лигандами донорно-акцепторная. Лиганды представляют электронные пары, а ядро комплекса свободные орбитали. Степенью прочности связи является степень перекрывания орбиталей. 2. Орбитали центрального атома, участвующие в образовании связи гибридизуються. Тип гибридизации определяется числом, природой и электронной структурой лигандов. Гибридизация электронных орбиталей комплексообразователя определяет геометрию комплекса. 3. Дополнительное укрепление комплекса обусловлено тем, что наряду с σ связями могут возникать и π-связи. Это происходит, когда занята электронами орбиталь центрального атома перекрывается с вакантной орбиталью лиганда. Перераспределение электронной плотности в результате σ и π перекрывания происходит в противоположных направлениях: при возникновении σ связи происходит перераспределение электронной плотности на комплексообразователь, а при π связи от него на лиганды. 4. Магнитные свойства, проявляет комплекс, объясняются исходя из заселенности орбиталей. При наличии неспаренных электронов комплекс парамагнитный (магнитный момент в магнетонах Бора где n число неспаренных электронов). Спаренность электронов обуславливает диамагнетизм комплексного соединения.

• При образовании комплекса распределение электронов на орбиталях комплексообразователя может оставаться таким же, как в изолированного иона, или изменяться. Например: • У комплекса [Co. F 6]3– 3 d • [Co. F 6]3 – sp 3 d 2 гибридизация (октаэдр), внешнеорбитальный комплекс (восьмигранник), спинсвободный, высокоспиновый, парамагнитный (есть неспаренные электроны); • А комплекс [Co(NH 3)6]3+ • d 2 sp 3 гибридизация (октаэдр), внутриорбитальный комплекс (в образовании связи принимают участие внутренние d орбитали) (восьмигранник), спинспаренный, низкоспиновый, диамагнитный (согласуется с экспериментом); При внешнеорбитальной гибридизации sp 3 d 2 облака образуют более отдаленные и менее плотные 4 d орбитали. Степень перекрывыния при этом меньше, и связь лигандов с комплексообразователем слабее, чем при внутриорбитальной гибридизации.

• Преимущества теории МВЗ 1. объясняет и предусматривает число неспаренных электронов и, таким образом, 2. магнитные свойства комплексных соединений, а также 3. трактует комплексы с нейтральными лигандами и комплексообразователем в нулевой степени окисления (например, карбонилы). • Недостатки МВЗ: 1. пригодна для описания ограниченного круга веществ, 2. не рассматривает соединения с многоцентровыми связями; 3. не объясняет и не предусматривает оптические свойства комплексных соединений, так как не учитывает возбужденного состояния, 4. не характеризует энергии связи. Теория носит дополнений. полуколичественный характер, требует

Теория кристаллического поля • В отличие от метода валентных связей, теория кристаллического поля (ТКП) основана на предположении, что связи между иономкомплексообразователем и лигандами носят ионный или иондипольный характер. Эта теория была создана физиком Х. А. Бете для объяснения спектров и магнитных свойств кристаллических веществ, благодаря чему и получила свое название. • Координируясь вокруг комплексообразователя, лиганды создают электростатическое поле, под действием которого происходит деформация или расщепление электронного подуровня орбитали с высоким и низким значением энергии. dγ (εg) dε (t 2 g) Схема расщепления d подуровня переходных металлов под действием поля лигандов (в октаэдрическом комплексе).

• • Разность между энергиями dγ и dε орбиталей называется энергией расщепления и обозначается Δ. Значение этой энергии соответствует обратимому электронному переходу с dε на dγ орбиталь, и может быть определено по спектрам поглощения комплексов. Величина Δ зависит от природы и заряда ионакомплексообразователя, а для одного и того же элемента от природы лигандов. Чем более сильное электростатическое поле создают лиганды, тем большее значение имеет энергия расщепления. Исследование спектров комплексных соединений позволило расположить лиганды в порядке уменьшения их расщепляющей способности: CO > CN– > Phen >NO 2– > En > NH 3 > SCN– >H 2 O > OH– > F– > Cl– > Br– > I– сильное поле лигандов среднее поле лигандов слабое поле лигандов • В атомах и ионах металлов размещения электронов осуществляется согласно правилу Хунда, то есть, таким образом, чтобы абсолютное суммарное значение спинов было максимальным. Например, не нарушая принцип наименьшей энергии и принципа Паули d электроны в ионе Co 3+ можно разместить Σms = + ½ + ½ + ½ = 2 • • Σms = + ½ + ½ + ½ = 2 Данная схема удовлетворяет правило Хунда. Однако в зависимости от того, в поле каких лигандов находится ион металла, происходит расщепление d уровня с разной энергией расщепления. При сильном поле лигандов наряду с расщеплением происходит спаривание электронов и правило Хунда нарушается.

• Влияние силы поля лигандов на примере координации d электронов иона Co 3+: [Co. F 6]3– [Co(NH 3)6]3+ • В комплексе слабого поля [Co. F 6]3 - расщепление d орбиталей слабое и энергия межэлектронного отталкивания оказывается больше, чем энергия расщепления Δ 1, поэтому электронам выгоднее хранить параллельные спины согласно правилу Хунда. • В случае сильного поля [Co(NH 3)6]3+ - энергия расщепления Δ 2 превышает энергию межэлектронного отталкивания и электроны сначала полностью заполняют dε орбитали с меньшей энергией, а затем dγ орбитали с большей энергией.

• • • В зависимости от характера распределения электронов по расщепленным орбиталям комплексы делят на высокоспиновые и низкоспиновые. Высокоспиновие комплексы содержат неспаренные электроны и образуются в слабых полях лигандов. Низкоспиновие комплексы не содержат неспаренных электронов и образуются в сильных полях лигандов. Примеры высокоспинових комплексов: [Fe. F 6]3 , [Co(H 2 O)6]2+, [Fe(H 2 O)6]3+. Примеры низкоспинових комплексов [Fe(CN)6]4 , [Co(CN)6]3 , [Co(NO 2)6]3. Наличие неспаренных электронов предоставляет высокоспиновим комплексам парамагнитные свойства, низкоспиновим комплексам диамагнитные. Наряду с магнитными свойствами с позиций ТКП можно объяснить окраску комплексных соединений. При переходе электронов поглощаются и выделяются кванты света определенной длины волны видимой области спектра. Этим и обусловлена специфическая окраска комплексных соединений. Проглощаемая часть спектра Границы спектрального диапазона в нм: Цвет вещества • красный 620 780 зеленый • желто зеленый 550 575 пурпурный • зеленый 510 550 красный • голубой 480 510 оранжевый • синий 450 480 желтый • фиолетовый 380 450 зелено желтый Однако ТКП не учитывает изменения свойств лигандов под влиянием центрального атома, поэтому существуют некоторые соединения, структуру и свойства которых эта теория объяснить не в состоянии.

Метод молекулярных орбиталей • Этот метод описывает химическую связь в комплексных соединениях наилучшим образом. В основе метода лежит представление об образовании молекулярных орбиталей путем комбинации атомных орбиталей комплексообразователя и лигандов. • Метод МО позволяет дать оценку распределения электронной плотности в комплексных соединениях, выяснить какие молекулярные орбитали у них есть и на каком энергетическом уровне. • Молекулярные орбитали делятся на связывающие, несвязывающие и разрыхляющие. Если энергия молекулярной орбитали меньше, чем энергия исходных атомных орбиталей, такая орбиталь будет связывающей. Молекулярная орбиталь, которая по уровню энергии практически не отличается от атомной орбитали комплексообразователя, называется несвязывающей. Молекулярная орбиталь с высоким уровнем энергии является разрыхляющей, поскольку размещение на ней электронов приводит к ослаблению химической связи. • В первую очередь электронами заполняются связывающие орбитали, затем оставшиеся электроны, распределяются между несвязывающими и разрыхляющими орбиталями.

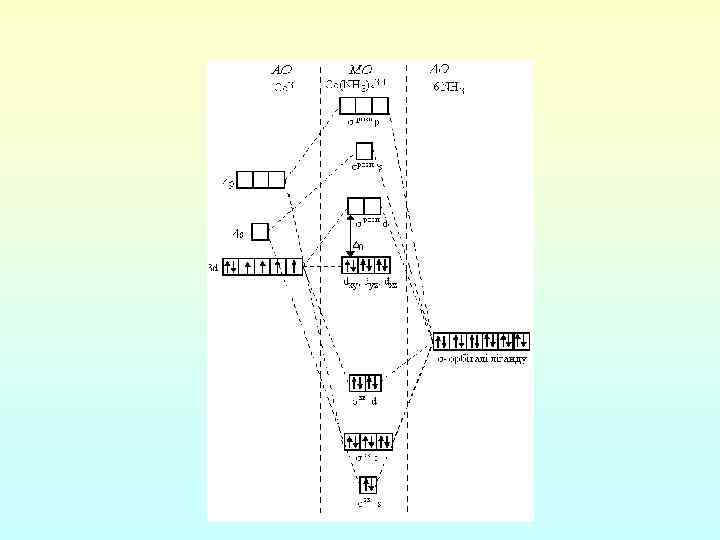
• В ММО учитывается подробная электронная структура не только комплексообразователя, но и лигандов. Здесь комплекс рассматривается как единая квантово-механическая система, в которой отдельные атомы и молекулы теряют свои индивидуальные свойства. Валентные электроны системы располагаются на многоцентровых МО, охватывают ядра комплексообразователя и всех лигандов, входящих в состав комплекса. Движение каждого электрона определяется положением ядер и характером движения всех других электронов. • При образовании октаэдрических комплексов переходного металла, лиганды которого не подвержены образованию π связей, из шести АО лигандов (s и p орбитали) и девяти АО комплексообразователя (s , p и d орбитали) возникает 15 МО. Для образования σ связей пригодны шесть орбиталей: • , так как их ветви лежат вдоль прямых, соединяющих атомы металла и лиганда. Остальные три орбитали ( ) является несвязывающими, так как их электронные облака направлены между лигандами и энергия этих орбиталей практически не меняется.

Если использовать изображение орбиталей, принятое в МВС, и дополнить его изображением разрыхляющих орбиталей, схемы комплексов [Co(NH 3)6]3+ и [Co. F 6]3 имеют вид: • [Co(NH 3)6]3+ • [Co. F 6]3– dz 2, dx 2 y 2, s, px, py, pz dxy, dyz, dxz НМО РМО ЗМО • В комплексе [Co(NH 3)6]3+ шесть электронов занимают три НМО иона Со 3+. Шесть СМО, соответствующие d 2 sp 3 гибридизации, заселяются электронами лигандов (по два от каждого) и, наконец, шесть РМО в диамагнитном комплексе [Co(NH 3)6]3+ остаются вакантными. • Для високоспинового комплекса [Co. F 6]3 в МВС постулируется внешнеорбитальная sp 3 d 2 гибридизация, поскольку все 3 d орбитали заселены. В ММО нет необходимости использовать 4 d орбитали, так как электроны комплексообразователя могут расположиться на РМО.
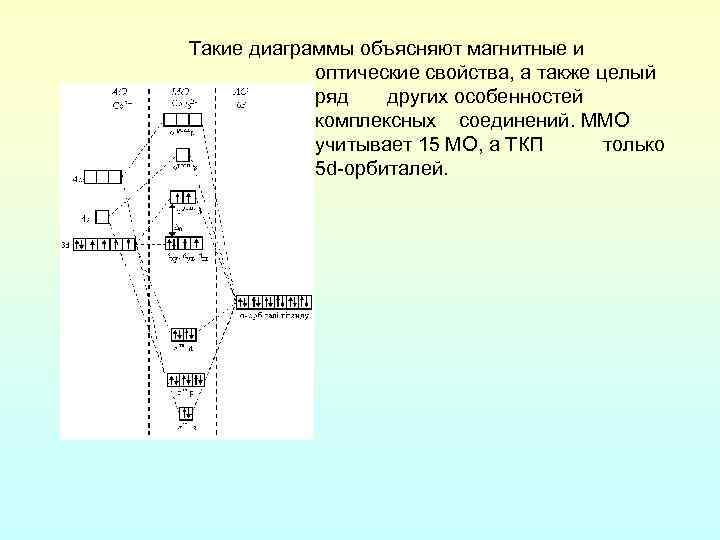
Такие диаграммы объясняют магнитные и оптические свойства, а также целый ряд других особенностей комплексных соединений. ММО учитывает 15 МО, а ТКП только 5 d-орбиталей.

Кинетика реакций комплексообразования • Многие реакций комплексообразования основаны на реакциях обмена лигандов, например: • Возможность протекания таких реакций определяется как термодинамическими, так и кинетическими факторами. Термодинамика процессов комплексообразования характеризуется константами устойчивости комплексов. С термодинамической точки зрения комплексы характеризуются как устойчивые или как неустойчивые зависимости от величины констант устойчивости, последние дают возможность определить принципиальную возможность протекания данной реакции комплексообразования. Однако не менее важной характеристикой таких реакций является их скорость, которая определяется константой скорости и показывает столь быстро в системе достигается состояние равновесия. Так, например для Co(III), Pt(IV), Pt(II) известно много изомеров. Это обусловлено высокой устойчивостью внутренней сферы и малой скоростью реакций внутрисферного обмена лигандов для этих ионов. • Для комплексов металлов, в которых реакции обмена лигандов проходят быстро, выделить все возможные изомеры невозможно, так как в растворе очень быстро достигается состояние равновесия, и в результате реакций замещения лигандов образуется, как правило, только один, термодинамически устойчивый комплекс.

• Комплексы, в которых обмен лигандами проходит быстро, называются лабильными. • Комплексы, для которых реакции обмена проходят медленно, называются инертными. • Нельзя смешивать понятия устойчивое и неустойчивое с понятиями инертен и лабильный. Лабильность - это кинетический параметр, а устойчивость термодинамический, и между ними нет прямой зависимости. • Термодинамически устойчивые комплексы могут быть как инертными, так и лабильными. Например, цианидные комплексы никеля очень устойчивы, однако характеризуются высокой скоростью обмена лигандами, то есть лабильными. • Комплексы [Fe(H 2 O)6]3+ и [Cr(H 2 O)6]3+ близкие по устойчивости, однако комплекс железа лабильный и легко вступает в реакции обмена, а аквакомплекс хрома инертный, и заменить молекулы воды во внутренней координационной сфере хрома на другие лиганды довольно трудно. • Для характеристики реакций замещения лигандов важно знать их механизм.

Методы определения координационной сферы Для установления координационного формулы соединения, изучение ее свойств используют химические, физико-химические и физические методы исследования. Изучения состава в твердом состоянии, как правило, начинают с химического анализа и установления общего ее состава. Затем определяют координационную и внешнюю сферу. • Например, нужно исследовать соединения: Co. Cl 3 • 6 NH 3, Co. Cl 3 • 5 NH 3 и Co. Cl 3 • 4 NH 3. Чтобы выяснить, что входит в внутреннюю сферу, а что во внешнюю, надо приготовить растворы трех солей в воде. 1. Реакция на лакмус во всех случаях нейтральная, следовательно свободного аммиака в растворе нет. 2. Качественные реакции на ионы кобальта показывают, что Со 3+ тоже входит в внутреннюю сферу комплекса. 3. Затем добавляют в раствор нитрата серебра и определяют, сколько Cl ионов осаждается в виде Ag. Cl. • Опыт показывает, что со свежеприготовленных растворов Co. Cl 3 • 6 NH 3 в виде Ag. Cl выделяются все три хлорид иона. Итак, формула соединения [Co(NH 3)6]Cl 3. • Если внутренняя сфера достаточно прочная, тогда для подтверждения координационной формулы соединения следует измерить электрическую проводимость (ЭП) свежеприготовленного раствора. • Экспериментально было установлено, что при 25°С молярная ЭП растворов комплексных соединений равна 100 См*см 2/моль для 1: 1 электролитов, для 1: 2 электролитов 250 См*см 2/моль , а для 1: 3 электролитов 400 См*см 2/моль , и для 1: 4 электролитов 500 См*см 2/моль.
L3.ppt