3Л+-+ОХТ.ppt
- Количество слайдов: 26

Общая химическая технология Лекция 3 ЭКСЕРГЕТИЧЕСКИЙ БАЛАНС. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКТОРОВ д. т. н. , профессор Бишимбаева Г. К.

Mатериальный и энергетический балансы. n n При разработке химико технологических процессов проводятся разнообразные расчеты для количественной оценки протекающих операций, а также для определения оптимальных значений параметров технологического процесса. Во всех случаях при расчетах учитываются законы гидродинамики, тепло-и массопередачи и химической кинетики, поэтому расчеты материальных потоков обычно сочетаются с энергетическими расчетами, для этого составляют материальный и энергетический балансы.

Материальный баланс n Материальный баланс – это вещественное выражение закона сохранения массы вещества, согласно которому во всякой замкнутой системе масса веществ, вступивших во взаимодействие, равна массе веществ, образовавшихся в результате этого взаимодействия, т. е. приход вещества ΣBприх равен его расходу Σ Bрасх. n Таким образом, уравнение материального баланса можно представить в виде ΣBприх = ΣBрасх Для периодических процессов материальный баланс составляют в расчете на одну операцию, для непрерывных процессов – за единицу времени.

Материальный баланс n n n n Материальный баланс составляют по уравнению основной суммарной реакции с учетом параллельных и побочных реакций. Он может быть составлен для всех веществ, участвующих в процессе, или только для одного какого либо вещества. Обычно учитываются не все протекающие реакции и получаемые побочные продукты, а лишь те, которые имеют существенное значение, т. е. материальный баланс носит приближенный характер. Материальный баланс составляют для процесса в целом или для отдельных его стадий. При этом учет массы веществ производится отдельно для твердой, жидкой и газовой фаз, поэтому, в общем виде, материальные балансы выражаются обычно в виде уравнения Вт + Вж + Вг = Вт′ + Вж′ + Вг′ где Вт, Вж, Вг – массы твердых, жидких и газообразных веществ, поступающих в производство или на анную операцию в единицу времени; В′т, В′ж, В′г – массы получаемых продуктов.

Тепловой баланс n n n Химико технологические процессы связаны с затратой различных видов энергии – тепловой, механической, электрической. поскольку в этих процессах тепловая энергия имеет наибольшее значение, для них обычно составляют тепловой баланс. В этом случае закон сохранения энергии формулируется так: приход тепла в данной производственной операции σq пpиx должен быть равен расходу тепла в той же операции σqpacx, т. е. qпpиx = qpacx

ТЕПЛОВОЙ БАЛАНС n ТЕПЛОВОЙ БАЛАНС СОСТАВЛЯЮТ ПО ДАННЫМ МАТЕРИАЛЬНОГО БАЛАНСА С УЧЕТОМ ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ И ФИЗИЧЕСКИХ ПРЕВРАЩЕНИЙ, ПРОТЕКАЮЩИХ В АППАРАТЕ, А ТАКЖЕ С УЧЕТОМ ПОДВОДА ИЛИ ОТВОДА ТЕПЛА. В ОБЩЕМ ВИДЕ ТЕПЛОВОЙ БАЛАНС ВЫРАЖАЮТ УРАВНЕНИЕМ: QТ + QЖ + QГ + QФ + QР + QП = Q′Т + Q′Ж + Q′Г + Q′Ф + Q′Р + Q′П n n n ГДЕ QТ, QЖ, QГ – ТЕПЛО, ВНОСИМОЕ С ПОСТУПАЮЩИМИ В АППАРАТ ТВЕРДЫМИ, ЖИДКИМИ И ГАЗООБРАЗНЫМИ МАТЕРИАЛАМИ; Q′Т, Q′Ж, Q′Г – ТЕПЛО, УНОСИМОЕ ВЫХОДЯЩИМИ МАТЕРИАЛАМИ; QФ, Q′Ф – ТЕПЛО, ВЫДЕЛЯЕМОЕ И ПОГЛОЩЕННОЕ ПРИ ФИЗИЧЕСКИХ ПРОЦЕССАХ; QР, Q′Р – ТЕПЛО ЭКЗО И ЭНДОТЕРМИЧЕСКИХ РЕАКЦИЙ; QП, Q′П – ТЕПЛО, ПОДВОДИМОЕ В АППАРАТ ИЗВНЕ И ВЫВОДИМОЕ ИЗ НЕГО.

Эксергетический баланс n n n Балансовые уравнения, базирующиеся на законах сохранения и превращения массы и энергии, дополняют эксергетическим балансом, основанным на одновременном учете первого и второго начал термодинамики. Уравнение эксергетического баланса в общем виде имеет следующий вид: Σ Е`= ΣЕ``+D где Σ Е`и ΣЕ – входящие и выходящие потоки эксергии D – потоки эксергии Разность между приходом и расходом эксергии представляет собой потери эксергии вследствие необратимого теплообмена: D =(E 1 – E 2) – (E 4 – E 1) Эти потери можно рассчитать без определения эксергии потоков, зная только энтропии теплоносителей: D 1 = T 0 ΔS = T 0 (S 4 – S 3)- (S 1 - S 2)

Эксергетический КПД n n Для эксергии неприменим общий закон сохранения: сумма эксергии всех элементов системы в ходе процесса уменьшается; только при отсутствии потерь (в обратимом процессе) сумма эксергии до и после процесса остается постоянной; в каждом необратимом процессе эксергия преобразуется в энергию. называется эксергетическим КПД, который всегда меньше единицы. Эксергетический КПД показывает степень приближения системы к идеальной. Для идеального процесса, где потери эксергии отсутствуют, n e, = 1, или 100%. Если же подведенная эксергия полностью теряется в процессе, то ne = 0.

КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКТОРОВ n n n Наиболее рациональные признаки классификации химиче ских реакторов следующие: • способ организации процесса, в котором участвует химический реактор (РХ), периодический, полунепрерывный, непрерывный; • режим движения реакционной смеси (смешение, вытеснение); • тепловой режим в реакторе; • фазовый состав реакционной смеси; • конструктивные характеристики

По способу организации процесса n n n способ организации процесса, в котором участвует химический реактор (РХ), периодический, полунепрерывный, непрерывный; периодические - заполняемые до начала химического процесса и опорожняющиеся после его завершения, и непрерывные (проточные), в которых вещества вводятся и выводятся в ходе процесса в котором участвует химический реактор (РХ), - периодический, полунепрерывный, непрерывный; периодические - заполняемые до начала химического процесса и опорожняющиеся после его завершения, и непрерывные (проточные), в которых вещества вводятся и выводятся в ходе
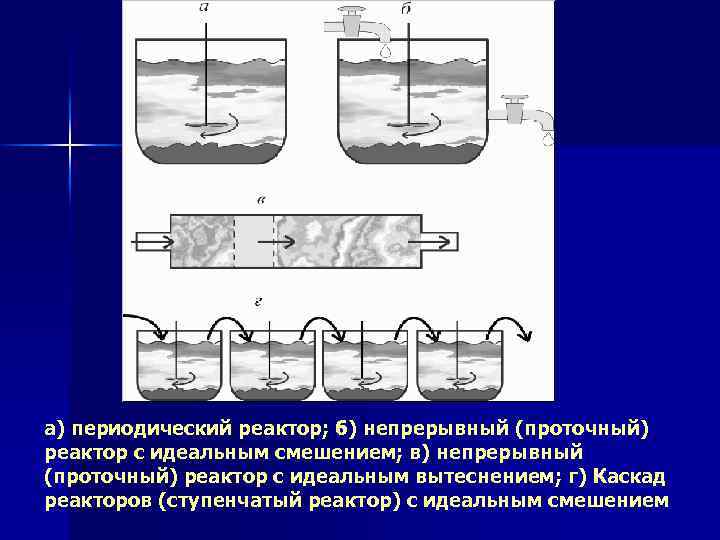
а) периодический реактор; б) непрерывный (проточный) реактор с идеальным смешением; в) непрерывный (проточный) реактор с идеальным вытеснением; г) Каскад реакторов (ступенчатый реактор) с идеальным смешением

Реактор периодического действия n n n рабочий цикл включает загрузку реагирующих веществ, проведение химического или физико химического превращения, выгрузку продуктов реакции или физико химического превращения, подготовку реактора к новому циклу. Производительное время пребывания реагирующих веществ равно времени, необходимому для полного свершения процесса взаимодействия до заданной степени превращения. Полное время цикла равно сумме длительностей всех операций. Производительность такого аппарата ниже производительности реактора непрерывного действия.

n В реакторе полунепрерывного действия одну из операций подачу сырья или вывод готового продукта проводят периодически в зависимости от свойств ФХС, положенной в основу ХТП.


В реакторе непрерывного действия все операции по получению целевого продукта (подача реагентов, химическое или физико химическое превращение, вывод получаемого продукта) выполняют одновременно. n Затраты времени на загрузку, выгрузку и подготовку аппарата к проведению реакции отсутствуют. n

КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКТОРОВ n n n По режиму движения реакционной смеси вещества непрерывные реакторы делятся на: реакторы смешения и реакторы вытеснения; предельные случаи называются идеальным смешением и идеальным (поршневым) вытеснением. Реальные реакторы вытеснения отклоняются от идеального случая вследствие многих причин: продольной диффузии, гидродинамической дисперсии, пристеночных гидродинамических эффектов и т. д. •

Режим движения реакционной смеси n n В зависимости от гидродинамического режима реакторы подразделяют на реакторы смещения и реакторы вытеснения. В реакторах вытеснения некоторое смешение реагирующих компонентов по длине (высоте) реактора. В реакторах смешения также нельзя полностью исключить небольшие зоны неравенства концентраций. Поэтому модели таких реакторов принято называть реакторами идеального смешения (РИС) и реакторами идеального вытеснения (РИВ).

РИС n Процесс смешения в РИС должен быть организован таким образом, чтобы в любой точке аппарата были абсолютно одинаковые условия по концентрации реагентов, продуктов реакции, степени превращения, температуре, скорости химического или физико химического превращения и т. д.

Реактор идеального смешения периодического действия n a. A+b. B —> d. D +-ΔH n Уравнение материального баланса по одному из исходных веществ где Cа - концентрация А в реакционной среде; х, у, z - пространственные координаты; Wx WY Wz составляющие скорости потока; Dк, м коэффициент конвективной и молекулярной диффузии; r- скорость реакции как функция СА.

n Но так как во всем объеме все параметры одинаковы производная любого порядка от концентраций по х, у, z равна нулю, следовательно уравнение можно записать в виде полного дифференциала: где r A - скорость реакции (функция убыли компонента А).

n Если взаимодействие не сопровождается изменением объема реакционной смеси, то скорость, выраженная через степень превращения компонента А, (ХА), равна где CAO - начальная концентрация компонента А; ХА заданная степень превращения компонента А. • Время, необходимое для достижения степени превращения Xа, состав

КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКТОРОВ По тепловому режиму выделяются n изотермические, n политермические, n адиабатические и др. типы реакторов ; n

КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКТОРОВ По фазовому составу реакционной смеси: n гомогенные; n гетерогенные. n

КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКТОРОВ По конструктивные характеристики реактора n типа реакционной камеры; n типа колонны; n типа теплообменника; n типа печи n
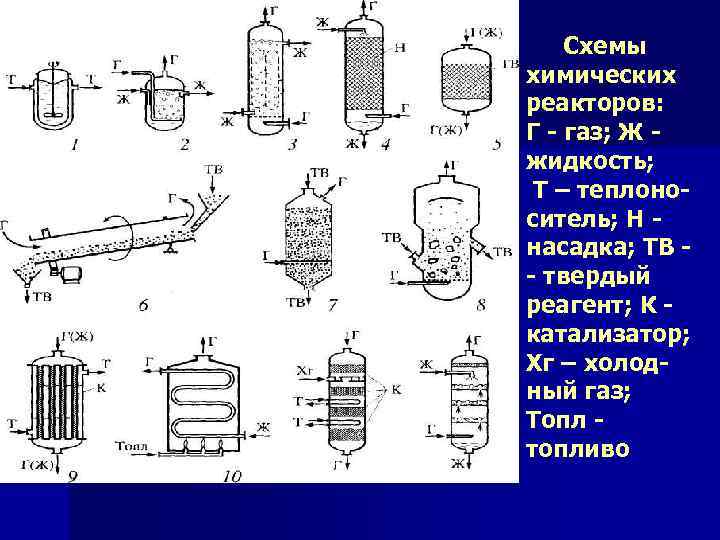
Схемы химических реакторов: Г - газ; Ж жидкость; Т – теплоноситель; Н насадка; ТВ - твердый реагент; К катализатор; Хг – холодный газ; Топл топливо

n Важнейшим из факторов, определяющих устройство реактора, можно отнести следующие: агрегатное состояние исходных веществ и продуктов реакции, а также их химические свойства, температуры и давление, при которых протекает процесс, тепловой эффект процесса и скорость теплообмена; интенсивность перемешивания реагентов, непрерывность или периодичность процесса; удобство монтажа и ремонта аппарата, простоту его изготовления; доступность конструкционных материалов и т. д.
3Л+-+ОХТ.ppt