Азот.ppt
- Количество слайдов: 53

ОБЩАЯ ХАРАКТЕРИСТИКА V-А ГРУППЫ Входят: азот (N), фосфор (Р), мышьяк (As), сурьма (Sb), висмут (Bi). Электронная конфигурация внешнего уровня: (ns 2 nр3). Элементы проявляют степень окисления (-3). Азот не имеет d подуровня. Для мышьяка более характерны соединения со степенью окисления +5, а для висмута +3. Соединения сурьмы занимают промежуточное положение. В ряду Аs – Sb – Вi размеры атомов и ионов увеличиваются, энергия ионизации уменьшается, ослабевают неметаллические свойства и усиливаются металлические. В ряду N-P-As-Sb-Bi неметаллические признаки ослабевает, т. к. увеличивается число энергетических уровней в атоме и появляется d подуровень экранирующий ядро. Азот и фосфор – неметаллы, висмут – металл.
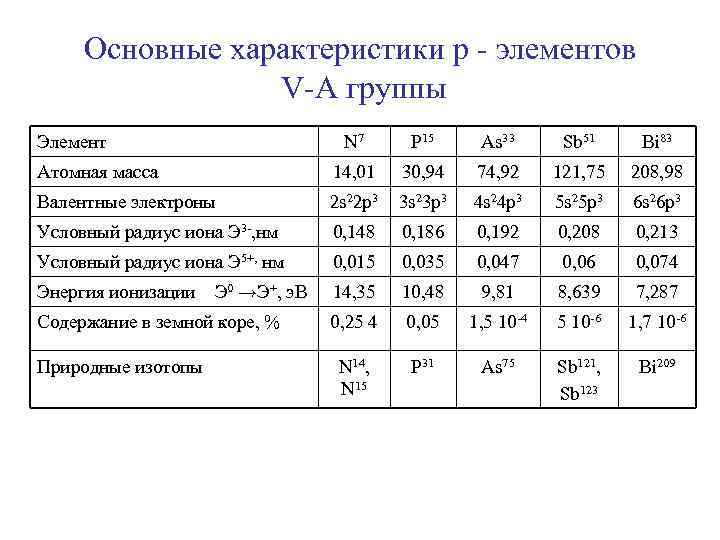
Основные характеристики р - элементов V-А группы Элемент N 7 Р 15 Аs 33 Sb 51 Вi 83 Атомная масса 14, 01 30, 94 74, 92 121, 75 208, 98 Валентные электроны 2 s 22 р3 3 s 23 р3 4 s 24 р3 5 s 25 р3 6 s 26 р3 Условный радиус иона Э 3 -, нм 0, 148 0, 186 0, 192 0, 208 0, 213 Условный радиус иона Э 5+, нм 0, 015 0, 035 0, 047 0, 06 0, 074 Энергия ионизации 14, 35 10, 48 9, 81 8, 639 7, 287 0, 25 4 0, 05 1, 5 10 -4 5 10 -6 1, 7 10 -6 N 14, N 15 Р 31 Аs 75 Sb 121, Sb 123 Вi 209 Э 0 →Э+, э. В Содержание в земной коре, % Природные изотопы

АЗОТ Выделен в 1772 г. Нахождение в природе: Содержание в земной коре 1, 9*10 -3%. В свободном состоянии входит в состав воздуха и составляет 78, 16% объема. В связанном состоянии: нитрат натрия, или натриевая (чилийская) селитра. белковые вещества (группа –СО-NН -амидная или пептидная).

Электронная конфигурация: 1 s 22 р3. Неметалл, по ЭО (3, 0 э. В) уступает фтору и кислороду. Атомные орбитали подвергаются sр3 -, sр2 - или sргибридизации. При sр2 - или sр- гибридизации образует 1 или 2 πсвязи. Возможные степени окисления: – 3, -1, +3, +5, а также +2 и +4. Имеет 2 устойчивых изотопа N 14 и N 15. Молекула N 2 имеет структуру: N ≡ N. Кратность связи равна 3. Молекула прочная: N 2↔ 2 N; ΔН 0298 = 945 к. Дж. При 30000 С степень диссоциации молекулы на атомы ~ 0, 1%.

Физические свойства: Азот – газ, без цвета, запаха, при – 195, 80 С переходит в жидкое состояние, а при – 2100 С затвердевает. Плохо растворим в воде. Молекула слабо поляризуется. в обычных условиях Химические свойства: Химически малоактивен. При обычных условиях взаимодействует только с литием: 6 Li+N 2=2 Li 3 N

Получение: В промышленности: Ректификация жидкого воздуха В лаборатории: 1) NН 4 Сl + КNО 2 = КСl + N 2 + 2 Н 2 О 2) 3 Сu. О + 2 NН 3=Сu + N 2 + 3 Н 2 О 3) сжигание азотосодержащих органических веществ. Применение: 1) производство аммиака; 2) производство цианида кальция: Са. С 2 + N 2 = Са. CN 2 + С 3) создание инертной среды; 4) для наполнения ламп; 5) газ носитель в хроматографии

КРУГОВОРОТ АЗОТА В ПРИРОДЕ Кислородные соединения азота образуются при грозовых разрядах (1). Аммиак (4) и соли HNO 3 (2) - материал для выработки растениями белковых веществ. Растения поедаются травоядными животными, которые служат пищей для плотоядных. Экскременты, трупы, останки растений возвращают почве связанный азот: останки ''гниют'‘ и азот переходит в аммиак и его соли (3). Продукты гниения вновь усваиваются растениями (4), и под воздействием нитрозобактерий и нитробактерий подвергаются превращению в HNO 3 (“нитрофикация”) (5). Нитрозобактерии окисляют аммиак: 4 NН 3 + 6 О 2 = 4 НNО 2 + 4 Н 2 О. Нитробактерии окисляют азотистую кислоту: 2 НNО 2+О 2=2 НNО 3. Образующаяся азотная кислота переводит углекислые соли почвы в нитраты, которые усваиваются растениями, и т. д. . Основной цикл превращений связанного азота замыкается.

В цикле имеются потери связанного азота: 1) Часть N 2 выделяется в свободном состоянии при гниении (6) и при нитрофикации (7). 2) При пожарах соединения N 2 переходят в свободный N 2 (6). 3) Работа ''денитрофицирующих'' бактерий: 5 С + 4 КNО 3 = 2 К 2 СО 3 + 3 СО 2 + 2 N 2. Происходит перевод нитратов в свободный азот (8), который выходит из круговорота. Источники пополнения: 1) атмосферные электрические разряды; 2) жизнедеятельность ''азотобактерий'‘(9): 2 N 2 + 6 Н 2 О + 3 С = 3 СО 2 + 4 NН 3 3) ''Клубеньковые'' бактерии – переводят N 2 атмосферы в азотные соединения. 4) Деятельность человека: а) использование жизнедеятельности бактерий (введение в севооборот бобовых растений); б) искусственное связывание N 2 атмосферы (методы ''сжигания воздуха'' (образуется HNO 3 и её соли).

СОЕДИНЕНИЯ СО СТЕПЕНЬЮ ОКИСЛЕНИЯ – 3 (НИТРИДЫ) Получение: При высоких температурах: 3 Мg + N 2 = Мg 3 N 2; 2 В + N 2 = 2 ВN; 3 Н 2 + N 2 = 2 NН 3 Химические свойства: В периоде слева на право меняются от основных к кислотным: Nа 3 N, Мg 3 N 2 Аl. N Si 3 N 4, Р 3 N 5 Основные амфотерные кислотные Основные нитриды – кристаллические вещества. Они легко разлагаются водой: Li 3 N + 3 Н 2 О = 3 Li. ОН + NН 3 Нитриды галогенов – эндотермические соединения. Взаимодействуют с водой: Сl 3 N + 3 Н 2 О = 3 НСl. О + NН 3. Нитриды ВN, А 1 N, Si 3 N 4, Ge 3 N 4 – твердые полимерные вещества, с высокой температурой плавления (2000 – 30000 С), они либо диэлектрики, либо полупроводники. Нитриды d – элементов - интерметаллические соединения, обладают блеском, электрической проводимостью, твердостью и тугоплавкостью. ПОЛУЧЕНИЕ НИТРИДОВ: 2 Аl + 2 NН 3 = 2 Аl. N + 3 Н 2 Сr. Сl 3 + NН 3 = Сr. N + 3 НСl

АММИАК Аммиак - ковалентный нитрид. Физические свойства: Бесцветный газ, с резким запахом. Ткип=– 33, 60 С, а Тзам= – 77, 80 С затвердевает. Хорошо растворим в воде. При нагревании растворимость аммиака резко уменьшается и он улетучивается из раствора. Концентрированный раствор содержит 25% аммиака, ρ=0, 91 г/см 3. Раствор аммиака называется аммиачной водой или нашатырным спиртом.

Структура молекулы: Азот имеет sp 3 -тип гибридизации, поэтому форма молекула NН 3 - тригональная пирамида. l. NН=0, 1 нм, <НNН = 107, 30. Полярная, между молекулами существуют водородные связи. Ими объясняются высокие температуры плавления и кипения. Легко сжижается. Хранят в стальных баллонах.

Получение: Лабораторный метод: t NН 4 Сl + КОН = КСl+ NН 3 + Н 2 О Промышленный метод: 1) N 2 + 3 Н 2↔ 2 NН 3 Катализатор – железо с добавками оксидов алюминия и калия. Т= 500 -5500 С и р= 200 -800 атм. 2) Побочный продукт при коксовании углей. 3) Цианамидный метод: Са. С 2 + N 2 = Са. СN 2 + С Са. СN 2 + 3 Н 2 О = Са. СО 3 + 2 NН 3 Применение аммиака: 1) производство азотной кислоты; 2) производство соды; 3) производство НCN; 4) производство мочевины; 5) хладоген в холодильных установках.

Химические свойства: Аммиак донор электронной пары, образуя ион NН 4+: NН 3+Н 2 О↔NН 4+ +ОНРаствор аммиака - слабое основание: Кдис = 1, 8*10 -5(при 200 С). NН 3 + НОН ↔ NН 4+ + ОНРеакции замещения водорода: При замещении в аммиаке двух атомов водорода образуются имиды, одного – амиды. При высокой температуре аммиак взаимодействует с металлами: 2 Nа + 2 NН 3 = 2 Nа. NН 2 + Н 2 – амид натрия. Амиды разлагаются водой: Nа. NН 2 + Н 2 О = NН 3 + Nа. ОН. Амиды используют в органическом синтезе. При замещении в аммиаке одного водорода на группу –ОН образуется гидраксиламин.

Химические свойства гидроксиламина: 1) Гидраксиламин – бесцветные кристаллы, хорошо растворимые в воде, проявляет свойства слабого основания, является восстановителем, окисляется до свободного азота или окислителем восстанавливаясь до аммиака. 2) Диспропорционирует: 3 NН 2 ОН = NН 3 + N 2 + 3 Н 2 О. 3) С кислотами образует соли гидроксиламмония: NH 2 OH+HC 1=[NH 3 OH]Cl Получение гидроксиламина: Электролиз НNО 3 ( с ртутным и свинцовым катодом): К(-) НNО 3 + 6 Н = 2 Н 2 О + NН 2 ОН. Применение гидроксиламина: 1) органический синтез

Реакции окисления: 1) Горит в кислороде: а) без катализатора 4 NН 3+3 О 2=2 N 2+6 Н 2 О б) с катализатором 4 NН 3+5 О 2=4 NО+6 Н 2 О

2) Окисляется хлором и бромом: 2 NН 3 + 3 Сl 2 = 6 НСl + N 2 3) Осторожное окисление гипохлоритом натрия: 2 NН 3 + Nа. Сl. О = Н 2 О + N 2 Н 4 + Nа. Сl N 2 Н 4 ( Н 2 N-NН 2) –гидразин, в нем степень окисления азота равна – 2:

Химические свойства гидразина: Гидразин – бесцветная жидкость, температура кипения 113, 50 С, смешивается с водой в любых соотношениях, дымит на воздухе. Слабое основание: N 2 Н 4 + Н 2 О↔N 2 Н 5+ + ОН- (Кд= 8, 5*10 -7). Восстановитель, горит на воздухе (окисляется до азота) с выделением большого количества тепла. Восстанавливается до аммиака. Гидразин и его производные ядовиты. Применение гидразина и его производных: 1)органический синтез, 2) производство взрывчатых веществ, 3) входят в состав реактивного топлива. Гидразин может окисляться азотистой кислотой, взятой в недостатке: N 2 Н 4 + НNО 2 = НN 3 + 2 Н 2 О НN 3 (Н-N=N=N) - азотистоводородная кислота: бесцветная, летучая жидкость с резким запахом, слабая (Кд=1, 8*10 -5) одноосновная кислота. Её соли – азиды. Чем пассивнее металл, входящий в их состав солей, тем менее устойчив азид. Некоторые азиды при ударе взрываются. Применение азидов: Pb(N 3)2 -в качестве детонатора.

Реaкции присоединения: 1) Взаимодействует с кислотами, образуя соли аммония: NН 3+НСl=NН 4 Сl NН 3+HNO 3=NH 4 NO 3 NН 3+Н 2 SО 4=(NН 4)2 SО 4 2) Комплексообразование: Сu. SO 4+4 NH 3=[Сu(NН 3)4]SО 4

Соли аммония Физические свойства: Бесцветны, хорошо растворимы в воде, в растворах сильно диссоциированы. Чем сильнее кислота, тем устойчивее её амонийные производные. В ряду NН 4 F – NН 4 Сl – NН 4 Вr – NН 4 I устойчивость к нагреванию увеличивается.
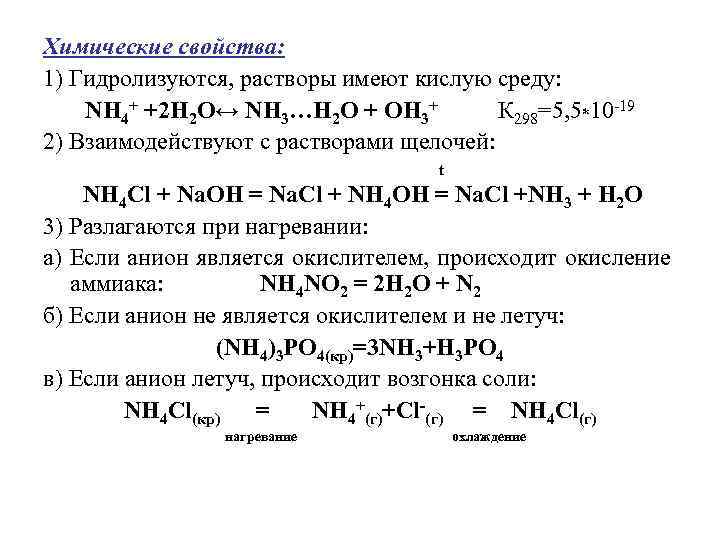
Химические свойства: 1) Гидролизуются, растворы имеют кислую среду: NН 4+ +2 Н 2 О↔ NН 3…Н 2 О + ОН 3+ К 298=5, 5*10 -19 2) Взаимодействуют с растворами щелочей: t NН 4 Сl + Nа. ОН = Nа. Сl + NН 4 ОН = Nа. Cl +NН 3 + Н 2 О 3) Разлагаются при нагревании: а) Если анион является окислителем, происходит окисление аммиака: NН 4 NО 2 = 2 Н 2 О + N 2 б) Если анион не является окислителем и не летуч: (NH 4)3 PO 4(кр)=3 NH 3+H 3 PO 4 в) Если анион летуч, происходит возгонка соли: NH 4 Cl(кр) = NH 4+(г)+Cl-(г) = NH 4 Cl(г) нагревание охлаждение

Применение: NН 4 Сl 1) входит в состав сухих гальванических элементов, 2) очистка поверхности металла от оксидов перед пайкой: 2 NН 4 Сl + 4 Сu. О = N 2 + 3 Сu + Сu. Сl 2 + 4 Н 2 О (NН 4)2 СО 3 – разрыхлитель в хлебопечении NН 4 NО 3 и NН 4 Сl. О 4 – входят в состав топлива реактивных двигателей, (NН 4)2 S – в аналитической химии

СОЕДИНЕНИЯ СО СТЕПЕНЬЮ ОКИСЛЕНИЯ +1 ОКСИД АЗОТА I Физические свойства: N 2 О (закись азота) – газ со сладковатым вкусом, приятным запахом, мало растворим в воде, Ткрист. =-910 С, Т парообр. =-890 С. Оказывает опьяняющее действие на человека, за что назван ''веселящим газом'', применяется в медицине, как анестезирующее средство. Структура молекулы N≡N=О. Химические свойства: Выше 5000 С разлагается по реакции: 2 N 2 О = 2 N 2 + О 2 + 39 ккал. Тлеющая лучина в нем вспыхивает. Восстанавливается до азота, аммиака, гидроксиламина. Получение: t NН 4 NО 3 = 2 Н 2 О + N 2 О (с примесями азота, NО и NО 2). Эта реакция протекает спокойно при нагревании до 3000 С, при более высокой температуре может произойти взрыв.

СОЕДИНЕНИЯ СО СТЕПЕНЬЮ ОКИСЛЕНИЯ +2 ОКСИД АЗОТА (II) Физические свойства: NО(окись азота), бесцветный токсичный газ (Ткип =151, 70 С). Молекулы распадаются при 5000 С, между атомами азота и кислорода кратность связи равна 2, 5. Молекула парамагнитна, менее прочна, чем у азота. В 1 объёме воды растворяется 0, 08 объёмов NО. NО – несолеобразующий оксид. Химические свойства: 1)Присоединяет другие радикалы: 2 NО + О 2 = 2 NО 2. Добавление NО в смесь мономеров приводит к обрыву цепи и прекращению процесса полимеризации. 2) Теряя неспаренный электрон, образует нитрозоний-ион NО+, входящий в состав солей очень сильных кислот (например, NО+С 1 О 4 -). 3) Присоединяясь в качестве радикала к другой частице, образует нитрозил. Например: 2 NО + Сl 2 = 2 NОСl- хлорид нитрозила.

NОСl –хлорангидрид азотистой кислоты. Хлорангидриды - хлорсодержащие вещества, которые при взаимодействии с водой образуют кислоту, содержащую элемент, входящий в состав хлорангидрида и соляную кислоту: NОСl + Н 2 О = НNО 2 + НСl. 5) Трудно отдает кислород. В атмосфере NО горят только вещества очень энергично соединяющиеся с кислородом (например, фосфор). Получение: В промышленности: 1) N 2+O 2=2 NO; kat 2) 4 NН 3 + 5 О 2 = 4 NО + 6 Н 2 О В лаборатории: 1) 3 Сu + 8 НNО 3 = 3 Сu(NО 3)2 + 2 NО + 4 Н 2 О. 2) Nа. NО 2 + Fe. Сl 2 + 2 НСl = NО + Fe. Сl 3 + Nа. Сl + Н 2 О. Применение: исходное вещество для получения НNО 3.

СОЕДИНЕНИЯ СО СТЕПЕНЬЮ ОКИСЛЕНИЯ +3 ОКСИД АЗОТА(III) Физические свойства: N 2 О 3 – легко сжижаемый газ (Ткип =3, 50 С), разлагается на NО и NО 2( при 250 С от N 2 О 3 остается лишь 10%), из-за присутствия NО 2 имеет красно-бурую окраску. Жидкий и твердый (tпл = -1020 С) синий цвет. В твердом состоянии существует при низких температурах.
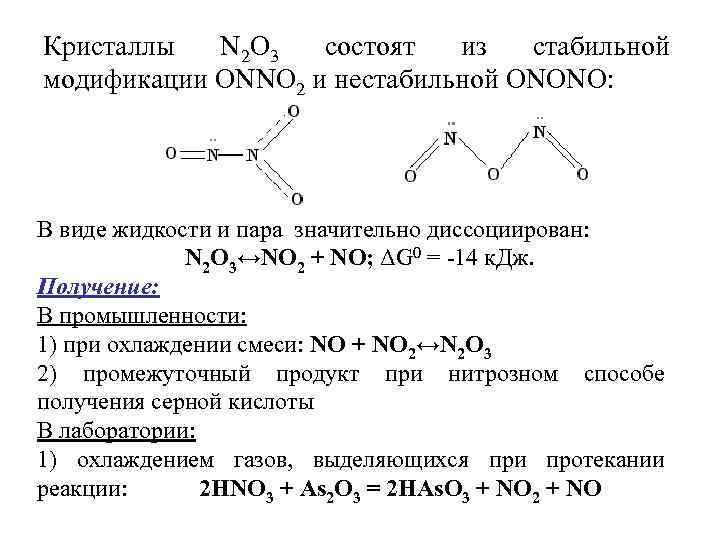
Кристаллы N 2 О 3 состоят из стабильной модификации ОNNО 2 и нестабильной ОNОNО: В виде жидкости и пара значительно диссоциирован: N 2 О 3↔NО 2 + NО; ΔG 0 = -14 к. Дж. Получение: В промышленности: 1) при охлаждении смеси: NО + NО 2↔N 2 О 3 2) промежуточный продукт при нитрозном способе получения серной кислоты В лаборатории: 1) охлаждением газов, выделяющихся при протекании реакции: 2 НNО 3 + Аs 2 О 3 = 2 НАs. О 3 + NО 2 + NО

Химические свойства: 1) Растворяется в воде, образуя азотистую кислоту: Н 2 О+N 2 O 3=2 HNO 2 2) N 2 О 3 – кислотный оксид, легко поглощается щелочами, образуя нитриты: N 2 О 3 + 2 Nа. ОН = 2 Nа. NО 2 + Н 2 О
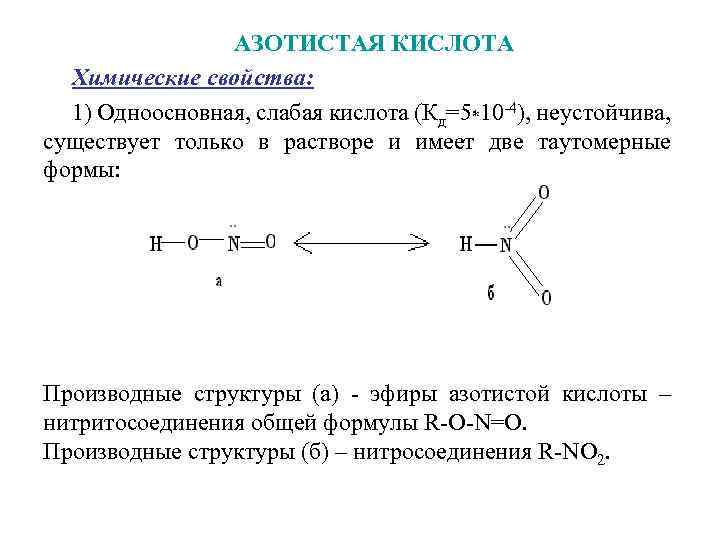
АЗОТИСТАЯ КИСЛОТА Химические свойства: 1) Одноосновная, слабая кислота (Кд=5*10 -4), неустойчива, существует только в растворе и имеет две таутомерные формы: Производные структуры (а) - эфиры азотистой кислоты – нитритосоединения общей формулы R-О-N=О. Производные структуры (б) – нитросоединения R-NО 2.

Неустойчивость НNО 2 возрастает увеличения концентрации раствора. Na. NO 2+HCl=HNO 2+Na. Cl 2 HNO 2=NO+NO 2+H 2 O по мере

НNО 2 проявляет и окислительные восстановительные свойства. 1) Свойства окислителя: 2 НNО 2 + 2 НI = I 2 + 2 NО + 2 Н 2 О 2) Свойства восстановителя: и 5 НNО 2+2 КМn. О 4+3 Н 2 SО 4=2 Мn. SО 4+К 2 SО 4+5 НNО 3+3 Н 2 О Для соединений азота со степенью окисления +3 более характерны окислительные свойства. При р. Н<7 НNО 2 восстанавливается до NО. При действии сильных восстановителей образует: N 2 О, NН 2 ОН и NН 3. При действии сильных окислителей НNО 2 окисляется до НNО 3.

СОЛИ АЗОТИСТОЙ КИСЛОТЫ (НИТРИТЫ) Химические свойства: 1) Бесцветны, хорошо растворимы в воде (кроме Аg. NО 2). 2) Могут быть окислителями: Sn. Cl +2 Na. NO =Sn. O +2 NO+2 Na. Cl 2 2 КI+2 H 2 SO 4+2 Na. NO 2=I 2+2 NO+K 2 SO 4+2 H 2 O+Na 2 SO 4 Побочный процесс: 2 NO+O 2=2 NO 2 2 2

3) Могут быть восстановителями: 2 KMn. O 4+3 H 2 SO 4+5 Na. NO 2=2 Mn. SO 4+5 Na. NO 3+K 2 SO 4+3 H 2 O
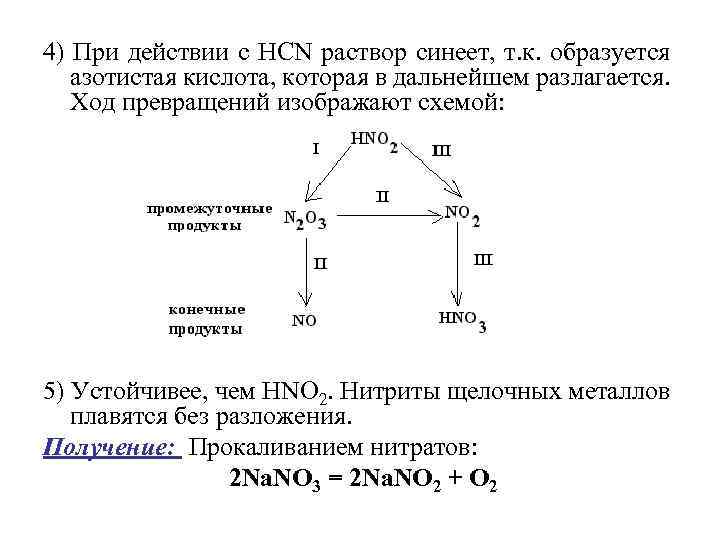
4) При действии с НСN раствор синеет, т. к. образуется азотистая кислота, которая в дальнейшем разлагается. Ход превращений изображают схемой: 5) Устойчивее, чем НNО 2. Нитриты щелочных металлов плавятся без разложения. Получение: Прокаливанием нитратов: 2 Nа. NО 3 = 2 Nа. NО 2 + О 2
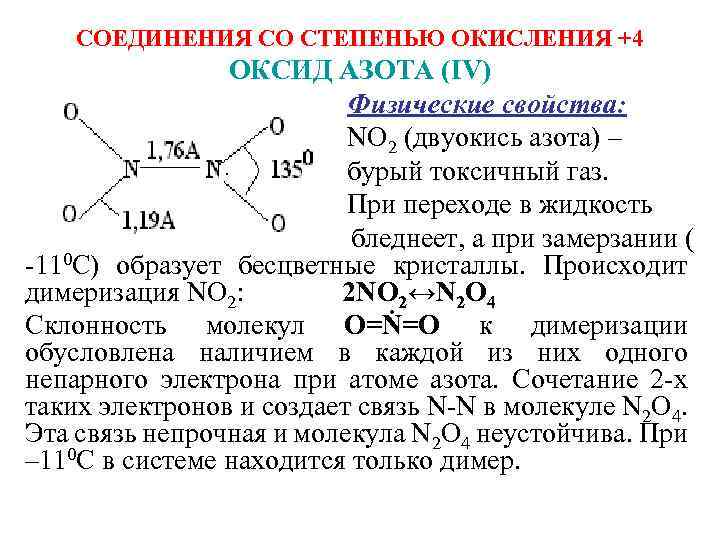
СОЕДИНЕНИЯ СО СТЕПЕНЬЮ ОКИСЛЕНИЯ +4 ОКСИД АЗОТА (IV) Физические свойства: NО 2 (двуокись азота) – бурый токсичный газ. При переходе в жидкость бледнеет, а при замерзании ( -110 С) образует бесцветные кристаллы. Происходит димеризация NО 2: 2 NО 2↔N 2 О 4 Склонность молекул О=Ṅ=О к димеризации обусловлена наличием в каждой из них одного непарного электрона при атоме азота. Сочетание 2 -х таких электронов и создает связь N-N в молекуле N 2 О 4. Эта связь непрочная и молекула N 2 О 4 неустойчива. При – 110 С в системе находится только димер.

Химические свойства: 1)Сложный оксид – оксид двух кислот НNО 3 и НNО 2. А) Растворяется в воде: 2 NО 2+ Н 2 О = НNО 3 + НNО 2 При растворении NО 2 в воде образуется НNО 3 и выделяется NО продукт разложения НNО 2: 3 NО 2 + Н 2 О = 2 НNО 3 + NО Б) Взаимодействует с щелочами: 2 NО 2 + 2 КОН = КNО 2 + КNО 3 + Н 2 О 2) Сильный окислитель: С+2 NO 2=CO 2+2 NO 2 P+5 NO 2=P 2 O 5+5 NO S+2 NO 2=SO 2+2 NO Сильными восстановителями превращается в NН 3. 3)Взаимодействует с NО: NО 2+NО↔N 2 О 3.

Получение: Промышленное: 2 NО +О 2=2 NO 2 Лабораторное: 1) Сu + 4 НNО 3(к) = Сu(NО 3)2 + 2 NО 2 + 2 Н 2 О S + 6 НNО 3(к) = Н 2 SО 4 + 6 NО 2 + 2 Н 2 О t 2) 2 Рb(NО 3)2 = 2 Рb. О + 4 NО 2 + О 2

СОЕДИНЕНИЯ СО СТЕПЕНЬЮ ОКИСЛЕНИЯ +5 АЗОТНЫЙ АНГИДРИД Физические свойства: N 2 О 5 (азотный ангидрид) – тв. кристаллическое вещество, плавится с возгонкой при 32, 30 С, разлагается на NО 2 и О 2: 2 N 2 О 5 = 4 NО 2 + О 2 Химические свойства: 1) N 2 О 5 неустойчив разлагается со взрывом. 2) Сильный окислитель. 3) Кислотный оксид: N 2 О 5 + Н 2 О = 2 НNО 3 N 2 О 5 + 2 КОН = 2 КNО 3 + Н 2 О Получение: 1) 2 НNО 3 + Р 2 О 5 = 2 НРО 3 + N 2 О 5 2) 2 NО 2 + О 3 = N 2 О 5 + О 2
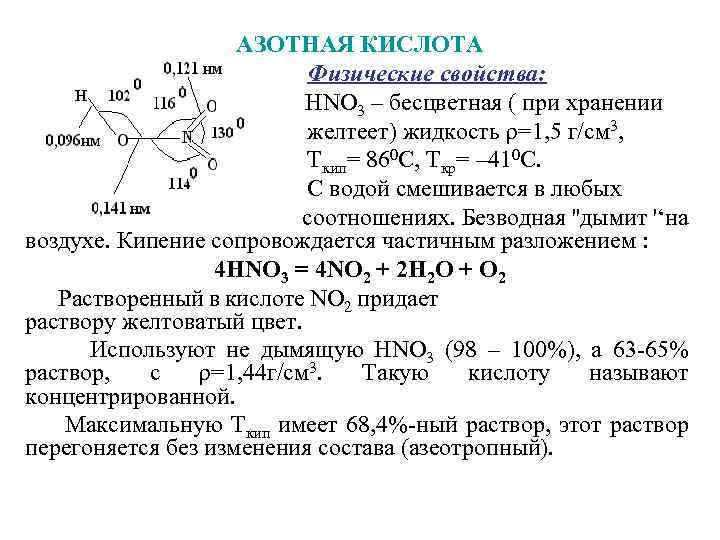
АЗОТНАЯ КИСЛОТА Физические свойства: НNО 3 – бесцветная ( при хранении желтеет) жидкость ρ=1, 5 г/см 3, Ткип= 860 С, Ткр= – 410 С. С водой смешивается в любых соотношениях. Безводная ''дымит '‘на воздухе. Кипение сопровождается частичным разложением : 4 НNО 3 = 4 NО 2 + 2 Н 2 О + О 2 Растворенный в кислоте NО 2 придает раствору желтоватый цвет. Используют не дымящую НNО 3 (98 – 100%), а 63 -65% раствор, с ρ=1, 44 г/см 3. Такую кислоту называют концентрированной. Максимальную Ткип имеет 68, 4%-ный раствор, этот раствор перегоняется без изменения состава (азеотропный).

Химические свойства: 1) НNО 3 сильный электролит в 0, 1 М растворе степень диссоциации 93% при 180 С. 2) В молекуле НNО 3 азот образует 4 ковалентные связи и одну электровалентную, , поэтому НNО 3 сильный окислитель: NО 3 - + 4 Н+ + 3 е=NО + 2 Н 2 О; Е 0298 = 0, 96 В NО 3 - + 2 Н+ + е = NО 2 + Н 2 О; Е 0298 = 0, 78 В

Окисляет неметаллы до высших оксидов или кислородсодержащих кислот, например, для фосфора: 3 Р + 5 НNО 3 + 2 Н 2 О = 3 Н 3 РО 4 + 5 NО для углерода: С+4 HNO 3=CO 2+4 NO 2+2 H 2 O высших

В НNО 3 роль окислителем является N+5, продукт его восстановления зависит от концентрации кислоты, природы восстановителя и температуры. Чем разбавленнее кислота, активнее восстановитель, выше температура, тем полнее восстановление азота – до NН 3. НNО 3(р) и активные металлы (типа Zn): 10 HNO 3(р)+4 Zn=4 Zn(NO 3)2+NH 4 NO 3+3 H 2 O НNО 3(р) и пассивные металлы (типа Сu): 8 HNO 3(р)+3 Сu=3 Cu(NO 3)2+2 NO+4 H 2 O НNО 3(к) и пассивный металл: 4 HNO 3(к)+Сu=Cu(NO 3)2+2 NO 2+2 H 2 O

Все металлы, расположенные в ряду напряжений правее водорода, окисляются НNО 3(к): Hg + 4 НNО 3(к) = Hg(NО 3)2 + 2 NО 2 + 2 Н 2 О

Аl, Сr пассивируются 68%-ной HNO 3(к) и остаются устойчивы к её действию. Fe, Со, Ni, Тi пассивируются 90%-ной НNО 3. Поэтому НNО 3(к) можно перевозить в железных бочках или стальных цистернах.

НNО 3 и НNО 2 по разному относятся к НI: 2 НNО 2 + 2 НI = I 2 +2 NO+2 Н 2 О Разбавленная НNО 3 на НI не действует. НNО 3(к) окисляет не только НI, но и НС 1: 2 НNО 3 + 6 НI = 3 I 2 +2 NO+4 Н 2 О НNО 3 + 3 НС 1 = 2 Н 2 О + NОСl + Сl 2 Над НNО 3 при выше 700 С образуется туман: 2 НNО 3= Н 2 О + N 2 О 5 Животные и растительные организмы при действии НNО 3 разрушаются.
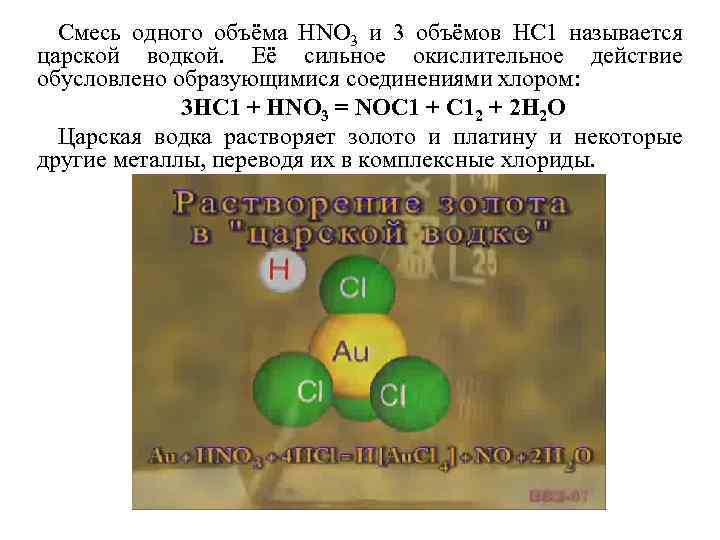
Смесь одного объёма НNО 3 и 3 объёмов НС 1 называется царской водкой. Её сильное окислительное действие обусловлено образующимися соединениями хлором: 3 НС 1 + НNО 3 = NОС 1 + С 12 + 2 Н 2 О Царская водка растворяет золото и платину и некоторые другие металлы, переводя их в комплексные хлориды.

Получение: НNО 3 получают 3 -мя способами: 1) Вытеснение НNО 3 из её солей Н 2 SО 4: Nа. NО 3+ Н 2 SО 4 = Nа. НSО 4 + НNО 3 Сейчас используется редко, чаще используют в лаборатории. Н 2 SО 4 берут так, чтобы образовался гидросульфат натрия, тогда реакция протекает при более низкой температуре и наблюдается меньшая потеря НNО 3. Выделяющиеся пары НNО 3 отводят в охлаждаемый сосуд, где они концентрируются.

2) Дуговой способ: а) Продувание воздуха через электрическую дугу, дающую температуру 3000 – 35000 С: N 2 + О 2↔ 2 NО б) NO охлаждают и окисляют: 2 NО + О 2=2 NО 2 При высокой температуре NО с О 2 не взаимодействует. в) NО 2 растворяют в воде: 4 NО 2 + 2 Н 2 О + О 2 = 4 НNО 3 Этот метод требует большого расхода электроэнергии и применяется редко.

3) Аммиачный способ: а) окисление аммиака на платиновом катализаторе: 4 NН 3 + 5 О 2 = 4 NО + 6 Н 2 О б) Выходящие из контактного аппарата нитрозные газы охлаждаются: 2 NО + О 2↔ 2 NО 2 в) NО 2 поглощается Н 2 О: 4 NО 2 + 2 Н 2 О↔ 4 НNО 3 Так получают раствор, содержащий только 60 -62% НNО 3. Для получения дымящей НNО 3 полученные растворы упаривают в присутствии Н 2 SО 4 или растворяют в них под давлением жидкий NО 2 (или N 2 О 4) в присутствии большого избытка кислорода: 2 N 2 О 4 + 2 Н 2 О + О 2 = 4 НNО 3

Применение: 1) получение красителей; 2) взрывчатых веществ; 3) азотных удобрений; 4) нитратов; 5) для получения серной кислоты нитрозным способом. НNО 3 – сильная кислота и образует устойчивые соли – нитраты.

НИТРАТЫ Нитратов бесцветны, хорошо растворимы в воде. КNО 3, Nа. NО 3, NН 4 NО 3 называют селитрами. Химические свойства: В водных растворах окислительными свойствами не обладают. NО 3 - в нейтральной среде окислительные свойства практически не проявляет: NО 3 -+Н 2 О+е = NО 2+2 ОН-; Е 0298= -0, 88 В, Хорошие окислители при сплавлении: Сr 2 О 3+3 Nа. NО 3+4 КОН=2 К 2 Сr. О 4+3 Nа. NО 2+2 Н 2 О Окислительные свойства в расплаве нитраты проявляют при горение черного пороха: 4 КNО 3 + S + С = 4 КNО 2 + SО 2 + СО 2 При этом в качестве продуктов сопутствующих реакций выделяется также К 2 СО 3, К 2 SО 4, К 2 S, СО и N 2.

При нагревании разлагаются тем полнее, чем пассивнее металл, ионы которого входят в их состав. Нитраты очень активных металлов( до Мg), отщепляют кислород и переходят в нитриты: 2 Nа. NО 3 = 2 Nа. NО 2 + О 2

Нитраты металлов (Мg –Сu) отщепляют кислород и NО 2 и переходят в оксиды: 2 Рb(NО 3)2 = 2 Рb. О + 4 NО 2 + О 2 Нитраты пассивных металлов ( правее Сu) за счет внутримолекулярного окисления восстановления превращаются в свободный металл: 2 Аg. NО 3 = 2 Аg + 2 NО 2 + О 2 Применение: в пиротехнике для изготовления черного пороха.

АЗОТНЫЕ УДОБРЕНИЯ Получение: Из НNО 3 и жидкого или газообразного NН 3 с использованием Н 2 SО 4, СО 2, Са(ОН)2 и др. веществ. В удобрениях азот находится либо в аммиачной форме NН 4+, либо в нитратной форме NО 3 -, либо в виде амида (-NН 2 -). Растения лучше усваивают азот из аммиачных и амидных соединений, чем из нитратов. На любой почве и для любых культур используют аммиачную селитру (NH 4 NO 3), которую получают нейтрализацией слабого раствора НNО 3 газообразным NН 3 с последующим упариванием раствора. Наиболее ценное удобрение азота – карамид (мочевина), который добавляют в корм скоту. Все азотные удобрения хорошо растворимы в воде, и поэтому до 13% связанного азота, вносимого в почву переходят в подземные воды. Нитраты могут вызывать отравления. По санитарным нормам ПДК в питьевой воде не превышает 10 -2 г/л.
Азот.ppt