
ОБЩАЯ ХАРАКТЕРИСТИКА III-А ГРУППЫ К III А группе относятся бор (В), алюминий (А 1), галлий (Ga), индий (In), таллий (Tl). Строение внешнего уровня: s 2 р1. Легко отдают электроны или образуют 3 не спаренных электрона, за счет переходы одного s электрона на р - подуровень. Для бора и алюминия характерна только с. о. +3. У элементов подгруппы галлия на внешнем уровне тоже 3 электрона, но они расположены после 18 электронного слоя. Поэтому галлий обладает явно не металлическими свойствами. Эти свойства в ряду Gа, In, Tl ослабевают, а металлические усиливаются. Элементы III А группы обладают сильным сродством к кислороду, и образование их оксидов сопровождается выделением большого количества теплоты. С увеличением атомного номера элементов энергия ионизации атомов уменьшается. Бор – неметалл, таллий – металл.

БОР Нахождение в природе: Содержание в земной коре 1, 2· 10 -3%. Минералы: Nа 2 В 4 О 7· 10 Н 2 О – бура, Nа 2 В 4 О 7· 4 Н 2 О – кернит, Н 3 ВО 3 – сассолин. Бор входит в число 5 важных элементов для растений, участвуя в процессе углеводородного и белкового обмена. Физические свойства: Кристаллический бор имеет серовато-черный цвет, полупроводник, по твердости близок к алмазу, тугоплавок. Примеси изменяют свойства и температуры плавления и кипения колеблются соответственно в пределах 2075 – 2300 и 2550 – 38600 С.

Получение: 1) Металлотермия: В 2 О 3+3 Мg = 3 Мg. О+ 2 В КВF 4 + 3 Nа = 3 Nа. F + КF + В. Выделяется аморфный бор, который перекристаллизацией в расплавленных металлах переводят в кристаллическое состояние. Метод дает продукт, загрязненный примесями. 2) Электролиз расплавленных фторобаратов. Получается чистый бор 99, 5% 3) Термическое разложение паров бромида бора на раскаленной (1000 -12000 С) танталовой проволоке в присутствии водорода: 2 ВВr 3 + 3 Н 2 = 2 В + 6 НВr 4) Разложение водородных соединений: В 2 Н 6 = 2 В + 3 Н 2 Применение: 1) бромирование металлов – повышает их твердость, прочность к истиранию, устойчивость к коррозии. 2) Освобождает медь от растворенных в ней газов.

Химические свойства: 1) Без нагревания химически инертен, взаимодействует только со фтором: 2 В+3 F 2=2 BF 3 2) При высоких температурах: 4 B+3 O 2=2 B 2 O 3 2 B+3 S=B 2 S 3 2 В+3 C 12=2 BC 13 2 B+N 2=2 BN 3)С водородом непосредственно не взаимодействует. 4) Стоек к действию щелочей и кислот, за исключением ''царской водки'' и горячих концентрированных растворов НNО 3 и Н 2 SО 4: B+3 HNO 3= Н 3 ВО 3+3 NO 2

СОЕДИНЕНИЯ СО СТЕПЕНЬЮ ОКИСЛЕНИЯ +3 При сплавлении с металлами является окислителем, проявляет с. о. – 3. Образуются боридами, разлагаются кислотами с образованием смеси бороводородов – боранов: 6 Мg. В 2+12 НС 1=Н 2+В 4 Н 10+6 Мg. С 12+8 В Простейшие бораны бесцветны, обладают отвратительным запахом и очень ядовиты.
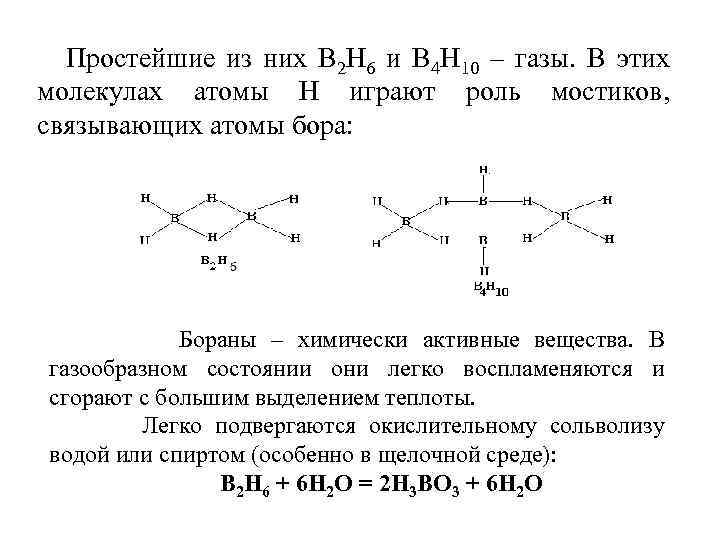
Простейшие из них В 2 Н 6 и В 4 Н 10 – газы. В этих молекулах атомы Н играют роль мостиков, связывающих атомы бора: Бораны – химически активные вещества. В газообразном состоянии они легко воспламеняются и сгорают с большим выделением теплоты. Легко подвергаются окислительному сольволизу водой или спиртом (особенно в щелочной среде): В 2 Н 6 + 6 Н 2 О = 2 Н 3 ВО 3 + 6 Н 2 О

Бориды большинства металлов имеют переменный состав в зависимости от условий получения от Ме 4 В до Ме. В 12. Физические и химические свойства: Бориды d-элементов – твердые, жаростойкие, химически инертные. Самый термостойкий из всех боридов – диборид гафния Нf. В 2, который плавится при 32500 С. Борид алюминия по твердости занимает второе место после алмаза На диборит тантала не действует кипящая ''царская водка''. . Применение: 1)изготовление деталей реактивных двигателей, лопаток, газовых турбин 2) катализаторы, 3) материалы для катодов электронных приборов и т. д.
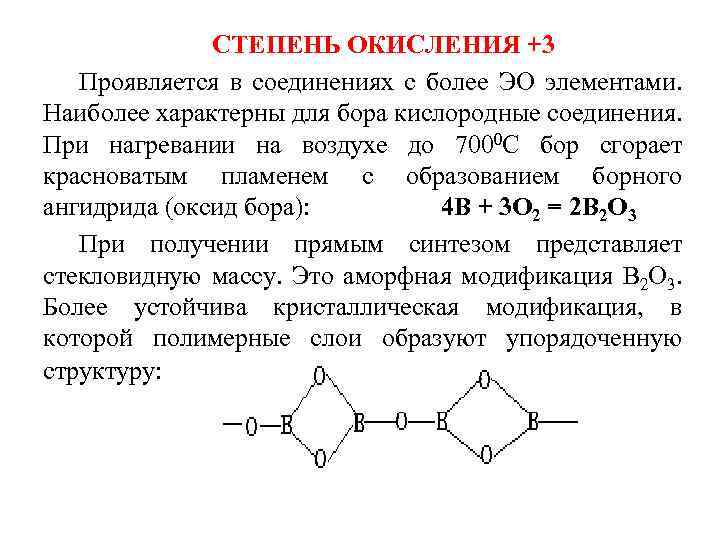
СТЕПЕНЬ ОКИСЛЕНИЯ +3 Проявляется в соединениях с более ЭО элементами. Наиболее характерны для бора кислородные соединения. При нагревании на воздухе до 7000 С бор сгорает красноватым пламенем с образованием борного ангидрида (оксид бора): 4 В + 3 О 2 = 2 В 2 О 3 При получении прямым синтезом представляет стекловидную массу. Это аморфная модификация В 2 О 3. Более устойчива кристаллическая модификация, в которой полимерные слои образуют упорядоченную структуру:

Химические свойства: В 2 О 3 – устойчив, не восстанавливается углеродом даже при температуре белого каления. В 2 О 3 гигроскопичен, на воздухе притягивает влагу. В воде растворяется с образованием борной кислоты: В 2 О 3 + 3 Н 2 О = 2 Н 3 ВО 3. В начале образуется мета форма (НВО 2)n, состоящая из полимерных лент или ячеистых плоскостей, в которых плоские треугольники ВО 3 соединены общими кислородными вершинами. Затем образуются менее крупные молекулы (тетраметрные, тримерные) типа Н 5 В 3 О 7. Затем максимально гидратированная орто-форма – мономер Н 3 ВО 3.

Борная кислота свободном виде кристаллическое, жирное на ощупь, блестящее вещество, имеющее слоистую структуру за счет объединения молекул Н 3 ВО 3 водородными связями в плоские ассоциаты. Н 3 ВО 3 в воде растворяется умеренно (при 200 С 4, 9 г на 100 г Н 2 О). Раствор обладает слабокислой реакцией(Кд=7, 3· 10 -10). При нагревании Н 3 ВО 3 дегидратируется, в итоге образуется В 2 О 3.
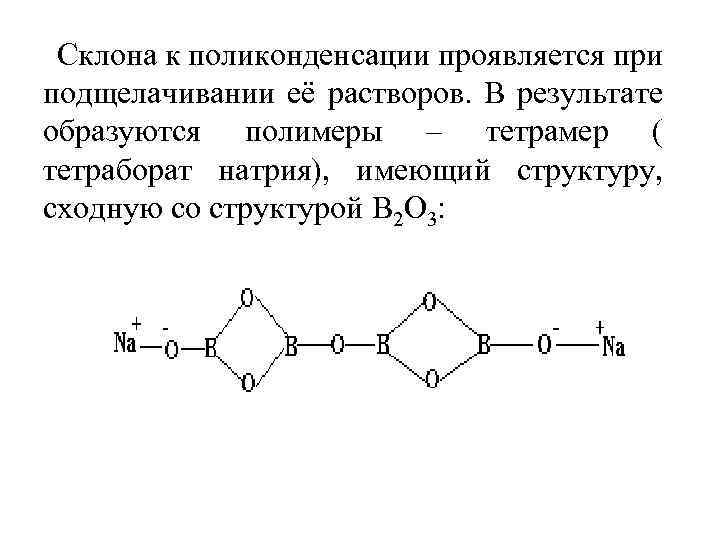
Склона к поликонденсации проявляется при подщелачивании её растворов. В результате образуются полимеры – тетрамер ( тетраборат натрия), имеющий структуру, сходную со структурой В 2 О 3:

Тетраборная кислота более сильная, чем борная. При избытке щелочи: Nа 2 В 4 О 7 + 2 Nа. ОН =4 Nа. ВО 2+Н 2 О При подкислении образуется борная кислота: Nа 2 В 4 О 7+Н 2 SО 4+5 Н 2 О=Nа 2 SО 4+4 Н 3 ВО 3 В воде растворимы бораты активных I валентных металлов. Растворы их в результате гидролиза имеют щелочную реакцию. При выделении Nа 2 В 4 О 7 из раствора образуется кристаллогидраты Nа 2 В 4 О 7· 10 Н 2 О(бура). Безводные бораты устойчивы к нагреванию.

Применение: 1) дезинфицирующие средства, 2) дубление кож, 3) изготовление красок, 4) добавка в моющие и консервирующие препараты, 5) для пропитки древесины. Оказывают токсичное действие на организм человека, в который они могут проникать даже через неповрежденную кожу. Смертельная доза – 15 -20 г для взрослых, 4 -5 г для детей. ПДК в воздухе и пыли 10 мг/м 3.

Галогениды Получение: взаимодействие бора и галогена при нагревании. ВНа 13 бесцветны, дымят на воздухе, из-за гидролиза: ВНа 13+3 Н 2 О=В(ОН)3+3 ННа 1. ВF 3 – газообразен при обычных условиях, ВС 13 – кипит при +180 С, ВВr 3 - жидкость, ВI 3 – твердые вещества. Для ВНа 13 характерны реакции присоединения. ВF 3 отличается от своих аналогов тем, что образует также продукты присоединения с НF и её солями. НВF 4 – борофтористая кислота – комплексное соединение, устойчива только в растворе, её кислотные свойства выражены сильнее, чем у НF. Большинство солей НВF 4 (фторобораты) бесцветны и легко растворимы в воде. Многие из них хорошо кристаллизуются и выдерживают сильное нагревание.

Нитрид: При температурах близких к 10000 С бор и азот образуют нитрид бора (ВN)n, имеющий структуру графита, в которой слои состоят из циклов. Такая модификация ВN – огнеупорена (до 20000), нерастворима, мягкая, как графит, но имеет белый цвет (похож на тальк), называется белым графитом. Полупроводник. Используют в качестве твердой высокотемпературной смазки. При 1400 – 18000 С и р=6 г. Па В и N образуют алмазоподобную модификацию (ВN)n боразон. Он тверд, как алмаз, но более термостоек и менее хрупок. Разлагается при нагревании лишь выше 20000 С, а алмаз загорается при 8000 С. Карбид: С углеродом бор взаимодействует при 25000 С, образуя карбид бора – В 12 С 3 (или проще В 4 С). Прочен, химически стоек, по твердости уступает алмазу и боразону, но превосходит алмаз по термостойкости.
![Гидридобораты Ионные соединения. Nа[ВН 4] – бесцветная соль, хорошо растворима в воде. При обычных Гидридобораты Ионные соединения. Nа[ВН 4] – бесцветная соль, хорошо растворима в воде. При обычных](https://present5.com/presentation/-31815908_84644950/image-16.jpg)
Гидридобораты Ионные соединения. Nа[ВН 4] – бесцветная соль, хорошо растворима в воде. При обычных температурах гидролизуются медленно. Получают: 1) 4 Nа. Н + В(ОСН 3)3 = Nа[ВН 4] + 3 СН 3 ОNа. метиловый эфир борной кислоты 2) 3 Nа[ВН 4] + А 1 С 13 = А 1(ВН 4)3 + Nа. С 1 Ковалентные тетрагидридобораты типа А 1[ВН 4] летучи, легкоплавки. Ковалентные гидридобораты реакционноспособные – взрываются на воздухе. Сильные восстановители. Широко используются для проведения различных синтезов, применяются как исходные вещества для получения гидридов и в особенности диборана: 3 Nа. ВН 4 + 4 ВF 3 = 2 В 2 Н 6 + 3 Nа. ВF 4