вводная лекция.ppt
- Количество слайдов: 17

Общая характеристика и номенклатура неорганических веществ

План лекции 1. Номенклатура и классификация неорганических веществ Система понятий и терминов в химии Номенклатура неорганических соединений Классификация неорганических веществ. Простые и сложные вещества Простые вещества. Металлы и неметаллы Классификация и свойства неорганических веществ Химические формулы и уравнения. Правила перевода информации с естественного языка на язык химии 2. Распространенность химических элементов в природе 3. Общие закономерности изменения атомных характеристик элементов в зависимости от положения в периодической системе

Что изучает неорганическая химия? Неорганическая химия – раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений Неорганические соединения – это группа веществ, которые не образованы живыми существами

Понятия и категории химии Элемент Вещество Химическая реакция Химический элемент — совокупность атомов с одинаковым зарядом ядра или числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Веществом называют ту форму существования материи, в которой она проявляет себя в виде частиц. Хими ческая реа кция (химический процесс) — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции).

Латинские корни в названиях неорганических соединений Элемен Латинский корень т Ag аргент Элемен Латинский корень т N нитр As арс, арсен Ni никкол Au аур O окс, оксиген C карб, карбон Pb плюмб Cu купр S сульф Fe ферр Sb стиб H гидр, гидроген Si сил, силик, силиц Hg меркур Sn станн Mn манган
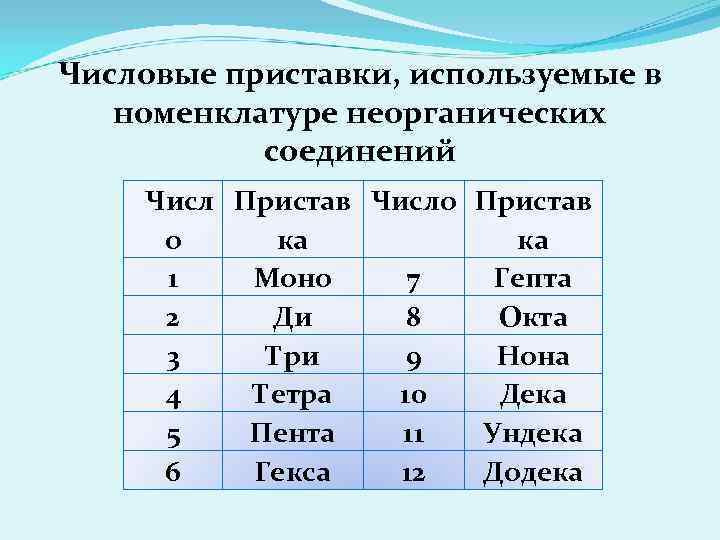
Числовые приставки, используемые в номенклатуре неорганических соединений Числ Пристав Число Пристав о ка ка 1 Моно 7 Гепта 2 Ди 8 Окта 3 Три 9 Нона 4 Тетра 10 Дека 5 Пента 11 Ундека 6 Гекса 12 Додека
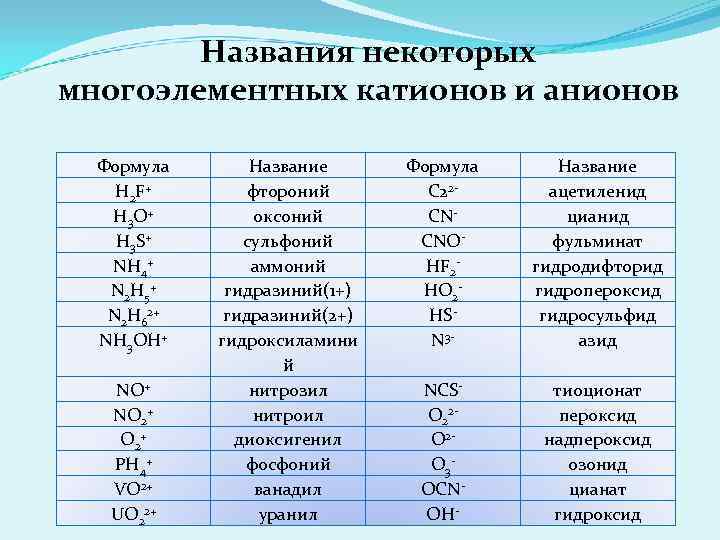
Названия некоторых многоэлементных катионов и анионов Формула H 2 F + H 3 O+ H 3 S+ NH 4+ N 2 H 5+ N 2 H 62+ NH 3 OH+ NO 2+ PH 4+ VO 2+ UO 22+ Название фтороний оксоний сульфоний аммоний гидразиний(1+) гидразиний(2+) гидроксиламини й нитрозил нитроил диоксигенил фосфоний ванадил уранил Формула C 22 CNCNOHF 2 HO 2 HSN 3 - Название ацетиленид цианид фульминат гидродифторид гидропероксид гидросульфид азид NCSO 22 O 2 O 3 OCNOH- тиоционат пероксид надпероксид озонид цианат гидроксид

Простые вещества образованы атомами одного химического элемента и поэтому являются формой его существования в свободном состоянии, напр. сера, железо, озон, алмаз, азот. Сложные вещества образованы разными элементами и могут иметь состав постоянный (стехиометрические соединения, или дальтониды) или меняющийся в некоторых пределах (нестехиометрические соединения, или бертоллиды). Вещества превращаются друг в друга в процессе реакций химических, однако таким образом одно простое вещество невозможно превратить в другое, образованное из атомов иного элемента.

Металлы Барий Осмий Металлы – это простые вещества, строение которых характеризуется наличием особой металлической решётки, а физические свойства – высокой тепло и электропроводностью, пластичностью, ковкостью, наличием металлического блеска

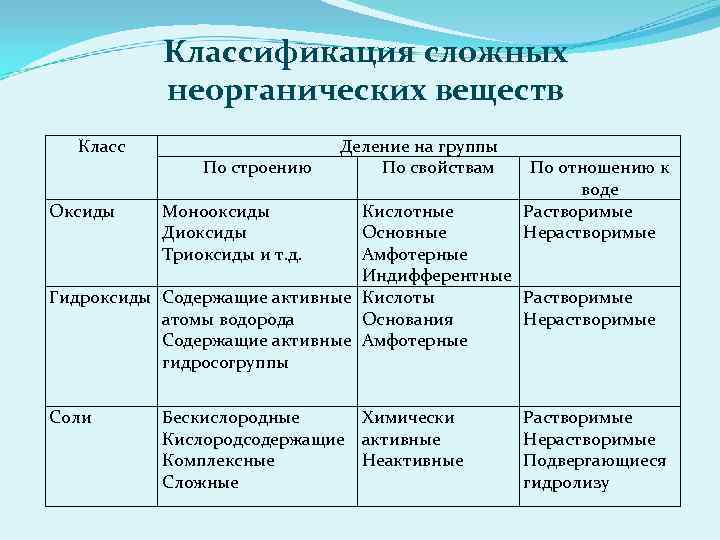
Классификация сложных неорганических веществ Класс По строению Деление на группы По свойствам Оксиды Монооксиды Диоксиды Триоксиды и т. д. Соли Бескислородные Химически Кислородсодержащие активные Комплексные Неактивные Сложные По отношению к воде Растворимые Нерастворимые Кислотные Основные Амфотерные Индифферентные Гидроксиды Содержащие активные Кислоты Растворимые атомы водорода Основания Нерастворимые Содержащие активные Амфотерные гидросогруппы Растворимые Нерастворимые Подвергающиеся гидролизу

Оксиды Оксид хрома(III) Окси д (о кисел, о кись) — бинарное соединение химического элемента с кислородом в степени окисления − 2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Свинцовый сурик (оксид свинца Pb 3 O 4) К исключениям относится, например, дифторид кислорода OF 2.

Гидрокси ды (гидроо киси) — соединения оксидов химических элементов с водой. Гидроксид меди (II) Гидроксид кремния (минерал опал) Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных металлов называются щелочами.

Соли - тип сложных веществ, в состав которых входят катионы металла Меn+ и кислотные остатки Сульфат кобальта Дигидроксид тетрааммиаката меди Соли с общей формулой Мех(ЕОу)n называют средними солями, а соли с незамещенными атомами водорода, - кислыми солями. Иногда соли содержат в своем составе также гидроксид или(и) оксид - ионы; такие соли называют основными солями. Комплексные соединения (лат. complexus — сочетание, обхват) или координационные соединения (лат. co — «вместе» и ordinatio — «упорядочение» ) — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами.

Галлуазит
![Тетрахлораурат водорода Тетрахлороаурат(III) водорода (золотохлористоводородная кислота) — H[Au. Cl 4] Является самым распространенным соединением Тетрахлораурат водорода Тетрахлороаурат(III) водорода (золотохлористоводородная кислота) — H[Au. Cl 4] Является самым распространенным соединением](https://present5.com/presentation/34935527_131953148/image-16.jpg)
Тетрахлораурат водорода Тетрахлороаурат(III) водорода (золотохлористоводородная кислота) — H[Au. Cl 4] Является самым распространенным соединением золота, служит для получения большинства остальных соединений.

Взаимодействие медного купороса и хлорида натрия
вводная лекция.ppt