лекция s and p elements.pptx
- Количество слайдов: 23

Общая и неорганическая химия Химия s-элементов (окончание). Особенности свойств Mg и Be. Химия p-элементов. Общая характеристика элементов VIIAгруппы (галогены). Фтор

Бериллий Амфотерность Be + 2 HCl = Be. Cl 2 + H 2 Be + 2 Na. OH + 2 H 2 O = Na 2[Be(OH)4] + H 2 t°(сплавление) Be + 2 Na. OH(т) = Na 2 Be. O 2 + H 3 O [Be(H 2 O)4]2+ Be(OH)2 (ПР 10– 22) OH – [Be(OH)4]2–

Магний Mg + H 2 O t° Mg + 2 H 2 O = Mg(OH)2 + H 2 Mg + 2 NH 4 Cl + 2 H 2 O = = Mg. Cl 2 + 2 NH 3·H 2 O + H 2 + O [Mg(H 2 O)6]2+ H 3 Mg(OH)2 (ПР 10– 10) OH –

Взаимодействие Mg(OH)2 и солей аммония Mg(OH)2(т) + 2 NH 4 Cl = Mg. Cl 2 + 2 NH 3·H 2 O Mg 2+ + 2 OH– 2 NH 4+ + 2 Cl– 2 NH 3·H 2 O Mg(OH)2(т) + 2 NH 4+ = Mg 2+ + 2 NH 3·H 2 O

Разделение катионов Be 2+ и Mg 2+ при их совместном присутствии в растворе 1. Действие избытка щелочи: Be 2+ + 4 OH– = [Be(OH)4]2– Mg 2+ + 2 OH– = Mg(OH)2 2. Действие NH 4 Cl + NH 3·H 2 O: Be 2+ + 2 NH 3·H 2 O = Be(OH)2 Mg 2+ + NH 3·H 2 O + NH 4+

Разделение катионов Sr 2+ и Ba 2+ при их совместном присутствии в растворе 1. Осаждение хроматов: Sr 2+ + Cr. O 42– = Sr. Cr. O 4 Ba 2+ + Cr. O 42– = Ba. Cr. O 4 2. Растворение хромата стронция в уксусной кислоте: 2 Sr. Cr. O 4(т) + 2 CH 3 COOH = = Sr. Cr 2 O 7 + Sr(CH 3 COO)2 + H 2 O
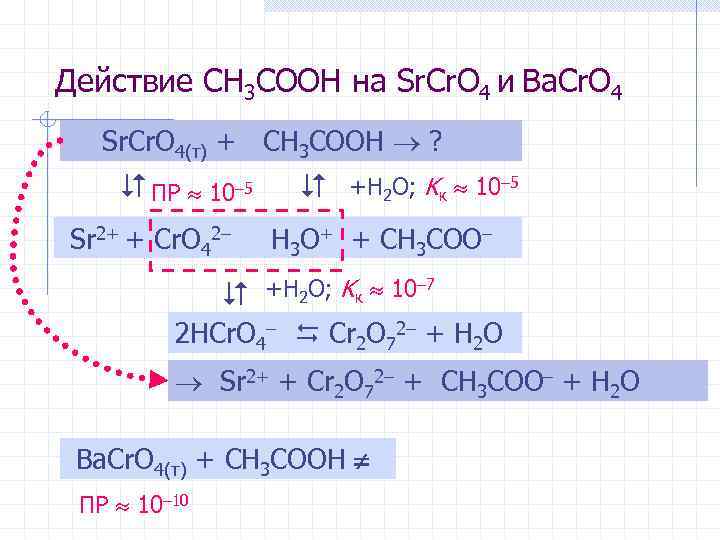
Действие CH 3 COOH на Sr. Cr. O 4 и Ba. Cr. O 4 Sr. Cr. O 4(т) + CH 3 COOH ? ПР 10– 5 Sr 2+ + Cr. O 42– +H 2 O; Kк 10– 5 H 3 O+ + CH 3 COO– +H 2 O; Kк 10– 7 2 HCr. O 4– Cr 2 O 72– + H 2 O Sr 2+ + Cr 2 O 72– + CH 3 COO– + H 2 O Ba. Cr. O 4(т) + CH 3 COOH ПР 10– 10
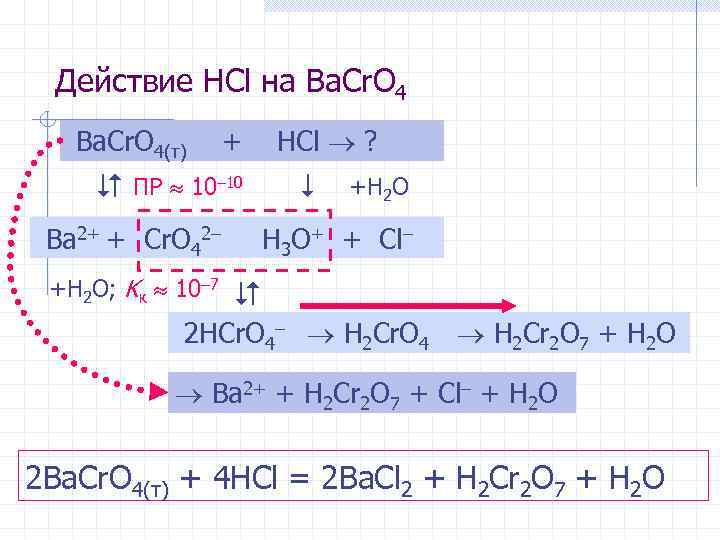
Действие HCl на Ba. Cr. O 4(т) + ПР 10– 10 Ba 2+ + Cr. O 42– +H 2 O; Kк 10– 7 HCl ? +H 2 O H 3 O+ + Cl– 2 HCr. O 4– H 2 Cr. O 4 H 2 Cr 2 O 7 + H 2 O Ba 2+ + H 2 Cr 2 O 7 + Cl– + H 2 O 2 Ba. Cr. O 4(т) + 4 HCl = 2 Ba. Cl 2 + H 2 Cr 2 O 7 + H 2 O

Осаждение Li 3 PO 4: CLi+3·CPO 43– ПРLi 3 PO 4 3 Li. Cl + Na 3 PO 4 = Li 3 PO 4 + 2 Na. Cl Li. Cl + Na 2 HPO 4 Li 3 PO 4 + … Na 2 HPO 4 = 2 Na+ + HPO 42– + H 2 O H 2 PO 4– + OH– HPO 42– + H 2 O PO 43– + H 3 O+ 3 Li. Cl = 3 Li+ + 3 Cl– 2 HPO 42– H 2 PO 4– + PO 43– 3 Li. Cl + 2 Na 2 HPO 4 Li 3 PO 4 + Na. H 2 PO 4 + 3 Na. Cl
![Общая характеристика p - элементов Общая электронная формула: […] ns 2(n– 2)f 14(n– 1)d Общая характеристика p - элементов Общая электронная формула: […] ns 2(n– 2)f 14(n– 1)d](https://present5.com/presentation/156553464_438986320/image-10.jpg)
Общая характеристика p - элементов Общая электронная формула: […] ns 2(n– 2)f 14(n– 1)d 10 np 1 6 Степени окисления (от –IV до +VII). Отличие свойств последнего элемента группы (6 период): стабилизация низшей степени окисления. Например, в IIIA-группе таллий(I); в IVA-группе свинец(II); в VA-группе висмут(III) и т. д. Характерно образование кратных ( - и -) связей; тип гибридизации атомных орбиталей преимущественно sp 3.

р - элементы: Для простых и сложных веществ: катенация – образование структур типа –Э—Э—Э– … (O 3, P 4, S 8, Na 2 Se 5, HN 3 …) и –Э—О—Э– … (H 2 S 2 O 7, Na 2 B 4 O 7. . . ). Неметаллические свойства: склонность к образованию одноатомных анионов (S 2–, Cl– и т. д. ), к образованию только сложных катионов (NH 4+, NO+ и т. д. ), окислительные свойства. С увеличением порядкового номера элемента (сверху вниз по группе) усиливается металличность.
![Элементы VIIА-группы (галогены) Общая электронная формула: […] ns 2 (n– 1)d 10 np 5 Элементы VIIА-группы (галогены) Общая электронная формула: […] ns 2 (n– 1)d 10 np 5](https://present5.com/presentation/156553464_438986320/image-12.jpg)
Элементы VIIА-группы (галогены) Общая электронная формула: […] ns 2 (n– 1)d 10 np 5 Ei 1700 к. Дж/моль Ee – 385 к. Дж/моль Г стремятся образовать анион Г– Степени окисления: F: –I, 0 Cl, Br, I, At: –I, 0, +I, …. +VII
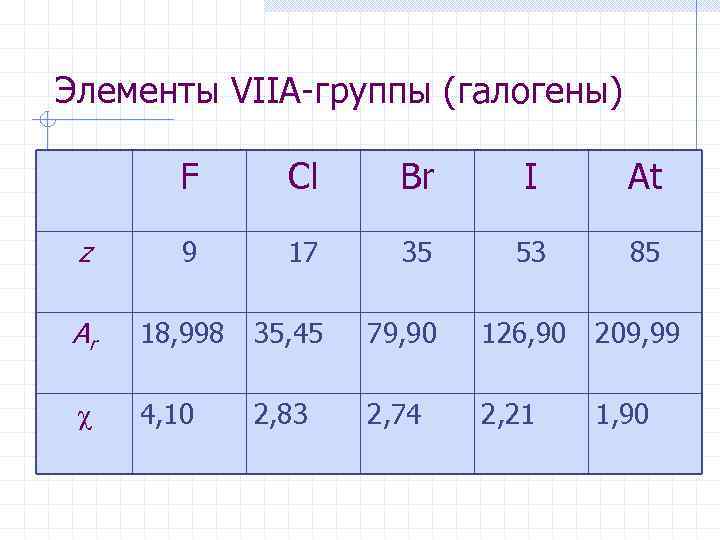
Элементы VIIА-группы (галогены) F Cl Br I At z 9 17 35 53 85 Ar 18, 998 35, 45 79, 90 126, 90 209, 99 4, 10 2, 83 2, 74 2, 21 1, 90

Простые вещества: F 2, Cl 2, Br 2, I 2, At 2 Фтор Бром Хлор Иод
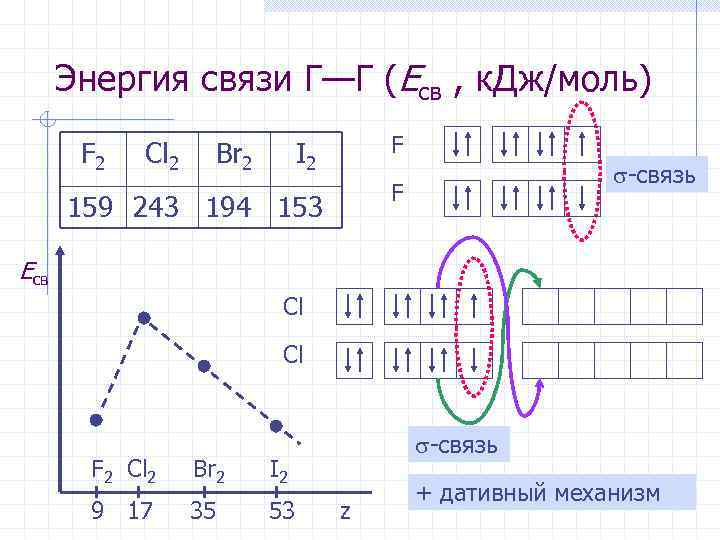
Энергия связи Г—Г (Eсв , к. Дж/моль) I 2 F 159 243 194 153 F F 2 Cl 2 Br 2 -связь Eсв Cl Cl F 2 Cl 2 Br 2 I 2 9 17 35 53 -связь z + дативный механизм

Фтор: распространение в природе Кларк 0, 03% Флюорит (плавиковый шпат) Ca. F 2 Криолит Na 3[Al. F 6] Фторапатит Флюорит 3 Ca 3(PO 4)2 · Ca. F 2 Криолит Фторапатит

Кристаллы флюорита

Фтор F 2 т. пл. – 220 °С, т. кип. – 183 °С Э + F 2 Э+ F –I ( - высшая возможная степень окисления; Э – все, кроме He, Ne, Ar, N 2, O 2) NH 3 + 3 F 2 = NF 3 + 3 HF H 2 O + F 2 = 2 HF + [O] + F 2 = OF 2 On. F 2 (n = 1 8) 2 F 2 + 2 KOH (разб. ) = 2 KF + OF 2 + H 2 O Si. O 2 + 2 F 2 = Si. F 4 + O 2

Соединения фтора. Фтороводород HF : (HF)n т. кип. +19, 5 °С, неограниченно растворим в воде Автопротолиз: H 2 F 2 + HF 2 + H 2 F+, Ks = 2, 1 · 10– 11 Протонодонорные свойства: HF + HNO 3 F – + H 2 NO 3+ В водном р-ре – слабая кислота: HF + H 2 O F – + H 3 O+, KК = 6, 67. 10 4 (25 °C)

Фтороводород Si. O 2 + 4 HF(г) = Si. F 4 + 2 H 2 O (травление стекла) Si. O 2 + 6 HF (изб. ) = =H 2[Si. F 6] + 2 H 2 O

Открытие фтора Фтор впервые получен в 1886 г. (А. Муассан, электролиз смеси HF и KF) Анри Муассан (1852 - 1907) Установки для получения фтора

Получение фтора и фтороводорода В промышленности: электролиз расплава KHF 2 (т. пл. 239 °C) или KH 2 F 3 (т. пл. 70 °C) Катод (–) : 2 HF + 2 e– = H 2 + 2 F– Анод (+): 2 F– – 2 e– = F 2 В лаборатории: 2 Co. F 3 = 2 Co. F 2 + F 2 K 2[Ni. F 6] = 2 KF + Ni. F 2 + F 2 Получение HF: Ca. F 2 + H 2 SO 4(конц) = Ca. SO 4 + 2 HF (150 -300 С)

Применение Водоподготовка (обеззараживание воды фторированием) Фторуглеродные соединения (фреоны, фторкаучуки, фторопласты (тефлоны) и т. п. HF: получение синтетического криолита для производства алюминия, катализаторы, травление стекла и металлов, получение фторидов урана, олова и др.
лекция s and p elements.pptx