ccf5c0435c9678a87294cd7c66844801.ppt
- Количество слайдов: 30

Общая и неорганическая химия. Лекция 13 Ковалентная химическая связь. Метод валентных связей. Полярность связей

Ковалентная связь n n n Возникает за счет увеличения электронной плотности в области между химически связанными атомами Гипотеза Льюиса (1916): связи между двумя атомами осуществляется парой электронов; при этом вокруг каждого атома обычно формируется восьмиэлектронная оболочка ( «правило октета» ). Гилберт-Ньютон ЛЬЮИС (23. 10. 1875 - 23. 03. 1946)
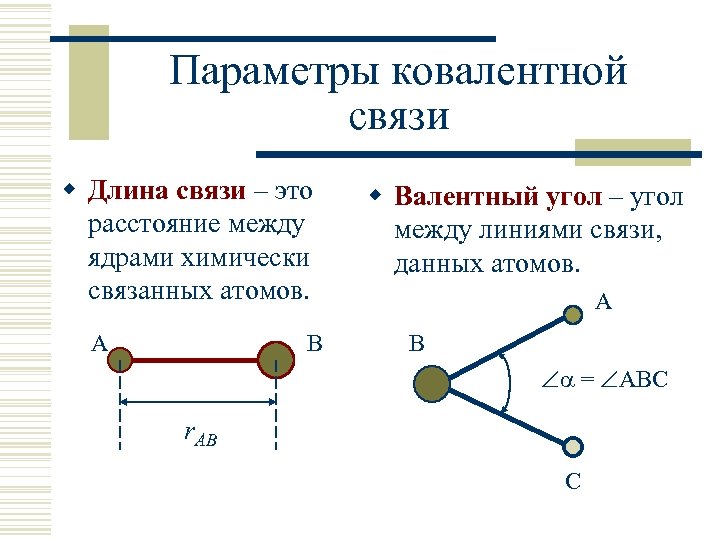
Параметры ковалентной связи w Длина связи – это расстояние между ядрами химически связанных атомов. A B w Валентный угол – угол между линиями связи, данных атомов. A B = ABC r. AB C

Энергия ковалентной связи w E(AB) – это энергия, необходимая для того, чтобы разорвать связь между атомами A и B и удалить их друг от друга на расстояние, на котором они не взаимодействуют. w Примеры: w Образование и диссоциация молекулы водорода: Н + Н = Н 2 + 435 к. Дж H 2 = H + H – 435 к. Дж w. Энергия связи в молекуле воды: H 2 O = 2 H + O – 921 к. Дж; E(OH) = 460, 5 к. Дж/моль

Валентное состояние и валентные возможности w w Валентность – это свойство одиночного атома к образованию того или иного числа ковалентных связей. Валентные возможности атома определяются числом неспаренных электронов и числом вакантных орбиталей данного атома, способных участвовать в образовании связей по донорноакцепторному механизму.
![Li: [He]2 s 1; валентность = 1 E Be*: [He]2 s 12 p 1 Li: [He]2 s 1; валентность = 1 E Be*: [He]2 s 12 p 1](https://present5.com/presentation/ccf5c0435c9678a87294cd7c66844801/image-6.jpg)
Li: [He]2 s 1; валентность = 1 E Be*: [He]2 s 12 p 1 323 к. Дж/моль 798 к. Дж/моль Be: [He]2 s 22 p 0 Be. F 2: 475 к. Дж/моль валентность = 2 Be. F 2 [Be. F 4]2– : валентность = 4

Основные положения метода валентных связей (МВС) w Ковалентная связь образуется в результате обобществления неспаренных электронов двумя взаимодействующими атомами. Эта пара электронов локализована в пространстве между ядрами данных атомов. w Ковалентная связь образуется в результате перекрывания либо двух атомных орбиталей с неспаренными электронами (обменный механизм), либо орбитали с парой электронов и пустой атомной орбитали (донорно-акцепторный механизм).

Основные положения МВС w Перекрывание атомных орбиталей происходит только тогда, когда симметрия перекрываемых орбиталей относительно межъядерной оси одинакова. w В образующейся частице (молекуле или сложном ионе) ядра взаимодействующих атомов считаются локализованными.

Свойства ковалентной связи w Насыщаемость. В соответствии с принципом Паули на перекрываемых орбиталях могут присутствовать не более двух электронов с противоположными спинами). w Направленность. Перекрываемые орбитали должны иметь одинаковую симметрию относительно межъядерной оси (вдоль σ-связей). Совокупность направленных, строго ориентированных в пространстве σ-связей создает структуру химической частицы. w Образование кратных связей при дополнительном перекрывании атомных орбиталей ( - и -связи).
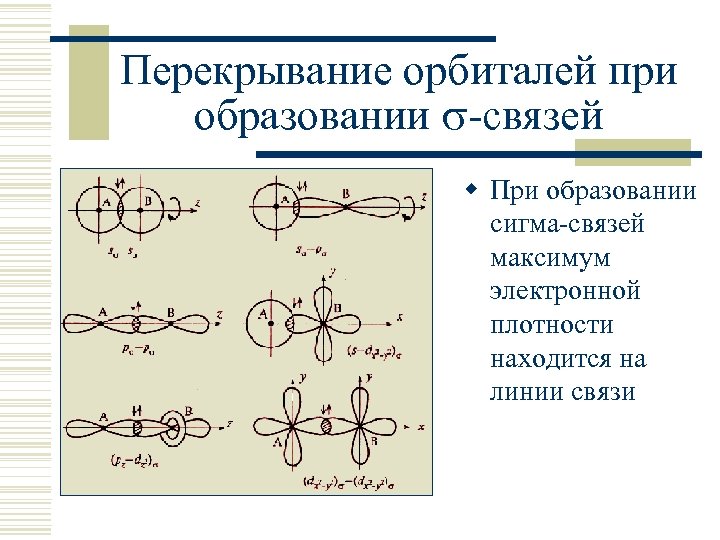
Перекрывание орбиталей при образовании -связей w При образовании сигма-связей максимум электронной плотности находится на линии связи
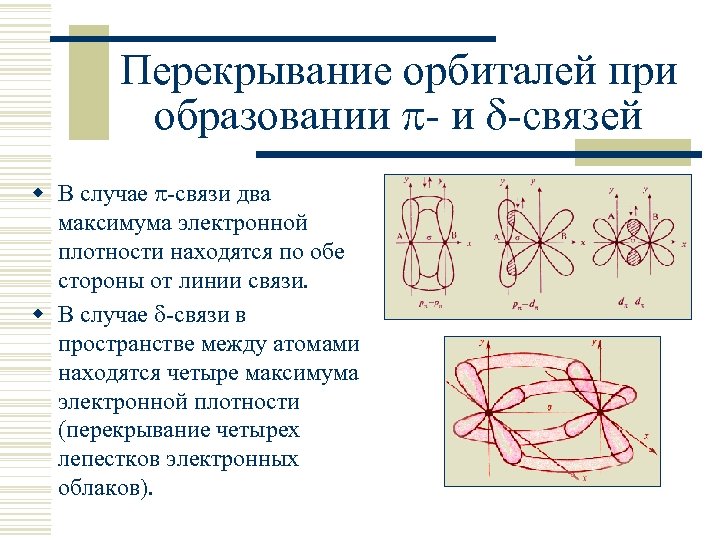
Перекрывание орбиталей при образовании - и -связей w В случае -связи два максимума электронной плотности находятся по обе стороны от линии связи. w В случае -связи в пространстве между атомами находятся четыре максимума электронной плотности (перекрывание четырех лепестков электронных облаков).

Гибридизация атомных орбиталей w Гибридизация – это выравнивание (усреднение) энергетических и геометрических характеристик атомных орбиталей разных подуровней при образовании химических связей. w В результате появляются гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы расположенные на них электронные пары (или неспаренные электроны) были максимально удалены друг от друга.
![Примеры гибридизации Be: [He]2 s 2 Be*: [He]2 s 12 p 1 2 s Примеры гибридизации Be: [He]2 s 2 Be*: [He]2 s 12 p 1 2 s](https://present5.com/presentation/ccf5c0435c9678a87294cd7c66844801/image-13.jpg)
Примеры гибридизации Be: [He]2 s 2 Be*: [He]2 s 12 p 1 2 s 22 p 0 2 s 12 p 1 s-АО + p-АО = 2 sp-АО 180° F Be F
![Примеры гибридизации B: [He]2 s 22 p 1 B*: [He]2 s 12 p 2 Примеры гибридизации B: [He]2 s 22 p 1 B*: [He]2 s 12 p 2](https://present5.com/presentation/ccf5c0435c9678a87294cd7c66844801/image-14.jpg)
Примеры гибридизации B: [He]2 s 22 p 1 B*: [He]2 s 12 p 2 s-АО + 2 p-АО = 3 sp 2 -АО F 120° B F F Плоский треугольник
![Примеры гибридизации С: [He]2 s 22 p 2 С*: [He]2 s 12 p 3 Примеры гибридизации С: [He]2 s 22 p 2 С*: [He]2 s 12 p 3](https://present5.com/presentation/ccf5c0435c9678a87294cd7c66844801/image-15.jpg)
Примеры гибридизации С: [He]2 s 22 p 2 С*: [He]2 s 12 p 3 s-АО + 3 p-АО = 4 sp 3 -АО F 2 s 12 p 3 С Тетраэдр F F F
![Примеры гибридизации P: [Ne]3 s 23 p 3 3 d 0 F 3 s Примеры гибридизации P: [Ne]3 s 23 p 3 3 d 0 F 3 s](https://present5.com/presentation/ccf5c0435c9678a87294cd7c66844801/image-16.jpg)
Примеры гибридизации P: [Ne]3 s 23 p 3 3 d 0 F 3 s 23 p 3 3 d 1 F P F 3 s 13 p 3 P*: [Ne]3 s 13 p 3 3 d 1 s-АО + 3 p-АО + d-АО = = 5 sp 3 d-АО F F Тригональная бипирамида
![Примеры гибридизации S: [Ne]3 s 23 p 4 3 d 0 F 3 s Примеры гибридизации S: [Ne]3 s 23 p 4 3 d 0 F 3 s](https://present5.com/presentation/ccf5c0435c9678a87294cd7c66844801/image-17.jpg)
Примеры гибридизации S: [Ne]3 s 23 p 4 3 d 0 F 3 s 23 p 4 3 d 2 F F S 3 s 13 p 3 S*: [Ne]3 s 13 p 3 3 d 2 F F F s-АО + 3 p-АО + 2 d-АО = = 6 sp 3 d 2 -АО Октаэдр
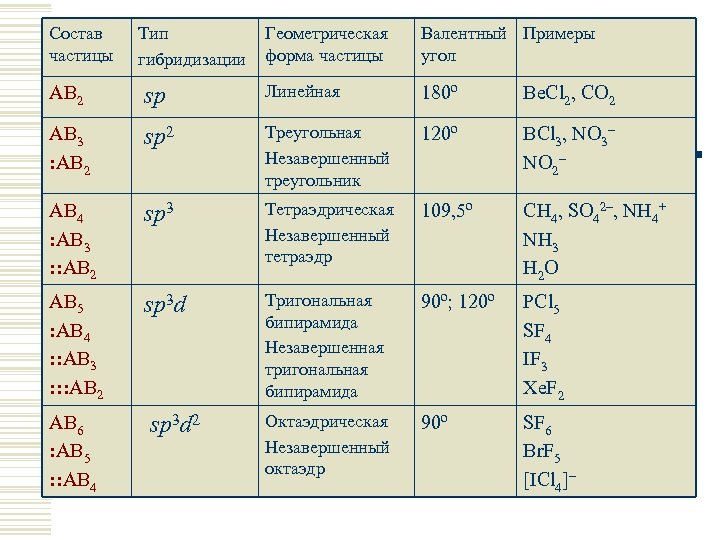
Состав частицы AB 2 AB 3 : AB 2 Тип гибридизации Геометрическая форма частицы Валентный Примеры угол Типы гибридизации атомных Линейная 180º Be. Cl , CO sp орбиталей BCl , NO Треугольная 120º sp 2 2 3 NO 2– Незавершенный треугольник 2 3 – AB 4 : AB 3 : : AB 2 sp 3 Тетраэдрическая Незавершенный тетраэдр 109, 5º CH 4, SO 42–, NH 4+ NH 3 H 2 O AB 5 : AB 4 : : AB 3 : : : AB 2 sp 3 d Тригональная бипирамида Незавершенная тригональная бипирамида 90º; 120º PCl 5 SF 4 IF 3 Xe. F 2 AB 6 : AB 5 : : AB 4 sp 3 d 2 Октаэдрическая Незавершенный октаэдр 90º SF 6 Br. F 5 [ICl 4]–
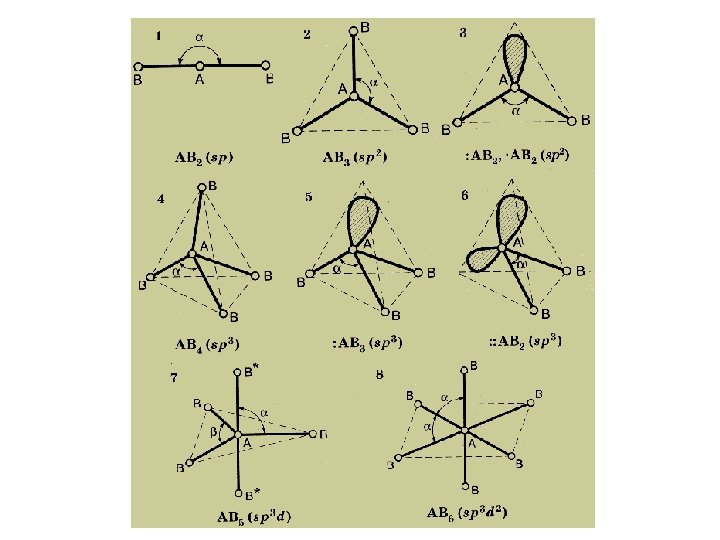

Алгоритм предсказания типа гибридизации w находят центральный атом и определяют число связей (по числу концевых атомов); w определяют степени окисления атомов в частице; w составляют электронную конфигурацию центрального атома в нужной степени окисления; w изображают схему распределения валентных электронов центрального атома по орбиталям, при этом, вопреки правилу Гунда, максимально «спаривают» электроны;

Алгоритм предсказания типа гибридизации (окончание) w отмечают орбитали, участвующие в образовании связей с концевыми атомами; w если валентных орбиталей недостаточно, используют орбитали последующих энергетических уровней; w определяют тип гибридизации, учитывая все орбитали, участвующие в образовании связи, а также неподеленные электронные пары; w по типу гибридизации определяют геометрическую конфигурацию химической частицы
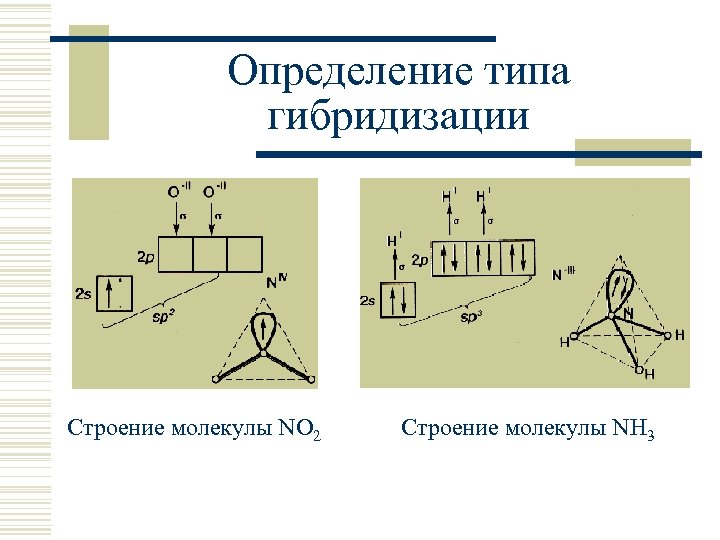
Определение типа гибридизации Строение молекулы NO 2 Строение молекулы NH 3
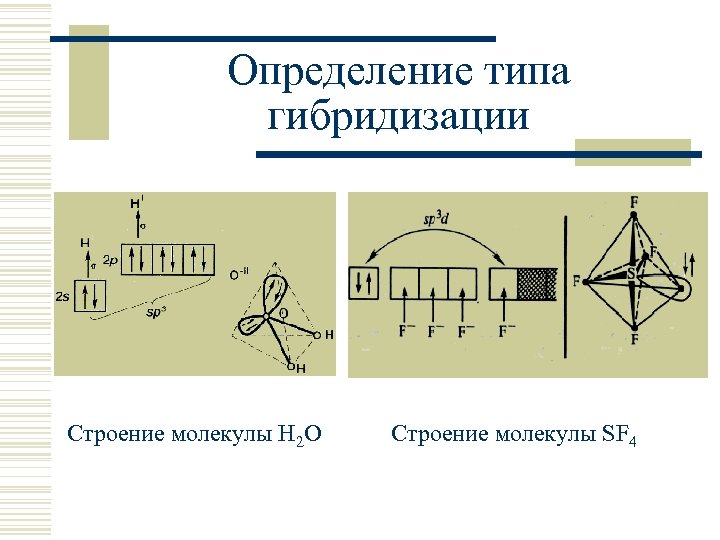
Определение типа гибридизации Строение молекулы H 2 O Строение молекулы SF 4
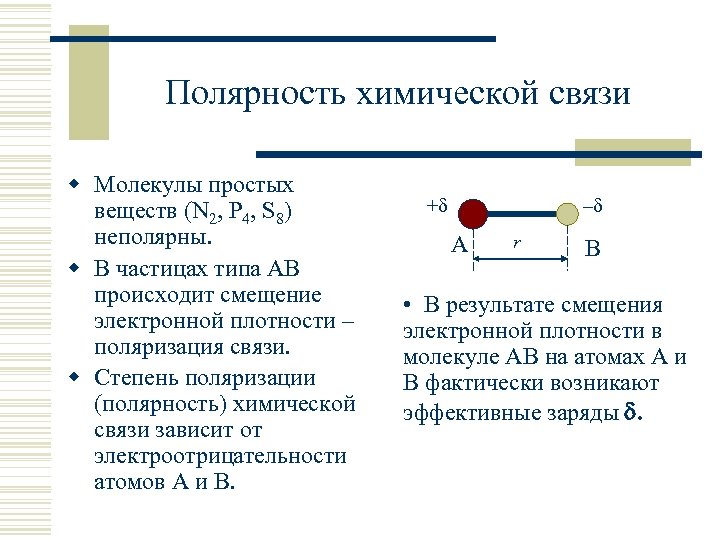
Полярность химической связи w Молекулы простых веществ (N 2, P 4, S 8) неполярны. w В частицах типа АВ происходит смещение электронной плотности – поляризация связи. w Степень поляризации (полярность) химической связи зависит от электроотрицательности атомов А и В. + – А r В • В результате смещения электронной плотности в молекуле АВ на атомах А и В фактически возникают эффективные заряды .

Эффективный заряд и степень окисления Степе Эффекти нь вный окисл заряд ения H 2 S S–II – 0, 1 Zn. Br Zn+II +0, 5 2 Mn. O Mn+VII – 4 +0, 3

Дипольный момент w Характеристика полярности связи – ее дипольный момент: = | | r w Дипольный момент связи – векторная величина. Он направлен от положительного эффективного заряда к отрицательному. w Единица измерения дипольного момента – дебай (Д): 1 Д = 0, 33 · 10– 29 Кл · м.
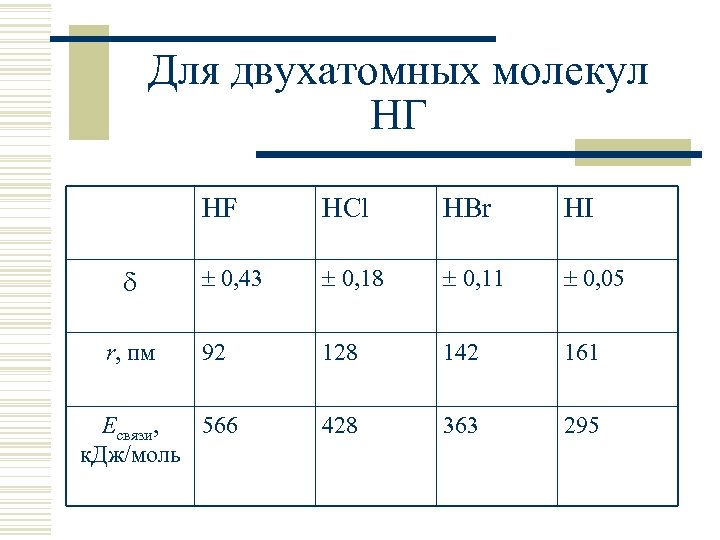
Для двухатомных молекул HГ HF r, пм HCl HBr HI 0, 43 0, 18 0, 11 0, 05 92 128 142 161 428 363 295 Eсвязи, 566 к. Дж/моль

Дипольный момент многоатомных молекул w Дипольный момент молекулы равен векторной сумме дипольных моментов ее химических связей (с учетом вклада неподеленных пар электронов). w Если полярные связи расположены в молекуле симметрично, молекула в целом является неполярной. Примеры: линейная молекула диоксида углерода CO 2, тетраэдрическая молекула CCl 4 и т. п.
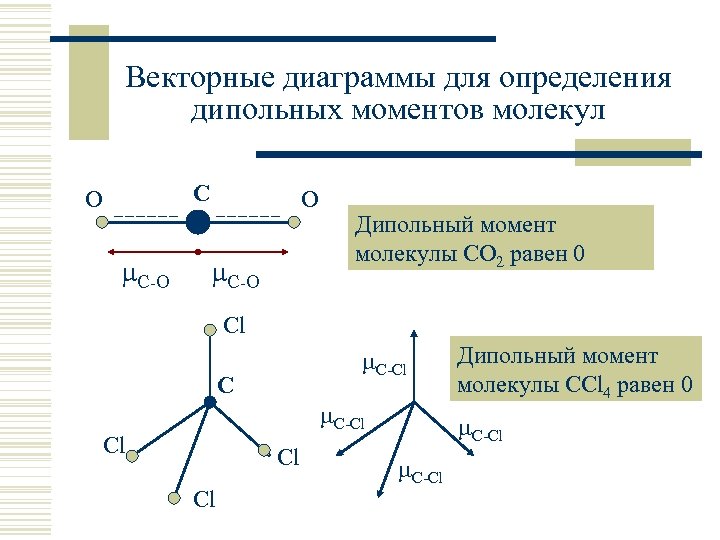
Векторные диаграммы для определения дипольных моментов молекул С O С-О Дипольный момент молекулы CO 2 равен 0 Cl С-Cl Cl Дипольный момент молекулы CCl 4 равен 0 С-Cl
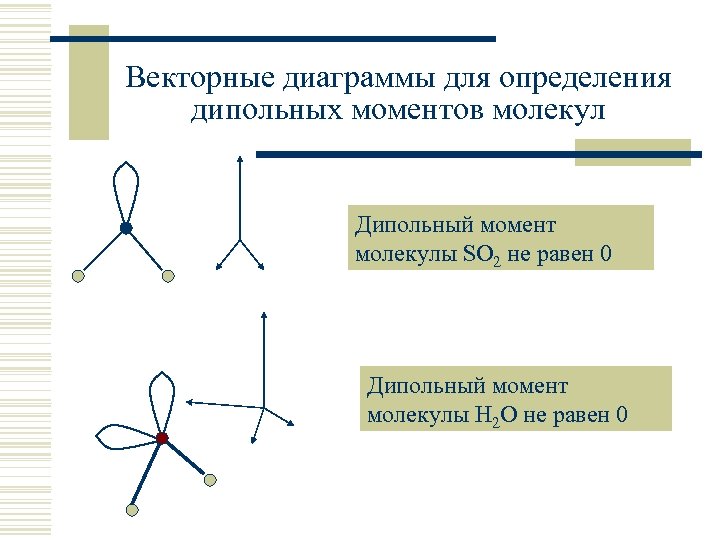
Векторные диаграммы для определения дипольных моментов молекул Дипольный момент молекулы SO 2 не равен 0 Дипольный момент молекулы H 2 O не равен 0
ccf5c0435c9678a87294cd7c66844801.ppt